Журнал неорганической химии, 2022, T. 67, № 1, стр. 103-117
Псевдобиядерный [Bi(S2CNiPr2)3]2 и псевдополимерный [Bi(S2CNiPr2)2][Bi(S2CNiPr2)Cl3] комплексы висмута(III): получение, супрамолекулярная самоорганизация (роль вторичных взаимодействий Bi⋅⋅⋅S, Bi⋅⋅⋅Cl, S⋅⋅⋅Cl) и термическое поведение
Е. В. Новикова a, А. С. Заева a, Г. Л. Денисов b, И. В. Егорова c, А. В. Иванов a, *
a Институт геологии и природопользования ДВО РАН
675000 Амурская обл., Благовещенск, Релочный пер., 1, Россия
b Институт элементоорганических соединений им. А.Н. Несмеянова РАН
119991 Москва, ул. Вавилова, 28, Россия
c Благовещенский государственный педагогический университет
675000 Амурская обл., Благовещенск, ул. Ленина, 104, Россия
* E-mail: alexander.v.ivanov@chemist.com
Поступила в редакцию 25.06.2021
После доработки 09.07.2021
Принята к публикации 10.09.2021
- EDN: DOPEPV
- DOI: 10.31857/S0044457X2201007X
Аннотация
Получены и структурно охарактеризованы псевдобиядерный [Bi(S2CNiPr2)3]2 (I) и 1D-псевдополимерный [Bi(S2CNiPr2)2][Bi(S2CNiPr2)Cl3] (II) комплексы висмута(III). Вторичные связи Bi⋅⋅⋅S, Bi⋅⋅⋅Cl и S⋅⋅⋅Cl объединяют моноядерные структурные единицы комплексов, играя ключевую роль в самоорганизации их супрамолекулярных структур. Термическое поведение полученных соединений изучено методом синхронного термического анализа в атмосфере аргона. По данным рентгенодисперсионного микроанализа и сканирующей электронной микроскопии установлено, что остаточными веществами после термолиза соединений I/II являются микрокристаллические Bi2S3/Bi2S3, BiCl3.
ВВЕДЕНИЕ
Комплексы висмута(III), включающие дитиокарбаматные лиганды (Dtc), представляют практический интерес как прекурсоры Bi2S3 [1–7]. Важно также отметить чрезвычайно низкую токсичность соединений висмута [8]. Поэтому для целого ряда дитиокарбаматных комплексов висмута установлена высокая противоопухолевая [9–12], антибактериальная [13–16] и противогрибковая [17] активность. Кроме того, ранее для дитиокарбаматов висмута нами была обнаружена способность к эффективному хемосорбционному связыванию золота(III) из растворов 2 M HCl в твердую фазу c образованием сложноорганизованных в структурном отношении двойных комплексов Au(III)–Bi(III) [6, 18, 19].
Висмут(III) наряду с дитиокарбаматными комплексами, характеризующимися гомогенной координационной сферой [2–5, 14–17, 20–26], образует также разнолигандные соединения общего состава [Bi(Dtc)2Cl] [27–31] и [Bi(Dtc)Cl2] [31–3311], внутренняя сфера которых дополнительно включает хлорид-ионы. Первые формируют псевдобиядерные образования [Bi(Dtc)3]2 за счет межмолекулярных парных вторичных взаимодействий Bi⋅⋅⋅S, тогда как вторые характеризуются 1D-полимерными структурами, в которых соседние атомы висмута объединяются одним или двумя мостиковыми лигандами μ2-Cl.
В настоящей работе получены и структурно охарактеризованы псевдобиядерный диизопропилдитиокарбамат висмута(III) [Bi{S2CN(изо-C3H7)2}3]2 (I) и псевдополимерный дитиокарбаматно-хлоридный комплекс нового типа [Bi{S2CN(изо-C3H7)2}2][Bi{S2CN(изо-C3H7)2}Cl3] (II). В первом соединении структурно-неэквивалентные моноядерные фрагменты [Bi{S2CN(изо-C3H7)2}3] объединяются тремя существенно неравноценными вторичными связями Bi⋅⋅⋅S; тогда как во втором катионную и анионную части комплекса связывают множественные вторичные связи Bi⋅⋅⋅Cl, Bi⋅⋅⋅S и S⋅⋅⋅Cl. Термическое поведение комплексов изучено методом синхронного термического анализа (СТА) с идентификацией финальных продуктов термолиза.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
N,N-диизопропилдитиокарбамат натрия Na{S2CN(изо-C3H7)2} · 3H2O [34] получали взаимодействием диизопропиламина HN(изо-C3H7)2 (Sigma) с сероуглеродом (Merck) в щелочной среде [35].
Синтез I, II. Псевдобиядерный трис(N,N-диизопропилдитиокарбамато-S,S')висмут(III) [Bi{S2CN(изо-C3H7)2}3] (I) и псевдополимерный трихлоро(N,N-диизопропилдитиокарбамато-S,S′)висмутат(III) бис(N,N-диизопропилдитио-карбамато-S,S')висмута(III) [Bi{S2CN(изо-C3H7)2}2] · [Bi{S2CN(изо-C3H7)2}Cl3] (II) получали согласно следующим реакциям:
Реакции проводили в растворе ацетона, при получении комплексов I/II использовали 3%-ный избыток лиганда iPr2Dtc/BiCl3. Реакционные смеси перемешивали на магнитной мешалке в течение 1 ч и оставляли на сутки при комнатной температуре. Затем растворы комплексов отделяли от осадка NaCl фильтрованием. Для улучшения кристаллизации комплексов растворы вдвое разбавляли этанолом. Красно-оранжевые/желтые призматические кристаллы I/II получали медленным испарением органических растворителей при комнатной температуре. Выход составил 82.2/71.7%; tпл = 163–164°С/разложение без плавления.
ИК-спектр I (KBr; ν, см–1): 2997 сл, 2968 с, 2925 с, 2869 сл, 1475 с, 1454 сл, 1439 с, 1409 сл, 1379 сл, 1366 с, 1349 сл, 1309 о.с, 1191 с, 1143 с, 1101 ср, 1054 сл, 1031 с, 934 сл, 904 сл, 846 ср, 788 ср, 752 сл, 668 сл, 638 сл, 609 сл, 583 ср, 529 сл, 474 сл.
ИК-спектр II (KBr; ν, см–1): 2997 сл, 2974 с, 2929 ср, 2869 ср, 1485 о.с, 1464 сл, 1446 ср, 1383 ср, 1370 с, 1325 о.с, 1187 с, 1140 с, 1116 ср, 1028 с, 940 сл, 924 сл, 901 сл, 845 ср, 786 ср, 615 сл, 578 с, 528 ср, 474 ср.
ИК-спектры комплексов I и II, запрессованных в таблетки с KBr, регистрировали на интерференционном ИК-спектрометре с Фурье-преобразованием ФСМ-1201 в диапазоне 4000–400 см–1 (программный продукт FSpec, версия 4.0.0.2 для Windows, ООО “Мониторинг”, Россия). Элементный анализ проводили на автоматическом анализаторе Carlo Erba EA 1108.
РСА выполнен c призматических монокристаллов на дифрактометре Bruker Apex II DUO при 120 K (CCD-детектор, MoKα, λ = 0.71073 Å, графитовый монохроматор). Расчеты по определению структур проведены с использованием программы SHELXT [36] с последующим уточнением полноматричным МНК с помощью программы OLEX2 [37] в анизотропном приближении для неводородных атомов. Положения атомов водорода рассчитаны геометрически и включены в уточнение в изотропном приближении в модели “наездника”. Основные кристаллографические данные и параметры уточнения структур I, II приведены в табл. 1, основные длины связей и углы – в табл. 2.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структур I и II
| Параметр | I | II |
|---|---|---|
| Брутто-формула | C42H84N6S12Bi2 | C21H42N3S6Cl3Bi2 |
| M | 1475.83 | 1053.24 |
| Сингония | Моноклинная | Моноклинная |
| Пр. гр. | P21 | P21 |
| Z | 2 | 2 |
| a, Å | 11.3176(7) | 8.1177(7) |
| b, Å | 20.6092(13) | 10.6674(10) |
| c, Å | 13.9691(9) | 20.0499(19) |
| α, град | 90 | 90 |
| β, град | 113.2600(10) | 92.197(2) |
| γ, град | 90 | 90 |
| V, Å3 | 2993.4(3) | 1734.9(3) |
| ρвыч, г/см3 | 1.637 | 2.016 |
| μ, см–1 | 6.323 | 10.738 |
| F(000) | 1472 | 1004 |
| Размер кристалла, мм3 | 0.41 × 0.38 × 0.35 | 0.39 × 0.37 × 0.34 |
| Область сбора данных по θ, град | 1.869–27.000 | 2.033–26.999 |
| Интервалы индексов отражений | –14 ≤ h ≤ 14, –26 ≤ k ≤ 26, –17 ≤ l ≤ 17 |
–10 ≤ h ≤ 10, –13 ≤ k ≤ 13, –25 ≤ l ≤ 25 |
| Измерено отражений | 32 001 | 18 496 |
| Независимых отражений (Rint) | 13 028 | 7572 |
| Отражений с I > 2σ(I) | 11 560 | 6634 |
| Переменных уточнения | 584 | 329 |
| GOOF | 0.784 | 0.870 |
| R-факторы по R[F 2 > 2σ(F 2)] | R1 = 0.0322, wR2 = 0.0628 | R1 = 0.0392, wR2 = 0.0786 |
| R-факторы по всем отражениям | R1 = 0.0403, wR2 = 0.0661 | R1 = 0.0481, wR2 = 0.0824 |
| Остаточная электронная плотность (min/max), e/Å3 | –0.827/1.017 | –1.569/2.568 |
Таблица 2.
Длины связей (d, Å), валентные (ω, град) и торсионные (φ, град) углы в структурах I и II
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| I | |||
| Bi(1)–S(1) | 2.630(2) | Bi(2)–S(7) | 2.919(2) |
| Bi(1)–S(2) | 2.929(2) | Bi(2)–S(8) | 2.779(2) |
| Bi(1)–S(3) | 2.887(2) | Bi(2)–S(9) | 2.719(2) |
| Bi(1)–S(4) | 2.731(2) | Bi(2)–S(10) | 2.878(2) |
| Bi(1)–S(5) | 2.801(2) | Bi(2)–S(11) | 2.631(2) |
| Bi(1)–S(6) | 2.954(2) | Bi(2)–S(12) | 2.970(2) |
| Bi(1)⋅⋅⋅S(8) | 3.464(2) | Bi(2)⋅⋅⋅S(6) | 3.140(2) |
| Bi(1)⋅⋅⋅S(9) | 3.371(2) | S(7)–C(4) | 1.723(9) |
| S(1)–C(1) | 1.742(9) | S(8)–C(4) | 1.751(9) |
| S(2)–C(1) | 1.714(9) | S(9)–C(5) | 1.759(10) |
| S(3)–C(2) | 1.730(9) | S(10)–C(5) | 1.714(10) |
| S(4)–C(2) | 1.756(9) | S(11)–C(6) | 1.746(9) |
| S(5)–C(3) | 1.745(9) | S(12)–C(6) | 1.714(9) |
| S(6)–C(3) | 1.724(8) | N(4)–C(4) | 1.327(11) |
| N(1)–C(1) | 1.346(11) | N(5)–C(5) | 1.338(11) |
| N(2)–C(2) | 1.324(11) | N(6)–C(6) | 1.335(11) |
| N(3)–C(3) | 1.335(10) | ||
| II | |||
| Bi(1)–Cl(1) | 2.697(3) | Bi(2)–S(6) | 2.646(3) |
| Bi(1)–Cl(2) | 2.647(4) | Bi(2)⋅⋅⋅S(1) | 3.247(3) |
| Bi(1)–Cl(3) | 2.692(3) | Bi(2)⋅⋅⋅Cl(3) | 3.182(3) |
| Bi(1)–S(1) | 2.797(3) | Bi(2)a⋅⋅⋅Cl(1) | 3.190(4) |
| Bi(1)–S(2) | 2.581(3) | Bi(2)a⋅⋅⋅Cl(2) | 3.203(4) |
| S(1)–C(1) | 1.720(13) | S(3)–C(2) | 1.751(13) |
| S(2)–C(1) | 1.732(13) | S(4)–C(2) | 1.717(14) |
| N(1)–C(1) | 1.339(16) | S(5)–C(3) | 1.714(13) |
| Bi(2)–S(3) | 2.677(3) | S(6)–C(3) | 1.763(13) |
| Bi(2)–S(4) | 2.736(3) | N(2)–C(2) | 1.317(17) |
| Bi(2)–S(5) | 2.747(3) | N(3)–C(3) | 1.321(16) |
| Угол | ω, град | Угол | ω, град |
| I | |||
| S(1)Bi(1)S(2) | 63.57(7) | S(7)Bi(2)S(8) | 62.77(6) |
| S(3)Bi(1)S(4) | 63.54(7) | S(9)Bi(2)S(10) | 63.91(7) |
| S(5)Bi(1)S(6) | 62.16(6) | S(11)Bi(2)S(12) | 63.51(6) |
| S(1)C(1)S(2) | 116.5(5) | S(7)C(4)S(8) | 117.5(5) |
| S(3)C(2)S(4) | 116.3(5) | S(9)C(5)S(10) | 117.3(5) |
| S(5)C(3)S(6) | 118.0(5) | S(11)C(6)S(12) | 117.8(5) |
| C(1)S(1)Bi(1) | 90.0(3) | C(4)S(7)Bi(2) | 87.8(3) |
| C(1)S(2)Bi(1) | 81.0(3) | C(4)S(8)Bi(2) | 91.9(3) |
| C(2)S(3)Bi(1) | 87.7(3) | C(5)S(9)Bi(2) | 91.3(3) |
| C(2)S(4)Bi(1) | 92.3(3) | C(5)S(10)Bi(2) | 87.0(3) |
| C(3)S(5)Bi(1) | 91.3(3) | C(6)S(11)Bi(2) | 91.0(3) |
| C(3)S(6)Bi(1) | 86.7(3) | C(6)S(12)Bi(2) | 80.8(3) |
| II | |||
| S(1)Bi(1)S(2) | 66.32(10) | C(3)S(5)Bi(2) | 87.9(4) |
| S(3)Bi(2)S(4) | 65.78(10) | Cl(1)Bi(1)Cl(2) | 86.93(12) |
| S(5)Bi(2)S(6) | 65.84(10) | Cl(2)Bi(1)Cl(3) | 92.86(12) |
| S(1)C(1)S(2) | 117.3(8) | Cl(1)Bi(1)Cl(3) | 177.39(12) |
| S(3)C(2)S(4) | 115.9(8) | S(1)Bi(1)Cl(1) | 95.24(10) |
| S(5)C(3)S(6) | 115.0(7) | S(1)Bi(1)Cl(2) | 147.95(11) |
| C(1)S(1)Bi(1) | 84.7(4) | S(1)Bi(1)Cl(3) | 86.32(10) |
| C(1)S(2)Bi(1) | 91.5(5) | S(2)Bi(1)Cl(1) | 90.65(12) |
| C(2)S(3)Bi(2) | 89.7(5) | S(2)Bi(1)Cl(2) | 81.71(11) |
| C(2)S(4)Bi(2) | 88.5(5) | S(2)Bi(1)Cl(3) | 91.90(11) |
| Угол | φ, град | Угол | φ, град |
| I | |||
| Bi(1)S(1)S(2)C(1) | 145.9(6) | Bi(2)S(7)S(8)C(4) | 178.0(6) |
| Bi(1)S(3)S(4)C(2) | 175.7(6) | Bi(2)S(9)S(10)C(5) | –172.0(7) |
| Bi(1)S(5)S(6)C(3) | –164.3(6) | Bi(2)S(11)S(12)C(6) | 149.5(6) |
| S(1)C(1)N(1)C(10) | –173.8(7) | S(7)C(4)N(4)C(28) | –163.6(8) |
| S(2)C(1)N(1)C(7) | 175.4(7) | S(8)C(4)N(4)C(28) | 18.6(13) |
| S(3)C(2)N(2)C(13) | –8.2(13) | S(9)C(5)N(5)C(34) | –1.0(12) |
| S(4)C(2)N(2)C(13) | 171.8(7) | S(10)C(5)N(5)C(34) | 178.3(7) |
| S(5)C(3)N(3)C(22) | –161.4(7) | S(11)C(6)N(6)C(40) | –14.2(12) |
| S(6)C(3)N(3)C(22) | 20.4(12) | S(12)C(6)N(6)C(37) | –5.8(12) |
| II | |||
| Bi(1)S(1)S(2)C(1) | –175.0(9) | S(4)C(2)N(2)C(13) | –17.1(17) |
| S(1)C(1)N(1)C(4) | –168.9(10) | Bi(2)S(5)S(6)C(3) | –167.9(8) |
| S(2)C(1)N(1)C(4) | 9.6(17) | S(5)C(3)N(3)C(19) | 0.5(17) |
| Bi(2)S(3)S(4)C(2) | 176.0(8) | S(6)C(3)N(3)C(19) | 180.0(9) |
| S(3)C(2)N(2)C(13) | 160.7(9) | ||
Координаты атомов, длины связей и валентные углы для полученных комплексов депонированы в Кембриджском банке структурных данных (CCDC № 2031830 (I) и 2031961 (II); deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk).
Термическое поведение комплексов I/II изучали методом синхронного термического анализа с параллельной регистрацией кривых термогравиметрии (ТГ) и дифференциальной сканирующей калориметрии (ДСК). Исследования проводили на приборе STA 449C Jupiter (Netzsch) в корундовых тиглях под крышкой с отверстием, что обеспечивало давление паров в процессе термолиза, равное 1 атм. Нагревание до 400/500°С проводили со скоростью 5 град/мин в атмосфере аргона. Масса навесок составляла 2.899−7.911 (I)/3.341−4.211 мг (II). Точность измерения температуры ±0.6°С, изменения массы ±1 × 10–4 мг. Для выявления аморфного состояния комплекса I исследования дополнительно проводили в алюминиевых тиглях со скоростью нагрева 10 град/мин, масса навески 5.058 мг, точность измерения температуры ±0.8°С. При записи кривых ТГ и ДСК использовали файл коррекции, а также калибровки по температуре и чувствительности для заданной температурной программы и скорости нагрева.
Дисперсность и морфологические особенности остаточного вещества, образовавшегося в результате термолиза комплексов, исследовали на растровом электронном микроскопе Zeiss SIGMA (Германия), оснащенном для качественного определения химического состава системой микроанализа Oxford X-MAX (Англия) с дисперсией по энергии и длинам волн.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
ИК-спектры исследуемых комплексов I/II включают высокоинтенсивные полосы поглощения при 1475/1485 см–1, которые отражают валентные колебания частично двойных связей ν(C–N) в >NC(S)S-группах лигандов iPr2Dtc. Соотношение между приведенными характеристиками согласуется с отмеченной нами ранее тенденцией к возрастанию частоты колебаний обсуждаемых связей при замещении Dtc-лигандов на анионы Cl– во внутренней сфере висмута [31]. Важно отметить, что возрастание частоты колебаний связи ν(C–N) является прямым указанием на повышение вклада двоесвязанности в формально ординарную связь N–C(S)S. Поэтому в комплексе II ожидаются более короткие связи N–C(S)S, чем в I (средняя длина связей N–C(S)S в II – 1.326 Å, в I – 1.334 Å, табл. 2). Кроме того, ИК-спектр комплекса II характеризуется смещением в высокочастотную область интенсивной полосы ν(N–C), обусловленной валентными колебаниями ординарных связей N–CH< iPr2Dtc-лигандов [38], которая проявляется при 1325 см–1 (для сравнения в спектре I соответствующая полоса регистрируется при 1309 см–1). К асимметричным (νas) и симметричным (νs) валентным колебаниям групп ‒С(S)S– в I/II отнесены соответственно полосы поглощения высокой интенсивности при 1143/1140 см–1 и слабоинтенсивные полосы при 934/940 см–1 [39–41]. В свою очередь, полосы поглощения валентных колебаний связей C–H алкильных заместителей (νas(СН3), νs(СН3) и ν(СН)) отмечены соответственно при 2968/2974, 2869/2869 и 2925/2929 см–1 [42]. Типичными для изопропильных групп являются также деформационные колебания (δs), расщепленная полоса поглощения которых обычно проявляется около 1375 см–1 [43]; в обсуждаемых ИК-спектрах комплексов I/II к δs(–CH(СН3)2) отнесены полосы при 1379, 1366/1383, 1370 см–1.
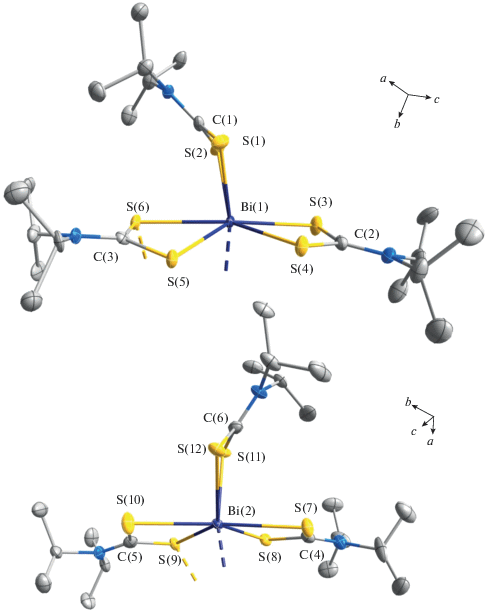
Структурная организация полученных соединений висмута(III) установлена прямым методом РСА. Элементарные ячейки комплексов I/II включают по две формульные единицы [Bi(S2CNiPr2)3]2/[Bi(S2CNiPr2)2][Bi(S2CNiPr2)Cl3] (табл. 1, рис. 1, 2). Основной структурной единицей I является псевдобиядерное образование [Bi(S2CNiPr2)3]2 (рис. 3), в состав которого входят две структурно-неэквивалентные молекулы [Bi(S2CNiPr2)3], включающие по совокупности шесть неэквивалентных iPr2Dtc-лигандов. Для лигандов характерна S,S'-анизобидентатно-терминальная координация, одна из связей Bi–S (2.630–2.801 Å) заметно короче другой (2.878–2.970 Å), что приводит к построению четырехчленных металлоциклов [BiS2C] и сопровождается формированием для металлических атомов шестерного окружения [BiS6]. Нужно отметить, что в четырех металлоциклах [BiS2C] значения торсионных углов Bi–S–S–C (табл. 2) указывают на относительно небольшое отклонение атомов от плоскостной конфигурации, тогда как геометрия двух других – [Bi(1)S(1)S(2)C(1)] и [Bi(2)S(11)S(12)C(6)] – соответствует конформации “бабочка” (рис. 4): оба обсуждаемых цикла характеризуются перегибом вдоль оси S–S, углы между плоскостями полуциклов [BiSS] и [SSC] составляют 145.9° и 149.5° соответственно. Рассмотрение неэквивалентных моноядерных молекул [Bi(S2CNiPr2)3] позволяет отметить, что в каждой из них соответственные углы S(3)Bi(1)S(6) (154.93°) и S(7)Bi(2)S(10) (157.58°) в два раза превышают значения противолежащих углов S(4)Bi(1)S(5) (77.45°) и S(8)Bi(2)S(9) (74.42°). Это обстоятельство прямо указывает на эффект структурного влияния пространственно-направленной неподеленной пары электронов металла [44], что ранее наблюдалось нами не только в комплексах висмута(III) [24, 25], но и свинца(II) [45].
Рис. 1.
Проекция псевдобиядерной структуры I на плоскость bc. Пунктиром показаны вторичные связи Bi⋅⋅⋅S.
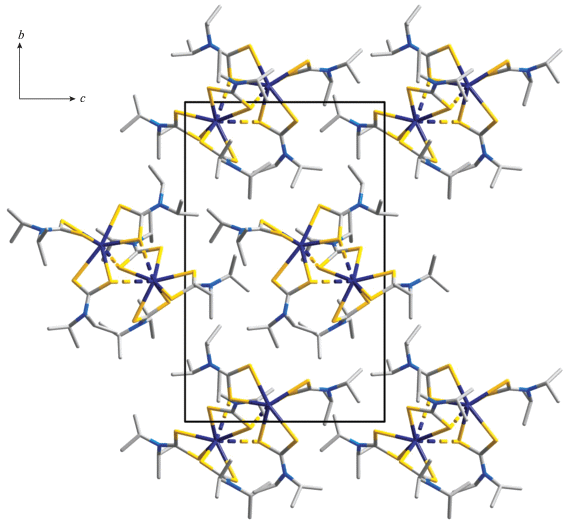
Рис. 2.
Проекция псевдополимерной структуры II на плоскость ac. Псевдополимерные цепи направлены вдоль оси a; пунктиром показаны вторичные связи Bi⋅⋅⋅S и Bi⋅⋅⋅Cl.
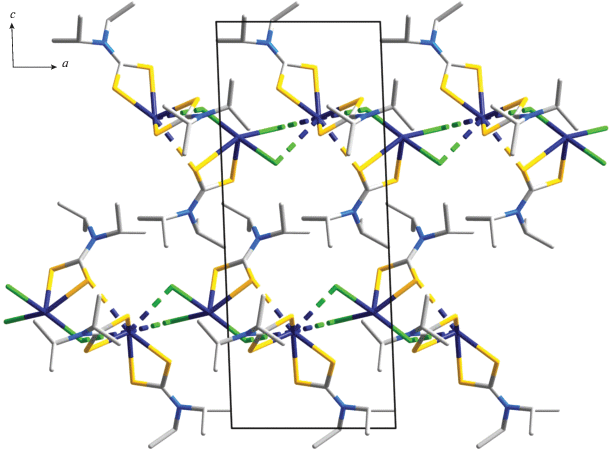
Рис. 3.
Молекулярная структура псевдодимера состава [Bi(S2CNiPr2)3]2 (I); пунктиром показаны вторичные связи Bi⋅⋅⋅S. Эллипсоиды 50%-ной вероятности; атомы водорода не приведены.
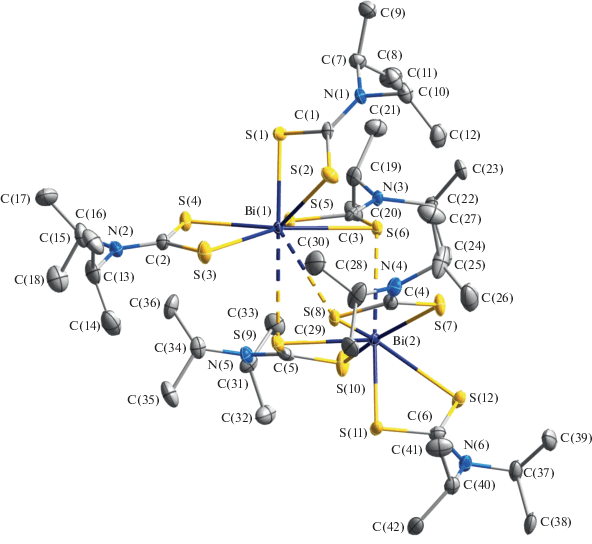
Рис. 4.
Строение моноядерных структурных фрагментов [Bi(S2CNiPr2)3], иллюстрирующее перегиб металлоциклов [Bi(1)S(1)S(2)C(1)] и [Bi(2)S(11)S(12)C(6)] вдоль оси S–S. Эллипсоиды 50%-ной вероятности; атомы водорода не приведены.
Несимметричное взаимное расположение неэквивалентных моноядерных молекул состава [Bi(S2CNiPr2)3] приводит к необычному способу формирования псевдодимера [Bi(S2CNiPr2)3]2 (межатомное расстояние Bi(1)–Bi(2) 4.1563(5) Å) при участии трех существенно неравноценных вторичных связей Bi⋅⋅⋅S22. Один из атомов висмута образует наиболее короткую межмолекулярную вторичную связь Bi(2)⋅⋅⋅S(6) длиной 3.140 Å; тогда как второй участвует в относительно слабом взаимодействии с двумя атомами серы: Bi(1)⋅⋅⋅S(9) 3.371 Å, Bi(1)⋅⋅⋅S(8) 3.464 Å. (Сумма ван-дер-ваальсовых радиусов атомов висмута33 и серы (1.80 Å [50]) значительно превышает длину каждой из обсуждаемых вторичных связей Bi⋅⋅⋅S.)
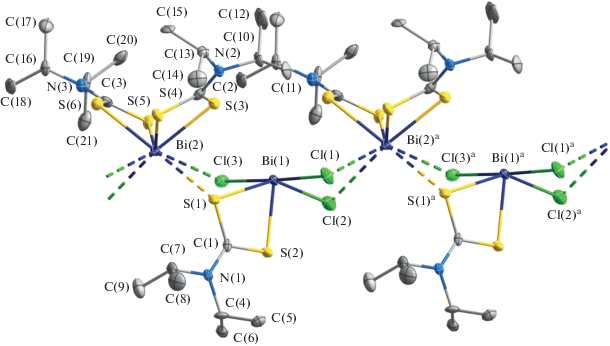
В комплексе II внутренняя сфера одного из атомов висмута включает два неэквивалентных S,S′-анизобидентатно-координированных iPr2Dtc-лиганда; тогда как второй, наряду с дитиокарбаматным лигандом, присоединяет три аниона Cl–. Таким образом, состав координационных сфер висмута(III) определяет ионную природу комплекса [Bi(S2CNiPr2)2][Bi(S2CNiPr2)Cl3]. При этом каждый из комплексных анионов за счет атомов хлора и серы, выполняющих μ2-мостиковую функцию, образует две пары вторичных связей: Bi(2)⋅⋅⋅S(1) 3.247 Å, Bi(2)⋅⋅⋅Cl(3) 3.182 Å и Bi(2)a⋅⋅⋅Cl(1) 3.190 Å, Bi(2)a⋅⋅⋅Cl(2) 3.203 Å (табл. 2) с двумя ближайшими соседями – противоионами [Bi(S2CNiPr2)2]+. Результатом совместного проявления этих взаимодействий является формирование зигзагообразной псевдополимерной цепи (угол BiBiBi 148.084(13)°, межатомное расстояние Bi(1)–Bi(2) 4.2999(7) Å), включающей чередование катионных и анионных структурных единиц (рис. 5). Дополнительный вклад в межионное связывание и общую структурную стабилизацию обсуждаемой супрамолекулярной цепи вносят также вторичные связи S⋅⋅⋅Cl, наиболее значимыми из которых являются S(4)a⋅⋅⋅Cl(1) 3.204(5) Å и S(5)⋅⋅⋅Cl(3) 3.395(5) Å (для сравнения: сумма ван-дер-ваальсовых радиусов атомов серы и хлора составляет 3.55 Å [50]), и относительно слабое взаимодействие Bi(1)⋅⋅⋅S(6)a 3.515(3) Å.
Рис. 5.
Четырехзвенный фрагмент псевдополимерной цепи ([Bi(S2CNiPr2)2][Bi(S2CNiPr2)Cl3])n; пунктиром показаны вторичные связи Bi⋅⋅⋅S и Bi⋅⋅⋅Cl. Эллипсоиды 50%-ной вероятности; атомы водорода не приведены.
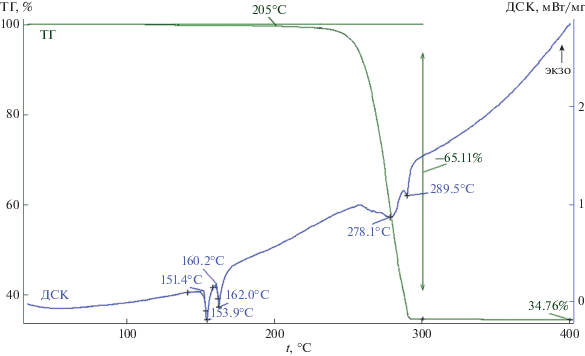
Термическое поведение I и II было изучено методом СТА (ТГ + ДСК) в атмосфере аргона. Кривые ТГ указывают на термическую устойчивость комплексов I/II до ∼205/160°С, после чего фиксируют начало плавной потери массы (рис. 6, 7). Несмотря на сложный характер протекания термолиза дитиокарбаматных комплексов [51, 52], основная потеря массы I (65.11%) формально проходит в одну стадию на крутопадающем участке кривой ТГ (230–295°С) с максимальной скоростью потери массы при 280.4°С. При 300°С масса остаточного вещества практически стабилизируется и по завершении измерений составляет 34.76%, что полностью согласуется с расчетным значением для Bi2S344 34.84%. По данным сканирующей электронной микроскопии, остаточное вещество (после термолиза комплекса I) представляет собой совокупность микрокристаллических пластинок и игл, собранных в пучки (рис. 8а). При качественном определении химического состава, выполненного методом микрозонда с применением энергодисперсионного спектрометра, показано присутствие в энергодисперсионных спектрах исследуемого вещества характеристических пиков висмута и серы (рис. 8a), что также подтверждает образование Bi2S3.
Рис. 8.
Размер, форма частиц и энергодисперсионные спектры остаточных веществ после термолиза комплексов I/II: Bi2S3 (а)/совокупности Bi2S3 и BiCl3 (б).

В низкотемпературной области, еще до начала потери массы, кривая ДСК кристаллов I (рис. 6) обнаруживает два эндоэффекта с экстремумами при 153.9 и 162.0°С. Последний обусловлен плавлением образца (экстраполированная tпл = = 160.2°С; плавление в капилляре при 163–164°С). Нагрев исследуемого образца в стеклянном капилляре показал, что в температурном диапазоне проявления первого эндоэффекта (150–158°С) вещество приобретает вид стекловидной массы, что, вероятно, обусловлено разрыхлением его кристаллической решетки. В пользу этого говорит следующее обстоятельство: кривая ДСК порошка диизопропилдитиокарбамата висмута(III), полученного осаждением из водной фазы, регистрирует в обсуждаемой температурной области только уширенный асимметричный эндоэффект плавления с экстремумом при 164.6°С. Кроме того, на участке кривой ДСК (рис. 6), который проецируется на крутопадающую ступень кривой ТГ, отмечены эндоэффекты (с экстремумами при 278.1 и 289.5°С), отражающие сложный характер протекания формально одностадийного процесса термолиза I и испарение летучих продуктов разложения.
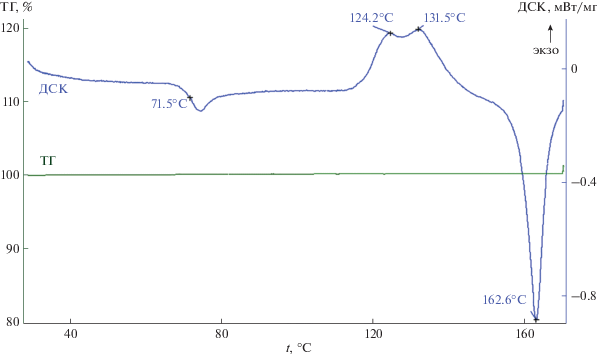
Для получения дополнительной информации о низкотемпературных эндоэффектах, обсуждавшихся выше, кристаллы комплекса I исследовали в программируемом режиме нагрев–охлаждение–нагрев: нагревали со скоростью 10 град/мин до 176.8°С с последующим охлаждением со скоростью 10 град/мин до 50°С (экзоэффект кристаллизации расплава не наблюдался) и повторным нагревом до 170°С (эндоэффекты, наблюдавшиеся при первичном нагреве, зарегистрировать также не удалось). При вскрытии тигля был обнаружен затвердевший расплав оранжевого цвета, который был оставлен на 24 дня. По истечении этого времени для исследуемого образца была получена типичная для аморфных веществ термограмма (рис. 9), включавшая эффект стеклования комплекса I при tg = 71.5°С [54] с последующей кристаллизацией метастабильной фазы при 124.2°С [55]. Двойной пик кристаллизации, вероятно, свидетельствует об экзотермическом переходе метастабильной фазы в более устойчивую (131.5°С) с последующим ее плавлением при 162.6°С [56].
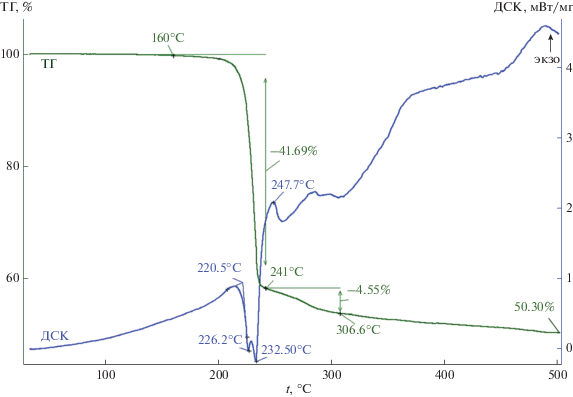
Кривая ТГ комплекса II фиксирует две ступени потери массы (рис. 7). Основная потеря массы (41.69%), наблюдаемая в температурном диапазоне 200–241°С, указывает на термолиз комплекса одновременно по катиону и аниону; максимальная скорость потери массы приходится на 231°С. На кривой ДСК (рис. 7) обсуждаемый процесс отражают два частично перекрывающихся эндоэффекта с экстремумами при 226.2 и 232.5°С. (В низкотемпературной области ДСК термический эффект, связанный с плавлением образца, не регистрируется; попытка определения tпл комплекса II в капилляре также подтвердила отсутствие признаков плавления образца). Последующий экзоэффект (при 247.7°С), проецируемый на самое начало второй, слабо выраженной, ступени потери массы (рис. 7), следует отнести к кристаллизации образовавшегося Bi2S3. Таким образом, вторая ступень (4.55%; 241.0–306.6°С) и последующий пологий участок потери массы (3.46%; 306.6–500.0°С) на кривой ТГ обусловлены испарением летучих продуктов термодеструкции II. По завершении процесса (500.0°С) остаточная масса образца составила 50.30%. При вскрытии тигля на дне обнаружены вспученные пластинки серо-черного цвета, микрокристаллическая структура которых выявлена методом электронной микроскопии (рис. 8б). Энергодисперсионные спектры, в свою очередь, показывают присутствие в исследуемом веществе Bi, S и Cl (рис. 8б), что указывает на образование двух финальных продуктов: Bi2S3 и BiCl3. При этом логично предположить, что первый является результатом термолиза комплекса II по катиону [Bi(S2CNiPr2)2]+, тогда как высвобождение второго обусловлено термодеструкцией аниона [Bi(S2CNiPr2)Cl3]–. В этом случае остаточная масса должна составить 54.35%: 24.41% (½Bi2S3) + + 29.94% (BiCl3), определяя потерю массы в 45.65%. Суммарная потеря массы по двум ступеням дает несколько завышенное значение (46.24%), что можно объяснить начавшимся испарением BiCl3 (tпл = 234°С, tкип = 440°С [57]); ранее [6] нами было показано, что испарение компактного BiCl3 начинается именно при 234°С. Последующий пологий участок кривой ТГ (306.6–500.0°С) также обусловлен продолжающимся испарением трихлорида висмута, понижая его долю до 25.89%.
ЗАКЛЮЧЕНИЕ
Получены и препаративно выделены новые соединения: диизопропилдитиокарбамат висмута(III) [Bi(S2CNiPr2)3]2 и дитиокарбаматно-хлоридный комплекс [Bi(S2CNiPr2)2][Bi(S2CNiPr2)Cl3] ионного типа. Первое представляет собой псевдодимер, включающий два структурно-неэквивалентных моноядерных фрагмента, объединенных существенно неравноценными вторичными связями Bi⋅⋅⋅S. Второе формирует супрамолекулярную псевдополимерную цепь из чередующихся ионных структурных единиц, связанных множественными вторичными связями Bi⋅⋅⋅S, Bi⋅⋅⋅Cl и S⋅⋅⋅Cl.
Исследование термического поведения полученных комплексов, выполненное методом СТА, позволило установить характер протекания термолиза и получить его финальные продукты. Показано, что соединения I/II являются удобными прекурсорами при получении микрокристаллических Bi2S3/(Bi2S3 + BiCl3), которые были идентифицированы методами рентгенодисперсионного микроанализа и электронной микроскопии.
Список литературы
Nomura R., Kanaya K., Matsuda H. // Bull. Chem. Soc. Jpn. 1989. V. 62. № 3. P. 939. https://doi.org/10.1246/bcsj.62.939
Monteiro O.C., Nogueira H.I.S., Trindade T., Motevalli M. // Chem. Mater. 2001. V. 13. № 6. P. 2103. https://doi.org/10.1021/cm000973y
Chauhan R., Chaturvedi J., Trivedi M. et al. // Inorg. Chim. Acta. 2015. V. 430. P. 168. https://doi.org/10.1016/j.ica.2015.03.007
Abdullah N.H., Zainal Z., Silong S. et al. // Thermochim. Acta. 2016. V. 632. P. 37. https://doi.org/10.1016/j.tca.2016.03.001
Tamilvanan S., Gurumoorthy G., Thirumaran S., Ciattini S. // Polyhedron. 2017. V. 123. P. 111. https://doi.org/10.1016/j.poly.2016.10.026
Ivanov A.V., Gerasimenko A.V., Egorova I.V. et al. // Russ. J. Сoord. Chem. 2018. V. 44. № 8. P. 518. [Иванов А.В., Герасименко А.В., Егорова И.В. и др. // Коорд. химия. 2018. Т. 44. № 4. С. 266.]https://doi.org/10.1134/S1070328418080043
Onwudiwe D.C., Oyewo O.A., Atamtürk U. et al. // J. Environ. Chem. Eng. 2020. V. 8. № 4. P. 103816. https://doi.org/10.1016/j.jece.2020.103816
Salvador J.A.R., Figueiredo S.A.C., Pinto R.M.A., Silvestre S.M. // Future Med. Chem. 2012. V. 4. № 11. P. 1495. https://doi.org/10.4155/fmc.12.95
Li H., Lai C.S., Wu J. et al. // J. Inorg. Biochem. 2007. V. 101. № 5. P. 809. https://doi.org/10.1016/j.jinorgbio.2007.01.010
Ishak D.H.A., Ooi K.K., Ang K.-P. et al. // J. Inorg. Biochem. 2014. V. 130. P. 38. https://doi.org/10.1016/j.jinorgbio.2013.09.018
Arda M., Ozturk I.I., Banti C.N. et al. // RSC Adv. 2016. V. 6. № 35. P. 29026. https://doi.org/10.1039/C6RA01181K
Chan P.F., Ang K.P., Hamid R.A. // Biometals. 2021. V. 34. № 2. P. 365. https://doi.org/10.1007/s10534-021-00286-0
Chauhan H.P.S., Joshi S., Carpenter J. // J. Therm. Anal. Calorim. 2016. V. 124. № 1. P. 117. https://doi.org/10.1007/s10973-015-5164-1
Tamilvanan S., Gurumoorthy G., Thirumaran S., Ciattini S. // Polyhedron. 2017. V. 121. P. 70. https://doi.org/10.1016/j.poly.2016.09.038
Ariza-Roldán A.O., López-Cardoso E.M., Rosas-Valdez M.E. et al. // Polyhedron. 2017. V. 134. P. 221. https://doi.org/10.1016/j.poly.2017.06.017
Adeyemi J.O., Onwudiwe D.C. // Molecules. 2020. V. 25. № 2. P. 305. https://doi.org/10.3390/molecules25020305
Ferreira I.P., de Lima G.M., Paniago E.B., Takahashi J.A., Pinheiro C.B. // J. Coord. Chem. 2014. V. 67. № 6. P. 1097. https://doi.org/10.1080/00958972.2014.908188
Zaeva A.S., Ivanov A.V., Gerasimenko A.V., Sergienko V.I. // Russ. J. Inorg. Chem. 2015. V. 60. № 2. P. 203. [Заева А.С., Иванов А.В., Герасименко А.В., Сергиенко В.И. // Журн. неорган. химии. 2015. Т. 60. № 2. С. 243.]https://doi.org/10.1134/S0036023615020229
Zaeva A.S., Ivanov A.V., Gerasimenko A.V. // Russ. J. Coord. Chem. 2015. V. 41. № 10. P. 644. [Заева А.С., Иванов А.В., Герасименко А.В. // Коорд. химия. 2015. Т. 41. № 10. С. 590.]https://doi.org/10.1134/S1070328415090109
Venkatachalam V., Ramalingam K., Casellato U., Graziani R. // Polyhedron. 1997. V. 16. № 7. P. 1211. https://doi.org/10.1016/S0277-5387(96)00362-2
Lai C.S., Tiekink E.R.T. // Z. Kristallogr. 2007. V. 222. № 10. P. 532. https://doi.org/10.1524/zkri.2007.222.10.532
Li F., Yin H.-D., Zhai J., Wang D.-Q. // Acta Crystallogr. E. 2006. V. 62. № 5. P. m1083. https://doi.org/10.1107/S1600536806013626
Sivasekar S., Ramalingam K., Rizzoli C., Alexander N. // Inorg. Chim. Acta. 2014. V. 419. P. 82. https://doi.org/10.1016/j.ica.2014.04.042
Ivanov A.V., Egorova I.V., Ivanov М.А. et al. // Dokl. Phys. Chem. 2014. V. 454. № 1. P. 16. [Иванов А.В., Егорова И.В., Иванов М.А. и др. // Докл. АН. 2014. Т. 454. № 2. С. 190.]https://doi.org/10.1134/S0012501614010059
Gowda V., Sarma B., Laitinen R.S. et al. // Polyhedron. 2017. V. 129. P. 123. https://doi.org/10.1016/j.poly.2017.03.018
Gowda V., Sarma B., Larsson A.-C. et al. // Chem. Select. 2020. V. 5. № 29. P. 8882. https://doi.org/10.1002/slct.202001692
Koh Y.W., Lai C.S., Du A.Y. et al. // Chem. Mater. 2003. V. 15. № 24. P. 4544. https://doi.org/10.1021/cm021813k
Ozturk I.I., Banti C.N., Kourkoumelis N. et al. // Polyhedron. 2014. V. 67. P. 89. https://doi.org/10.1016/j.poly.2013.08.052
Jamaluddin N.A., Baba I., Halim S.N.A., Tiekink E.R.T. // Z. Kristallogr. NCS. 2015. V. 230. № 3. P. 239. https://doi.org/10.1515/ncrs-2015-0008
Novikova E.V., Ivanov A.V., Egorova I.V. et al. // Russ. J. Coord. Chem. 2019. V. 45. № 10. P. 695. [Новикова Е.В., Иванов А.В., Егорова И.В. и др. // Коорд. химия. 2019. Т. 45. № 10. С. 599.]https://doi.org/10.1134/ S1070328419100038
Novikova E.V., Isakovskaya K.L., Antzutkin O.N., Ivanov A.V. // Russ. J. Сoord. Chem. 2021. V. 47. № 1. P. 43. [Новикова Е.В., Исаковская К.Л., Анцуткин О.Н., Иванов А.В // Коорд. химия. 2021. Т. 47. № 1. С. 48.]https://doi.org/10.1134/S1070328421010036
Bharadwaj P.K., Lee A.M., Skelton B.W. et al. // Aust. J. Chem. 1994. V. 47. № 2. P. 405. https://doi.org/10.1071/CH9940405
Raston C.L., Rawbottom G.L., White A.H. // Dalton Trans. 1981. № 6. P. 1379. https://doi.org/10.1039/DT9810001379
Ivanov A.V., Korneeva E.V., Bukvetskii B.V. et al. // Russ. J. Сoord. Chem. 2008. V. 34. № 1. P. 59. [Иванов А.В., Корнеева Е.В., Буквецкий Б.В. и др. // Коорд. химия. 2008. Т. 34. № 1. С. 61.]https://doi.org/10.1134/S1070328408010107
Бырько В.М. Дитиокарбаматы. М.: Наука, 1984. 341 с.
Sheldrick G.M. // Acta Crystallogr., Sect. A. 2015. V. 71. № 1. P. 3. https://doi.org/10.1107/S2053273314026370
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Crystallogr. 2009. V. 42. № 2. P. 339. https://doi.org/10.1107/S0021889808042726
Angeloski A., Baker A.T., Bhadbhade M., McDonagh A.M. // J. Mol. Struct. 2016. V. 1113. P. 127. https://doi.org/10.1016/j.molstruc.2016.02.028
Yin H.D., Li F., Wang D. // J. Coord. Chem. 2007. V. 60. № 11. P. 1133. https://doi.org/10.1080/00958970601008846
Brown D.A., Glass W.K., Burke M.A. // Spectrochim. Acta A. 1976. V. 32. № 1. P. 137. https://doi.org/10.1016/0584-8539(76)80059-1
Kellner R., Nikolov G.S., Trendafilova N. // Inorg. Chim. Acta. 1984. V. 84. № 2. P. 233. https://doi.org/10.1016/S0020-1693(00)82413-5
Казицына Л.A., Куплетская Н.Б. Применение УФ-, ИК-, ЯМР- и масс-спектроскопии в органической химии. М.: Изд-во Моск. ун-та, 1979. 240 с.
Гремлих Г.У. Язык спектров. Введение в интерпретацию спектров органических соединений. М.: ООО “Брукер Оптик”, 2002. 93 с.
Gillespie R.J., Nyholm R.S. // Quart. Rev. Chem. Soc. 1957. V. 11. № 4. P. 339.
Larsson A.-C., Ivanov A.V., Antzutkin O.N. et al. // Inorg. Chim. Acta. 2004. V. 357. № 9. P. 2510. https://doi.org/10.1016/j.ica.2003.12.045
Alcock N.W. // Adv. Inorg. Chem. Radiochem. 1972. V. 15. № 1. P. 1. https://doi.org/10.1016/S0065-2792(08)60016-3
Batsanov S.S. // Inorg. Mater. 2001. V. 37. № 9. P. 871. [Бацанов С.С. // Неорган. материалы. 2001. Т. 37. № 9. С. 1031.]https://doi.org/10.1023/A:1011625728803
Hu S.-Z., Zhou Z.-H., Robertson B.E. // Z. Kristallogr. 2009. V. 224. № 8. P. 375. https://doi.org/10.1524/zkri.2009.1158
Alvarez S. // Dalton Trans. 2013. V. 42. № 24. P. 8617. https://doi.org/10.1039/C3DT50599E
Bondi A. // J. Phys. Chem. 1964. V. 68. № 3. P. 441. https://doi.org/10.1021/j100785a001
Скачков Б.К., Олейник С.П., Матына Л.И. и др. // Докл. АН СССР. 1988. Т. 302. № 5. С. 1149.
Олейник С.П., Матына Л.И., Чистяков Ю.Д. и др. // Докл. АН СССР. 1989. Т. 307. № 6. С. 1411.
Разуваев Г.А., Алмазов Г.В., Домрачев Г.А. и др. // Докл. АН СССР. 1987. Т. 294. № 1. С. 141.
Widmann G. // Thermochim. Acta. 1987. V. 112. № 1. P. 137. https://doi.org/10.1016/0040-6031(87)88093-0
Wunderlich B. Thermal Analysis of Polymeric Materials. Berlin-Heidelberg: Springer-Verlag, 2005. 894 p.
Perrenot B., Widmann G. // Thermochim. Acta. 1994. V. 234. P. 31. https://doi.org/10.1016/0040-6031(94)85133-6
Лидин Р.А., Андреева Л.Л., Молочко В.А. Константы неорганических веществ: справочник. М.: Дрофа, 2008. 685 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии