Журнал неорганической химии, 2021, T. 66, № 8, стр. 1017-1024
ГИДРОТЕРМАЛЬНЫЙ СИНТЕЗ И СВОЙСТВА НАНОКОМПОЗИТОВ ХИТОЗАН-СЕРЕБРО
К. С. Гилевская a, *, М. Е. Машкин a, А. Н. Красковский a, О. В. Кабанова a, Е. А. Степанова b, И. И. Кузьминский b, В. И. Куликовская a, В. Е. Агабеков a
a Институт химии новых материалов НАН Беларуси
220141 Минск, ул. Ф. Скорины, 36, Беларусь
b Институт экспериментальной ветеринарии им. С.Н. Вышелесского
220063 Минск, ул. Брикета, 28, Беларусь
* E-mail: k_hilevskay@mail.ru
Поступила в редакцию 05.02.2021
После доработки 10.03.2021
Принята к публикации 11.03.2021
Аннотация
Предложен способ получения нанокомпозитов хитозан-Ag методом гидротермального синтеза в соответствии с принципами “зеленой химии”. В качестве восстановителя и стабилизатора частиц использовали хитозаны с различной молекулярной массой (от 20 до 1200 кДа). Синтезированные нанокомпозиты хитозан-Ag исследованы методами УФ-Вид- и ИК-спектроскопии, рентгенофазового анализа и просвечивающей электронной микроскопии. Нанокомпозиты представляют собой структуру ядро–оболочка, имеют сферическую форму, размер до 60.0 нм и величину ξ-потенциала >40.0 мВ. Установлены оптимальные параметры синтеза (время, температура, молекулярная масса хитозана) наночастиц хитозан-Ag с наибольшей антимикробной активностью в отношении грамположительных и грамотрицательных бактерий и грибов.
ВВЕДЕНИЕ
Одна из быстро развивающихся областей современной нанотехнологии – создание и использование нанокомпозитов на основе металлических частиц и полимеров в качестве противомикробных препаратов [1 ] . Они должны объединять в себе такие свойства, как высокая антибактериальная активность, экологичность, низкая токсичность, безопасность, простота изготовления и использования.
Особое внимание в последнее время уделяется материалам на основе наночастиц (НЧ) серебра [2 ] , которые обладают бактерицидным и противогрибковым действием [3 ] . К настоящему моменту в литературе описано большое количество методов синтеза (традиционных и нетрадиционных) НЧ серебра [2 ] . Однако в связи с мировой тенденцией экологизации производства актуальной является разработка “зеленых” методов синтеза наночастиц. В качестве полимерных стабилизаторов синтезируемых НЧ серебра в таких случаях широко используются полисахариды, например хитозан, который обладает широким спектром физиологической активности, в том числе антибактериальной [4–6 ] . Эти свойства в сочетании с высокой сорбционной емкостью и низкой токсичностью хитозана для организма животных и человека служат основанием для его использования при разработке лечебно-профилактических и дезинфицирующих препаратов. Кроме собственного антибактериального действия хитозан также способен повышать чувствительность к антибиотикам некоторых устойчивых к ним микроорганизмов [7 ] .
На сегодняшний день существует ряд исследований [8–13 ] , посвященных методам синтеза и изучению свойств нанокомпозитов хитозан-серебро. Показано, что форма, морфология и кристалличность таких частиц зависят от условий их синтеза.
Цель настоящей работы – получение наночастиц серебра методом гидротермального синтеза в присутствии хитозана, исследование их физико-химических свойств и оценка антимикробного потенциала.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Нанокомпозиты хитозан-Ag получали методом “зеленой химии” путем химического восстановления нитрата серебра хитозаном. Использовали хитозаны с молекулярной массой от 20 до 1200 кДа и степенью дезацетилирования (СД) от 75 до 98% (табл. 1). Для проведения реакции в гомогенных условиях в качестве растворителя для хитозана использовали 2%-ный раствор уксусной кислоты (х. ч.). К раствору хитозана (10 мг/мл) при перемешивании добавляли раствор нитрата серебра (2мМ), через 15 мин реакционную смесь помещали в автоклав. Гидротермальный синтез проводили в паровом стерилизаторе ГК-100-3 (ТЗМОИ, Россия). Полученные гидрозоли очищали диализом против дистиллированной воды.
Таблица 1.
Номенклатурный перечень и характеристики используемых хитозанов
| Параметр | Хит20 | Хит30 | Хит250 | Хит340 | Хит800 | Хит1200 |
|---|---|---|---|---|---|---|
| Mw, кДа | 20 | 30 | 250 | 340 | 800 | 1200 |
| СД, % | 98.1 | 98.3 | 98.5 | 74.8 | 75.4 | 89.0 |
| Концентрация NH2-групп, ммоль/г хитозана | 6.05 | 6.07 | 6.09 | 4.36 | 4.40 | 5.37 |
Измерения гидродинамического диаметра и величины ζ-потенциала синтезированных наночастиц проводили методом динамического светорассеивания с помощью анализатора Zetasizer Nano-ZS (Malvern, Великобритания). Измерения проводили для предварительно разбавленных в 10 раз образцов.
Спектры оптического поглощения гидрозолей хитозан-Ag регистрировали с помощью спектрофлуориметра CM2203 (Солар, Беларусь) при длине волны λ = 400–700 нм.
Морфологию частиц изучали методом просвечивающей электронной микроскопии (ПЭМ) на электронном микроскопе HD-2700 (Hitachi, Япония).
Рентгенофазовый анализ (РФА) образцов проводили на дифрактометре ДРОН-3 (Россия).
ИК-спектры синтезированных композитов записывали на ИК-Фурье-спектрометре Tensor 27 (Bruker, Германия) в диапазоне частот 4000–400 см–1. Образцы для исследования готовили в виде таблеток с KBr.
Скрининг антимикробной активности проводили диско-диффузионным методом (модификация лунок). Минимальную ингибирующую концентрацию (МИК) определяли по стандартной методике методом двойных разведений: в лунки планшета, содержащие питательную среду (МПБ) и инокулят-тест бактерий в концентрации 106 КОЕ/мл, добавляли исследуемый нанокомпозит хитозан-Ag с уменьшающейся концентрацией. Необходимую концентрацию суспензии тест-организма получали методом серийных разведений. Результаты оценивали через 24 ч инкубации при 37°С по накоплению бактериальной биомассы в МПБ путем измерения оптической плотности на спектрофотометре при длине волны λ = 525 нм. Минимальной ингибирующей концентрацией считали минимальную концентрацию препарата, которая ингибирует рост микроорганизмов.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Спектры поглощения синтезированных гидрозолей приведены на рис. 1. В них регистрируется полоса поверхностного плазмонного резонанса (ППР), что подтверждает формирование наночастиц серебра (Ag0). Известно [14, 15 ] , что анализ формы, интенсивности и значения длины волны максимума ППР (λmax) позволяет оценить габитус наночастиц серебра и их распределение. Увеличение размера частиц приводит к сдвигу λmax в длинноволновую область, при анизотропии частиц можно наблюдать асимметричную форму ППР, а уширение ППР часто обусловлено увеличением полидисперсности образца. В нашем случае спектральный максимум находится в диапазоне 410–424 нм (рис. 1), что соответствует ППР изолированных и слабовзаимодействующих наночастиц серебра. Положение и форма полосы ППР указывают также на формирование сферических НЧ Ag с размерами ≤100 нм [14–16 ] : а – 20, б – 30, в – 250, г – 340, д – 800, е – 1200 кДа; разведение гидрозолей в 10 (*), 2 (**) и 5 (***) раз.
Рис. 1.
Спектры поглощения гидрозолей хитозан-Ag, синтезированных на основе хитозанов с различной молекулярной массой: а – 20, б – 30, в – 250, г – 340, д – 800, е – 1200 кДа. Разведение гидрозолей в 10 (*), 2 (**) и 5 (***) раз.
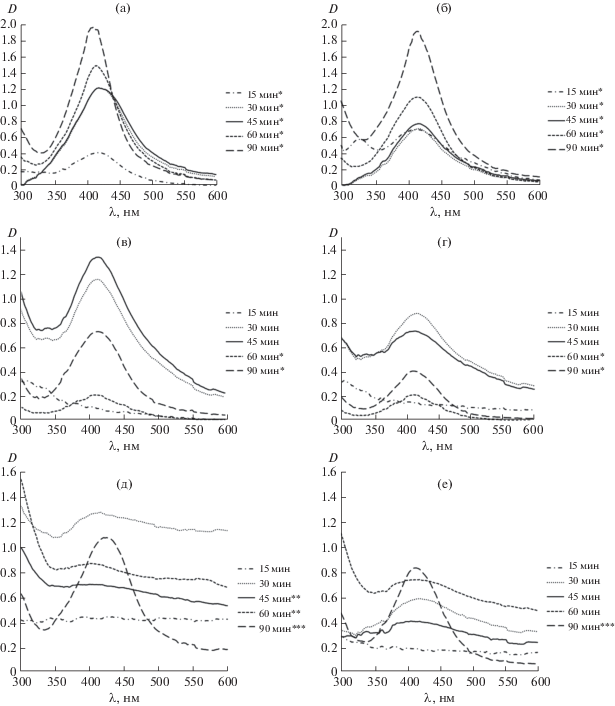
Форма полосы ППР и значение λmax зависят от времени синтеза и молекулярной массы хитозана. Независимо от молекулярной массы используемого хитозана интенсивность ППР возрастает с увеличением времени синтеза, это связано с ростом концентрации восстановленного серебра в реакционной смеси. В присутствии Хит20 с увеличением времени синтеза наблюдается значительный сдвиг полосы ППР в коротковолновую область от 420 до 409 нм (рис. 1а), т.е. повышается содержание более мелких частиц серебра.
В спектре поглощения наночастиц Хит30-Ag, синтезированных в течение 15 мин, наблюдаются два максимума (рис. 1б). Это связано с присутствием в синтезированном гидрозоле серебра в различном дисперсном состоянии кластеров ${\text{Ag}}_{{\text{8}}}^{{{\text{2}} + }}$ c оптическим поглощением при λ = 328 нм [17 ] и наночастиц Ag0 с максимумом поглощения при λ = 416 нм. С увеличением времени гидротермальной обработки полоса поглощения кластеров исчезает, а в спектрах регистрируется одиночный интенсивный пик, характерный для высокодисперсного наноразмерного серебра (рис. 1б). При этом наблюдается незначительный гипсохромный сдвиг λmax.
Для спектров нанокомпозитов на основе Хит250 и Хит340 по сравнению с нанокомпозитами на основе низкомолекулярных хитозанов (20 и 30 кДа) характерны более широкие полосы ППР с меньшей (в ~2 и 5 раз соответственно) интенсивностью (рис. 1в, 1г). Время синтеза не оказывает существенного влияния на значение λmax нанокомпозитов на основе Хит250 (λmax = 412 нм), в то время как в спектрах Хит340 наблюдается сдвиг максимума в коротковолновую область от 416 до 411 нм (рис. 1г).
Для гидрозолей нанокомпозитов на основе высокомолекулярных хитозанов (800 и 1200 кДа) характерны опалесценция и высокая оптическая плотность (рис. 1д, 1е). Следует отметить, что в спектрах этих нанокомпозитов выраженная широкая полоса ППР регистрируется лишь после гидротермальной обработки в течение 90 мин (рис. 1д, 1е). При этом для нанокомпозитов Хит800-Ag наблюдается сдвиг максимума ППР в длинноволновую область до 420–424 нм, что указывает на формирование более крупных частиц или их агрегацию.
Максимальной восстанавливающей способностью по отношению к ионам Ag+ обладают низкомолекулярные хитозаны (20 и 30 кДа), при этом наибольшая концентрация восстановленного серебра наблюдается при времени синтеза 60 и 90 мин. С увеличением молекулярной массы хитозана снижается эффективность восстановления серебра и увеличивается степень полидисперсности гидрозолей (рис. 1).
Синтезированные нанокомпозиты имеют положительный ξ-потенциал поверхности (табл. 2), обусловленный наличием заряженных аминогрупп хитозана. Известно [18 ] , что значение ξ-потенциала является критерием устойчивости дисперсных систем: чем больше ξ-потенциал, тем выше агрегативная устойчивость системы. Порогом коагуляции является значение ξ-потенциала, равное 25–30 мВ [18 ] . Величина ξ-потенциала частиц хитозан-Ag составляет 42–65 мВ, что свидетельствует об их высокой агрегативной устойчивости за счет стабилизирующего действия биополимера хитозана.
Таблица 2.
Значение ξ-потенциала синтезированных нанокомпозитов хитозан-Ag
| Mwхит, кДа | Время синтеза, мин | ||||
|---|---|---|---|---|---|
| 15 | 30 | 45 | 60 | 90 | |
| 20 | 50.1 ± 2.5 | 44.8 ± 1.1 | 42.1 ± 0.3 | 45.2 ± 0.2 | 50.8 ± 3.2 |
| 30 | 56.3 ± 1.4 | 52.7 ± 1.1 | 54.8 ± 0.2 | 48.4 ± 1.6 | 46.8 ± 0.5 |
| 250 | 58.9 ± 3.4 | 60.7 ± 2.1 | 52.3 ± 4.8 | 58.7 ± 1.9 | 61.6 ± 7.1 |
| 340 | 63.3 ± 2.6 | 59.8 ± 0.1 | 58.2 ± 2.0 | 59.6 ± 0.8 | 57.5 ± 3.1 |
| 800 | 58.4 ± 0.8 | 54.2 ± 0.6 | 53.1 ± 0.1 | 57.4 ± 1.2 | 56.1 ± 3.0 |
| 1200 | 65.3 ± 9.9 | 58.9 ± 0.1 | 57.9 ± 2.8 | 55.3 ± 0.9 | 59.4 ± 0.1 |
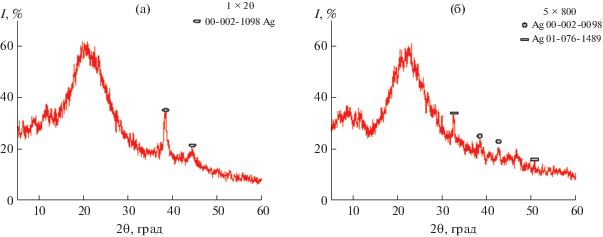
Согласно РФА, нанокомпозиты хитозан-Ag являются рентгеноаморфными (рис. 2). На дифрактограммах образцов наблюдается аморфное гало с широким пиком при 2θ ~ 22.5°, соответствующим хитозану, и рефлексами, характерными для кристаллического серебра: 27.81°, 32.25°, 38.15°, 44.3°, 46.21°, 54.83°, которые относятся к (210), (122), (111), (200), (231), (142) кристаллографическим плоскостям обычной кубической решетки Аg (JCPDS, file № 04-0783) [19, 20 ] .
Для понимания молекулярных взаимодействий серебра и хитозана записаны ИК-спектры исходных хитозанов и композитов на их основе (рис. 3). В ИК-спектре исходных хитозанов присутствуют характеристические пики при 3440–3430 см–1 (соответствуют валентным колебаниям O–H и N–H функциональных групп, вовлеченных во внутримолекулярные водородные связи), 2920 и 2879 см–1 (относятся к νs(C–H) и νas(C–H) соответственно), 1645–1641 см–1 (отвечают деформационным колебаниям N–H первичного амина) [21 ] . Наличие остаточных N-ацетильных групп подтверждается полосами поглощения с максимумами при 1656 см–1 (валентные колебания C=O в амидной группе, амид I) и 1323 см–1 (колебания C–N в амиде III). Пики при 1383 и 1084 см–1 обусловлены колебаниями С–О в первичных спиртах [21 ] . Полоса поглощения с максимумом при 1154 см–1 может быть отнесена к валентным асимметричным колебаниям C–O–C, а пик при 894 см–1 соответствует деформационным колебаниям С–Н глюкопиранозного кольца [22, 23 ] .
Рис. 3.
ИК-спектры исходных хитозанов 30 (1) и 800 кДа (3), нанокомпозитов Хит30-Ag (2) и Хит800-Ag (4).
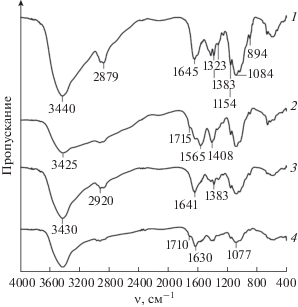
В ИК-спектрах нанокомпозитов хитозан-Ag увеличивается интенсивность полосы деформационных колебаний δ(NH2) при 1565 см–1, что свидетельствует о взаимодействии этих групп с серебром. Наблюдается также уменьшение интенсивности и гипсохромный сдвиг до 1630 см–1 полосы поглощения, относящейся к валентным колебаниям CONH2-группы. Полосы колебаний связей C–N и С–О сдвигаются в область низких частот до 1408 и 1077 см–1 соответственно. Эти изменения указывают на формирование координационных связей между ионами серебра и гидроксильными и аминогруппами хитозана, что коррелирует с данными [24 ] . Следует отметить, что в спектрах нанокомпозитов хитозан-Ag появляется новая характеристическая полоса валентных колебаний C=O при 1715–1710 см–1, обусловленная формированием кетонов, альдегидов и карбоксилов в реакции восстановления ионов серебра гидроксильными группами хитозана [10 ] . В то же время отсутствует пик при 817 см–1, характерный для ${\text{NO}}_{{\text{3}}}^{--}$-ионов [24 ] , что подтверждает эффективную очистку нанокомпозитов диализом против воды.
В длинноволновой области ИК-спектров нанокомпозитов хитозан-Ag по сравнению со спектром исходных хитозанов наблюдается уменьшение интенсивности и гипсохромный сдвиг полосы поглощения (за исключением образцов Хит800-Ag и Хит1200-Ag), являющейся суперпозицией полос валентных колебаний ν(OH) и ν(NH) хитозана, что доказывает взаимодействие этих групп с серебром. Наиболее интенсивное уменьшение полосы поглощения характерно для образцов на основе низкомолекулярных хитозанов, а величина сдвига максимума составляет 20 и 15 см–1 для Хит20-Ag и Хит30-Ag соответственно, в то время как для образцов Хит800-Ag и Хит1200-Ag изменения в длинноволновой области по сравнению с исходными хитозанами не столь значительны, а сдвиг максимума не наблюдается. Авторы [10 ] отмечают, что уменьшение интенсивности этой полосы тем больше, чем больше концентрация металлического серебра в образцах. Это согласуется с данными УФ-Вид-спектроскопии, согласно которым наиболее интенсивные пики ППР НЧ Ag0 регистрируются в образцах Хит20-Ag и Хит30-Ag.
Таким образом, в растворах хитозана в уксусной кислоте при давлении 1.5 атм происходит восстановление ионов серебра с образованием наночастиц хитозан-Ag, представляющих собой структуру металлическое ядро–полимерная оболочка (core-shell). Это подтверждают данные ПЭМ-анализа (рис. 4).
Рис. 4.
ПЭМ-изображения нанокомпозитов Хит20-Ag (а–в) и Хит800-Ag (г). Время синтеза 30 (а, б) и 60 мин (в, г).

Морфология частиц зависит от времени синтеза и молекулярной массы полимера. В образцах на основе низкомолекулярных хитозанов наблюдается бимодальное распределение: наряду с мелкими частицами (кластерами) серебра размером ≤8 нм присутствует фаза крупных металлических частиц (30–60 нм) (рис. 4а–4в), что нехарактерно для образцов на основе высокомолекулярных хитозанов (рис. 4г). Так, на микрофотографиях нанокомпозитов Хит800-Ag присутствуют крупные субмикронные агломераты (150–500 нм), состоящие из множества мелких сферических (20–50 нм) частиц металлического серебра в матрице полимера. Гидродинамический диаметр таких частиц составляет 704.0 ± 9.0 и 1356.0 ± 13.0 нм для Хит1200-Ag и Хит800-Ag соответственно.
Во всех случаях размер металлического ядра составляет <60 нм, что согласуется с данными спектрального анализа. Толщина полимерной оболочки образцов составляет ≤30 нм.
Гидродинамический диаметр (табл. 3) нанокомпозитов значительно превышает размеры, оцененные методом ПЭМ, это обусловлено высокой степенью гидратации хитозановой оболочки. Величина гидродинамического диаметра нанокомпозитов хитозан-Ag возрастает с увеличением молекулярной массы хитозана (табл. 3). Так, для низкомолекулярных хитозанов Хит20 и Хит30 величина DH находится в наноразмерном диапазоне и не превышает 150 нм. Для частиц серебра, стабилизированных хитозанами со средней молекулярной массой, значения гидродинамического диаметра составляют 300–500 нм. Наибольшие значения DH характерны для частиц на основе высокомолекулярных хитозанов. При этом максимальное значение DH, зарегистрированное для Хит800-Ag, вероятно, обусловлено образованием агрегатов частиц, которые вносят значительный вклад в интенсивность рассеивания света. Это согласуется с анализом данных, полученных методом ПЭМ (рис. 4г). Высокомолекулярные хитозаны по сравнению с низкомолекулярными имеют меньшие значения СД и меньшую концентрацию аминогрупп (табл. 1). Поэтому агрегирование и увеличение эффективного гидродинамического диаметра Хит800-Ag и Хит1200-Ag можно объяснить меньшей растворимостью высокомолекулярных хитозанов при рН 4 (значение рН гидрозолей после диализа). Так, авторы в работе [25 ] описывают эффект обратимого агрегирования наночастиц серебра, стабилизированных хитозаном, при повышении значения рН.
Таблица 3.
Гидродинамический диаметр частиц нанокомпозита хитозан-Ag, полученных после гидротермальной обработки в течение 60 мин
| Mwхит, кДа | DH, нм |
|---|---|
| 20 | 143.0 ± 4.0 |
| 30 | 129.0 ± 4.0 |
| 250 | 340.0 ± 20.0 |
| 340 | 490.0 ± 6.0 |
| 800 | 1356.0 ± 13.0 |
| 1200 | 704.0 ± 9.0 |
По сравнению с низкомолекулярными у высокомолекулярных хитозанов стабилизирующие свойства преобладают над восстанавливающими. Вероятным механизмом формирования наночастиц является предварительная фиксация ионов серебра на аминогруппах хитозана, а затем формирование НЧ серебра за счет восстановления гидроксогруппами полимера [10, 26]. Стабилизация частиц происходит на аминогруппах хитозана за счет образования химической связи между электронами атома азота и незаполненной орбиталью атома серебра [26]. Можно предположить, что различие в морфологии наночастиц Ag связано с конформационными различиями макромолекул хитозана. Так, по сравнению с высокомолекулярными низкомолекулярные хитозаны содержат большее количество аминогрупп (табл. 1), которые из-за наличия одноименного заряда отталкиваются и могут удаляться от центральных участков макромолекул хитозана, содержащих восстанавливающие гидроксильные группы [26]. В результате восстановленные кластеры серебра, менее стабилизированные в растворах низкомолекулярных хитозанов по сравнению с высокомолекулярными, образуют более крупные частицы. В случае высокомолекулярных хитозанов низкая степень восстановления может быть обусловлена стерической стабилизацией ионов серебра.
Проведенный скрининг антибактериальной активности синтезированных образцов в отношении широкого спектра штаммов условно-патогенных и патогенных микроорганизмов (Bacillus pumilus, Pseudomonas aeruginosa, Geobacillus, Proteus vulgaris, Staphylococcus aureus, Salmonella dublin, Escherichia coli, Candida albicans) показал, что наибольшая антимикробная активность характерна для образцов с максимальной концентрацией Ag0: Хит20-Ag и Хит30-Ag, синтезированных на основе низкомолекулярных хитозанов (20 и 30 кДа) при времени выдерживания в автоклаве 60 мин. Поэтому указанные образцы использовали в дальнейшем для изучения чувствительности микроорганизмов к нанокомпозитам хитозан-Ag. Методом серийных разведений установлено, что наибольшая чувствительность наблюдалась у E. coli (МИКAg = 1.1 мкг/мл), умеренная – у S. aureus и S. dublin (МИКAg = 4.25 мкг/мл), наименьшая – у P. vulgaris (МИКAg = 8.5 мкг/мл). Это согласуется с литературными данными об антимикробной активности гидрозолей хитозан-серебро, синтезированных электрохимическим методом [27]: МИКAg = 1.56 и 3.13 м.д. для E. coli и S. aureus соответственно. Сопоставимые значения МИК получены авторами [28] для суспензии нановолокон хитозана, допированных наночастицами Ag: 0.68 и 1.36 мг/л для E. coli и S. aureus соответственно. Полученные нами результаты также подтверждают большую резистентность грамположительных бактерий к наночастицам серебра, которую отмечают авторы в работах [27–29].
Анализ данных скрининга антимикробной активности синтезированных образцов свидетельствует о перспективности использования нанокомпозитов Хит20-Ag и Хит30-Ag как потенциальных протекторов при лечении различных бактериальных инфекций.
ЗАКЛЮЧЕНИЕ
Методом гидротермального синтеза получены нанокомпозиты хитозан-Ag в форме агрегативно устойчивых гидрозолей. Показано, что нанокомпозиты представляют собой структуру ядро–полимерная оболочка. Установлено, что наиболее полное восстановление Ag+ наблюдается при использовании низкомолекулярных хитозанов (20 и 30 кДа) и времени синтеза 60 и 90 мин. Оптимизированы условия синтеза для получения нанокомпозита хитозан‑Ag с максимальной антимикробной активностью. Полученные материалы перспективны для использования в качестве антимикробных компонентов в фармацевтической, парфюмерно-косметической отраслях и пищевой промышленности.
Список литературы
Correa M.G., Martínez F.B., Vidal C.P. et al. // Beilstein J. Nanotechnol. 2020. V. 11. P. 1450. https://doi.org/10.3762/bjnano.11.129
Krutyakov Y.A., Kudrinskiy A.A., Olenin A.Y. et al. // Russ. Chem. Rev. 2008. V. 77. P. 233. https://doi.org/10.1070/RC2008v077n03ABEH003751
Букина Ю.А., Сергеева Е.А. // Вестник Казанского технологического университета. 2012. Т. 15. № 14. С. 170.
Крыжановская Е.В., Варламов В.П., Самуйленко А.Я. и др. // Сельскохозяйственная биология. 2008. Т. 6. С. 119.
Gil G., del Mónaco S., Cerrutti P. et al. // Biotechnol. Lett. 2004. V. 26. P. 569. https://doi.org/10.1023/B:BILE.0000021957.37426.9b
Варламов В.П., Ильина А.В., Шагдарова Б.Ц. и др. // Успехи биологической химии. 2020. Т. 60. С. 317.
Abioye A., Sanyaolu A., Dudzinska P. et al. // Pharm. Nanotechnol. 2020. V. 8. № 1. P. 33. https://doi.org/10.2174/2211738507666191021102256
Li J., Zhang G., Wang L. et al. // Talanta. 2015. V. 140. P. 204. https://doi.org/10.1016/j.talanta.2015.03.050
Sharma S., Sanpui P., Chattopadhyay A. et al. // RSC Adv. 2012. V. 2. P. 5837. https://doi.org/10.1039/C2RA00006G
Wei D., Qian W. // Colloids Surf., B. 2008. V. 62. P. 136. https://doi.org/10.1016/j.colsurfb.2007.09.030
Sanpui P., Murugadoss A., Durga Prasad P.V. et al. // Int. J. Food Microbiol. 2008. V. 124. P. 142. https://doi.org/10.1016/j.ijfoodmicro.2008.03.004
Youssef A.M., Abdel-Aziz M.S., El-Sayed S.M. // Int. J. Biol. Macromol. 2014. V. 69. P. 185. https://doi.org/10.1016/j.ijbiomac.2014.05.047
Huang L., Zhai M.L., Long D.W. et al. // J. Nanopart. Res. 2008. V. 10. P. 1193. https://doi.org/10.1007/s11051-007-9353-0
Olenin A.Y. // Russ. J. Inorg. Chem. 2020. V. 65. № 4. P. 542. https://doi.org/10.31857/S0044457X20040157
Al-Muhanna M.K.A., Hileuskaya K.S., Kulikouskaya V.I. et al. // Colloid J. 2015. V. 77. P. 677. https://doi.org/10.1134/S1061933X15060022
Hileuskaya K., Ladutska A., Kulikouskaya V. et al. // Colloids Surf., A. 2020. V. 585. P. 124141. https://doi.org/10.1016/j.colsurfa.2019.124141
Ершов Б.Г. // Микросистемная техника. 2003. № 12. С. 31.
Kumar A., Dixit C.K. // Advances in nanomedicine for the delivery of therapeutic nucleic acids / Eds. Nimesh S., Chandra R., Gupta N. Woodhead Publishing, 2017. P. 43. https://doi.org/10.1016/B978-0-08-100557-6.00003-1
Novikov I.V., Pigaleva M.A., Abramchuk S.S. et al. // Carbohydr. Polym. 2018. V. 190. P. 103. https://doi.org/10.1016/j.carbpol.2018.02.076
Kumar-Krishnan S., Prokhorov E., Hernández-Iturriaga M. et al. // Eur. Polym. J. 2015. V. 67. P. 242. https://doi.org/10.1016/j.eurpolymj.2015.03.066
Kraskouski A.N., Nikalaichuk V.V., Kulikouskaya V.I. et al. // Theor. Exp. Chem. 2020. V. 56. P. 243. https://doi.org/10.1007/s11237-020-09655-1
Queiroz M.F., Teodosio Melo K.R., Sabry D. et al. // Mar. Drugs. 2014. V. 13. P. 141. https://doi.org/10.3390/md13010141
Pieróg M., Gierszewska-Drużyńska M., Ostrowska-Czubenko J. // Progress on Chemistry and Application of Chitin and its Derivatives. 2009. V. 14. P. 75.
Novikov I.V., Pigaleva M.A., Levin E.E. et al. // Colloid Polym. Sci. 2020. V. 298. P. 1135. https://doi.org/10.1007/s00396-020-04683-8
Saini R.K., Srivastava A.K., Gupta P.K. et al. // Chem. Phys. Lett. 2011. V. 511. № 4–6. P. 326. https://doi.org/10.1016/j.cplett.2011.06.044
Chashchin I.S., Abramchuk S.S., Nikitin L.N. // Dokl. Phys. Chem. 2017. V. 475. № 1. P. 134. https://doi.org/10.1134/S0012501617070041
Cinteza L.O., Scomoroscenco C., Voicu S.N. et al. // Nanomat. 2018. V. 8. № 10. P. 826. https://doi.org/10.3390/nano8100826
Zienkiewicz-Strzałka M., Deryło-Marczewska A., Skorik Y.A. et al. // Int. J. Mol. Sci. 2020. V. 21. P. 166. https://doi.org/10.3390/ijms21010166
Holubnycha V., Kalinkevich O., Ivashchenko O. et al. // Nanoscale Res. Lett. 2018. V. 13. P. 71. https://doi.org/10.1186/s11671-018-2482-9
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии