Журнал неорганической химии, 2021, T. 66, № 8, стр. 1025-1031
Влияние условий синтеза силикатов кальция на кинетику процесса микробиологической очистки водных сред
С. Б. Ярусова a, b, *, С. Н. Сомова a, У. В. Харченко a, П. С. Гордиенко a, И. А. Беленева c
a Институт химии ДВО РАН
690022 Владивосток, пр-т 100-летия Владивостока, 159, Россия
b Владивостокский государственный университет экономики и сервиса
690014 Владивосток, ул. Гоголя, 41, Россия
c Национальный научный центр морской биологии им. А.В. Жирмунского ДВО РАН
690041 Владивосток, ул. Пальчевского, 17, Россия
* E-mail: yarusova_10@mail.ru
Поступила в редакцию 12.02.2021
После доработки 09.03.2021
Принята к публикации 10.03.2021
Аннотация
Представлены результаты исследования процессов формирования силикатов кальция при обычных условиях (20°С) и в условиях автоклавной обработки реакционной смеси (220°С). Исследован состав, морфология и сорбционные свойства синтетических силикатов кальция по отношению к микроорганизмам Escherichia coli и Bacillus subtilis. Установлено, что наибольшая сорбционная емкость исследуемых образцов наблюдается по отношению к бактериям Escherichia coli (до 79.4%). Эффективность сорбции Bacillus subtilis ниже по сравнению с Escherichia coli (до 45.5%). С использованием уравнения кинетики топохимических реакций определены кинетические параметры исследуемого процесса. Показано, что экспериментальные результаты по кинетике с минимальными отклонениями отличаются от расчетных величин, полученных по предложенному уравнению во всем анализируемом временном интервале. Полученные результаты представляют определенный научно-практический интерес при разработке перспективных и экологически безопасных материалов для микробиологической очистки водных сред.
ВВЕДЕНИЕ
Природные и синтетические силикаты различного состава и структуры, а также материалы на их основе активно исследуются с целью их применения в процессах извлечения различных поллютантов из объектов окружающей среды (тяжелых металлов, долгоживущих радионуклидов, пестицидов, красителей, фенолов, неорганических анионов). Проводятся исследования процессов взаимодействия силикатов с различными микроорганизмами, в том числе с патогенными и условно-патогенными микроорганизмами, что позволяет расширить области применения данных соединений, используя их, например, в качестве энтеросорбентов с сорбционно-детоксикационными свойствами, а также для очистки воды [1–6].
В работе [7] исследована возможность использования строительного карьерного песка, гранулированного мелкопористого технического силикагеля и цеолитсодержащей породы (состав: клиноптилолит – 12%, полевой шпат – 2%, кварц – 17.5%, кристобалит – 28.5%, кальцит – 18.1%, смектит – 20.3%, слюда – 3.9%) для связывания бактерий Escherichia coli в водной среде. Установлено, что цеолитсодержащая порода и силикагель проявляют высокую сорбционную активность в отношении клеток E. coli и могут быть рекомендованы для дальнейших испытаний с целью очистки загрязненных водных сред в качестве сорбентов патогенных и условно-патогенных микроорганизмов.
Авторы [8] исследовали процесс адсорбции Escherichia coli и Streptococcus suis на монтмориллоните и каолините в зависимости от pH (диапазон 4.0–9.0) и ионной силы раствора (1–100 мM KCl и CaCl2). Было обнаружено, что исследуемыми минералами в большей степени адсорбируются микроорганизмы S. suis, чем E. coli. При этом установлено, что адсорбционная способность монтмориллонита выше, чем каолинита.
В работе [9] предлагается создание типовой серии малогабаритных автоматизированных установок обезжелезивания и обеззараживания воды, где на второй стадии водоподготовки для доочистки и обеззараживания предлагается использовать модифицированные ионами серебра цеолиты. Проведенные на микроорганизмах E. сoli исследования показали, что цеолит, модифицированный ионами серебра, может быть включен в систему очистки воды для хозяйственно-питьевых целей как элемент доочистки и обеззараживания воды.
Следует отметить, что определенную перспективу представляют силикаты различного состава и структуры (в том числе силикаты щелочноземельных металлов), а также материалы на их основе [10]. Так, в отечественной и зарубежной литературе представлены сведения по сорбционным характеристикам силикатов кальция и бария. Проводятся исследования сорбционных свойств таких соединений, как ксонотлит Ca6[Si6O17](OH)2, волластонит Ca6Si6O18, 11 Å тоберморит Ca10[Si12O31](OH)6 · 8H2O по отношению к ионам тяжелых металлов [11–14]. Авторы [15, 16] указывают на использование сорбентов на основе аморфных силикатов и алюмосиликатов бария BaSiO3 и ВаAl2Si2O8. Литературные данные по сорбции микроорганизмов синтетическими силикатами кальция и бария практически отсутствуют, хотя логично предположить, что эти продукты должны обладать высокой сорбционной способностью по отношению и к микробным популяциям.
Существенными преимуществами синтетических аналогов данных соединений в сравнении с природными является их стабильный и регулируемый состав, а также возможность получать материал с заданными свойствами.
Ранее авторами работы было проведено сравнительное исследование сорбционных свойств аморфных и кристаллических силикатов кальция, полученных из водных растворов при обычных условиях и в условиях автоклавного синтеза, относительно тестовых культур микроорганизмов Escherichia coli и Bacillus subtilis и ассоциации пресноводных бактерий. Результаты, полученные авторами, показали целесообразность проведения дальнейших исследований [17].
Цель настоящей работы – изучение сорбционных свойств синтетических силикатов кальция по отношению к микроорганизмам Escherichia coli и Bacillus subtilis в зависимости от условий их формирования.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез силикатов кальция проводили при обычных условиях (t = 20°С, образец 1) и в условиях автоклавной обработки реакционной смеси (t = 220°С, образец 2).
Удельную поверхность образцов определяли методом низкотемпературной адсорбции азота с использованием прибора Сорбтометр-М (Россия).
Рентгенограммы образцов снимали на автоматическом дифрактометре D8 Advance (Германия) с вращением образца в СuKα-излучении. Рентгенофазовый анализ (РФА) проводили с использованием программы поиска EVA с базой данных РФА Powder Diffraction FileTM (Soorya N Kabekkodu, 2007).
Изучение морфологии образцов проводили на сканирующем электронном микроскопе высокого разрешения Hitachi S5500 (Япония) с приставкой для энергодисперсионного анализа Thermo Scientific.
Для исследования сорбционных характеристик полученных образцов использовали тестовые культуры микроорганизмов, хранящиеся в музее культур ННЦМБ им. А.В. Жирмунского ДВО РАН: Escherichia coli ATCC 15034, Bacillus subtilis BKM B501. Бактериальные штаммы выращивали на триптозо-соевом агарe (Caso-agar, Merck) в течение 24 ч при 28°С. Колонии бактерий суспендировали в 0.05 М растворе NaCl для получения суспензии с оптической плотностью OD670 = 0.300.
Связывание микроорганизмов с сорбентом регистрировали турбидиметрическим методом по изменению концентрации клеток в водной среде с использованием спектрофотометра Shimadzu UV-1280. Для этого 0.5 см3 исследуемых образцов смешивали с 20 мл бактериальной суспензии с OD670 = 0.300. Смесь устанавливали на шейкере на определенное время (30, 60, 90, 120 мин) при комнатной температуре, затем центрифугировали при 4000 об/мин в течение 15 мин и измеряли оптическую плотность супернатанта. Концентрацию клеток в суспензии после центрифугирования оценивали с помощью спектрофотометра в соответствии с предварительно построенными калибровочными графиками. Количество адсорбированных клеток рассчитывали по уравнению:
где С0 и С1 – концентрация бактериальных клеток до и после взаимодействия с образцами, кл/мл. Все экспериментальные данные представлены как среднее значение трех независимых экспериментов.РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Характеристика сорбентов на основе силикатов кальция
Согласно данным РФА, образец 1 с удельной поверхностью 105.9 м2/г характеризуется наличием аморфной фазы и кальцита CaCO3. Образование CaCO3 в многокомпонентной системе CaCl2–Na2SiO3–H2O при обычных условиях связано с карбонизацией гидроксида кальция, который, в свою очередь, образуется при взаимодействии аморфного силиката кальция с растворенным в воде углекислым газом.
В составе образца 2 с удельной поверхностью 146.4 м2/г присутствует аморфная фаза и фазы волластонита CaSiO3 моноклинной модификации, гидросиликата кальция Ca1.5SiO3.5 · · xH2O/1.5CaO · SiO2 · xH2O и тоберморита 9 Å Ca4(Si6O15)(OH)2 · 5H2O (табл. 1).
Таблица 1.
Фазовый состав и удельная поверхность продуктов синтеза в различных системах и при различных условиях (образцы после сушки при температуре 85°С)
| Образец | Система и условия синтеза | Фазовый состав | Удельная поверхность, м2/г |
|---|---|---|---|
| 1 | CaCl2–Na2SiO3–H2O, 20°С | Аморфная фаза, кальцит CaCO3 | 105.9 |
| 2 | CaSO4 · 2H2O–SiO2 ⋅ · nH2O–KOH–H2O, 220°С (автоклав) | Аморфная фаза, волластонит CaSiO3 моноклинной модификации (PDF-2, 00-027-0088) с параметрами кристаллической ячейки: а = 15.42600; b = 7.32000; с = 7.06600 Å; α = 90.000°; ß = 95.400°; γ = 90.000°); гидросиликат кальция Ca1.5SiO3.5 · xH2O/1.5CaO · ⋅ SiO2 · xH2O (PDF-2, 00-033-0306), тоберморит 9 Å Ca4(Si6O15)(OH)2 · 5H2O (PDF-2, 01-089-6459) с параметрами кристаллической ячейки: а = 6.73500; b = 7.38500; с = 22.48700 Å ; α = 90.000°; β = 90.000°; γ = 123.250°) | 146.4 |
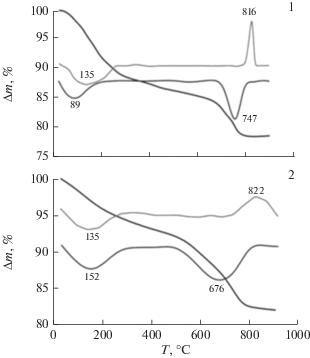
Термогравиметрический анализ (рис. 1) показал, что синтезированные образцы содержат до 20% воды, выделяющейся в интервале температур от 20 до 700°С. Наибольшее содержание воды характерно для образца 1, полученного при обычных условиях (20°С). При температурах 816 и 822°С на термограммах образцов 1 и 2 соответственно зарегистрированы экзоэффекты, которые относятся к переходу аморфных гидратированных форм силикатов кальция в кристаллическую фазу волластонита, что было подтверждено данными РФА нелетучих остатков при обжиге образцов до указанных температур. Следует отметить, что экзоэффект наиболее выражен для образца, полученного при обычных условиях.
Согласно данным сканирующей электронной микроскопии (рис. 2), в морфологии полученных образцов наблюдаются различия. В условиях автоклавной обработки реагирующей смеси при 220°С происходит формирование агломератов частиц размером от 1 до 40 мкм с развитой пористой поверхностью, включающих тонкодисперсные наноразмерные частицы игольчатой формы. Образец, полученный в многокомпонентной системе CaCl2–Na2SiO3–H2O при обычных условиях (20°С), также состоит из агломератов тонкодисперсных пористых частиц размером от 1 до нескольких десятков микрон. Частицы игольчатой формы отсутствуют.
Кинетика сорбции микроорганизмов силикатами кальция
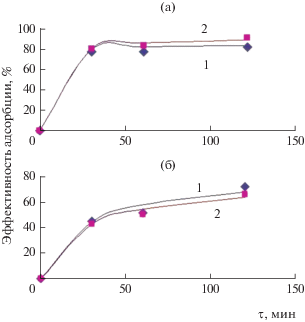
Данные по кинетике процесса сорбции бактерий силикатами кальция приведены в табл. 2 и на рис. 3. Как видно из представленных данных для образцов 1 и 2, при сорбции исследуемых бактерий наблюдаются общие закономерности. Сорбционная емкость растет с увеличением времени контакта микроорганизмов с исследуемыми образцами. При этом наибольшая сорбционная емкость наблюдается по отношению к бактериям Escherichia coli для исследуемых образцов, и уже через 30 мин эффективность сорбции составляет 76.1 и 79.4% для образцов 1 и 2 соответственно. Наибольшую сорбционную емкость по отношению к Escherichia coli проявляет образец 2, представляющий собой материал, состоящий из нескольких кристаллических фаз силикатов кальция и имеющий большую величину удельной поверхности. Эффективность сорбции Bacillus subtilis для образцов 1 и 2 ниже по сравнению с Escherichia coli, через 30 мин эффективность сорбции составляет 45.5 и 43.3% соответственно.
Таблица 2.
Кинетика сорбции микроорганизмов синтетическими силикатами кальция
| Культура микроорганизмов | Время, мин | Эффективность сорбции, % | |
|---|---|---|---|
| образец 1 | образец 2 | ||
| Escherichia coli | 30 | 76.1 | 79.4 |
| 60 | 76.3 | 81.8 | |
| 90 | 81.2 | 89.6 | |
| 120 | 80.3 | 89.3 | |
| Bacillus subtilis | 30 | 45.5 | 43.3 |
| 60 | 51.9 | 50.7 | |
| 90 | 63.2 | 55.2 | |
| 120 | 72.7 | 66.7 | |
Рис. 3.
Зависимости сорбционной емкости образцов 1 и 2 от времени при сорбции бактерий Escherichia coli (а), Bacillus subtilis (б).
Полученные кинетические данные анализировали в соответствии с уравнением кинетики, предложенным в работе [18]:
где k – константа (время–1), ατ – степень прохождения реакции в момент времени τ, αm – максимальная величина степени прохождения реакции, τ – время реакции.Из уравнения (1) следует, что константа k может быть определена как из экспериментальных зависимостей значений ατ от τ расчетным путем согласно уравнению:
(2)
$k = \sum {\frac{{\frac{{{{\alpha }_{\tau }}}}{\tau }\left( {\frac{1}{{{{\alpha }_{m}} - {{\alpha }_{\tau }}}}} \right)}}{N}} ,$(3)
$\frac{1}{{{{\alpha }_{\tau }}}} = \frac{1}{{{{\alpha }_{m}}}} + \frac{1}{{k\tau {{\alpha }_{m}}}},$Примененное уравнение кинетики топохимических реакций с минимальными отклонениями описывает процессы сорбции ионов металлов сорбентами, механизм сорбции для которых связан с ионным обменом; кинетику реакции получения гидросиликатов кальция; кинетику сорбции ионов тяжелых металлов на ионнообменных смолах [16, 18].
В табл. 3 приведены параметры, полученные графически при представлении экспериментальных данных по кинетике в виде зависимостей обратной величины степени прохождения реакции (в данном случае степени извлечения микроорганизмов) от обратной величины времени процесса (рис. 4).
Таблица 3.
Данные по кинетике процесса сорбции бактерий силикатами кальция, разница (Δ) экспериментальных и расчетных значений степени прохождения реакции Aτ
| Образец | Штамм | τ, мин | А, % | y = ax + b, (R2) | Am, % | kτ, мин–1 | Aτ, % | Δ, % |
|---|---|---|---|---|---|---|---|---|
| 1 | Escherichia coli | 30 | 76.1 | y = 0.023x + 0.012, (0.615) | 83.33 | 0.5217 | 78.33 | 2.8 |
| 60 | 76.3 | 80.75 | 5.5 | |||||
| 120 | 80.3 | 82.02 | 2.1 | |||||
| Bacillus subtilis | 30 | 45.5 | y = 0.305x + 0.012, (0.859) | 83.33 | 0.0393 | 45.11 | 0.9 | |
| 60 | 51.9 | 58.53 | 11.3 | |||||
| 120 | 72.7 | 68.77 | 5.7 | |||||
| 2 | Escherichia coli | 30 | 79.4 | y = 0.051x + 0.011, (0.806) | 90.91 | 0.2157 | 78.74 | 0.8 |
| 60 | 81.8 | 84.39 | 10.1 | |||||
| 120 | 89.3 | 87.53 | 4.4 | |||||
| Bacillus subtilis | 30 | 43.3 | y = 0.306x + 0.013, (0.92) | 76.92 | 0.0425 | 43.1 | 2.6 | |
| 60 | 50.7 | 55.25 | 7.1 | |||||
| 120 | 66.7 | 64.31 | 2.4 |
Рис. 4.
Зависимости обратной величины сорбционной емкости образцов 1 (a) и 2 (б) от обратной величины времени при сорбции бактерий Escherichia coli (1), Bacillus subtilis (2).
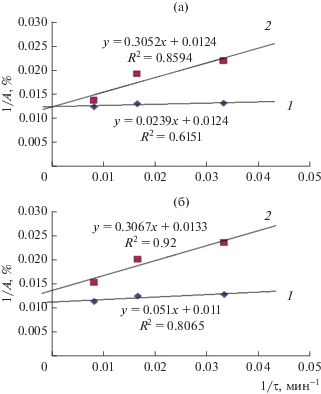
Как видно из представленных в табл. 3 данных, предложенное уравнение подходит для описания кинетики исследуемых процессов, о чем свидетельствуют соответствующие коэффициенты корреляции.
ЗАКЛЮЧЕНИЕ
Проведен анализ кинетики сорбции микроорганизмов Escherichia coli и Bacillus subtilis на синтетических силикатах кальция, полученных при обычных условиях (20°С) и в условиях автоклавной обработки реакционной смеси (220°С). Установлены общие закономерности при сорбции исследуемых бактерий. Для исследуемых образцов наибольшая сорбционная емкость наблюдается по отношению к бактериям Escherichia coli.
Полученные кинетические данные проанализированы в соответствии с уравнением кинетики, которое ранее было применено авторами для анализа кинетики ряда топохимических реакций. Экспериментально доказано, что уравнение с высокой точностью описывает исследуемый процесс, что следует из сравнения расчетных и экспериментальных зависимостей.
Полученные в работе данные представляют научно-практический интерес и могут быть использованы при выборе такой интересной области применения силикатов кальция, как селективная адсорбция из водных сред патогенных и условно-патогенных микроорганизмов, что позволит расширить области биологического и медицинского применения данных материалов.
Список литературы
Hrenovic J., Rozic M., Sekovanic L. et al. // J. Hazard. Mater. 2008. V. 156. P. 576. https://doi.org/10.1016/j.jhazmat.2007.12.060
Сазановец М.А., Игнатенко А.В. // Тр. БГТУ. Химия, технология органических веществ и биотехнология. 2013. № 4. С. 205.
Cu Bui Q., Nguen H.C., Vesentsev A.I. et al. // Research Result: Pharmacology and Clinical Pharmacology. 2016. V. 2. № 3. P. 63.https://doi.org/10.18413/2500-235X-2016-2-3-63-74
Везенцев А.И., Трубицын М.А., Кормош Е.В. // Сорбционные и хроматографические процессы. 2012. Т. 12. № 6. С. 998.
Kubota M., Nakabayashi T., Matsumoto Y. et al. // Colloid Surf., B. 2008. V. 64. P. 88. https://doi.org/10.1016/j.colsurfb.2008.01.012
Li G.L., Zhou C.H., Fiore S. et al. // Appl. Clay Sci. 2019. V. 177. P. 91. https://doi.org/10.1016/j.clay.2019.04.025
Савин А.В., Денисова А.П., Хузиахметов Р.Х. и др. // Вестник Казанского технолог. ун-та. 2012. Т. 15. № 19. С. 123.
Zhao W., Liu X., Huang Q. et al. // Appl. Clay Sci. 2012. V. 69. P. 37. https://doi.org/10.1016/j.clay.2012.07.003
Куликова М.В., Косинцев В.И., Сечин А.И. и др. // Изв. Томского политех. ун-та. 2010. Т. 317. № 3. С. 44.
Jantzen C.M., Ojovan M.I. // Russ. J. Inorg. Chem. 2019. V. 64. № 13. P. 1611. https://doi.org/10.1134/S0036023619130047
Гладун В.Д., Акатьева Л.В., Холькин А.И. Синтетические силикаты кальция. М.: ИРИСБУК, 2011. 232 с.
Tsutsumi T., Nishimoto S., Kameshima Y. et al. // J. Hazard. Mater. 2014. V. 266. P. 174. https://doi.org/10.1016/j.jhazmat.2013.12.024
Mancini A., Wieland E., Geng G. et al. // Appl. Geochem. 2020. V. 113. Art. 104460. https://doi.org/10.1016/j.apgeochem.2019.104460
Zou J., Guo C., Zhou X. et al. // Colloids Surf., A: Physicochemical and Engineering Aspects. 2018. V. 538. P. 825. https://doi.org/10.1016/j.colsurfa.2017.11.073
Тананаев И.Г., Авраменко В.А. // Журн. Белорус. гос. ун-та. Экология. 2017. № 4. С. 33. https://journals.bsu.by/index.php/ecology/article/view/2612
Гордиенко П.С., Шабалин И.А., Ярусова С.Б. и др. // Журн. неорган. химии. 2019. Т. 64. № 12. С. 1326. https://doi.org/10.1134/S0044457X19120055
Харченко У.В., Беленева И.А., Ярусова С.Б. и др. // Химия и хим. технология: VI Междунар. конф: Сб. мат-лов, Республика Армения, г. Ереван, 23–27 сентября 2019 г. Ер.: ИОНХ НАН РА, 2019. С. 133.
Гордиенко П.С., Шабалин И.А., Ярусова С.Б. и др. // Журн. физ. химии. 2019. Т. 93. № 11. С. 1724. https://doi.org/10.1134/S0044453719110128
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии