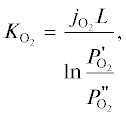Журнал неорганической химии, 2021, T. 66, № 8, стр. 1126-1130
КИСЛОРОДОПРОНИЦАЕМЫЙ МЕМБРАННЫЙ МАТЕРИАЛ Bi1.4Er0.6Ru2O7–50 МАС. % δ-Bi2O3, ПОЛУЧЕННЫЙ КРИСТАЛЛИЗАЦИЕЙ ИЗ ЧАСТИЧНО РАСПЛАВЛЕННОГО СОСТОЯНИЯ
П. Е. Дергачева a, И. В. Кульбакин a, *, А. А. Ашмарин a, Д. Д. Титов a, С. В. Федоров a
a Институт металлургии и материаловедения им. А.А. Байкова РАН
119334 Москва, Ленинский пр-т, 49, Россия
* E-mail: ivkulbakin@mail.ru
Поступила в редакцию 15.02.2021
После доработки 01.03.2021
Принята к публикации 03.03.2021
Аннотация
В результате взаимодействия Bi3Ru3O11 и Bi1.6Er0.4O3 при 900°С и кристаллизации из частично расплавленного состояния получен высокоплотный керамический композит Bi1.4Er0.6Ru2O7–50 мас. % δ-Bi2O3, стабильный в диапазоне температур 730–820°С. Проведены рентгенофазовый анализ и дилатометрия, исследованы микроструктура и транспортные свойства полученного композита. Установлено, что при охлаждении композита ниже 730°С формируется метастабильная модификация γ-Bi2O3, устойчивая до комнатной температуры и препятствующая растрескиванию при термоциклировании, объяснены причины данного явления. Показано, что композит обладает смешанной ионно-электронной проводимостью и коэффициентом проницаемости по кислороду ∼1.8 × 10–8 моль см–1 с–1 при 800°С, что указывает на перспективу его использования в качестве ионно-транспортных мембран для получения чистого кислорода из воздуха.
ВВЕДЕНИЕ
С каждым годом все активнее развиваются технологии селективного выделения чистого кислорода из воздуха и других кислородсодержащих газовых смесей при помощи плотных ионно-транспортных мембран со смешанной ионно-электронной проводимостью [1–3], работающих при 600–1000°С. Так, традиционно используемые для получения кислорода перовскитные мембраны при работе в средней области температур (<800°С) склонны к растрескиванию и сорбции “кислых” газов (СO2 и SO2) из атмосферы [4–6], поэтому актуален поиск новых материалов мембран. Перспективными материалами таких мембран могут стать керамические композиты на основе рекордсмена по кислород-ионной проводимости при 730–820°С – нестабилизированного δ-Bi2O3 (~2 См/см) [7]. Однако получение материалов на основе чистого δ-Bi2O3 затруднительно из-за значительного изменения объема и растрескивания вследствие полиморфных превращений δ → β → α при охлаждении [8]. Проблему растрескивания можно решить в композитах на его основе с химически и термически совместимым электронопроводящим компонентом за счет обратимого метастабильного превращения δ-Bi2O3 ↔ γ-Bi2O3 при термоциклировании благодаря принципу ориентационного и размерного соответствия Данкова–Конобеевского [9]. Такой подход был успешно реализован в композитах In2O3–55 мас. % δ-Bi2O3 [10] и NiO–54 мас. % δ-Bi2O3 [11], однако уровень их электронной проводимости и проницаемости по кислороду был недостаточно высок. Настоящая работа посвящена получению и исследованию керамического композита Bi1.4Er0.6Ru2O7–50 мас. % δ-Bi2O3, в котором также может быть реализован этот подход, но достигнуты более высокая электронная проводимость и коэффициент проницаемости по кислороду.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходных реагентов использовали оксиды висмута, эрбия и рутения(IV) квалификации “ос. ч.”, а также этиловый спирт квалификации “х. ч.”. Bi3Ru3O11 и Bi1.6Er0.4O3 получали твердофазным обжигом шихт исходных оксидов, взятых в соответствующих мольных соотношениях. Гомогенизацию шихт проводили в планетарной мельнице Pulverisette 5 (Fritsch GmbH, Германия) в этиловом спирте (20% от общей массы порошков) с использованием агатовых барабанов и шаров (соотношение по массе порошка и шаров – 1 : 5, скорость вращения барабанов – 200 об/мин, продолжительность – 30 мин). Далее шихты для синтеза Bi3Ru3O11 и Bi1.6Er0.4O3 выдерживали в течение 3 ч при 90°С в сушильном шкафу для удаления спирта, после чего обжигали в алундовых тиглях при 700 и 800°С соответственно в течение 24 ч с промежуточным помолом. Состав полученных соединений Bi3Ru3O11 и Bi1.6Er0.4O3 контролировали при помощи рентгенофазового анализа (Shimadzu, Япония).
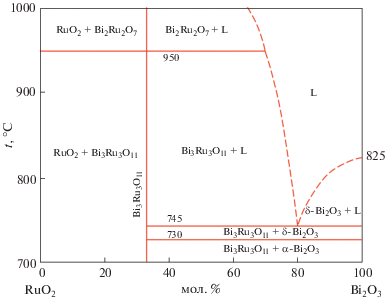
Керамический композит Bi1.4Er0.6Ru2O7–50 мас. % Bi2O3 получали из приготовленной по аналогичной методике смешением в планетарной мельнице шихты на основе Bi3Ru3O11 и Bi1.6Er0.4O3, взятых в необходимых массовых соотношениях. Далее к высушенной шихте добавляли 5 мас. % 10%-ного водного раствора поливинилового спирта и подвергали холодному одноосному прессованию при 200 МПа в бруски (5 × 5 × 20 мм) и таблетки (диаметр 10 мм, толщина 2 мм). Образцы нагревали со скоростью 2 град/мин и обжигали на воздухе при 800°С в течение 8 ч с последующим жидкофазным спеканием при 900°С в течение 2 ч, затем медленным охлаждением (2 град/мин) и кристаллизацией из частично расплавленного состояния. Условия синтеза композита подбирали эмпирически исходя из диаграммы состояния системы RuO2–Bi2O3 (рис. 1) [12].
Фазовый состав композита после твердофазного обжига, в процессе жидкофазного спекания при 900°C и после охлаждения ниже 700°C определяли методом РФА на дифрактометре XRD-6000 c высокотемпературной приставкой HA-1001 (Shimadzu, Япония). Рентгенограммы снимали в интервале углов 2θ от 10° до 61° с шагом 0.1°. Расшифровку полученных рентгенограмм осуществляли с помощью базы данных дифрактограмм ICDD PDF-2.
Поверхности брусков шлифовали на материалографическом оборудовании Tegra System (Struers, Дания), затем проводили измерения электропроводности по методике, описанной в работе [13]. Электропроводность измеряли при охлаждении от 900 до 700°C с шагом 25°C и выдержкой в течение 30 мин при каждой температуре для достижения стационарного состояния.
Поверхность таблеток шлифовали до толщины 1.8 мм, после чего проводили газохроматографические измерения потока кислорода при 730, 750, 775 и 800°C по методике, описанной в работе [13]. Коэффициент проницаемости по кислороду (${{K}_{{{{{\text{O}}}_{{\text{2}}}}}}}$) полученного керамического композита Bi1.4Er0.6Ru2O7–50 мас. % δ-Bi2O3 в сравнении с другими мембранными материалами на основе оксида висмута [10, 11] оценивали по формуле:
где ${{j}_{{{{{\text{O}}}_{{\text{2}}}}}}}$ – поток кислорода, $P_{{{{{\text{O}}}_{{\text{2}}}}}}^{'}$ и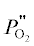 – парциальное давление кислорода по обе стороны мембраны
– парциальное давление кислорода по обе стороны мембраны 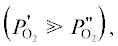 L – толщина мембраны.
L – толщина мембраны.
Микроструктуру композита, охлажденного до комнатной температуры после проведения газохроматографических испытаний, изучали с помощью растрового электронного микроскопа JSM-7401F (Jeol, Япония), анализируя поверхность шлифа в режиме обратнорассеянных электронов при ускоряющем напряжении 5 кВ. Измерение линейного термического расширения этого же композита, шлифованного до диаметра 5 мм и толщины 1.5 мм, осуществляли на дилатометре DIL 402 C (Netzsch–Geratebau GmbH, Германия) в атмосфере аргона в диапазоне температур 25–850°C при нагревании и охлаждении печи со скоростью 5 град/мин.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Рентгенограмма керамического композита Bi1.4Er0.6Ru2O7–50 мас. % Bi2O3 представлена на рис. 2. В результате взаимодействия исходных Bi3Ru3O11 (JCPDS № 52-0271, пр. гр. Pn$\bar {3},$ a = = 9.304 Å) и Bi1.6Er0.4O3 (JCPDS № 34-0377, пр. гр. Fm$\bar {3}$m, a = 5.502 Å) при 900°C формируется расплав и твердый раствор Bi1.4Er0.6Ru2O7, изоструктурный пирохлору Bi2Ru2O7 (JCPDS № 82-2002, пр. гр. Fd$\bar {3}$m, a = 10.2934 Å). Параметр кристаллической решетки Bi1.4Er0.6Ru2O7 при комнатной температуре равен 10.255 Å, что немного отличается от рассчитанного по правилу Вегарда гипотетического параметра a(Bi1.4Er0.6Ru2O7) = = 0.7a(Bi2Ru2O7) + 0.3a(Er2Ru2O7, JCPDS № 28-0412, пр. гр. Fd$\bar {3}$m, a = 10.116 Å), составившего 10.240 Å. Различие экспериментального и гипотетического параметров решетки Bi1.4Er0.6Ru2O7, также наблюдавшееся в ряде других твердых растворов Bi2 – хLnхRu2O7 [14, 15], обусловлено нелинейным изменением угла RuORu в структуре пирохлора в зависимости от содержания лантаноида (х) в составе и, соответственно, нелинейным изменением характера проводимости [16]. При кристаллизации из расплава ниже 820°C образуется модификация δ-Bi2O3 со структурой флюорита (JCPDS № 77-0374, пр. гр. Fm$\overline 3 $m, a = = 5.648 Å), переходящая ниже 730°C в метастабильную модификацию γ-Bi2O3 со структурой силленита (пр. гр. I23, a = 10.250 Å) [17]. На рентгенограмме композита Bi1.4Er0.6Ru2O7–50 мас. % Bi2O3 при 700°C также присутствуют следы промежуточной тетрагональной модификации β-Bi2O3 (JCPDS № 78-1793, пр. гр. P$\bar {4}$21c, a = 7.741 Å, с = = 5.634 Å), исчезающей ниже 650°C и также превращающейся в γ-Bi2O3. Следует отметить, что наличие пиков низкотемпературной моноклинной модификации α-Bi2O3 при охлаждении до комнатной температуры не обнаружено даже в следовых количествах.
Рис. 2.
Рентгенограммы исходного композита Bi3Ru3O11–Bi1.6Er0.4O3 при комнатной температуре, композита Bi1.4Er0.6Ru2O7–расплав при 900°C и композита Bi1.4Er0.6Ru2O7–Bi2O3 при 700°C.
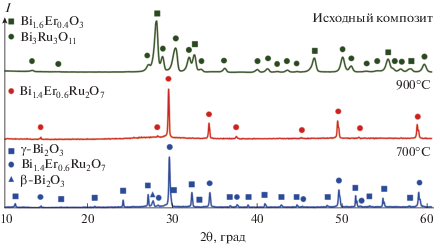
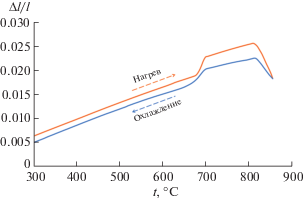
Примечательно, что формирование следов метастабильной фазы силленита состава Bi12RuO20 в системе Bi2O3–RuO2 наблюдали ранее лишь ниже 630°C [18], при этом основной фазой при охлаждении ниже 730°C являлась стабильная модификация α-Bi2O3, образование которой из δ-Bi2O3 чаще всего приводит к растрескиванию материала. В нашем случае растрескивание материала при термоциклировании не наблюдалось, а обратимость метастабильного равновесия δ-Bi2O3 ↔ γ-Bi2O3 сохранялась в том числе при термоциклировании композита. По-видимому, это можно объяснить близостью параметров кристаллических решеток силленита γ-Bi2O3 (a = 10.250 Å) и твердого раствора Bi1.4Er0.6Ru2O7 со структурой пирохлора (a = = 10.255 Å) и принципом ориентационного и размерного соответствия Данкова–Конобеевского, который наблюдался ранее в системе In2O3–Bi2O3 [19]. Действительно, исследование термических свойств композита подтвердило, что значительного изменения объема при циклировании процессов нагревания–охлаждения не происходит (рис. 3), что решает проблему растрескивания, характерную для материалов на основе чистого нестабилизированного оксида висмута. Оцененный при 300–650°C коэффициент линейного термического расширения композита Bi1.4Er0.6Ru2O7–50 мас. % Bi2O3 составил 3.2 × 10–5 K–1, это значение коррелирует с таковым для композита In1.985Zr0.015O3 + δ–50 мол. % Bi2O3 [20].
Рис. 3.
Температурная зависимость линейного термического расширения (Δl/l) композита Bi1.4Er0.6Ru2O7–50 мас. % Bi2O3 при 300–850°C.
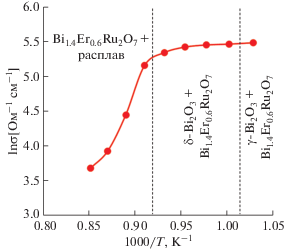
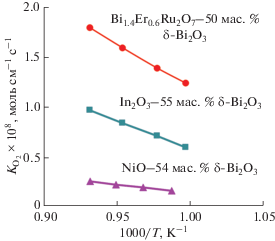
Микроструктура керамического композита Bi1.4Er0.6Ru2O7–50 мас. % Bi2O3, полученного в результате медленной кристаллизации из расплава ниже 820°C и охлажденного после проведения газохроматографических испытаний при 730–800°C, представлена на рис. 4. Видно, что наблюдаются три структурные составляющие: светлая (γ-Bi2O3), серая (твердый раствор Bi1.4Er0.6Ru2O7) и темная (поры). Пористость, по-видимому, сформировалась в результате выделения кислорода при разложении Bi3Ru3O11, что коррелирует с диаграммой состояния системы RuO2–Bi2O3 (рис. 1) [12] и подтверждается термогравиметрическими исследованиями композита, фиксирующими незначительную потерю массы. Из микроструктуры композита также видно, что на поверхности формируется плотный слой толщиной ∼70 мкм, способствующий достижению высокой селективности по кислороду. Действительно, оцененная по отношению площадей пиков кислорода к азоту селективность составила более 100, т.е. чистота получаемого кислорода превысила 99%. Показано также, что композит преимущественно обладает металлическим типом проводимости, характерным для Bi2Ru2O7 (рис. 5), при этом общий уровень проводимости на два порядка величины превышает электронную проводимость композита In2O3–55 мас. % δ-Bi2O3 [11] и на три порядка – проводимость композита NiO–54 мас. % δ-Bi2O3 [10]. Соответственно, оцененный коэффициент проницаемости по кислороду керамического композита Bi1.4Er0.6Ru2O7–50 мас. % δ-Bi2O3, составивший 1.8 × 10–8 моль/(см с) при 800°С, в шесть раз выше такового для NiO–54 мас. % δ-Bi2O3 [11] и почти вдвое выше, чем у композита In2O3–55 мас. % δ-Bi2O3 [10] (рис. 6), что указывает на перспективу его использования в качестве материала ионно-транспортных мембран.
Рис. 4.
Микрофотография поверхности шлифа композита Bi1.4Er0.6Ru2O7–50 мас. % Bi2O3, охлажденного до комнатной температуры после проведения газохроматографических испытаний при 730–800°C.

ЗАКЛЮЧЕНИЕ
Можно сделать вывод, что керамический композит Bi1.4Er0.6Ru2O7–50 мас. % δ-Bi2O3, полученный в результате медленной кристаллизации из частично расплавленного состояния, демонстрирует значительный потенциал для использования в качестве материала ионно-транспортных мембран. Отсутствие проблемы растрескивания при термоциклировании за счет реализации принципа Данкова–Конобеевского и высокая селективная проницаемость по кислороду керамического композита указывают на возможность разработки производительных асимметричных мембран на его основе, что и будет являться предметом дальнейших исследований.
Список литературы
Zhu X., Yang W. Mixed conducting ceramic membranes: fundamentals, materials and applications. Berlin: Springer, 2017. 367 p. https://doi.org/10.1007/978-3-662-53534-9
Anderson L.L., Armstrong P.A., Broekhuis R.R. et al. // Solid State Ionics. 2016. V. 288. P. 331. https://doi.org/10.1016/j.ssi.2015.11.010
Steele B.C.H. // Mater. Sci. Eng. B. 1992. V. 13. № 2. P. 79. https://doi.org/10.1016/0921-5107(92)90146-Z
Zhang C., Sunarso J., Liu S. // Chem. Soc. Rev. 2017. V. 46. № 10. P. 2941. https://doi.org/10.1039/C6CS00841K
Nauels N., Herzog S., Modigell M. et al. // J. Membr. Sci. 2019. V. 574. P. 252. https://doi.org/10.1016/j.memsci.2018.12.061
Liu Y., Zhu X., Yang W. // AIChE J. 2015. V. 61. № 11. P. 3879. https://doi.org/10.1002/aic.14900
Harwig H.A., Gerards A.G. // J. Solid State Chem. 1978. V. 26. № 3. P. 265. https://doi.org/10.1016/0022-4596(78)90161-5
Levin E.M., Roth R.S. // J. Res. Natl. Bur. Stand. A. Phys. Chem. 1964. V. 68. № 2. P. 189. https://doi.org/10.6028/jres.068A.019
Каргин Ю.Ф., Бурков В.И., Марьин А.А. и др. Кристаллы Bi12MxO20 ± δ со структурой силленита. Синтез, строение, свойства. М.: ИОНХ, 2004. 316 с.
Belousov V.V., Schelkunov V.A., Fedorov S.V. et al. // Electrochem. Commun. 2012. V. 20. P. 60. https://doi.org/10.1016/j.elecom.2012.04.001
Belousov V.V., Schelkunov V.A., Fedorov S.V. et al. // Ionics. 2012. V. 18. № 8. P. 787. https://doi.org/10.1007/s11581-012-0753-5
Hrovat M., Bernik S., Kolar D. // J. Mater. Sci. Lett. 1988. V. 7. № 6. P. 637. https://doi.org/10.1007/BF01730319
Fedorov S.V., Belousov V.V., Vorobiev A.V. // J. Electrochem. Soc. 2008. V. 155. № 12. P. F241. https://doi.org/10.1149/1.2990701
Kanno R., Takeda Y., Yamamoto T. et al. // J. Solid State Chem. 1993. V. 102. № 1. P. 106. https://doi.org/10.1006/jssc.1993.1012
Li L., Kennedy B.J. // Chem. Mater. 2003. V. 15. № 21. P. 4060. https://doi.org/10.1021/cm034503q
Cox P.A., Egdell R.G., Goodenough J.B. et al. // J. Phys. C: Solid State Phys. 1983. V. 16. № 32. P. 6221. https://doi.org/10.1088/0022-3719/16/32/014
Radaev S.F., Simonov V.I., Kargin Y.F. // Acta Crystallogr. B. 1992. V. 48. № 5. P. 604. https://doi.org/10.1107/S0108768192003847
Prosychev I.I., Lazarev V.B., Shaplygin I.S. // Russ. J. Inorg. Chem. 1981. V. 26. № 7. P. 1011.
Kargin Y.F. // Russ. J. Inorg. Chem. 2000. V. 45. № 9. P. 1419.
Dergacheva P.E., Kulbakin I.V., Fedorov S.V. // IOP Conf. Ser.: Mater. Sci. Eng. 2019. V. 683. № 1. P. 012091. https://doi.org/10.1088/1757-899X/683/1/012091
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии