Журнал неорганической химии, 2021, T. 66, № 7, стр. 907-910
Теплоемкость и термическое расширение гафната лантана
А. В. Гуськов a, *, П. Г. Гагарин a, В. Н. Гуськов a, А. В. Хорошилов a, К. С. Гавричев a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: a.gus@igic.ras.ru
Поступила в редакцию 09.02.2021
После доработки 15.03.2021
Принята к публикации 16.03.2021
Аннотация
Молярная теплоемкость гафната лантана структурного типа пирохлора измерена методом дифференциальной сканирующей калориметрии в интервале температур 310–1380 K. Установлена температурная зависимость параметра кристаллической решетки a в области 303–1273 K. Показано отсутствие структурных превращений и проведена оценка коэффициентов термического расширения в этом температурном интервале.
ВВЕДЕНИЕ
Проблема термической и коррозионной защиты газоэнергетических установок и авиационных двигателей остается актуальной на протяжении последних десятилетий [1–5]. Одним из претендентов на роль защитного материала является гафнат лантана структурного типа пирохлора [6]. Среди положительных качеств следует отметить высокую температуру конгруэнтного плавления, низкие теплопроводность и давление паров, относительно широкую область гомогенности [7–10]. Высокотемпературная химическая стойкость гафната лантана к газообразным и твердым веществам, содержащимся в воздухе, особенно к оксидам группы CMAS (calcium-magnesium-alumina-silicate) [11], требует тщательного экспериментального исследования, объем которого в значительной мере может быть сокращен предварительным термодинамическим моделированием [12]. Основой для проведения модельных расчетов служит температурная зависимость свободной энергии Гиббса, которую рассчитывают с учетом энтальпии образования гафната лантана, и температурная зависимость теплоемкости в широком температурном диапазоне. Энтальпия образования La2Hf2O7 структурного типа пирохлора (Fd3m) определена в работах [13, 14]. Низкотемпературная теплоемкость (0–346 K) и рассчитанные термодинамические функции представлены нами ранее [15] по результатам адиабатической калориметрии на синтезированном и охарактеризованном образце La2Hf2O7 (пирохлор). Молярная теплоемкость при более высоких температурах приведена в работах [6, 10, 16]. Однако эти данные не согласуются между собой, поэтому целью настоящей работы было измерение температурных зависимостей теплоемкости в интервале 310–1380 K. Второй задачей исследований являлось определение термического расширения путем изучения температурной зависимости параметра а кристаллической решетки гафната лантана структурного типа пирохлора в области 303–1273 K.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Особенности синтеза методом обратного осаждения и последующего ступенчатого отжига, идентификации образца гафната лантана методами рентгеновской дифрактометрии, химического и рентгенофлюоресцентного анализа и растровой электронной микроскопии, а также дифференциального термического анализа подробно описаны в работе [15]. Молекулярная масса образца 746.78933 г/моль определена из атомной массы элементов [17]. Молярную теплоемкость гафната лантана измеряли методом дифференциальной сканирующей калориметрии (ДСК) на установке STA 449 F1 Jupiter Netzsch в атмосфере газообразного аргона высокой чистоты (99.995%). Температурную зависимость параметра кристаллической решетки изучали методом высокотемпературной дифракции с использованием приставки НА-1001 и дифрактометра Shimadzu X-ray (CuKα-излучение, λ = 1.5418 Å) в интервале температур 303–1273 K с шагом 100 K и предварительной выдержкой 20 мин при каждой температуре измерений [18].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Окончательный отжиг образца гафната лантана проводили при температуре 1773 K в течение 4 ч. Эта процедура необходима для полного взаимодействия исходных компонентов и формирования кристаллической структуры пирохлора, не являющейся наноразмерной [14, 19]. По данным элементного анализа, полученный образец имеет состав La1.992Hf2.008O7.004. Как было показано нами в работе [20], такое отклонение от стехиометрии не может внести существенных искажений в расчет молярной теплоемкости для рационального состава из экспериментальных данных.
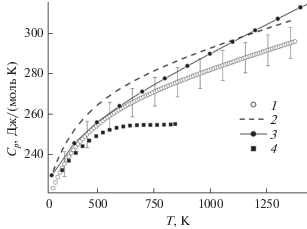
Измерения молярной теплоемкости методом дифференциальной сканирующей калориметрии были выполнены в интервале температур 310–1380 K и приведены на рис. 1 (кривая 1) с интервалом неопределенности метода ДСК (~2.5%). Полученные результаты хорошо описываются уравнением Майера–Келли [21]:
(1)
$\begin{gathered} {{C}_{p}}{\text{(Дж/(мольK))}} = 252.70 + 0.03253159T-- \\ {{ - \,\,3682068.4} \mathord{\left/ {\vphantom {{ - \,\,3682068.4} {{{T}^{2}}}}} \right. \kern-0em} {{{T}^{2}}}},\,{{R}^{2}} = 0.9999. \\ \end{gathered} $На рис. 1 показана оценка теплоемкости La2Hf2O7 по правилу Неймана–Коппа из теплоемкостей индивидуальных оксидов La2O3 [22] и HfO2 [23] (кривая 2):
(2)
$\begin{gathered} {{C}_{p}}{\text{(Дж/(мольK))}} = \\ = \,\,263.15 + 0.0329683T--{{3878855.8} \mathord{\left/ {\vphantom {{3878855.8} {{{T}^{2}}}}} \right. \kern-0em} {{{T}^{2}}}}, \\ \end{gathered} $(3)
$\begin{gathered} {{C}_{p}}({\text{Дж/(моль}}\,{\text{К)}}) = \\ = \,\,237.08 + \,\,0.054532T--{{2135800} \mathord{\left/ {\vphantom {{2135800} {{{T}^{2}}}}} \right. \kern-0em} {{{T}^{2}}}}, \\ \end{gathered} $Температурную зависимость теплоемкости в работе [6] также измеряли методом дифференциальной сканирующей калориметрии, однако приведенное в этой работе аналитическое выражение содержит явные опечатки, не соответствует графическому изображению и не поддается сравнению с другими данными.
Как видно из рис. 1, кривая расчета по Нейману–Коппу (кривая 2) располагается практически параллельно и выше доверительного интервала для экспериментальной теплоемкости, начиная со значения 229.3 Дж/(моль K) при 298 K, которое отличается от экспериментального значения Cp (Дж/(моль K), 298.15 K) = 221.8 Дж/(моль K), найденного нами методом адиабатической калориметрии в работе [15]. Рассчитанное по Нейману–Коппу значение теплоемкости использовано в работе [16] при расчете теплоемкости из приращения энтальпии $H_{T}^{^\circ }$ – $H_{{298.15}}^{^\circ }$ (уравнение (3)). Как было отмечено нами в [24], дифференцирование приращения энтальпии не всегда дает удовлетворительный результат. Необходимо отметить, что, хотя кривая 3 (уравнение (3)) до 1000 K находится в пределах доверительного интервала наших данных, она является более крутой, что при экстраполяции в область высоких температур может внести существенные искажения в расчеты.
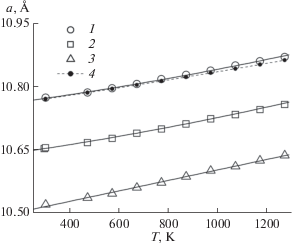
Термическое расширение гафната лантана со структурой пирохлора изучали методом высокотемпературной рентгеновской дифракции. Температурная зависимость параметра а приведена на рис. 2 и имеет близкий к линейному вид, но более точно может быть описана квадратичной зависимостью:
(5)
$\begin{gathered} a({\text{{\AA})}} = 10.7469 + 7.9785 \times {{10}^{{--5}}}T + \\ + \,\,1.4099 \times {{10}^{{--8}}}{{T}^{2}},{{R}^{2}} = {\text{ }}0.9986. \\ \end{gathered} $На основании этой зависимости можно оценить коэффициенты термического расширения: текущий αT = (da/dT)/aT, относительный α298 = = (da/dT)/a298 и линейный относительный TE, % = = 100 × (aT – a298)/a298.
Рассчитанные коэффициенты и параметр кристаллической решетки при температурах 303–1273 K с интервалом в 100 K приведены в табл. 1. Термическое расширение носит положительный характер: (da/dT) > 0, а структурный тип Fd3m сохраняется во всем температурном интервале.
Таблица 1.
Температурная зависимость параметра a кристаллической решетки La2Hf2O7 и коэффициентов термического расширения: текущего (αT) относительного (α298) и линейного относительного (ТЕ), P = 101.3 кПа
| T, K | a, Å | αT × 10–6, K–1 | α298 × 10–6, K–1 | ТЕ, % |
|---|---|---|---|---|
| 303 | 10.774 | 8.20 | 8.20 | 0.02 |
| 473 | 10.786 | 8.63 | 8.65 | 0.13 |
| 573 | 10.796 | 8.89 | 8.91 | 0.22 |
| 673 | 10.806 | 9.14 | 9.17 | 0.32 |
| 773 | 10.818 | 9.39 | 9.43 | 0.43 |
| 873 | 10.828 | 9.64 | 9.69 | 0.52 |
| 973 | 10.838 | 9.89 | 9.95 | 0.61 |
| 1073 | 10.850 | 10.14 | 10.22 | 0.72 |
| 1173 | 10.860 | 10.39 | 10.48 | 0.82 |
| 1273 | 10.870 | 10.64 | 10.74 | 0.91 |
Как видно из рис. 2, температурные зависимости параметров решетки гафната лантана и полученные ранее кривые для гафната неодима (кривая 2) [24] и гадолиния (кривая 3) [25] практически параллельны, следовательно, коэффициенты термического расширения, рассчитанные с помощью производной (da/dT), имеют близкие зависимости от температуры. Здесь же показана зависимость а(Т) (кривая 4), взятая из работы [26] при условии, что аргументом в приведенном в статье уравнении является (Т – 273 K), но не Т. При такой замене температурная зависимость приобретает смысл и фактически совпадает с полученной нами.
ЗАКЛЮЧЕНИЕ
Синтезирован и идентифицирован поликристаллический образец La2Hf2O7 структурного типа пирохлора и с помощью дифференциальной сканирующей калориметрии измерена его теплоемкость в интервале температур 310–1380 K, которая согласуется с полученными ранее методом адиабатической калориметрии результатами. Температурная зависимость молярной теплоемкости представлена в виде уравнения Майера–Келли. При температурах 303–1273 K методом высокотемпературной дифрактометрии рассчитано изменение параметра кристаллической решетки гафната лантана, показан положительный характер термического расширения и отсутствие структурных превращений, проведена оценка коэффициентов термического расширения. Результаты исследований могут быть использованы в термодинамических расчетах фазовых равновесий с участием гафната лантана, определении его химической стойкости в агрессивных средах, а также в разработках технологий синтеза и нанесения защитных покрытий.
Список литературы
Subramanian M.A., Aravamudan G., Subba Rao G.V. // Prog. Solid State Chem. 1983. V. 15. P. 55. https://doi.org/10.1016/0079-6786(83)90001-8
Vaßen R., Jarligo M.O., Steinke T. et al. // Surf. Coat. Technol. 2010. V. 205. P. 938. https://doi.org/10.1016/j.surfcoat.2010.08.151
Padture N.P., Gell M., Jordan E.H. // Science. 2002. V. 296. P. 280. https://doi.org/10.1126/science.1068609
Tejero-Martin D., Bennett C., Hussain T. // J. Eur. Ceram. Soc. 2021. V. 41. P. 1747. https://doi.org/10.1016/j.jeurceramsoc.2020.10.057
Chen H.-F., Zhang C., Liu Y.-C. et al. // Rare Metals. 2019. https://doi.org/10.1007/s12598-019-01307-1
Liang P., Dong S., Zeng J. et al. // Ceram. Int. 2019. V. 45. P. 22432. https://doi.org/10.1016/j.ceramint.2019.07.235
Арсеньев П.А., Глушкова В.Б., Евдокимов А.А. и др. Соединения редкоземельных элементов. Цирконаты, гафнаты, ниобаты, танталаты, антимонаты. М.: Наука, 1985. 261 с.
Andrievskaya E.R. // J. Eur. Ceram. Soc. 2008. V. 28. P. 2363. https://doi.org/10.1016/jeurceramsoc.2008.01.009
Ushakov S.V., Saradhi P.M., Navrotsky A. et al. // Meet. Abstr. 2012. MA2012-02. 2329. https://doi.org/10.1149/MA2012-02/24/2329
Vorozhtcov V.A., Stolyarova V.L., Chislov M. et al. // J. Mater. Res. 2019. P. 1. https://doi.org/10.1557/jmr.2019.206
Costa G., Harder B.J., Wiesner V.L. et al. // J. Am. Ceram. Soc. 2019. V. 102. P. 2948. https://doi.org/10.1111/jace.16113
Summers W.D., Poerschke D.L., Begley M.R. et al. // J. Am. Ceram. Soc. 2020.https://doi.org/10.1111/jace.17187
Глушко В.П. Термодинамические свойства индивидуальных веществ. Справочник. М.: Изд-во АН СССР, 1978.
Ushakov S.V., Navrotsky A. // J. Am. Ceram. Soc. 2007. V. 90. P. 1171. https://doi.org/10.1111/j.1551-2916.2007.01592.x
Гуськов В.Н., Гагарин П.Г., Гуськов А.В. и др. // Журн. неорган. химии. 2019. Т. 64. С. 1210. [Guskov V.N., Gagarin P.G., Guskov A.N. et al. // Russ. J. Inorg. Chem. 2019. V. 64. P. 1436.] https://doi.org/10.1134/S0036023619110068
Babu R., Nagarajan K. // J. Alloys Compd. 1998. V. 265. P. 137. https://doi.org/10.1016/s0925-8388(97)00430-1
Wieser M.E. // Pure Appl. Chem. 2006. V. 78. P. 2051. https://doi.org/10.1351/pac200678112051
Коломиец Т.Ю., Тельнова Г.Б., Ашмарин А.А. и др. // Неорган. материалы. 2017. Т. 53. С. 890. [Kolomiets T.Yu., Tel’nova G.B., Ashmarin A.A., et al. // Inorg. Mater. 2017. V. 53. P. 874. https://doi.org/10.1134/s0020168517080076]
Popov V.V., Menushenkov A.P., Yaroslavtsev A.A. et al. // J. Alloys Compd. 2016. V. 689. P. 669. https://doi.org/10.1016j.jallcom.2016.08.019
Gagarin P.G., Guskov A.V., Guskov V.N. et al. // Ceram. Int. 2021. V. 47. P. 2892. https://doi.org/10.1016/j.ceramint.2020.09072
Maier C.G., Kelley K.K. // J. Am. Chem. Soc. 1932. V. 54. P. 3243. https://doi.org/10.1021/ja01347a029
Konings R.J.M., Beneš O., Kovács A. et al. // J. Phys. Chem. Ref. Data. 2014. V. 43. Art. 013101. https://doi.org/10.1063/1.4825256
Pankratz L.B. // U.S. Bureau of Mines Bulletin. 1982. V. 672. P. 188.
Guskov V.N., Gagarin P.G., Guskov A.V. et al. // Ceram. Int. 2019. V. 45. P. 20733. https://doi.org/10.1016/j.ceramint.2019.07.057
Guskov V.N., Tyurin A.V., Guskov A.V. et al. // Ceram. Int. 2020. V. 46. P. 128229. https://doi.org/10.1016/j.ceramint.2020.02.052
Govindan Kutti, Rajagopaian S., Mathews C.K., Varadaraju U.V. // Mater. Res. Bull. 1994. V. 29. P. 759. https://doi.org/10.1016/0025-5408(94)90201-1
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии