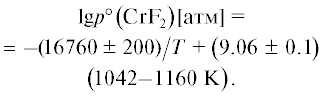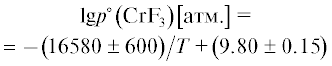Журнал неорганической химии, 2021, T. 66, № 7, стр. 900-906
Энтальпии образования фторидов хрома. I. Низшие фториды CrF, CrF2, CrF3
М. И. Никитин a, И. П. Малкерова a, Д. Б. Каюмова a, А. С. Алиханян a, *
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: alikhan@igic.ras.ru
Поступила в редакцию 16.02.2021
После доработки 04.03.2021
Принята к публикации 05.03.2021
Аннотация
Проведен детальный анализ совокупности экспериментальных данных с учетом наиболее поздних работ о газовых и гетерогенных равновесиях реакций с участием низших фторидов хрома. Объяснены причины расхождения полученных в них величин одинаковых термодинамических характеристик соединений. Результаты анализа представлены в виде уточненных энтальпий образования кристаллических и газообразных соединений: ΔfН°(CrF, г, 0) = –42.5 ± 15.1 кДж/моль, ΔfН°(CrF2, к, 298.15 K) = –780.7 ± 2.5 кДж/моль, ΔfН°(CrF2, г, 0) = –454.7 ± 4.6 кДж/моль, ΔfН°(CrF3 к, 298.15 K) = = –1146.7 ± 4.2 кДж/моль, ΔfН°(CrF3, г, 0) = –799.9 ± 12.1 кДж/моль. Подтверждена возможность образования кристаллического Cr2F5 при восстановлении CrF3(к).
ВВЕДЕНИЕ
Несмотря на важность свойств низших фторидов, например для оценки свойств хромистых сталей в аппаратах, работающих при высоких температурах в агрессивных средах, в последние десятилетия они экспериментально не уточнялись и даже не пересматривались.
Представленный в [1] выбор термохимических характеристик низших фторидов хрома(I)–(III) можно рассматривать как сжатый обзор экспериментальных работ, опубликованных до 1988 г. Наиболее полный и подробный анализ с учетом результатов более новых исследований проведен в [2].
Характерной чертой работ [1, 2] является стремление включить в базу данных для выбора рекомендованных величин максимальное число значений этих величин из оригинальных работ. Часто их значительные расхождения не объясняются и маскируются большими погрешностями, которые рассматриваются как случайные, хотя при этом не исключен и значительный вклад систематической составляющей, а иногда являются экспертными оценками. В некоторой степени такой подход носит формальный характер и приводит к увеличению итоговой погрешности. Причиной является использование только заключительных (в лучшем случае промежуточных) результатов оригинальных работ. Часто это связано с недостатком информации о методике эксперимента и объективными трудностями интерпретации получаемых первичных данных. Практически это означает, что целесообразнее рекомендовать надежный (даже менее точный) результат одной работы, чем десяти других с необъясненными причинами расхождения конечных результатов.
В настоящей работе основное внимание уделено как раз первичным экспериментальным данным и отнесению их к равновесиям различных реакций, протекание которых возможно в конкретном опыте, и определены термодинамические характеристики молекул, позволяющие количественно оценить их термическую устойчивость и реакционную способность.
Для обработки данных о газовых и гетерогенных равновесиях, полученных по 3-му закону термодинамики, использовали термодинамические функции участников равновесий из работ [1, 3]. Приведенные погрешности полученных энтальпий реакций, фазовых переходов и образования веществ соответствуют 95%-ному доверительному интервалу средних значений.
АНАЛИЗ ЛИТЕРАТУРНЫХ ДАННЫХ
Фторид хрома(II)а
Равновесия реакций с участием кристаллического дифторида хрома исследовали методом ЭДС [4, 5]. Их энтальпии использовали в настоящей работе для расчета рекомендованных энтальпий образования ∆fH°(CrF2, к, 0) = –780.0 ± 2.5 и ∆fH°(CrF2, к, 298.15 K) = –780.7 ± 2.5 кДж/моль (средневзвешенное значение). Здесь и далее индексы к, ж, г при формулах означают: к – кристалл; ж – жидкость; г – газ. Подробности выбора приведены в [2].
Давление насыщенного пара CrF2 было определено в [6, 7] эффузионным методом с масс-спектрометрическим определением его состава. В обеих работах была использована электронная ионизация, причем и в [6], и в [7] были сняты кривые эффективности ионизации и определены энергии появления ионов. Несмотря на максимальное сходство экспериментальных методик, были получены различающиеся на порядок величины. Заниженное давление в [6] объясняется в [7] уменьшением активности CrF2 из-за взаимодействия препарата дифторида хрома с материалом эффузионной камеры танталом. О взаимодействии можно судить по его продуктам [6]: 1) в масс-спектре электронной ионизации помимо ионов Cr+, CrF+ и ${\text{CrF}}_{2}^{ + }$ в небольших количествах присутствует ион ${\text{TaF}}_{4}^{ + }$ из молекулы TaF5; 2) в паре обнаружен атомарный хром. Однако в [1] на основании только качественного замечания о малой доле ионов хрома в суммарном масс-спектре ионов категорически утверждается, что заметного понижения активности фторида хрома(II) не происходит.
Данных, приведенных в [6], недостаточно для точных расчетов равновесий реакций с участием TaF5, поэтому проиллюстрируем возникшую ситуацию на похожем примере испарения фторида железа(II) [8]. В [8], как и в [6], те же авторы, используя тот же метод и то же экспериментальное оборудование, установили малую долю ионов ${\text{TaF}}_{4}^{ + }$ в суммарном масс-спектре, но получили сильно завышенную энтальпию сублимации FeF2. Следует отметить, что при выборе энтальпии сублимации FeF2 в [1] эти результаты не учитывались.
И все же количественная оценка взаимодействия фторида хрома(II) и тантала возможна. Рассмотрим равновесие реакции:
(1)
${\text{5Cr}}{{{\text{F}}}_{{\text{2}}}}({\text{г}}) + {\text{2Ta(к)}} = {\text{5Cr(к)}} + {\text{2Ta}}{{{\text{F}}}_{{\text{5}}}}({\text{г}}){\text{.\;\;}}$При расчете термодинамических характеристик реакции (1) использовали данные [9] для TaF5 и данные [10] для Ta(к) и Cr(к). Последняя из полученных характеристик – ∆rH°((1), 298 K) = –1356.7 кДж/моль; ∆rΦ'((1), 1100 K) = –644.7 Дж/моль K; ∆rG°((1), 1100K) = = –2065.9 кДж/моль – означает, что восстановление фторида хрома(II) танталом идет до металлического хрома при практически полном расходовании одного из исходных реагентов, несмотря на то что ∆rG°(1) является сильно отрицательной величиной.
Приведенные факты и расчеты убедительно показывают, что тантал непригоден для изготовления эффузионных камер, предназначенных для исследования даже устойчивых фторидов, из-за исключительной термодинамической устойчивости легколетучего пентафторида.
В работе [7] проводилось исследование испарения фторида хрома(II) из молибденовой, хромовой и платиновой эффузионных камер в интервале температур 1030–1280 K. Прежде всего следует отметить принципиальное отличие масс-спектра насыщенного пара, который оказался более сложным, чем в [6]. Его количественная расшифровка по кривым эффективности ионизации показала присутствие в паре молекул CrF2 (основной компонент), CrF3 и CrF. Примеры приведены в табл. 1. Одинаковые масс-спектры пара из молибденовой и хромовой камер указывают на инертность их материала по отношению к фториду хрома(II) и его диспропорционирование на трифторид, монофторид и кристаллический хром с единичной активностью. Из-за хорошей растворимости хрома в платине его активность оказывается меньше единицы и доля CrF3 в паре возрастает. Очевидно, тантал является настолько сильным восстановителем, что молекулы CrF2 гибнут на его поверхности, намного превышающей площадь эффузионного отверстия, превращаясь в CrF и хром. Это приводит к уменьшению потока молекул CrF2 из камеры, несмотря на сохранение постоянства активности кристаллического CrF2, близкого к единице. Внешне же создается видимость снижения активности CrF2 из-за неустановления в системе гетерогенных равновесий. Дополнительная информация приведена в разделах “Фторид хрома(I)” и “Фторид хрома(III)”.
Энтальпия сублимации фторида хрома(II) рассчитана нами с использованием температурной зависимости давления насыщенного пара из [7]:
По 2-му закону ∆sH°(CrF2, 0) = 335.9 ± ± 4.3 кДж/моль, по 3-му закону – 325.4 ± ± 3.8 кДж/моль. Последняя величина и принятая в этой работе ∆fH°(CrF2, к, 0) дает ∆fH°(CrF2, г, 0) = = –454.6 ± 4.6 кДж/моль.
Для жидкого фторида хрома(II) в [7] приведено уравнение:
(3)
$\begin{gathered} {\text{lg}}p^\circ {\text{(Cr}}{{{\text{F}}}_{{\text{2}}}}{\text{,}}\,{\text{ж) [атм]}} = \\ = \,{{\,{\text{--}}({\text{15080}} \pm {\text{590}})} \mathord{\left/ {\vphantom {{\,{\text{--}}({\text{15080}} \pm {\text{590}})} T}} \right. \kern-0em} T} + ({\text{7}}{\text{.48}} \pm {\text{0}}{\text{.2}}) \\ {\text{ }}\left( {{\text{1170--1280 K}}} \right){\text{.}} \\ \end{gathered} $Соответствующая энтальпия испарения, рассчитанная по 2-му закону, равна ∆vH°(CrF2,0) = = 306.3 ± 11.3, по 3-му закону – 323.1 ± 11.3 кДж/моль. Энтальпия плавления CrF2 (2.3 кДж/моль, 3-ий закон) явно мала, очевидно, она имеет большую погрешность и нуждается в уточнении. Величина ∆mH°(CrF2) = 48 кДж/моль, использованная в [1], представляется более предпочтительной.
Фторид хрома(I)
Для увеличения парциального давления CrF в насыщенном паре CrF2 в [6] исследована система CrF2–Cr. В остальном, за исключением температурного интервала, методика и условия измерений были такими же, как при определении давления насыщенного пара CrF2. Константу равновесия реакции
(4)
${\text{2CrF(г)}} = {\text{Cr}}{{{\text{F}}}_{{\text{2}}}}{\text{(г)}} + {\text{Cr(г)}}{\text{.}}$Первичные экспериментальные данные в виде ионных токов в относительных единицах (две точки в относительных единицах) при неуказанных температурах, взятые с рис. 1 и 3 работы [6], представлены в табл. 2 совместно с K° (4).
Таблица 2.
Ионные токи (относительные единицы) и K°(4) с рис. 1, 3 [6]
| Конденсированная фаза | CrF2+ | CrF+ | Cr+ | Ko(4) |
|---|---|---|---|---|
| CrF2, рис. 1 | 397 | 46.9 | 15.6 | 2.7 |
| CrF2–Cr, рис. 3 | 1737 | 74.9 | 5.99 | 1.8 |
Видно, что добавка металлического хрома к фториду хрома(II) не только не увеличила, но даже уменьшила парциальное давление CrF по сравнению с CrF2 (табл. 1). При температурах опыта в системе Cr–Ta существует соединение Cr2Ta и твердые растворы [11]. Это может приводить к заметным и даже большим ошибкам при априорном выборе активностей компонентов конденсированной фазы. В данном случае произошло уменьшение активности тантала и, соответственно, уменьшение его восстановительной способности.
Как отмечено в [1], проблема расчета энтальпии реакции (4) состоит в том, что константы ее равновесия в табл. 2 совершенно не соответствуют величинам, приведенным авторами [6] в табл. 3, ни при каких температурах. В настоящей работе данный факт рассмотрен более подробно.
Таблица 3.
Константы равновесия и энтальпия (кДж/моль) реакции (4) [6]
| T, K | lgKo(4) | –∆rHo((4), 0) | Ko(4) | –∆rHo((4), 0) |
|---|---|---|---|---|
| [6] | по данным [6] | наст. работа | ||
| 1259 | 1.530 | 68.2 | 2.2 | 39.6 |
| 1286 | 1.696 | 73.6 | 2.2 | 40.3 |
| 1307 | 1.596 | 72.1 | 2.2 | 40.8 |
| 1269 | 1.839 | 76.2 | 2.2 | 39.8 |
| 1272 | 1.681 | 72.5 | 2.2 | 39.9 |
| 1290 | 1.668 | 73.1 | 2.2 | 40.4 |
| 1294 | 1.303 | 64.3 | 2.2 | 40.5 |
| 1317 | 1.311 | 65.4 | 2.2 | 41.0 |
| Среднее арифметическое | 70.7 ± 4.2 | 40.3 ± 0.5 | ||
Ограниченный качественный объем исходного материала не дает возможности объяснить это расхождение. Как нулевое приближение для всего температурного интервала принята среднеарифметическая величина K°(4) из табл. 2. Это соответствует ∆rS°((4) T) = 6.6 (рассчитано по 2-му закону по данным из табл. 3), которая не согласуется с расчетной величиной –17.8 Дж/моль K при 1300 K по 3-му закону. Попытки уточнить результаты введением учета температурной зависимости K°(4) в пределах температурного интервала не приводят к существенным изменениям.
Использование определенных в [6] значений энергии появления ионов хрома и его фторидов для расчетов энтальпий реакций нецелесообразно из-за больших погрешностей (±0.3 эВ).
Другие равновесия реакций с участием CrF рассмотрены в разделе “Фторид хрома(II)б”.
Фторид хрома(III)
Две работы по определению энтальпии образования кристаллического фторида хрома(III), проанализированные в [1], дают плохо согласующиеся результаты. Усреднять их вряд ли целесообразно, поэтому окончательный выбор можно будет сделать на основании дополнительной информации из рассмотренных в этой работе материалов.
Давление насыщенного пара CrF3 было определено в [12] в температурном интервале 906–1058 K и приведено в виде уравнения:
(6)
$\begin{gathered} {\text{lg}}p^\circ \left( {{\text{Cr}}{{{\text{F}}}_{{\text{3}}}}} \right)\left[ {{\text{атм}}} \right] = \\ = \,\,{{{\text{--}}\left( {{\text{12640}} \pm {\text{120}}} \right)} \mathord{\left/ {\vphantom {{{\text{--}}\left( {{\text{12640}} \pm {\text{120}}} \right)} T}} \right. \kern-0em} T} + \left( {{\text{7}}{\text{.20}} \pm {\text{0}}{\text{.12}}} \right){\text{.}} \\ \end{gathered} $Использована та же методика и аппаратура, что и при исследовании CrF2(к) в [6] (см. выше). Взаимодействие с материалом эффузионной камеры (танталом) не отмечено. В паре присутствовал только мономер CrF3, что позволило проводить измерения при энергии ионизирующих электронов 50 эВ. Кроме трифторида хрома в [12] измерено давление насыщенного пара фторидов железа(III) и марганца(III).
Аналогичные измерения были выполнены в [7] при испарении фторида хрома(III) из платиновой эффузионной камеры:
в интервале температур 1040–1160 K.Прежде всего обращают на себя внимание относительно низкие температуры измерений при сравниваемых давлениях CrF3: 906 K при 1.8 × × 10–7 атм. [12] и 1040 K при 7.2 × 10–7 атм. [7]. При одинаковой температуре, например 1050 K, данные [12] и [7] расходятся в 14.2 раза. Объяснение этого явления в [1] не дано и при выборе энтальпии сублимации предложена величина ∆sH°(CrF3, 0) = 330.0 ± 15.0 кДж/моль. Однозначно прокомментировать такой выбор невозможно. Более подробно этот вопрос рассмотрен в [13], но сводится только к обоснованию погрешности.
Тем не менее существует простое и разумное объяснение результатов [12] – большая систематическая погрешность измерения температуры, а именно ее занижение. Эта погрешность определяется не возможным градиентом температуры по эффузионной камере (единицы K) или другими факторами, вносящими отклонения такого же порядка, и составляет десятки K. Точно указать, из-за чего это произошло, невозможно, но причина чисто техническая: состояние термопары, ее контакта с камерой, полярность ее соединения с выводами из испарителя, неисправность системы измерения и т.п.
Обоснованием этого предположения является практически полное испарение фторида марганца(III) с разложением до дифторида, рассмотренное в [14], и рекордно высокое давление насыщенного пара фторида железа(III), больше нигде не подтвержденное. В [1] надежность полученных результатов основана на совпадении величин энтальпий и энтропий сублимации FeF3, рассчитанных по 2-му и 3-му законам. Однако этот часто используемый в литературе критерий не абсолютен. Согласие результатов обработки по 2-му и 3-му законам является необходимым, но недостаточным условием, подтверждающим правильность исходных данных и рассчитанных с их использованием термодинамических характеристик. Искусственное увеличение температур измерения на 70–100 K заметно увеличивает расчетную величину ∆sH°(FeF3, T), а согласие разных методов расчетов практически не меняет.
В настоящей работе для фторида хрома(III) получены: по 2-му закону величина ∆sH°(CrF3, 0) = = 335.9 ± 11.5 кДж/моль, по 3-му закону величина 343.4 ± 11.5 кДж/моль, рассчитанные по уравнению (7) [7].
Фторид хрома(II)б
В разделе “Фторид хрома(II)а” рассмотрено испарение фторида хрома(II) из молибденовой и хромовой камер (табл. 1) [7]. Его диспропорционирование с образованием трех фторидов в газовой фазе и существование в конденсированной фазе CrF2 (возможно, жидкий) и Cr позволяют рассмотреть равновесия двух реакций:
(8)
${\text{3Cr}}{{{\text{F}}}_{{\text{2}}}}({\text{к}}) = {\text{2Cr}}{{{\text{F}}}_{{\text{3}}}}({\text{к}}) + {\text{Cr}}({\text{к}}){\text{,}}$(9)
${\text{2Cr}}{{{\text{F}}}_{{\text{2}}}}({\text{г}}) = {\text{Cr}}{{{\text{F}}}_{{\text{3}}}}({\text{г}}) + {\text{CrF}}({\text{г}}){\text{.}}$При a(Cr) = a(CrF2) = 1 константы равновесия этих реакций можно записать в следующем виде:
Выбор этих реакций обусловлен независимостью расчета их констант равновесия от константы чувствительности прибора. Для первых двух измерений константы равновесия рассчитывали по молекулярным ионам при энергиях электронов, на 4 эВ превышающих энергии ионизации, в остальных случаях ‒ по расшифрованным с использованием индивидуальных масс-спектров суммарных ионных токов. Предполагалось, что температура плавления CrF2 ниже 1180 K, поэтому давление насыщенного пара рассчитывалось, соответственно, по уравнениям (2) и (3). Результаты представлены в табл. 4.
Таблица 4.
Ионные токи ∑I+(i), константы равновесия и энтальпии (кДж/моль) реакций (8), (9)
| T, K | ∑I+(i), В [7] | a(CrF3) × 103 |
Ko(8) × 106 |
∆rHo((8), 298.15 K) | Ko(9) × 103 |
∆rHo((9), 0) | ||
|---|---|---|---|---|---|---|---|---|
| CrF | CrF2 | CrF3 | ||||||
| 1139 | 0.21 | 1.51 | 0.025 | 1.83 | 3.35 | 53.9 | 2.35 | 61.7 |
| 1245 | 2.23 | 16.51 | 0.5 | 2.03 | 4.12 | 51.6 | 4.18 | 60.9 |
| 1179 | 1.62 | 39.43 | 0.74 | 2.10 | 4.41 | 52.8 | 0.787 | 74.4 |
| 1219 | 0.48 | 12.49 | 0.83 | 4.73 | 2.24 | 36.5 | 2.61 | 64.5 |
| 1235 | 0.52 | 16.42 | 0.59 | 2.46 | 6.07 | 48.4 | 1.16 | 73.6 |
Средняя арифметическая величина ∆rH°((8), 298.15 K) = 48.7 ± 6.8, ∆rH°((9), 0) = 67.0 ± ± 6.2 кДж/моль. С принятыми энтальпиями образования кристаллического фторида хрома(II) и реакции (8) получено значение ∆fH°(CrF3, к, 0) = = –1143.5 ± 4.2 и ∆fH°(CrF3, к, 298.15 K) = –1146.7 ± ± 4.2 кДж/моль.
При исследовании насыщенного пара систем Cr–CrF3 и Cr–VF3 в работе [15] эффузионным методом с масс-спектрометрическим анализом состава пара были обнаружены молекулы CrF3, CrF2 и CrF. Последние идентифицированы по остаточному масс-спектру после вычитания из суммарного масс-спектра индивидуальных масс-спектров CrF3, CrF2, полученных в этой же работе. Действительно, проведение этой процедуры дает для CrF (табл. 2 в [15]) отношение i(CrF+)/i(Cr+) = 0.78 ± 0.39, близкое к 0.6 [7]. Пересчет с принятыми в данной работе термодинамическими функциями дает величину ∆rH°((9), 0) = = 47 ± 9, практически согласующуюся в пределах погрешностей с найденной по данным [7].
Окончательный выбор энтальпий образования низших фторидов хрома(I)–(III) сделан ниже.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Отмеченные в разделах “Фторид хрома(II)” и “Фторид хрома(I)” недостатки работы [6] делают нецелесообразным использование извлеченной из нее информации для определения энтальпий образования CrF2 и CrF. Для кристаллического CrF3 принята энтальпия образования из данной работы ∆fH°(CrF3, к, 298.15 K) = –1146.7 ± 4.2 кДж/моль. Эта величина очень хорошо согласуется с полученной в [16, 1 ] при исследовании равновесия реакции:
(10)
${\text{Cr}}{{{\text{F}}}_{{\text{3}}}}({\text{к}}) + {\text{1/2}}{{{\text{H}}}_{{\text{2}}}}({\text{г}}) = {\text{Cr}}{{{\text{F}}}_{{\text{2}}}}{\text{(к}}) + {\text{HF(г}})$Заниженная в [17] величина энтальпии образования кристаллического фторида хрома(III) может быть следствием образования промежуточного продукта восстановления – Cr2F5. Термодинамические свойства аналогичных соединений подробно рассмотрены в [18]. При этом потенциалобразующей оказывается реакция:
(11)
${\text{Cr}}({\text{к}}) + {\text{2C}}{{{\text{r}}}_{{\text{2}}}}{{{\text{F}}}_{{\text{5}}}}{\text{(к}}) = {\text{5Cr}}{{{\text{F}}}_{{\text{2}}}}{\text{(к}}){\text{,}}$Теперь становится возможным по энтальпии реакции (9) найти ∆fH°(CrF, г, 0) = –42.5 ± ± 15.1 кДж/моль. Эта величина и принята в качестве рекомендованной.
Наиболее объективной оценкой K°(4), по первичным экспериментальным данным [6], является K°((4), T) = 2.2 и соответствующая ей ∆rH°((4), 0) = = –40.3 кДж/моль. При этом величина ∆fH°(CrF, г, 0) = –10.0 кДж/моль оказывается ближе к рекомендованной. Еще ближе она оказывается, если приведенные в [6] величины lgK°(4) относятся к обратной реакции. В этом случае ∆rH°((4), 0) = 7.1 ± ± 3.5 и ∆fH°(CrF, г, 0) = –33.7 кДж/моль.
Ограниченный объем первичных экспериментальных данных в [15] не позволяет провести расшифровку суммарных масс-спектров пара других систем, например CrF3–Cr–ScF3 (см. предыдущий раздел), и индивидуального CrF2 с целью однозначного установления величин вклада ионных токов из молекул CrF. Если в [7] для этого применялась ионизация электронами с энергией, незначительно превышающей энергию ионизации CrF, то для данных [15] можно использовать только статистическую обработку.
Основанные на данных из [7] и приведенные в литературе рекомендованные величины энтальпий образования низших фторидов хрома представлены в табл. 5.
Таблица 5.
Стандартные энтальпии образования* (кДж/моль) фторидов хрома в газовой (–∆fH°(0)) и конденсированной (–∆fH°(298.15 K)) фазах
| CrF | CrF2(к) | CrF2 | CrF3(к) | CrF3 | Данные |
|---|---|---|---|---|---|
| –18.5 ± 10.1 | 778.2 | 434.0 ± 12.4 | 1173.2 | 836.1 ± 14.4 | [2, 19]** |
| –33.4 ± 42 | 775.3 ± 12.6 | 414.6 ± 17.6 | 1159.0 ± 4.2 | 906.2 ± 13.4 | [20] |
| –11.6 ± 10.2 | 780 ± 5 | 439.3 ± 15.8 | 1160.0 ± 10.0 | 826.8 ± 18.0 | [1] |
| 42.5 ± 15.1 | 780.7 ± 2.5 | 454.7 ± 4.6 | 1146.7 ± 4.2 | 799.9 ± 12.1 | Наст. работа |
Список литературы
Термодинамические свойства индивидуальных веществ. Электронное справочное издание. Т. 5. Элементы Mn, Cr, V, Sc и их соединения (2004). http://www.chem.msu.su/rus/tsiv/
Ebbinghaus B.B. // Combust. Flame. 1995. V. 101. P. 311. https://doi.org/10.1016/0010-2180(94)00215-E
Гурвич Л.В., Вейц И.В., Медведев В.А. и др. Термодинамические свойства индивидуальных веществ. Справочное издание в 4-х т. М.: Наука, 1982. Т. IV. Кн. 1 и 2. 623 с.
Вечер Р.А., Вечер А.А., Зильберман Т.Б. // Изв. АН СССР. Неорган. материалы. 1975. Т. 11. № 8. С. 1520.
Резухина Т.Н., Горшкова Т.И., Цветков А.А. // Журн. физ. химии. 1983. Т. 57. № 8. С. 1887.
Kent R.A., Margrave J.L. // J. Am. Chem. Soc. 1965. V. 87. № 16. P. 3582. https://doi.org/10.1021/ja01094a010
Малкерова И.П., Алиханян А.С., Первов В.С. и др. // Журн. неорган. химии. 1979. Т. 24. № 12. С. 3191.
Kent R.A., Margrave J.L. // J. Am. Chem. Soc. 1965. V. 87. № 21. P. 4754. https://doi.org/10.1021/ja00949a016
Lau K.H., Hildenbrand D.L. // J. Chem. Phys. 1979. V. 71 № 4. P. 1572. https://doi.org/10.1063/1.438482
JANAF https://janaf.nist.gov/
Диаграммы состояния двойных металлических систем: справочник / Под ред. Лякишева Н.П. М.: Машиностроение, 1996. Т. 1–3. 996 с.
Zmbov K.F., Margrave J.L. // J. Inorg. Nucl. Chem. 1967. V. 29. P. 673. https://doi.org/10.1016/0022-1902(67)80322-1
Гусаров А.В. // ТВТ. 2013. Т. 51. № 2. С. 318.
Никитин М.И., Раков Э.Г., Цирельников В.B., Хаустов С.В. // Журн. неорган. химии. 1997. Т. 42. № 7. С. 1154.
Болталина О.В., Борщевский А.Я., Сидоров Л.Н. // Журн. физ. химии. 1991. Т. 65. № 4. С. 884.
Jellinek K., Rudat A. // Z. Anorg. Allg. Chem. 1928. B. 175. № 4. S. 281. https://doi.org/10.1002/zaac.19281750120
Tanaka H., Yamaguchi A., Moriama J. // J. Jpn. Inst. Met. 1971. V. 35. № 12. P. 1161. https://doi.org/10.2320/jinstmet1952.35.12_1161
Nikitin M.I., Chilingarov N.S., Alikhanyan A.S. // Russ. J. Inorg. Chem. 2021. V. 66. № 1. P. 89. [Никитин М.И., Чилингаров Н.С., Алиханян А.С. // Журн. неорган. химии. 2021. Т. 66. № 1. С. 81.]https://doi.org/10.1134/S0036023621010058
Thermochemical properties of inorganic substances / Ed. Barin I. N.Y.: Springer, 1977. 861 p.
Термические константы веществ. Справочник в 10 вып. / Под ред. Глушко В.П. М.: ВИНИТИ, 1974. Т. 7. Ч. 1. http://www.chem.msu.ru/cgi-bin/tkv.pl
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии