Журнал неорганической химии, 2021, T. 66, № 6, стр. 729-736
БИ- И ТЕТРАЯДЕРНЫЕ БРОМИДНЫЕ КОМПЛЕКСЫ СУРЬМЫ(III) С БИС(3-ПИРИДИН)АЛКИЛЬНЫМИ КАТИОНАМИ
А. Н. Усольцев a, М. Н. Соколов a, b, В. П. Федин a, С. А. Адонин a, c, *
a Институт неорганической химии им. А.В. Николаева СО РАН
630090 Новосибирск, пр-т Академика Лаврентьева, 3, Россия
b Казанский (Приволжский) федеральный университет, Институт химии им. А. Бутлерова
420111 Казань, ул. Кремлевская, 1/29, Россия
c Южно-Уральский государственный университет
454080 Челябинск, пр-т Ленина, 76, Россия
* E-mail: adonin@niic.nsc.ru
Поступила в редакцию 25.01.2021
После доработки 28.01.2021
Принята к публикации 29.01.2021
Аннотация
Полиядерные бромоантимонаты(III) с катионами типа бис(3-метилпиридиний)алканов ((3-MePy)${\text{C}}_{n}^{{2 + }}$), а именно: (3-MePyC2)3[Sb2Br9]2 (1), (3-MePyC3)2[β-Sb4Br16] (2) и (3-MePyC4)2[α-Sb4Br16] (3), а также бромовисмутат(III) (3-MePyC3)3[Bi2Br9]2 (4) получены в результате реакций растворов Sb2O3 (Bi2O3) в HBr с бромидами соответствующих органических катионов. Рассмотрены отличия в строении соединений 1–3 и бромовисмутатов(III) с аналогичными катионами (4 и соединения, исследованные ранее).
ВВЕДЕНИЕ
Галогенидные комплексы (галогенометаллаты, ГМ) p-элементов представляют обширный класс комплексных соединений [1, 2]. С точки зрения структурной неорганической химии они имеют интересную особенность, без сомнения, заслуживающую подробного изучения, а именно богатство структурных типов: только для Bi(III) их число превышает 40 [2], включая дискретные анионы с ядерностью до 8 [3–12], одно- [13–16] и (реже) двухмерные [17] координационные полимеры. С точки зрения материаловедения интерес к ним обусловлен разнообразными физическими свойствами: для них характерны сегнетоэлектричество и сегнетоэластичность [12, 18–22], термохромизм [23, 24] и др. Особое внимание привлекает возможность использования иодидных комплексов в качестве компонентов солнечных батарей [25–31].
Наиболее сложная задача в химии ГМ – это невозможность предсказать образование комплекса определенного структурного типа, зная условия синтеза. Широко распространенный подход “строительных блоков” неприменим в этой области в силу сравнительно низких энергий связей M–X и быстрой кинетики замещения лигандов. Согласно наиболее распространенной точке зрения [32], в растворах ГМ существуют исключительно в виде мономерных форм [MXn]m–; их конденсация, приводящая к образованию различных полиядерных анионов, происходит в процессе образования твердой фазы. Ключевым фактором, определяющим ее строение, является природа растворителя, в особенности катиона, соль которого используется в синтезе [33], однако корреляции, которые могли бы иметь предсказательную силу, на данный момент не установлены. По этой причине получение новых данных о строении ГМ, а также их анализ остаются актуальными задачами. В настоящей работе нами получены и структурно охарактеризованы три новых гомолигандных комплекса Sb(III) с катионами – производными 3-пиколина: (3-MePyC2)3[Sb2Br9]2 (1), (3-MePyC3)2[β-Sb4Br16] (2) и (3-MePyC4)2[α-Sb4Br16] (3); обсуждается строение этих соединений в сравнении с бромовисмутатами(III) с аналогичными катионами (для этой цели получен новый бромовисмутат(III) (3-MePyC3)3[Bi2Br9]2 (4)).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез соединений 1–4 проводили на воздухе. Реактивы марки “х. ч.” получали из коммерческих источников и использовали без дополнительной очистки. Бромидные соли органических катионов получали взаимодействием 2 эквивалентов 3-пиколина и 1 эквивалента соответствующего 1,Х-дибромалкана в CH3CN (кипячение, 18 ч, выход >90% во всех случаях); чистоту продуктов проверяли с помощью элементного анализа. Во всех случаях использовали концентрированную HBr.
Синтез 1. Навеску 58 мг (0.2 ммоль) Sb2O3 растворяли в 2 мл HBr и добавляли раствор 112 мг (0.3 ммоль) (3-MePyC2)Br2 в 1 мл HBr. В течение нескольких минут начиналось образование бледно-желтых кристаллов 1. Выход 77%.
Синтез 2. Процедура аналогична получению 1. Использовали 77 мг (0.2 ммоль) (3-MePyC3)Br2. Выход 69%.
Синтез 3. Процедура аналогична получению 1. Использовали 80 мг (0.2 ммоль) (3-MePyC4)Br2. Выход 75%.
Синтез 4. Навеску 93 мг (0.2 ммоль) Bi2O3 растворяли в 3 мл HBr и добавляли раствор 116 мг (0.3 ммоль) (3-MePyC3)Br2 в 1 мл HBr. В течение нескольких минут начиналось образование бледно-желтых кристаллов 4. Выход 66%.
Рентгеноструктурное исследование. Данные для монокристаллов соединений 1–4 получены при 130 K на дифрактометре Agilent Xcalibur, оснащенном двухкоординатным детектором Atlas S2 (графитовый монохроматор, λ(MoKα) = = 0.71073 Å, сканирование по ω). Интегрирование, учет поглощения, определение параметров элементарной ячейки проводили с использованием пакета программ CrysAlisPro. Структура расшифрована с использованием программы SHELXT [34] и уточнена полноматричным методом наименьших квадратов в анизотропном приближении (за исключением атомов водорода) с использованием программ SHELXL [35]. Позиции атомов водорода органического катиона рассчитаны геометрически и уточнены по модели “наездника”. Детали РСА и основные кристаллоструктурные данные приведены в табл. 1. Данные депонированы в Кембриджском банке структурных данных (CCDC 2057946-2057949; http://www.ccdc.cam.ac.uk/structures), а также могут быть получены у авторов.
Таблица 1.
Детали рентгеноструктурных экспериментов для соединений 1–4
| Параметр | 1 | 2 | 3 | 4 |
|---|---|---|---|---|
| Брутто-формула | C42H54Sb4Br18N6 | C30H40Br16N4Sb4 | C32H44Br16N4Sb4 | C45H60Bi4Br18N6 |
| M, г/моль | 1284.14 | 2222.22 | 2250.27 | 1479.64 |
| Сингония | Триклинная | Моноклинная | Моноклинная | Моноклинная |
| Пр. гр. | P$\bar {1}$ | P21/n | P21/n | P21/c |
| a, Å | 10.6368(4) | 11.6777(6) | 14.2410(5) | 33.2031(6) |
| b, Å | 10.8059(6) | 42.2817(17) | 11.2731(5) | 12.2909(2) |
| c, Å | 15.4810(7) | 16.5504(8) | 19.0662(8) | 18.3480(3) |
| α, град | 76.034(4) | 95.618(5) | 110.674(5) | 101.466(2) |
| β, град | 81.735(3) | 95.618(5) | 110.674(5) | 101.466(2) |
| γ, град | 83.387(4) | |||
| V, Å3 | 1702.8(14) | 8132.56(70) | 2863.78(20) | 7338.3(20) |
| Z | 2 | 6 | 2 | 8 |
| ρвыч, г/см3 | 2.504 | 2.722 | 2.609 | 2.67839 |
| μ, мм−1 | 12.163 | 13.79 | 13.06 | 19.40 |
| F(000) | 1182.0 | 6072 | 2056 | 5336.0 |
| Размер кристалла, мм | 0.27 × 0.19 × 0.06 | 0.24 × 0.20 × 0.15 | 0.29 × 0.24 × 0.21 | 0.14 × 0.11 × 0.10 |
| Область сканирования по θ, град | 3.5–29.0 | 3.3–29.0 | 3.4–28.9 | 3.5–28.8 |
| Диапазон индексов hkl | h = −13→14, k = −13→14, l = −15→18 |
h = −15→11, k = −53→51, l = −14→21 |
h = −19→15, k = −14→12, l = −18→25 |
h = −31→41, k = −16→12, l = −22→23 |
| Nhkl измеренных/независимых | 14851/7482 | 41181/16292, | 13896/6252 | 40970/16272 |
| Rint | 0.038 | 0.053 | 0.029 | 0.036 |
| Nhkl с I > 2σ(I) | 5757 | 11833 | 5154 | 12286 |
| R[F2 > 2σ(F2)], wR(F2), S | 0.048, 0.113, 1.02 | 0.053, 0.101, 1.06 | 0.029, 0.100, 0.70 | 0.040, 0.076, 1.02 |
| Ост. электронная плотность (max/min), e/Å3 | 1.46, −3.01 | 1.16, −1.93 | 0.72, –1.43 | 3.78, −3.70 |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
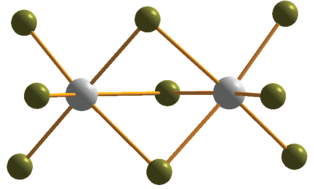
Анионы, присутствующие в соединениях 1–4, относятся к известным и описанным ранее структурным типам. Биядерные анионы ${{[{\text{M}}_{2}^{{{\text{III}}}}{{{\text{X}}}_{9}}]}^{{3 - }}}$ (соединения 1 и 4) состоят из двух октаэдров {MX6}, объединенных общей гранью (рис. 1). Комплексы, содержащие данный фрагмент, широко представлены для M = Bi [9–11, 36, 37]. Согласно Кембриджской структурной базе данных, для M = = Sb(III) и X = Br описано 17 подобных соединений [12, 20, 38, 39]. Длины связей Sb–Brterm и Sb–μ2-Br в 1 лежат в диапазонах 2.572–2.701 и 2.907–3.319 Å соответственно; аналогичные расстояния в 4 – 2.706–2.783 и 2.951–3.056 Å.
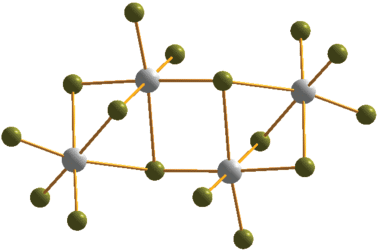
Несмотря на то, что для синтеза соединений 2 и 4 был использован идентичный органический прекурсор ((3-MePyC3)Br2), строение анионной части существенно различается. В случае M = = Sb(III) (2) в структуре присутствует тетраядерный анион (рис. 2), принадлежащий к весьма редкому структурному типу (ранее было описано всего лишь два примера подобных галогенометаллатов [40, 41]). Данный анион можно представить как результат объединения двух биядерных фрагментов [M2X9]3–, при котором два μ2-мостиковых бромидных лиганда становятся μ3. Длины связей Sb–Brterm, Sb–μ2-Br и Sb–μ3-Br в 2 лежат в диапазонах 2.534–5.610, 2.810–3.206 и 2.779–3.478 Å.
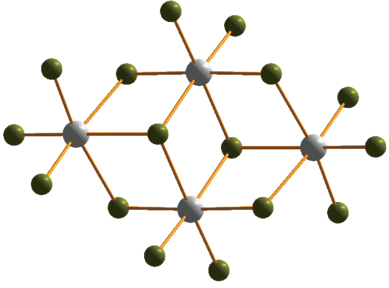
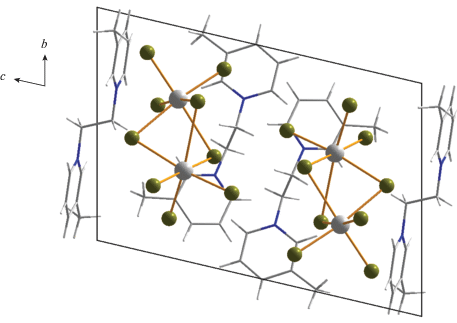
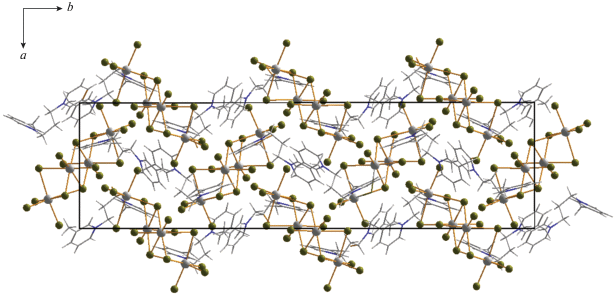
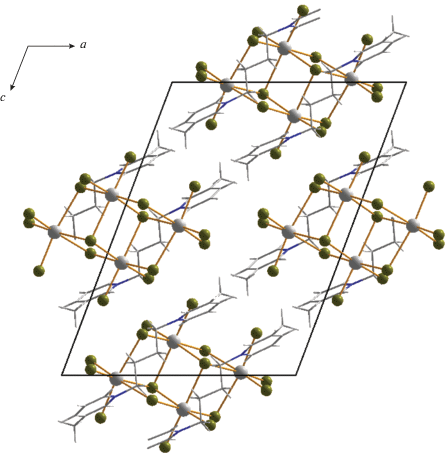
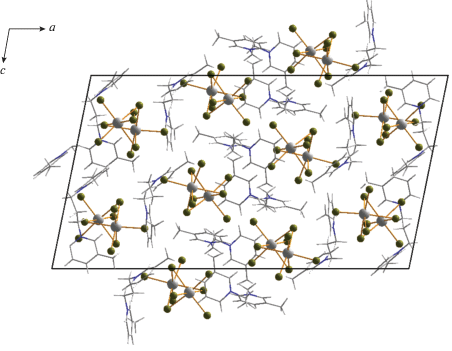
В случае катиона с большей длиной углеводородного “линкера”, соединяющего два 3-метилпиридиниевых фрагмента ((3-MePyC4)2+), был получен галогенидный комплекс сурьмы (3) с дискретным анионом тетраядерного строения. Данный тип (рис. 3) достаточно часто встречается в структурной химии галогенометаллатов и представлен хлоридами [36, 42], иодидами [43] и бромидами [44]. В данном анионе атомы сурьмы расположены в вершинах ромба и связаны между собой мостиковыми фрагментами μ2-Br и μ3-Br. Длины связей Sb–Brterm, Sb–μ2-Br и Sb–μ3-Br в 3 лежат в диапазонах 2.524–5.600, 2.781–3.151 и 3.110–3.162 Å. Упаковки в кристаллах 1–4 изображены на рис. 4–7.
Таким образом, можно отметить следующее. Строение бромидных комплексов сурьмы(III) и висмута(III), образующихся в присутствии идентичных органических катионов, может кардинально различаться, что заметно даже на небольшом числе представленных примеров. Можно предположить, что Sb(III), в отличие Bi(III), будет обнаруживать большую склонность к образованию дискретных полиядерных комплексных анионов, а не соответствующих координационных полимеров. В настоящее время нами проводятся эксперименты, направленные на проверку данной гипотезы. Учитывая, что структурная химия бромоантимонатов(III) изучена в меньшей степени, чем бромовисмутатов(III), а также ярко выраженный интерес к соединениям сурьмы в целом [45–49], представляется вероятным, что данная тематика вызовет растущий интерес исследователей в ближайшей перспективе.
Список литературы
Wu L.-M., Wu X.-T., Chen L. // Coord. Chem. Rev. 2009. V. 253. № 23–24. P. 2787. https://doi.org/10.1016/J.CCR.2009.08.003
Adonin S.A., Sokolov M.N., Fedin V.P. // Russ. J. Inorg. Chem. 2017. V. 62. № 14. P. 1789. https://doi.org/10.1134/S0036023617140029
Buikin P.A., Rudenko A.Y., Baranchikov A.E. et al. // Russ. J. Coord. Chem. 2018. V. 44. № 6. P. 373. https://doi.org/10.1134/S1070328418060015
Kotov V.Y., Ilyukhin A.B., Simonenko N.P. et al. // Polyhedron. 2017. V. 137. P. 122. https://doi.org/10.1016/J.POLY.2017.08.016
Sharutin V.V., Sharutina O.K., Khisamov R.M. et al. // Russ. J. Inorg. Chem. 2017. V. 62. № 6. P. 766. https://doi.org/10.1134/S0036023617060201
Sharutin V.V., Yegorova I.V., Klepikov N.N. et al. // Russ. J. Inorg. Chem. 2009. V. 54. № 1. P. 52. https://doi.org/10.1134/S0036023609010124
Sharutin V.V., Egorova I.V., Sharutina O.K. et al. // Russ. J. Coord. Chem. 2004. V. 30. № 12. P. 874. https://doi.org/10.1007/s11173-005-0042-1
Bowmaker G.A., Junk P.C., Lee A.M. et al. // Aust. J. Chem. 1998. V. 51. № 4. P. 293. https://doi.org/10.1071/C97036
Bowmaker G.A., Harrowfield J.M., Junk P.C. et al. // Aust. J. Chem. 1998. V. 51. № 4. P. 285. https://doi.org/10.1071/C97035
Wojtaś M., Jakubas R., Baran J. // Vib. Spectrosc. 2005. V. 39. № 1. P. 23. https://doi.org/10.1016/J.VIBSPEC.2004.10.004
Kulicka B., Lis T., Kinzhybalo V. et al. // Polyhedron. 2010. V. 29. № 8. P. 2014. https://doi.org/10.1016/J.POLY.2010.03.017
Wojtaś M., Jakubas R., Ciunik Z. et al. // J. Solid State Chem. 2004. V. 177. № 4–5. P. 1575. https://doi.org/10.1016/J.JSSC.2003.12.011
Goforth A.M., Peterson L.R., Smith M.D. et al. // J. Solid State Chem. 2005. V. 178. № 11. P. 3529. https://doi.org/10.1016/j.jssc.2005.09.010
Krautscheid H. // Z. Anorg. Allg. Chem. 1995. V. 621. № 12. P. 2049. https://doi.org/10.1002/zaac.19956211212
Toma O., Mercier N., Allain M. et al. // CrystEngComm. 2013. V. 15. № 42. P. 8565. https://doi.org/10.1039/c3ce41579a
Jóźków J., Medycki W., Zaleski J. et al. // Phys. Chem. Chem. Phys. 2001. V. 3. № 15. P. 3222. https://doi.org/10.1039/b102697f
Mitzi D.B. // Inorg. Chem. 2000. V. 39. № 26. P. 6107. https://doi.org/10.1021/ic000794i
Leblanc N., Mercier N., Zorina L. et al. // J. Am. Chem. Soc. 2011. V. 133. № 38. P. 14924. https://doi.org/10.1021/ja206171s
Bi W., Leblanc N., Mercier N. et al. // Chem. Mater. 2009. V. 21. № 18. P. 4099. https://doi.org/10.1021/cm9016003
Wojta M., Bator G., Jakubas R. et al. // J. Phys. Condens. Matter. 2003. V. 15. № 33. P. 5765. https://doi.org/10.1088/0953-8984/15/33/310
Piecha-Bisiorek A., Jakubas R., Medycki W. et al. // J. Phys. Chem. A. 2014. V. 118. № 20. P. 3564. https://doi.org/10.1021/jp501331c
Mercier N. // Eur. J. Inorg. Chem. 2013. V. 2013. № 1. P. 19. https://doi.org/10.1002/ejic.201201125
Zhang W., Sun Z., Zhang J. et al. // J. Mater. Chem. C. 2017. V. 5. № 38. P. 9967. https://doi.org/10.1039/c7tc02721d
Gągor A., Węcławik M., Bondzior B. et al. // CrystEngComm. 2015. V. 17. № 17. P. 3286. https://doi.org/10.1039/C5CE00046G
Frolova L.A., Anokhin D.V., Piryazev A.A. et al. // J. Phys. Chem. Lett. 2017. V. 8. № 1. P. 67. https://doi.org/10.1021/acs.jpclett.6b02594
Frolova L.A., Anokhin D.V., Piryazev A.A. et al. // J. Phys. Chem. Lett. 2017. V. 8. № 7. P. 1651. https://doi.org/10.1021/acs.jpclett.7b00210
Belich N.A., Tychinina A.S., Kuznetsov V.V. et al. // Mendeleev Commun. 2018. V. 28. № 5. P. 487. https://doi.org/10.1016/j.mencom.2018.09.011
Fateev S.A., Petrov A.A., Khrustalev V.N. et al. // Chem. Mater. 2018. V. 30. № 15. P. 5237. https://doi.org/10.1021/acs.chemmater.8b01906
Petrov A.A., Sokolova I.P., Belich N.A. et al. // J. Phys. Chem. C. 2017. V. 121. № 38. P. 20739. https://doi.org/10.1021/acs.jpcc.7b08468
Shlenskaya N.N., Belich N.A., Grätzel M. et al. // J. Mater. Chem. A. 2018. V. 6. № 4. P. 1780. https://doi.org/10.1039/c7ta10217h
Ganose A.M., Savory C.N., Scanlon D.O. // Chem. Commun. 2017. V. 53. № 1. P. 20. https://doi.org/10.1039/C6CC06475B
Mercier N., Louvain N., Bi W. // CrystEngComm. 2009. V. 11. № 5. P. 720. https://doi.org/10.1039/b817891g
Adonin S.A., Gorokh I.D., Novikov A.S. et al. // Polyhedron. 2018. V. 139. https://doi.org/10.1016/j.poly.2017.11.002
Sheldrick G.M. // Acta Crystallogr., Sect. A: Found. Adv. 2015. V. 71. № 1. P. 3. https://doi.org/10.1107/S2053273314026370
Sheldrick G.M. // Acta Crystallogr., Sect. C: Struct. Chem. 2015. V. 71. № 1. P. 3. https://doi.org/10.1107/S2053229614024218
Ahmed I.A., Blachnik R., Reuter H. // Z. Anorg. Allg. Chem. 2001. V. 627. № 9. P. 2057. https://doi.org/10.1002/1521-3749(200109)627:9<20-57::AID-ZAAC2057>3.0.CO;2-7
Szklarz P., Jakubas R., Piecha-Bisiorek A. et al. // Polyhedron. 2018. V. 139. P. 249. https://doi.org/10.1016/J.POLY.2017.10.030
Hall M., Nunn M., Begley M.J. et al. // J. Chem. Soc., Dalton. Trans. 1986. № 6. P. 1231. https://doi.org/10.1039/DT9860001231
Porter S.K., Jacobson R.A. // J. Chem. Soc. A. Inorganic, Phys. Theor. Chem. 1970. P. 1359. https://doi.org/10.1039/J19700001359
Sharutin V.V., Egorova I.V., Levchuk M.V. et al. // Russ. J. Coord. Chem. 2002. V. 28. № 9. P. 613. https://doi.org/10.1023/A:1020082731096
Kou B., Zhang W., Ji C. et al. // Chem. Commun. 2019. V. 55. № 94. P. 14174. https://doi.org/10.1039/C9CC05365D
Al-Farhan K.A., Al-Wassil A.I. // J. Chem. Crystallogr. 1995. V. 25. № 12. P. 841. https://doi.org/10.1007/BF01671080
Sharutin V.V., Egorova I.V., Sharutina O.K. et al. // Russ. J. Coord. Chem. 2008. V. 34. № 6. P. 461. https://doi.org/10.1134/S1070328408060122
Rheingold A.L., Uhler A.D., Landers A.G. // Inorg. Chem. 1983. V. 22. № 22. P. 3255. https://doi.org/10.1021/ic00164a018
Sharutin V.V., Poddel’sky A.I., Sharutina O.K. // Russ. J. Coord. Chem. 2020. V. 46. P. 663. https://doi.org/10.1134/S1070328420100012
Okhlopkova L.S., Poddel’sky A.I., Smolyaninov I.V. et al. // Russ. J. Coord. Chem. 2020. V. 46. P. 386. https://doi.org/10.1134/S107032842005005X
Okhlopkova L.S., Smolyaninov I.V., Baranov E.V. et al. // Russ. J. Coord. Chem. 2020. V. 46. P. 466. https://doi.org/10.1134/S1070328420060081
Sharutin V.V., Sharutina O.K., Efremov A.N. // J. Struct. Chem. 2020. V. 61. P. 1414. https://doi.org/10.1134/S0022476620090085
Sharutin V.V., Sharutina O.K., Efremov A.N. et al. // Russ. J. Inorg. Chem. 2020. V. 65. P. 992.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии