Журнал неорганической химии, 2021, T. 66, № 6, стр. 721-728
КОМПЛЕКСООБРАЗОВАНИЕ Н[AuCl4] C 2-МЕТИЛИМИДАЗОЛОМ
Д. Бахроми a, С. М. Сафармамадзода a, *, И. О. Фрицкий b, Д. А. Мубораккадамов a
a Таджикский национальный университет
734025 Душанбе, пр-т Рудаки, 17, Таджикистан
b Киевский национальный университет им. Т. Шевченко
01601 Киев, ул. Владимирская, 60, Украина
* E-mail: sash65@mail.ru
Поступила в редакцию 28.10.2020
После доработки 26.01.2021
Принята к публикации 27.01.2021
Аннотация
Потенциометрическим методом изучено комплексообразование Н[AuCl4] с 2-метилимидазолом при 288–318 K. Установлено, что даже при избытке 2-метилимидазола в растворе происходит замещение трех хлоридных ионов из состава Н[AuCl4]. Рассчитаны общие константы устойчивости образующихся комплексов в широком интервале температур (при 298 K: lgβ1 = 8.04 ± 0.04; lgβ2 = 13.53 ± ± 0.03; lgβ3 = 19.23 ± 0.09). С увеличением температуры и ионной силы раствора общие константы устойчивости комплексов увеличиваются. Вычислены термодинамические константы образования комплексов. Показано, что разница в величинах концентрационных и термодинамических констант зависит от величины Δνz2 (Δνz2 = $\Delta \nu z_{{{\text{пр}}{\text{.р}}}}^{2}--\Delta \nu z_{{{\text{исх}}{\text{.в}}}}^{2}$). Установлено, что образование всех комплексных форм протекает с поглощением энергии. Величина ΔS на всех стадиях комплексообразования положительна. Для равновесия [AuCl4]– + L ↔ [AuLCli]3 –i + (4 – i)Cl– число молей реагирующих веществ и продуктов реакции остается неизменным. Возрастание энтропии при комплексообразовании, скорее всего, является следствием появления в растворе “размороженной” воды из гидратных оболочек ионов в результате реакций. Величина ΔG на всех стадиях комплексообразования отрицательна. Самопроизвольное протекание реакции комплексообразования определяется энтропийной составляющей.
ВВЕДЕНИЕ
Координационные соединения d-переходных металлов с азотсодержащими гетероциклами характеризуются значительным фармакологическим эффектом и участвуют в ключевых процессах жизнедеятельности. Среди комплексных соединений Au(I) детально изучено золотосодержащее производное тиоглюкозы и триэтилфосфина, которое под названием Ауранофин было введено в клиническую практику еще в 1985 г. для лечения ревматоидного артрита. Показано [1], что терапевтический эффект ауранофина обусловлен его противовоспалительным и иммуносупрессивным действием. В работе [2] приведены данные о противоопухолевых свойствах комплексных соединений золота. Комплексные соединения золота (КСЗ) проявляют противоопухолевую активность in vivo на моделях ксенографтов опухолей человека и перевиваемых опухолей животных, а также обладают цитотоксическим эффектом in vitro, установленным на широкой панели клеточных линий опухолей человека. КСЗ проявляют цитотоксичность в отношении злокачественных опухолей, резистентных по отношению к соединениям платины. Процессы действия КСЗ и производных цис-платины имеют существенные различия. Основными мишенями для действия КСЗ, в отличие от соединений платины, являются белки, в том числе митохондриальная тиоредоксин-редуктаза и протеасома 26s, ингибирование которых соединениями золота ведет к индукции апоптоза.
Имидазолы наряду с химической активностью проявляют также высокую биологическую активность. Имидазольный цикл входит в состав незаменимой аминокислоты гистидина и является структурным фрагментом гистамина, пуриновых оснований, ряда лекарственных средств [3, 4]. Производные имидазола широко применяются в медицине. 2-Метилимидазол используется в качестве исходного сырья для получения противоинфекционных веществ. Широкое применение 2-метилимидазол нашел в производстве ионных жидкостей [5, 6]. Кроме того, он является распространенным отвердителем эпоксидных смол, причем используется как при обычных условиях, так и в процессах горячего отверждения, т.е. вызывает гелеобразование за разумные сроки только при повышенной температуре (от 80–100 до 200–250°C) [7].
На основе производных имидазола готовят препараты, применяемые для лечения гипертонии, сердечной недостаточности, ишемических нарушений, проходимости периферических сосудов, миокардиальной ишемии, диабетической нефропатии, глаукомы, заболеваний желудочно-кишечного тракта и мочевого пузыря [8, 9].
Бензимидазол и его производные известны как ингибиторы селективной коррозии латуней в водных растворах и привлекают постоянное внимание [10, 11]. При использовании 2-меркаптобензимидазола для защиты латуни в 0.1 М NH4Cl при рН 9.2 на ее поверхности каждый атом меди связывается с двумя лигандами, при этом образуется полимерная пленка, которая вызывает замедление электродных реакций [10].
В работе [12] определены составы соединений [MIm(MtIm)x]L, полученных при взаимодействии сукцинитов, фумаратов кобальта(II) и меди(II) состава ML · nH2O с имидазолом и 2-метилимидазолом. Проведен анализ процесса термического разложения солей с помощью ЭСП и ИК-спектроскопии. Доказано участие в комплексообразовании пиридинового атома азота имидазола и атомов кислорода карбоксильных анионов. Спектрофотометрическим методом определены состав и устойчивость имидазолатсукцинатных комплексов кобальта(II) и меди(II) в водном растворе, показана их более высокая устойчивость по сравнению с монолигандными комплексами.
Авторами работ [13, 14] установлено, что кадмий(II) с 1-метил-2-меркаптоимидазолом в водном и водно-спиртовых растворах переменного состава образует четыре комплексные формы. При повышении температуры устойчивость комплексов уменьшается, а при добавлении неводного компонента увеличивается.
В работе [15] исследовано комплексообразование имидазола, 2-метилимидазола, бензимидазола, пиразола, 1,2,4-триазола и изучена их донорная способность по отношению к солям ряда ионов металлов (Cu+, Ag+, Pt2+, Pt4+, Cu2+). В этих комплексах лиганды ведут себя как монодентатные с координацией атома азота. Авторы работы [16] показали, что при взаимодействии хлорида меди с имидазолом местом локализации координационной связи является пиридиновый атом азота, и имидазол ведет себя как монодентатный лиганд. Это подтверждено квантово-химическим расчетом электронного строения, согласно которому наибольший отрицательный заряд сосредоточен на атоме азота N3 (–0.1704), тогда как у остальных атомов N1, С2, С4, С5 заряды равны 0.0465, 0.0833, 0.0128 и 0.0715 соответственно.
В обзорной статье [17] приведены данные по химии соединений золота в растворах. Авторы работы на основании литературных и собственных данных пришли к выводу что $Е_{{{{{\text{A}}{{{\text{u}}}^{{{\text{3 + }}}}}} \mathord{\left/ {\vphantom {{{\text{A}}{{{\text{u}}}^{{{\text{3 + }}}}}} {{\text{Au}}}}} \right. \kern-0em} {{\text{Au}}}}}}^{^\circ }.$ можно принять равным 1.0 ± 0.003 В. В этой же работе рассмотрена возможность акватации и гидролиз ${\text{AuCl}}_{4}^{ - }$ в зависимости от рН и концентрации хлорид-ионов. Показано, что в солянокислых, но разбавленных по ${\text{AuCl}}_{4}^{ - }$ растворах наряду с диспропорционированием возможен процесс акватации:
При повышении рН протекает также и гидролиз по реакции:
Авторы [18] для определения устойчивости димеркаптидных комплексов золота(III) использовали систему ${{{\text{Au}}} \mathord{\left/ {\vphantom {{{\text{Au}}} {{\text{AuCl}}_{4}^{ - }}}} \right. \kern-0em} {{\text{AuCl}}_{4}^{ - }}}.$ В интервале концентраций ${\text{AuCl}}_{4}^{ - }$ 5 × 10–6–5 × 10–5 моль/л и Cl– 0.05–1.0 г-ион/л экспериментально определены величины $Е_{{{{{\text{A}}{{{\text{u}}}^{{{\text{3 + }}}}}} \mathord{\left/ {\vphantom {{{\text{A}}{{{\text{u}}}^{{{\text{3 + }}}}}} {{\text{Au}}}}} \right. \kern-0em} {{\text{Au}}}}}}^{^\circ }.$ При этом установлено, что величина Е° изменяется в пределах 1.013–1.041 В. Среднее значение Е° составило 1.03 ± 0.009 В.
Авторами работы [19] с помощью рН-метрического титрования изучено замещение ионов Cl– на ОН– в комплекcном анионе [AuCl4]–. Константы равновесия ступенчатого замещения Cl– на ОН– в водном растворе при 25°С равны: lgβ1 = = 7.87, lgβ2 = 14.79, lgβ3 = 20.92, lgβ4 = 25.98. Исследована зависимость стандартного потенциала $Е_{{{{{\text{A}}{{{\text{u}}}^{{{\text{3 + }}}}}} \mathord{\left/ {\vphantom {{{\text{A}}{{{\text{u}}}^{{{\text{3 + }}}}}} {{\text{Au}}}}} \right. \kern-0em} {{\text{Au}}}}}}^{^\circ }.$ от рН в растворе с [Cl–] = 1 моль/л и общей концентрацией золота(III) 1 моль/л. Из зависимости Е от рН установлено, что потенциал системы ${{{\text{Au}}} \mathord{\left/ {\vphantom {{{\text{Au}}} {{\text{AuCl}}_{4}^{ - }}}} \right. \kern-0em} {{\text{AuCl}}_{4}^{ - }}}$ до рН 5 остается неизменным. Возрастание рН > 5 приводит к резкому уменьшению величины потенциала золотого электрода. Авторы работы считают, что во всей области рН > 4 растворы золота(III) являются термодинамически неустойчивыми, т.е. должны распадаться с выделением металлического золота, а при рН > 11 возможен также переход золото(III) → золото(I).
Спектрофотометрическим методом в работе [20] при 298 K, I = 1 моль/л в кислом водном растворе изучены равновесия замещения хлорид-ионов в составе ${\text{AuCl}}_{4}^{ - }$ на пиридин (ру), 2,2-дипиридил (bipy), 1,10-фенантролин (phen). С учетом констант протонирования аминов для равновесия
В работах [22, 23] с использованием потенциометрического метода изучено комплексообразование золота(III) с триазолом и бензотриазолом. Показано, что оба органических лиганда образуют с золотом(III) четыре комплексные частицы. Установлено, что устойчивость комплексов с увеличением температуры уменьшается. Введение 1,2-бензенного радикала в молекулу триазола оказывает существенное влияние на устойчивость образующихся комплексов. В работе [22] методом потенциометрии изучено комплексообразование золота(III) c 1-фурфурлиденамино-1,3,4-триазолом. Методом температурного коэффицента определены изменения энтальпии и энтропии реакции образования комплексов. Показано, что самопроизвольное протекание реакций комплексообразования определяется энтальпийной составляющей.
Анализ литературных источников показал, что экспериментальные данные о комплексообразовании золота с имидазолами немногочисленны. В работе [24] проведено исследование кинетики замещения гетероциклического лиганда на хлорид-ионы в составе плоскоквадратных комплексов состава AuCl3(nu), где nu – ряд пятичленных N-донорных гетероциклических лигандов, в частности, имидазол и 2-метилимидазол. В настоящей работе также сообщается о синтезе моноядерных комплексов состава [Au(И)Cl3] и [Au(2-МИ)Cl3], причем идентичность синтезированных соединений подтверждена методами элементного анализа и ЯМР [24]. Установлено, что гетероциклические лиганды входят в состав координационных соединений в нейтральной форме. В то же время в упомянутой работе не проводилось исследование процессов комплексообразования в растворах, приводящих к формированию указанных комплексов, не определялись соответствующие константы устойчивости. Учитывая высокую биологическую активность золота(III), 2-метилимидазола, с научной и практической точки зрения актуальным является исследование комплексообразования в системе H[AuCl4]–2-метилимидазол–H2O.
Цель настоящей работы – определение состава, устойчивости и термодинамических характеристик разнолигандных комплексов состава [AuLiCl4–i]–1+i и в дальнейшем иследование их биологической и каталитической активности.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходных соединений использовали 2-метилимидазол (L) и Н[AuCl4]. Раствор Н[AuCl4] готовили согласно методике, предложенной в [25]. Начальная концентрация Н[AuCl4] составляла 1 × 10–5 моль/л, концентрация 2-метилимидазола – 4 × 10–4 моль/л. Для исследования взаимодействия Н[AuCl4] с 2-метилимидазолом был использован гальванический элемент с переносом: Au/[AuCl4]–║Ag,AgCl/Cl–. Потенциометрическое титрование проводили на рН-метре МИ-150 из полумикробюретки вместимостью 5 мл с ценой деления 0.01 мл. В работе использовали слабокислый раствор Н[AuCl4] (рН 5) и водный раствор 2-метилимидазола (рН 10.4). Концентрация хлорид-ионов составляла 0.1 моль/л и поддерживалась добавлением в раствор KCl. Ионную силу создавали добавлением в раствор перхлората натрия (I = 0.1 моль/л). Потенциометрическое титрование проводили 4–5 раз при каждой температуре. Потенциал системы устанавливался в течение 10–15 мин. Температуру в ячейке поддерживали постоянной при помощи водяного термостата (±0.5°С). Равновесные концентрации золота(III), 2-метилимидазола, образующихся комплексов и их константы устойчивости были определены по программе KEV [26].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Проведенный литературный обзор показал, что использование золотого электрода при потенциометрическом исследовании комплексообразования золота(III) связано с определенными ограничениями, обусловленными непостоянным значением электродного потенциала системы Au/[AuCl4]–, а также процессами гидролиза при разбавлении раствора Н[AuCl4].
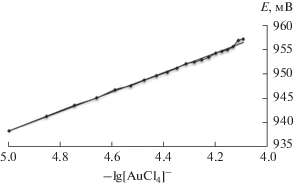
В этой связи перед исследованием процесса комплексообразования Н[AuCl4] с 2-метилимидазолом были проведены исследования по установлению обратимости золотого электрода к Н[AuCl4] и определению электродного потенциала этой системы. На рис. 1 приведена зависимость Е от –lg[AuCl4]– для системы Au/[AuCl4]–.
Как видно из рис. 1, зависимость Е от –lg[AuCl4]– имеет линейный характер с углом наклона 19.97 мВ, что удовлетворяет уравнению Нернста для электродов первого рода. Стандартный потенциал системы составляет 1038 мВ, что согласуется с литературными данными.
Для установления влияния гидролиза на электродный потенциал Au/[AuCl4]– нами изучена зависимость электродного потенциала этой системы от рН в растворе с [Cl–] = 0.1 моль/л и общей концентрацией золота(III) 3.59 × 10–3 моль/л. На рис. 2 приведена зависимость Е от рН.
Рис. 2.
Зависимость электродного потенциала от рН, I = 0.1 моль/л: 298 K, ${{C}_{{{{{[{\text{AuC}}{{{\text{l}}}_{{\text{4}}}}]}}^{ - }}}}}$ = 3.59 × 10–3 моль/л, CKCl = 0.1 моль/л.
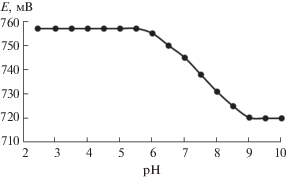
Как следует из рис. 2, в интервале рН 2.5–5 потенциал системы Au/[AuCl4]– остается постоянным, а начиная с рН 5.5 резко уменьшается, что является следствием протекания гидролитических процессов. На это указывают и авторы работы [19], изучавшие зависимость Е от рН для этой системы. Авторы [19] также считают, что во всей области рН > 4 растворы золота(III) являются термодинамически неустойчивыми, т.е. должны распадаться с выделением металлического золота. С этим выводом мы не согласны, так как растворы Н[AuCl4] при рН 5 стабильны и при долгом хранении из них не выпадает осадок металлического золота.
Электродный потенциал системы [AuCl4]–/Au по отношению к хлорсеребряному электроду при концентрации [AuCl4]– 1 × 10–5 моль/л равен 712 мВ. При добавлении к этой системе 2-метилимидазола в интервале температур 278–318 K наблюдается плавное уменьшение потенциала без каких-либо скачков. Такое изменение потенциала свидетельствует о том, что между Н[AuCl4] и 2-метилимидазолом протекает комплексообразование и исключается изменение степени окисления Au(III) в процессе комплексообразования, так как происходит ее термодинамическая стабилизация.
В работе [27] приведено значение рKа 2-метилимидазола. Используя значение рKа 2-метилимидазола, мы установили, что максимальная доля накопления молекулярной формы 2-метилимидазола приходится на pH 10–10.5. Ниже pH 10 в растворе начинает накапливаться протонированная форма 2-метилимидазола. Поскольку в проведенных нами исследованиях исходный раствор 2-метилимидазола имел рН 10.4, можно предположить, что в реакции комплексообразования в основном участвует молекулярная форма этого соединения:
В табл. 1 приведены данные потенциометрического титрования [AuCl4]– раствором 2-метилимидазола при 298 K и рассчитанные по программе KEV [26] равновесные концентрации [AuCl4]– и [L].
Таблица 1.
Данные потенциометрического титрования системы [AuCl4]– раствором 2-метилимидазола при 298 K. СL = 4 × 10–4 моль/л; ${{C}_{{{{{[{\text{AuC}}{{{\text{l}}}_{{\text{4}}}}]}}^{ - }}}}}$ = 1 × 10–5 моль/л, I = 0.1 моль/л
| Еэксп, мВ | ${{C}_{{{{{[{\text{AuC}}{{{\text{l}}}_{{\text{4}}}}]}}^{ - }}}}}$ × 106 | СL × 106 | [AuCl4]– × 108 | [L] × 107 | Етеор, мВ |
|---|---|---|---|---|---|
| 929.1 | 9.96 | 1.59 | 838 | 0.0191 | 929.8 |
| 925.7 | 9.92 | 3.17 | 677 | 0.0468 | 928.0 |
| 923.0 | 9.88 | 4.74 | 520 | 0.0903 | 925.7 |
| 919.4 | 9.84 | 6.30 | 367 | 0.167 | 922.8 |
| 915.3 | 9.80 | 7.84 | 266 | 0.326 | 918.6 |
| 910.7 | 9.77 | 9.38 | 113 | 0.714 | 912.7 |
| 904.8 | 9.73 | 10.9 | 51.2 | 1.54 | 905.9 |
| 901.0 | 9.69 | 12.4 | 26.1 | 2.73 | 900.1 |
| 896.8 | 9.65 | 13.9 | 14.9 | 4.15 | 895.3 |
| 892.5 | 9.62 | 15.4 | 9.16 | 5.78 | 891.2 |
| 888.5 | 9.58 | 16.9 | 5.77 | 7.67 | 887.2 |
| 884.5 | 9.54 | 18.3 | 3.79 | 9.74 | 883.6 |
| 879.7 | 9.51 | 19.8 | 2.42 | 12.3 | 879.8 |
| 876.4 | 9.47 | 21.2 | 1.57 | 15.3 | 876.0 |
| 870.9 | 9.43 | 22.6 | 0.999 | 18.8 | 872.2 |
| 867.1 | 9.40 | 24.1 | 0.608 | 23.4 | 867.9 |
| 862.9 | 9.36 | 25.5 | 0.372 | 28.8 | 863.7 |
| 858.7 | 9.33 | 26.9 | 0.226 | 35.1 | 859.5 |
| 854.7 | 9.29 | 28.3 | 0.136 | 42.9 | 855.1 |
| 851.0 | 9.26 | 29.6 | 0.0856 | 51.1 | 851.1 |
| 847.4 | 9.23 | 31.0 | 0.0532 | 60.9 | 847.1 |
| 843.9 | 9.19 | 32.4 | 0.0336 | 72.0 | 843.1 |
| 841.2 | 9.16 | 33.7 | 0.0228 | 82.9 | 839.8 |
| 837.7 | 9.12 | 35.0 | 0.0157 | 94.5 | 836.6 |
| 835.8 | 9.09 | 36.4 | 0.011 | 107.0 | 833.5 |
| 831.2 | 9.06 | 37.7 | 0.00804 | 120.0 | 830.9 |
| 827.4 | 9.03 | 39.0 | 0.00603 | 132.0 | 828.4 |
| 824.3 | 8.99 | 40.3 | 0.00459 | 145.0 | 826.1 |
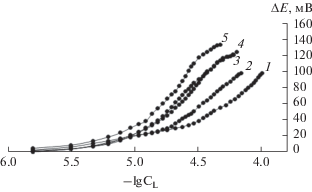
Для установления характера взаимодействия Н[AuCl4] с 2-метилимидазолом с помощью данных потенциометрического титрования построена зависимость ΔЕ от –lgСL, где ΔЕ = Енач – Ев.к.т. Из рис. 3 видно, что зависимость ΔЕ от –lgСL имеет нелинейный характер, что свидетельствует о протекании ступенчатого процесса комплексообразования между [AuCl4]– и 2-метилимидазолом (при образовании единственной комплексной частицы эта зависимость была бы линейной).
Рис. 3.
Зависимость ΔЕ от –lgСL для системы Н[AuCl4]–2-метилимидазол в диапазоне 278–318 K, I = = 0.1 моль/л: 1 – 278, 2 – 288, 3 – 298, 4 – 308, 5 – 318 K.
Общие константы устойчивости образующихся комплексов рассчитывали по программе KEV. Для расчета констант образования в программу вводили данные потенциометрического титрования, концентрации [AuCl4]– и 2-метилимидазола в каждой точке титрования, предположительно протекающие процессы, т.е. реакцию протонирования 2-метилимидазола, реакции комплексообразования между [AuCl4]– и 2-метилимидазолом:
(2)
${{\left[ {{\text{AuC}}{{{\text{l}}}_{{\text{4}}}}} \right]}^{--}} + {\text{L}} = \left[ {{\text{AuLC}}{{{\text{l}}}_{{\text{3}}}}} \right] + {\text{C}}{{{\text{l}}}^{--}},$(3)
${{\left[ {{\text{AuC}}{{{\text{l}}}_{{\text{4}}}}} \right]}^{--}} + {\text{2L}} = {{\left[ {{\text{Au}}{{{\text{L}}}_{{\text{2}}}}{\text{C}}{{{\text{l}}}_{{\text{2}}}}} \right]}^{ + }} + {\text{2C}}{{{\text{l}}}^{--}},$(4)
${{\left[ {{\text{AuC}}{{{\text{l}}}_{{\text{4}}}}} \right]}^{--}} + {\text{3L}} = {{\left[ {{\text{Au}}{{{\text{L}}}_{{\text{3}}}}{\text{Cl}}} \right]}^{{{\text{2}} + }}} + {\text{3C}}{{{\text{l}}}^{--}},$(5)
${{\left[ {{\text{AuC}}{{{\text{l}}}_{{\text{4}}}}} \right]}^{--}} + {\text{4L}} = {{\left[ {{\text{Au}}{{{\text{L}}}_{{\text{4}}}}} \right]}^{{{\text{3}} + }}} + {\text{4C}}{{{\text{l}}}^{--}},$(6)
${{\left[ {{\text{AuC}}{{{\text{l}}}_{{\text{4}}}}} \right]}^{--}} + {\text{Н}}{{{\text{L}}}^{ + }} = {{[{\text{AuC}}{{{\text{l}}}_{{\text{3}}}}{\text{НL}}]}^{ + }} + {\text{C}}{{{\text{l}}}^{--}}.$Обработка данных потенциометрического титрования по программе KEV дает удовлетворительные результаты только для образования трех комплексных форм (реакции (2)–(4)). В табл. 2 приведены значения общих констант устойчивости комплексов золота(III) с 2-метилимидазолом при 278–318 K. Достоверность определения констант доказана удовлетворительным совпадением экспериментально найденных значений потенциалов с теоретическими (табл. 1).
Таблица 2.
Величины общих констант устойчивости 2-метилимидазольных комплексов золота(III)
| Т, K | I = 0.1 моль/л | I = 0.2 моль/л | ||||
|---|---|---|---|---|---|---|
| lgβ1 [AuLCl3]0 | lgβ2 [AuL2Cl2]+ | lgβ3 [AuL3Cl]2+ | lgβ1 [AuLCl3]0 | lgβ2 [AuL2Cl2]+ | lgβ3 [AuL3Cl]2+ | |
| 278 | 6.95 ± 0.05 | 11.12 ± 0.05 | 17.4 ± 0.07 | 7.07 ± 0.04 | 12.44 ± 0.03 | 17.67 ± 0.08 |
| 288 | 7.52 ± 0.03 | 12.37 ± 0.04 | 18.34 ± 0.08 | 7.64 ± 0.01 | 13.35 ± 0.02 | 18.6 ± 0.08 |
| 298 | 8.04 ± 0.04 | 13.53 ± 0.03 | 19.23 ± 0.09 | 8.17 ± 0.05 | 14.19 ± 0.03 | 19.48 ± 0.05 |
| 308 | 8.53 ± 0.06 | 14.61 ± 0.02 | 20.06 ± 0.06 | 8.67 ± 0.03 | 14.98 ± 0.04 | 20.27 ± 0.06 |
| 318 | 9.0 ± 0.07 | 15.61 ± 0.01 | 20.85 ± 0.07 | 9.14 ± 0.04 | 15.72 ± 0.02 | 21.05 ± 0.06 |
Как видно из данных табл. 2, с увеличением температуры и ионной силы раствора наблюдается повышение значений общих констант устойчивости комплексов золота(III).
Для расчета термодинамических функций образования комплексов золота(III) с 2-метилимидазолом необходимы численные значения термодинамических констант устойчивости. В этой связи найденные при двух значениях ионной силы концентрационные константы устойчивости были использованы для определения термодинамических констант 2-метилимидазольных комплексов золота(III) с применением уравнения [28]:
(7)
$\lg {{\beta }_{0}} = \lg {{\beta }_{{\text{C}}}} - \Delta \nu {{z}^{2}}{{{\text{A}}}_{{\text{r}}}}\left( {\frac{{{{I}^{{1{\text{/}}2}}}}}{{1 + 1.6{{I}^{{1{\text{/}}2}}}}} - 0.05I} \right)\alpha J.$Для расчета термодинамической константы устойчивости по уравнению (7) необходимо знать изменение концентрационной константы при переходе от ионной силы
1 к ионной силе 2 (α = = 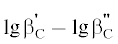 ), которая существенно зависит от свойств реагирующей системы и электролитической
среды.
), которая существенно зависит от свойств реагирующей системы и электролитической
среды.
Величину Δνz2 в уравнении (7) находили для каждой комплексной формы по формуле Δνz2 = = $\Delta \nu z_{{{\text{пр}}{\text{.р}}}}^{2} - \Delta \nu z_{{{\text{исх}}{\text{.в}}}}^{2}.$ Образование монозамещенного комплекса золота(III) с 2-метилимидазолом протекает по реакции:
Величина Δνz2 для этой реакции равна (–1)2 – – (–1)2 = 0. Для комплексов золота, содержащих две и три молекулы 2-метилимидазола, величины Δνz2 будут равны 2 и 6 соответственно.
В табл. 3 приведены значения термодинамических констант устойчивости комплексов золота(III), рассчитанные по уравнению (7), при 278–318 K.
Таблица 3.
Величины термодинамических констант устойчивости комплексов золота(III) с 2-метилимидазолом в диапазоне температур 278–318 K
| Т, K | $\lg \beta _{1}^{0}$ | $\lg \beta _{2}^{0}$ | $\lg \beta _{3}^{0}$ |
|---|---|---|---|
| 278 | 6.93 ± 0.03 | 10.80 ± 0.04 | 16.81 ± 0.03 |
| 288 | 7.50 ± 0.04 | 12.10 ± 0.06 | 17.79 ± 0.07 |
| 298 | 8.02 ± 0.05 | 13.30 ± 0.03 | 18.71 ± 0.09 |
| 308 | 8.51 ± 0.03 | 14.41 ± 0.02 | 19.57 ± 0.08 |
| 318 | 8.98 ± 0.01 | 15.45 ± 0.05 | 20.38 ± 0.05 |
Сопоставление концентрационных и термодинамических констант устойчивости показало, что разница в величинах констант во многом зависит от численного значения Δνz2. Так, для реакции образования [AuLСl3]+ значение Δνz2 равно нулю, реакция изозарядная, поэтому разница в значениях констант незначительна. С увеличением величины Δνz2 для ([AuL2Cl2]+ и [AuL3Cl]2+) разница в величинах термодинамических и концентрационных констант возрастает.
В работе [29] методом потенциометрического титрования исследован процесс комплексообразования Au(III) с 1,2,4-триазолом при 298 K. При этом установлено, что Au(III) с 1,2,4-триазолом реагирует ступенчато. Сопоставление полученных нами данных с данными работы [29] показывает, что при взаимодействии Au(III) с 1,2,4-триазолом образуются четыре комплексные формы, а с 2-метилимидазолом – три. По устойчивости моно- и бизамещенные комплексы Au(III) с 2-метилимидазолом превосходят таковые для 1,2,4-триазола.
Термодинамические константы устойчивости использовали для определения термодинамических функций образования комплексов методом температурного коэффициента с использованием уравнения:
Поскольку уравнение (8) содержит два неизвестных, величины ΔН и ΔS были найдены графическим методом.
Величину ΔН определяли по тангенсу угла наклона прямой зависимости $\lg \beta _{i}^{0}$ = f(1/T) (рис. 4), а величину ΔS – по отрезку, отсекаемому этой прямой на оси ординат. Изменение изобарно-изотермического потенциала рассчитывали по уравнению ΔG = ΔH – TΔS.
Рис. 4.
Зависимость $\lg \beta _{i}^{0}$ от 1/Т для комплексов: 1 – [AuLСl3]0; 2 – [AuL2Сl2]+; 3 – [AuL3Сl]2+.
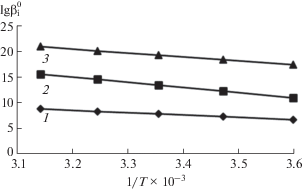
Как видно из данных табл. 4, образование всех трех комплексных форм протекает с поглощением энергии (процесс эндотермический). Такое изменение теплосодержания системы отрицательно сказывается на самопроизвольном протекании реакции комплексообразования. Вместе с тем при образовании всех комплексных форм величина ΔS положительна. В результате реакций:
Таблица 4.
Величины термодинамических функций реакций образования 2-метилимидазольных комплексов золота(III)
| Реакция образования комплексов |
ΔН, кДж/моль |
ΔG, кДж/моль |
ΔS, Дж/(моль K) |
|---|---|---|---|
| [AuCl4]– + L ↔ [AuLCl3]0 + Cl– | 86.54 ± 0.77 | –41.44 ± 0.34 | 444.42 ± 2.60 |
| [AuCl4]– + 2L ↔ [AuL2Cl2]+ + 2Cl– | 190.07 ± 1.38 | –77.2 ± 0.11 | 896.77 ± 4.66 |
| [AuCl4]– + 3L ↔ [AuL3Cl]2+ + 3Cl– | 145.98 ± 1.24 | –109.74 ± 1.38 | 858.14 ± 1.38 |
ЗАКЛЮЧЕНИЕ
На основании проведенных исследований установлено, что между Н[AuCl4] и 2-метилимидазолом протекает ступенчатое комплексообразование. Показано, что в реакции комплексообразования участвует молекулярная форма этого соединения. Данный вывод коррелирует с сообщением о получении комплекса состава [AuLCl3]0 с нейтральным гетероциклическим лигандом в работе [24]. Обработка данных потенциометрического титрования по программе KEV дает удовлетворительные результаты для образования трех комплексных форм состава [AuLCl3]0, [AuL2Cl2]+, [AuL3Cl]2+. Установлено, что с увеличением температуры устойчивость комплексов золота(III) повышается. Образование как моно-, так и бис- и трис-лигандного комплексов протекает с поглощением энергии. Вместе с тем при образовании всех комплексных форм величина ΔS положительна. Наиболее вероятной причиной возрастания энтропии при комплексообразовании является появление в растворе “размороженной” воды из гидратных оболочек ионов в результате реакций. Величина ΔG на всех стадиях комплексообразования отрицательна. Самопроизвольное протекание реакции комплексообразования определяется энтропийной составляющей.
Список литературы
Nardon C., Boscutti G., Fregona D. // Anticancer Res. 2014. V. 34. P. 487.
Корман Д.Б., Островская Л.А., Кузьмин В.А. // Вопросы онкологии. 2018. Т. 64. № 6. С. 697.
Машковский М.Д. // Лекарственные средства. 2002. Т. 2. № 14. С. 608.
Машковский М.Д. // Лекарственные средства. 2005. Т. 2. № 15. С. 1200.
Olivier-Bourbigou H., Magna L., Morvan D. // Appl. Catal. A. General. 2010. V. 373. P. 1.
Jarosik A., Krajewski S.R., Lewandowski A., Radzimski P. // J. Mol. Liq. 2006. V. 123. P. 43.
Мещеряков Ю.Я., Бухтиенко В.И., Плужников В.Н. и др. Эпоксидный олигомер для связующей композиции, способ его получения и способ получения связующей композиции на его основе. Пат. РФ. № 2221816. Заявл. 02.11.2001. Опубл. 10.07.2003.
Тран Тхан Тун Синтез и физико-химические исследования комплексных соединений бромида меди(II) с азотсодержащими гетероциклическими основаниями. Автореф. … дис. канд. хим. наук. М., 2007. 17 с.
Зайцева С.В., Зданович С.А., Койфман О.И. // Макрогетероциклы. 2012. Т. 5. № 1. С. 81.
Assouli B., Srhiri A. // Idrissi. Corrosion. 2004. V. 60. P. 399.
Вахрушев Я.М., Хохлачева Н.А. // Экспериментальная и клиническая гастроэнтерология. 2010. № 4. С. 105.
Скорик Н.А., Филиппова М.М., Бухольцева Е.И. и др. // Журн. неорган. химии. 2015. Т. 60. № 6. С. 806.
Мирзохонов Д.Ч., Мабаткадамзода К.С., Сафармамадов С.М. // Изв. Санкт-Петербургского гос. технол. ин-та. 2018. № 44. С. 3.
Мирзохонов Д.Ч., Сафармамадов С.М., Мабаткадамова К.С. // XXVII Междунар. Чугаевская конф. по коорд. химии. Нижний Новгород, 2017. С. 280.
Зырянова И.А. Новые лиганды и металлокомплексы на базе функционально замещенных азолов. Автореф. … дис. канд. хим. наук. Иркутск, 2003. 23 с.
Шыйтыева Н., Малабаева А.М., Бердалиева Ж.И. // Химические науки. НАУ. 2016. Т. 21. № 5. С. 150.
Пищевицкий Б.И., Белеванцев В.И., Земсков С.В. // Изв. Сибирск. отд. АН СССР. 1976. № 4. С. 24.
Чуйко Т.В., Тулюпа Ф.М., Аришкевич А.М. // Журн. неорган. химии. 1977. Т. 22. № 6. С. 1602.
Миронов И.В., Харламова В.Ю. // Журн. неорган. химии. 2020. Т. 65. № 3. С. 391. [Mironov I.V., Kharlamov V. Yu. // Russ. J. Inorg. Chem. 2020. V. 65. P. 420. https://doi.org/10.1134/S0036023620030092]https://doi.org/10.31857/S0044457X20030095
Миронов И.В., Цвелодуб Л.Д. // Журн. неорган. химии. 2001. Т. 46. № 1. С. 154.
Миронов И.В., Цвелодуб Л.Д. // Журн. неорган. химии. 2000. Т. 45. № 4. С. 425. [Mironov I.V., Tsvelodub L.D. // Russ. J. Inorg. Chem. 2000. V. 45. № 3. P. 361.]
Сафармамадов С.М., Мубораккадамов Д.А., Мабаткадамова К.С. // Изв. вузов. Химия и хим. технология. 2017. Т. 60. Вып. 5. С. 37.
Сафармамадов С.М., Мубораккадамов Д.А., Мабаткадамова К.С. // Материалы республиканской научн.-теор. конф. профессорско-преподавательского состава и сотрудников ТНУ. Душанбе, 2018. С. 649.
Pitteri B., Bortoluzzi M. // Trans. Met. Chem. 2006. V. 31. P. 102.
Мубораккадамов Д.А. Комплексообразование золота(III) с триазолами. Автореф. … дис. канд. хим. наук. Душанбе, 2019. 26 с.
Mehkov A.N., Gamov G.A. // Talanta. 2019. V. 198. P. 200.
Perrin H.H. Dissociation Constants of Organic Bases in Aqueous Solution: Supplement. London: International Union of Pure and Applied Chemistry, 1972.
Васильев В.П. // Аналитическая химия. М.: Высшая школа, 1989. Ч. I. 319 с.
Сафармамадов С.М., Мубораккадамов Д.А., Мабаткадамова К.С. // Изв. АН. РТ. 2015. № 160. С. 65.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии