Журнал неорганической химии, 2021, T. 66, № 6, стр. 737-749
КООРДИНАЦИОННЫЕ ПОЛИМЕРЫ ТРИФТОРАЦЕТАТОВ ЦИНКА, НИКЕЛЯ(II) И МАРГАНЦА(II) C 1,4-ДИОКСАНОМ
М. А. Уварова a, С. Е. Нефедов a, *
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: snef@igic.ras.ru
Поступила в редакцию 27.12.2020
После доработки 10.02.2021
Принята к публикации 11.02.2021
Аннотация
Установлено, что при взаимодействии водных ацетатов цинка, никеля(II) и марганца(II) с избытком трифторуксусной кислоты в кипящем 1,4-диоксане образуются координационные полимеры (КП) {[Zn3(µ-OH2)2(µ-OOСCF3)4(OOCСF3)2(OH2)2][µ-O(CH2CH2)2O)] · 3O(CH2CH2)2O}n (1, выход 81%), {[Ni2(µ-OH2)(µ-OOCСF3)2(OOСCF3)2(OH2)2(O(CH2CH2)2O)]2[µ-O(CH2CH2)2O)] · 5O(CH2CH2)2O}n (2, выход 89%), {[Mn2(µ-OOСCF3)3(OOCСF3)(OH2)][µ-O(CH2CH2)O]2}n (4, выход 79%), строение которых, согласно данным РСА, определяется природой переходного металла. В полимере 1 трехъядерные фрагменты Zn3(µ-OH2)2(µ-OOСCF3)4(OOCСF3)2(OH2)2 (Zn…Zn 3.6490(3) Å) связаны мостиковыми молекулами диоксана с образованием зигзагообразного 1D-КП, а атомы водорода координированных молекул воды посредством межмолекулярных водородных связей (ВС) с атомами кислорода сольватных молекул растворителя образуют 2D-КП. В КП 2 в четырехъядерном комплексе Ni4 два биядерных фрагмента Ni2(µ-OH2)(µ-OOCСF3)2(OOСCF3)2(OH2)2(O(CH2CH2)2O (Ni…Ni 3.5388(13) Å) соединены мостиковой молекулой диоксана, а концевые и сольватные молекулы растворителя формируют с атомами водорода периферийных молекул воды межмолекулярные BC, образуя 2D-КП. В случае наиболее электронодефицитного атома Mn(II) в биядерных комплексах Mn2(µ-OOСCF3)3(OOCСF3)(OH2) (Mn…Mn 4.2487(5) Å) каждый атом металла связан с двумя мостиковыми молекулами диоксана, образуя 2D-КП, размерность которого увеличивается до 3D за счет образования межмолекулярных ВС концевой молекулы воды и атома кислорода концевого и мостикового карбоксилат-аниона. Также показано, что при аналогичной реакции Ni(OOCMe)2(OH2)4 c 2 молями HOOСCF3 при комнатной температуре происходит лишь анионный обмен, приводящий к полимеру {Ni(OOСCF3)2(OH2)4 ⋅ [O(CH2CH2)2O]}n (3). Полученные КП, помимо РСА, исследованы также методами химического анализа и ИК-спектроскопии.
ВВЕДЕНИЕ
В отличие от металлорганических соединений, в которых координированные молекулы соединены с атомом металла прочными связями М–С, для координационных соединений более характерно возникновение помимо σ-связей сравнительно слабых двухэлектронных донорно-акцепторых взаимодействий, дополняющих координационную сферу металла в соответствии с правилом Н.В. Сиджвика [1, 2].Такие связи могут легко разрушаться из-за присутствия в реакционном растворе полярных координирующих растворителей, обладающих более нуклеофильными центрами и связывающихся непосредственно с центральным атомом металла (ацетонитрил, ТГФ, различные спирты и др). Бидентатный 1,4-диоксан, имеющий два нуклеофильных центра, способен не только входить в координационную сферу металла как обычный η-лиганд, но и образовывать координационные полимеры (КП), становясь мостиковым, непосредственно связываясь с металлом, а также за счет образования межмолекулярных водородных связей [3–8].
Кроме того, большинство соединений, используемых в качестве исходных, содержит координированные и/или сольватные молекулы воды, что существенно влияет на протекание дальнейших реакций из-за ее высокой полярности и координирующей способности [9]. При этом образование азеотропной смеси вода–диоксан (tкип = = 87.8°С) с учетом температуры кипения чистого диоксана (101°С) позволяет частично или полностью убрать Н2О из реакционного раствора [10].
В настоящей работе сообщается о строении КП – продуктов реакций водных ацетатов цинка, никеля(II) и марганца(II) с избытком трифторуксусной кислоты в кипящем координирующем бидентатном 1,4-диоксане.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали Zn(OOCMe)2(OH2)2, Ni(OOCMe)2(OH2)4 и Mn(OOCMe)2(OH2)4 квалификации “ч.” фирмы Acros, трифторуксусную кислоту, 1,4-диоксан (ч. д. а.) фирмы ООО “Химмед cинтез”.
ИК-спектры кристаллических образцов регистрировали в интервале 4000–550 см–1 методом НПВО на ИК-Фурье-спектрометре NEXUS фирмы Nicolet с использованием приставки MIRacle фирмы PIKETechnologies с алмазным кристаллом.
Химический анализ проводили на автоматическом CHN-анализаторе Vario Microcube (Elementar).
Рентгеноструктурный анализ (РСА) кристаллов 1–4 осуществляли по стандартной методике на автоматическом дифрактометре Bruker SMART Apex II, оборудованном CCD-детектором (λMo, графитовый монохроматор, ω-сканирование).
Уточнение структур выполняли с использованием комплекса программ SHELXTL PLUS (PC-версия) [11–14].
Кристаллографические данные и детали уточнения приведены в табл. 1, основные геометрические параметры изученных комплексов – в табл. 2–5. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (CCDC № 2013552–2013555).
Таблица 1.
Кристаллографические параметры и детали уточнения структур комплексов 1–4
| Параметр | 1 | 2 | 3 | 4 |
|---|---|---|---|---|
| CCDC | 2 013 552 | 2 013 553 | 2 013 554 | 2 013 555 |
| Брутто-формула | C28H40F18O24Zn3 | C48H76F24Ni4O38 | C8H16F6NiO10 | C16H18F12Mn2O13 |
| М. м. | 1298.71 | 1951.92 | 444.92 | 756.18 |
| Цвет | Бесцветный | Зеленый | Зеленый | Бесцветный |
| T, K | 150(2) | 150(2) | 100(2) | 150(2) |
| Сингония | Триклинная | Моноклинная | Триклинная | Моноклинная |
| Пр. гр. | P | P2(1)/с | P | P2(1)/n |
| a, Å | 10.0507(7) | 15.271(2) | 4.83430(10) | 9.6873(3) |
| b, Å | 10.0801(7) | 10.9510(16) | 7.7351(2) | 28.6691(9) |
| c, Å | 12.8001(9) | 23.119(3) | 10.7507(4) | 10.9073(3 |
| α, град | 93.326(2) | 90 | 79.6682(12) | 90 |
| β, град | 100.252(8) | 98.185(5) | 88.5112(13) | 116.2930(10) |
| γ, град | 103.765(2) | 90 | 77.7672(10) | 90 |
| V, Å3 | 1195.57(14) | 3826.9(9) | 386.481(19) | 2715.84(14) |
| Z | 1 | 4 | 1 | 4 |
| dрасч, мг/м3 | 1.804 | 1.694 | 1.912 | 1.849 |
| µ, мм–1 | 1.642 | 1.116 | 1.373 | 1.072 |
| F(000) | 652 | 1992 | 226 | 1504 |
| Размеры кристалла, мм | 0.24 × 0.22 × 0.20 | 0.26 × 0.24 × 0.22 | 0.26 × 0.24 × 0.22 | 0.22 × 0.20 × 0.18 |
| θ-область сканирования, град | 2.50–30.00 | 2.44–30.57 | 3.85–29.99 | 2.20–30.00 |
| Интервалы индексов отражений | –14 ≤ h ≤ 14, –14 ≤ k ≤ 14, –17 ≤ l ≤ 18 |
–20 ≤ h ≤ 18, –14 ≤ k ≤ 14, –30 ≤ l ≤ 30 |
–6 ≤ h ≤ 6, –10 ≤ k ≤ 10, –10 ≤ l ≤ 15 |
–13 ≤ h ≤ 13, –40 ≤ k ≤ 40, –15 ≤ l ≤ 14 |
| Число отражений | 14362 | 5509 | 3280 | 34338 |
| Число независимых отражений | 6901 [Rint = 0.0397] | 2747 [Rint = 0.0117] | 2106 [Rint = 0.0135] | 7912 [Rint = 0.0364] |
| GOOF | 1.034 | 1.079 | 0.983 | 1.023 |
| R[I > 2σ(I)] | R1 = 0.0433, wR2 = 0.1152 | R1 = 0.0970, wR2 = 0.2690 | R1 = 0.0288, wR2 = 0.0784 | R1 = 0.0474, wR2 = 0.11143 |
| R (по всем рефлексам) | R1 = 0.0480, wR2 = 0.1189 | R1 = 0.0995, wR2 = 0.2728 | R1 = 0.0293, wR2 = 0.0789 | R1 = 0.0618, wR2 = 0.1186 |
| max/min пики электронной плотности, e Å–3 | 1.182 и –0.909 | 0.900 и –0.570 | 0.939 и –0.631 | 0.799 и –0.585 |
Таблица 2.
Основные длины связей и валентные углы в комплексе 1
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| Zn(1)–O(4)#1 | 2.0719(16) | Zn(1)–O(4) | 2.0719(16) |
| Zn(1)–O(2)#1 | 2.0836(16) | Zn(1)–O(2) | 2.0836(16) |
| Zn(1)–O(1) | 2.1318(14) | Zn(1)–O(1)#1 | 2.1318(14) |
| Zn(1)–Zn(2) | 3.6490(3) | Zn(2)–O(8) | 2.0272(17) |
| Zn(2)–O(5) | 2.0562(16) | Zn(2)–O(3) | 2.0647(16) |
| Zn(2)–O(6) | 2.0735(16) | Zn(2)–O(9) | 2.1423(14) |
| Zn(2)–O(1) | 2.1758(14) | ||
| Угол | ω, град | Угол | ω, град |
| O(4)#1Zn(1)O(4) | 180.0 | O(4)#1Zn(1)O(2)#1 | 89.85(7) |
| O(4)Zn(1)O(2)#1 | 90.15(7) | O(4)#1Zn(1)O(2) | 90.15(7) |
| O(4)Zn(1)O(2) | 89.85(7) | O(2)#1Zn(1)O(2) | 180.0 |
| O(4)#1Zn(1)O(1) | 85.34(6) | O(4)Zn(1)O(1) | 94.66(6) |
| O(2)#1Zn(1)O(1) | 89.98(6) | O(2)Zn(1)O(1) | 90.02(6) |
| O(4)#1Zn(1)O(1)#1 | 94.66(6) | O(4)Zn(1)O(1)#1 | 85.34(6) |
| O(2)#1Zn(1)O(1)#1 | 90.02(6) | O(2)Zn(1)O(1)#1 | 89.98(6) |
| O(1)Zn(1)O(1)#1 | 180.0 | O(4)#1Zn(1)Zn(2) | 111.84(4) |
| O(4)Zn(1)Zn(2) | 68.16(4) | O(2)#1Zn(1)Zn(2) | 107.79(4) |
| O(2)Zn(1)Zn(2) | 72.21(4) | O(1)Zn(1)Zn(2) | 32.47(4) |
| O(1)#1Zn(1)Zn(2) | 147.53(4) | O(8)Zn(2)O(5) | 88.47(7) |
| O(8)Zn(2)O(3) | 177.04(7) | O(5)Zn(2)O(3) | 91.50(7) |
| O(8)Zn(2)O(6) | 90.84(7) | O(5)Zn(2)O(6) | 175.79(6) |
| O(3)Zn(2)O(6) | 88.97(7) | O(8)Zn(2)O(9) | 87.53(7) |
| O(5)Zn(2)O(9) | 90.58(6) | O(3)Zn(2)O(9) | 89.52(6) |
| O(6)Zn(2)O(9) | 85.24(6) | O(8)Zn(2)O(1) | 93.23(7) |
| O(5)Zn(2)O(1) | 92.91(6) | O(3)Zn(2)O(1) | 89.72(6) |
| O(6)Zn(2)O(1) | 91.28(6) | O(9)Zn(2)O(1) | 176.45(6) |
| O(8)Zn(2)Zn(1) | 114.78(5) | O(5)Zn(2)Zn(1) | 71.36(4) |
| O(3)Zn(2)Zn(1) | 67.97(4) | O(6)Zn(2)Zn(1) | 112.65(4) |
| O(9)Zn(2)Zn(1) | 150.05(4) | O(1)Zn(2)Zn(1) | 31.74(4) |
| Zn(1)O(1)Zn(2) | 115.79(6) |
Таблица 3.
Основные длины связей и валентные углы в комплексе 2
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| Ni(1)–O(4) | 2.017(5) | Ni(1)–O(1) | 2.030(5) |
| Ni(1)–O(12) | 2.045(5) | Ni(1)–O(6) | 2.060(5) |
| Ni(1)–O(1) | 2.073(5) | Ni(1)–O(10) | 2.094(5) |
| Ni(1)–Ni(3) | 3.5386(13) | Ni(3)–O(3) | 2.036(5) |
| Ni(3)–O(5) | 2.032(6) | Ni(3)–O(8) | 2.043(5) |
| Ni(3)–O(14) | 2.056(5) | Ni(3)–O(1) | 2.072(5) |
| Ni(3)–O(13) | 2.110(5) | ||
| Угол | ω, град | Угол | ω, град |
| O(4)Ni(1)O(1) | 93.8(2) | O(4)Ni(1)O(12) | 87.4(2) |
| O(1)Ni(1)O(12) | 176.8(2) | O(4)Ni(1)O(6) | 171.7(2) |
| O(1)Ni(1)O(6) | 91.2(2) | O(12)Ni(1)O(6) | 87.2(2) |
| O(4)Ni(1)O(1) | 95.0(2) | O(1)Ni(1)O(1) | 90.4(2) |
| O(12)Ni(1)O(1) | 92.5(2) | O(6)Ni(1)O(1) | 91.6(2) |
| O(4)Ni(1)O(10) | 85.9(2) | O(1)Ni(1)O(10) | 88.3(2) |
| O(12)Ni(1)O(10) | 88.9(2) | O(6)Ni(1)O(10) | 87.6(2) |
| O(1)Ni(1)O(10) | 178.4(2) | O(4)Ni(1)Ni(3) | 72.30(15) |
| O(1)Ni(1)Ni(3) | 71.05(14) | O(12)Ni(1)Ni(3) | 112.12(16) |
| O(6)Ni(1)Ni(3) | 115.67(16) | O(1)Ni(1)Ni(3) | 31.37(13) |
| O(10)Ni(1)Ni(3) | 148.34(15) | O(3)Ni(3)O(5) | 93.2(2) |
| O(3)Ni(3)O(8) | 173.6(2) | O(5)Ni(3)O(8) | 89.7(2) |
| O(3)Ni(3)O(14) | 88.9(2) | O(5)Ni(3)O(14) | 175.8(2) |
| O(8)Ni(3)O(14) | 87.9(2) | O(3)Ni(3)O(1) | 94.2(2) |
| O(5)Ni(3)O(1) | 90.1(2) | O(8)Ni(3)O(1) | 91.5(2) |
| O(14)Ni(3)O(1) | 93.4(2) | O(3)Ni(3)O(13) | 90.4(2) |
| O(5)Ni(3)O(13) | 87.4(2) | O(8)Ni(3)O(13) | 84.0(2) |
| O(14)Ni(3)O(13) | 88.9(2) | O(1)Ni(3)O(13) | 174.9(2) |
| O(3)Ni(3)Ni(1) | 71.26(14) | O(5)Ni(3)Ni(1) | 70.91(16) |
| O(8)Ni(3)Ni(1) | 115.13(15) | O(14)Ni(3) Ni(1) | 113.27(15) |
| O(1)Ni(3)Ni(1) | 31.40(13) | O(13)Ni(3)Ni(1) | 150.15(15) |
| Ni(3)O(1)Ni(1) | 117.2(2) |
Таблица 4.
Основные длины связей и валентные углы в комплексе 3
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| Ni(1)–O(3)#1 | 2.0338(10) | Ni(1)–O(3) | 2.0338(10) |
| Ni(1)–O(4) | 2.0675(10) | Ni(1)–O(4)#1 | 2.0675(10) |
| Ni(1)–O(1) | 2.0863(10) | Ni(1)–O(1)#1 | 2.0863(10) |
| Угол | ω, град | Угол | ω, град |
| O(3)#1Ni(1)O(3) | 180.00(3) | O(3)#1Ni(1)O(4) | 87.68(4) |
| O(3)Ni(1)O(4) | 92.32(4) | O(3)#1Ni(1)O(4)#1 | 92.32(4) |
| O(3)Ni(1)O(4)#1 | 87.68(4) | O(4)Ni(1)O(4)#1 | 179.999(1) |
| O(3)#1Ni(1)O(1) | 94.24(4) | O(3)Ni(1)O(1) | 85.76(4) |
| O(4)Ni(1)O(1) | 89.49(4) | O(4)#1Ni(1)O(1) | 90.51(4) |
| O(3)#1Ni(1)O(1)#1 | 85.76(4) | O(3)Ni(1)O(1)#1 | 94.24(4) |
| O(4)Ni(1)O(1)#1 | 90.51(4) | O(4)#1Ni(1)O(1)#1 | 89.49(4) |
| O(1)Ni(1)O(1)#1 | 180.0 | C(2)O(1)Ni(1) | 125.60(9) |
Таблица 5.
Основные длины связей и валентные углы в комплексе 4
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| Mn(1)–O(7) | 2.1142(18) | Mn(1)–O(3) | 2.1241(19) |
| Mn(1)–O(1) | 2.1365(19) | Mn(1)–O(5) | 2.1405(18) |
| Mn(1)–O(9) | 2.2198(17) | Mn(1)–O(10) | 2.2774(17) |
| Mn(1)–Mn(2) | 4.2487(5) | Mn(2)–O(2) | 2.113(2) |
| Mn(2)–O(6) | 2.1152(18) | Mn(2)–O(4) | 2.1261(19) |
| Mn(2)–O(13) | 2.170(2) | Mn(2)–O(11) | 2.2321(18) |
| Mn(2)–O(12) | 2.2400(18) | ||
| Угол | ω, град | Угол | ω, град |
| O(7)Mn(1)O(3) | 92.29(8) | O(7)Mn(1)O(1) | 92.08(8) |
| O(3)Mn(1)O(1) | 109.73(8) | O(7)Mn(1)O(5) | 174.52(7) |
| O(3)Mn(1)O(5) | 90.39(9) | O(1)Mn(1)O(5) | 91.51(9) |
| O(7)Mn(1)O(9) | 90.15(7) | O(3)Mn(1)O(9) | 164.76(7) |
| O(1)Mn(1)O(9) | 85.20(8) | O(5)Mn(1)O(9) | 86.02(7) |
| O(7)Mn(1)O(10) | 89.48(7) | O(3)Mn(1)O(10) | 84.40(7) |
| O(1)Mn(1)O(10) | 165.70(8) | O(5)Mn(1)O(10) | 86.03(7) |
| O(9)Mn(1)O(10) | 80.58(7) | O(7)Mn(1)Mn(2) | 121.03(5) |
| O(3)Mn(1)Mn(2) | 57.82(5) | O(1)Mn(1)Mn(2) | 60.62(6) |
| O(5)Mn(1)Mn(2) | 64.40(5) | O(9)Mn(1)Mn(2) | 132.20(5) |
| O(10)Mn(1)Mn(2) | 129.65(4) | O(2)Mn(2)O(6) | 98.47(8) |
| O(2)Mn(2)O(4) | 98.86(10) | O(6)Mn(2)O(4) | 99.60(8) |
| O(2)Mn(2)O(13) | 83.56(10) | O(6)Mn(2)O(13) | 175.33(8) |
| O(4)Mn(2)O(13) | 84.19(10) | O(2)Mn(2)O(11) | 89.54(8) |
| O(6)Mn(2)O(11) | 86.58(7) | O(4)Mn(2)O(11) | 168.66(8) |
| O(13)Mn(2)O(11) | 89.23(9) | O(2)Mn(2)O(12) | 170.65(7) |
| O(6)Mn(2)O(12) | 87.03(7) | O(4)Mn(2)O(12) | 87.60(8) |
| O(13)Mn(2)O(12) | 90.41(9) | O(11)Mn(2)O(12) | 83.21(7) |
| O(2)Mn(2)Mn(1) | 61.83(6) | O(6)Mn(2)Mn(1) | 59.03(5) |
| O(4)Mn(2)Mn(1) | 63.34(5) | O(13)Mn(2)Mn(1) | 125.48(6) |
| O(11)Mn(2)Mn(1) | 127.82(6) | O(12)Mn(2)Mn(1) | 127.46(5) |
Синтез комплексов
Синтез {[Zn3(µ-OH2)2(µ-OOСCF3)4(OOCСF3)2(OH2)2][µ-O(CH2CH2)2O)] · · 3O(CH2CH2)2O}n (1). К монокристаллам (0.3 г, 1.36 ммоль) водного ацетата цинка добавляли избыток (0.3 мл, 4 ммоль) трифторуксусной кислоты. Полученную смесь растворяли в 20 мл 1,4-диоксана и кипятили с обратным холодильником в течение 1 ч. Раствор концентрировали в токе аргона до 5 мл и выдерживали 2 сут в холодильнике при 5°С. Образовавшиеся при этом крупные бесцветные кристаллы комплекса 1 отделяли от маточного раствора декантацией, промывали последовательно бензолом (10 мл), холодным гексаном (10 мл) и сушили в токе аргона. Выход 81% (0.53 г).
ИК-спектр (ν, см–1): 3181 сл. ш, 3974 сл, 2873 сл, 1685 с, 1637 ср, 1590 сл, 1460 ср, 1377 сл, 1301 сл, 1258 сл, 1190 с, 1144 с, 1112 с, 1080 с, 1043 ср, 896 сл, 867 с, 830 ср, 796 с, 721 с, 609 с, 523 ср, 463 сл.
Синтез [Ni2(µ-OH2)(µ-OOCСF3)2(OOСCF3)2(OH2)2(O(CH2CH2)2O)]2[µ-O(CH2CH2)2O)] ⋅ 5O(CH2CH2)2O (2). К монокристаллам (0.3 г, 1.12 ммоль) водного ацетата никеля добавляли избыток (0.3 мл, 4 ммоль) трифторуксусной кислоты. Полученную смесь растворяли в 20 мл 1,4-диоксана и кипятили с обратным холодильником в течение 1 ч. Раствор концентрировали в токе аргона до 5 мл и выдерживали 2 сут в холодильнике при 5оС. Образовавшиеся при этом крупные зеленые кристаллы комплекса 2 отделяли от маточного раствора декантацией, промывали последовательно бензолом (10 мл), холодным гексаном (10 мл) и сушили в токе аргона. Выход 89% (0.52 г).
ИК-спектр (ν, см–1): 3199 сл. ш, 2930 сл, 1784 сл, 1686 с, 1595 сл, 1461 ср, 1377 сл, 1300 сл, 1258 сл, 1191 с, 1144 с, 1112 с, 1080 с, 1043 ср, 895 сл, 865 с, 851 ср, 834 ср, 794 с, 723 с, 610 ср, 523 ср, 476 ср.
Синтез {Ni(OOCCF3)2(OH2)4 ⋅ · [O(CH2CH2)2O]}n (3). К монокристаллам водного ацетата никеля (0.5 г, 2 ммоль) добавляли 0.3 мл (4 ммоль) трифторуксусной кислоты и 5 мл диоксана. Полученный зеленый раствор оставляли в открытой колбе в вытяжном шкафу. Образовавшиеся через 5 сут зеленые монокристаллы комплекса 3 промывали последовательно холодным бензолом (10 мл), гексаном (10 мл) и сушили в токе аргона. Выход 83% (0.73 г).
ИК-спектр (ν, см–1): 3120 ср. ш, 1661 с, 1526 сл, 1448 ср, 1295 сл, 1188 с, 1141 с, 988 сл, 857 ср, 794 с, 724 с, 606 ср, 517 ср, 500 сл, 468 сл.
Синтез {[Mn2(µ-OOСCF3)3(OOCСF3)(OH2)][µ-O(CH2CH2)2O]2}n (4). К монокристаллам (0.3 г, 1.22 ммоль) водного ацетата марганца добавляли избыток (0.3 мл, 4 ммоль) трифторуксусной кислоты. Полученную смесь растворяли в 20 мл 1,4-диоксана и кипятили с обратным холодильником в течение 1 ч. Раствор концентрировали в токе аргона до 5 мл и выдерживали 2 сут в холодильнике при 5°С. Образовавшиеся при этом крупные зеленые кристаллы комплекса 4 отделяли от маточного раствора декантацией, промывали последовательно бензолом (10 мл), холодным гексаном (10 мл) и сушили в токе аргона. Выход 79% (0.36 г).
ИК-спектр (ν, см–1): 3230 сл. ш, 2938 сл, 1713 с, 1683 с, 1641 с, 1641 ср, 1464 ср, 1443 ср, 1376 сл, 1303 сл, 1262 сл, 1197 с, 1153 с, 1137 с, 1105 с, 1090 с, 1041 ср, 894 ср, 873 с, 841 с, 860 с, 795 с, 718 с, 607 с, 521 ср, 467 сл.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
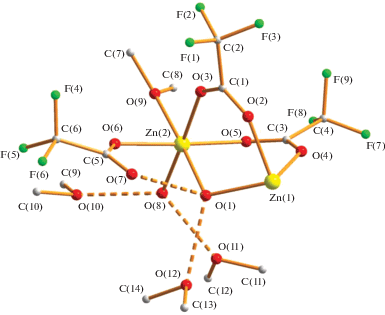
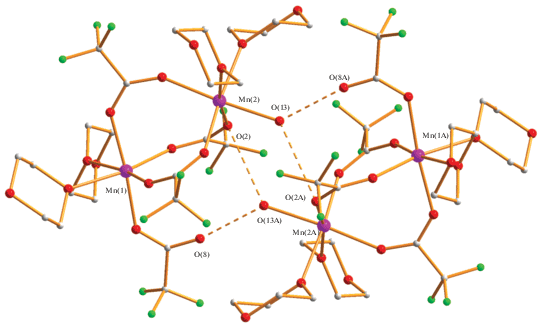
Обнаружено, что добавление к монокристаллам водного ацетата цинка избытка трифторуксусной кислоты с последующим кипячением в течение 1 ч в диоксане и частичным удалением растворителя приводит к образованию бесцветного 2D-КП {[Zn3(µ-OH2)2(µ-OOСCF3)4(OOCСF3)2(OH2)2] [µ-O(CH2CH2)2O)] · 3O(CH2CH2)2O}n (1) с выходом 81%. По данным РСА, в центросимметричном соединении 1 (рис. 1, табл. 1, 2) три атома металла находятся на одной линии (M…M 3.6490(3) Å) и соединены попарно двумя трифторацетатными мостиками (Zn(1)–O 2.0719(16), 2.0836(16) Å; Zn(2)–O 2.0562(16), 2.0647(16) Å), а также мостиковой молекулой воды (Zn(1)–O(1) 2.1318(14) Å, Zn(2)–O(1) 2.1758(14) Å). Каждый атом цинка (Zn2+, d10) в рассматриваемом комплексе имеет искаженное октаэдрическое окружение, которое для периферийного атома Zn(2) дополнено атомом кислорода концевого карбоксилат-аниона (Zn(2)–O(6) 2.0735(16) Å), атомами кислорода координированных молекул воды (Zn(2)–O(8) 2.0272(17) Å) и диоксана (Zn(2)–O(9) 2.1423(14) Å). Последний связывает трехъядерные комплексы Zn3 в зигзагообразный 1D-полимер, в котором все металлсодержащие фрагменты параллельны и лежат в одной плоскости, расстояние между ближайшими атомами цинка составляет 6.644 Å, угол между линиями Zn3/O2(dioxane) – 11°.
В комплексе 1 мостиковая молекула воды образует короткую внутримолекулярную ВС с атомом кислорода концевого аниона OOCCF3 (О(1)…О(7) 2.589 Å) и атомом кислорода сольватной молекулы диоксана (О(1)…О(12) 2.705 Å), второй атом кислорода которой связан с мостиковой водой второго металлсодержащего 1D-полимера, увеличивая его размерность до 2D.
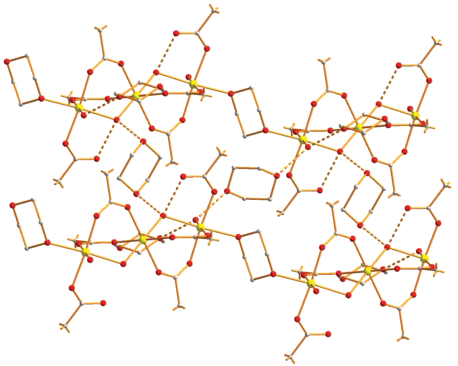
Две другие сольватные молекулы диоксана также являются формально мостиковыми между соседними полимерами в результате образования межмолекулярных ВС с концевыми молекулами воды (О(8)…О(10) 2.687 Å, О(8)…О(11) 2.652 Å) (рис. 1, 2).
Рис. 2.
Фрагмент упаковки полимерных молекул 1 в кристалле (цвета атомов: желтые –цинк, красные – кислород, серые – углерод), атомы фтора для ясности не показаны.
Аналогичная реакция обмена мостиковых карбоксилат-анионов в кипящем диоксане наблюдается и для водного ацетата никеля, приводя к образованию с выходом 89% зеленых монокристаллов полимера {[Ni2(µ-OH2)(µ-OOCСF3)2(OOСCF3)2(OH2)2(O(CH2CH2)2O)]2[µ-O(CH2CH2)2O)] ⋅ 5O(CH2CH2)2O}n (2).
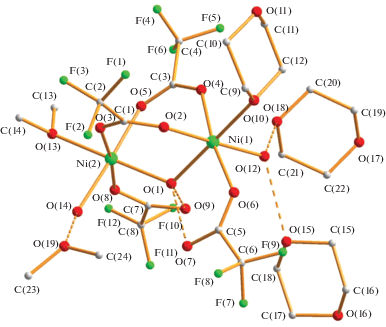
В КП 2, согласно данным РСА (табл. 1, 3), в каждом из двух димеров Ni2 атомы металла (Ni2+, d8) находятся на несвязывающем расстоянии металл–металл длиной 3.5388(13) Å и соединены мостиковой молекулой воды (Ni(1)–O(1) 2.075(5) Å, Ni(2)–O(1) 2.073(5) Å) и двумя мостиковыми трифторацетат-анионами (Ni(1)–µ-${{{\text{O}}}_{{{\text{OOCC}}{{{\text{F}}}_{3}}}}}$ 2.018(5), 2.028(5) Å, Ni(2)–µ-${{{\text{O}}}_{{{\text{OOCC}}{{{\text{F}}}_{3}}}}}$ 2.035(5), 2.031(6) Å). Каждый атом металла имеет искаженное октаэдрическое окружение, дополненное атомами кислорода концевого карбоксилат-аниона (Ni(1)–O(6) 2.061(5) Å, Ni(2)–O(8) 2.043(5) Å) и молекул воды (Ni(1)–O(12) 2.043(5) Å, Ni(2)–O(14) 2.056(5) Å) (рис. 3). При этом атом Ni(2) также связан с атомом кислорода О(13) диоксана, расположенного в центре симметрии и являющегося мостиковым, с образованием тетраядерного комплекса Ni4 (Ni(2)–O(13) 2.110(5) Å), а атом Ni(1) – с атомом кислорода концевой молекулы диоксана (Ni(1)–O(10) 2.095(5) Å) (рис. 4). В димере Ni2 присутствуют внутримолекулярные ВС между атомами водорода мостиковой молекулы воды и атомами кислорода концевых анионов (О(1)…О(7) 2.560 Å, О(1)…О(9) 2.558 Å) (рис. 3).
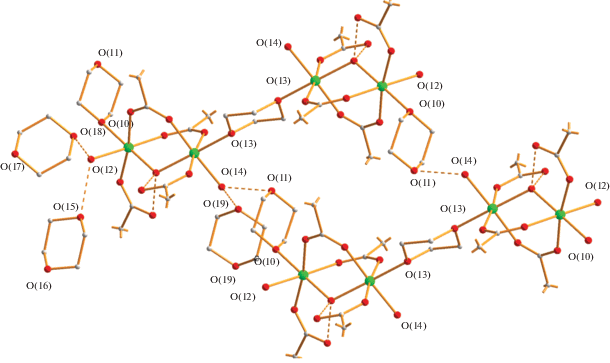
Атомы водорода координированных молекул воды образуют межмолекулярные ВС: в случае молекулы О(12) с атомами кислорода двух сольватных молекул растворителя (О(12)…О(15) 2.715 Å, О(12)…О(18) 2.735 Å), в случае молекулы О(14) с атомами кислорода концевого и сольватного диоксана (О(14)…О(11) 2.708 Å, О(14)…О(19) 2.831 Å), образуя тем самым 2D-полимер (рис. 5).
Рис. 5.
Фрагмент упаковки молекул соединения 2 в кристалле. Атомы фтора CF3-заместителей для ясности не показаны (цвета атомов: никель – зеленый, кислород – красный, углерод – серый).
Необходимо отметить, что ранее в аналогичной реакции для кобальта(II) (Co2+, d7) синтезирован 2D-КП {Co3(µ-OOCCF3)4(µ-OH2)2(OOCCF3)2[O(CH2CH2)2O]2(ОН2)2} · (OOCCF3)2 ⋅ ⋅ [O(CH2CH2)2O]2 (Co…Co 3.6374 Å) [15], а кипячение Co(OOCCF3)2(H2O)4 (получали растворением СоО в горячей НООСF3) с кислотой и ее ангидридом (10 : 1) в диоксане дает полимер [Co3(µ-OOCCF3)4(µ-H2O)2(OOCCF3)2(H2O)2(C4H8O2)] · · 2C4H8O2(Co…Co 3.632 Å) [16], причем основой таких комплексов является металлофрагмент Co3. Структурно охарактеризованные безводные трифторацетаты с металлоостовом М3 – M3(µ-OOCCF3)6[O(H)OCCF3]6 · ⋅ HOOCCF3 (M = Ni (Ni…Ni 4.100, 4.132 Å; Co…Co 4.161, 4.164 Å) – образуются при взаимодействии моноядерных M(OOCCF3)2(OH2)4 c ангидридом трифторуксусной кислоты с последующим выдерживанием над P4O10 в течение 5 сут и перекристаллизацией из безводной HOOCCF3. Исходя из Zn(OOCCF3)2(OH2)2 выделены монокристаллы 1D-КП {[Zn2(µ-OOCCF3)3(O(H)OCCF3)2](µ-OOCCF3)}n (Zn…Zn 3.728 Å), а комплексы M3(µ-OOCCF3)4(µ-OH2)2[OOCCF3]4(OH2)4 · 2HOOCCF3 (Ni…Ni 3.506 Å, Co…Co 3.533 Å) получены в результате аналогичной процедуры, но при растворении в безводной кислоте [17, 18].
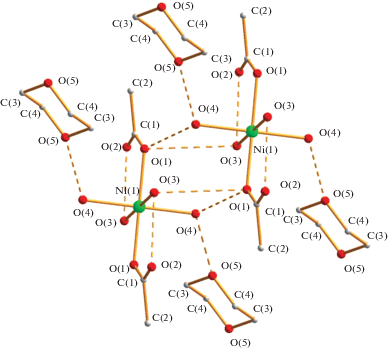
Реакция монокристаллов Ni(OOCMe)2(OH2)4 с 2 молями трифторуксусной кислоты с последующим растворением в 1,4-диоксане приводит к обмену анионов с образованием при комнатной температуре моноядерного комплекса Ni(OOCCF3)2(OH2)4 · [O(CH2CH2)2O] (3, выход 83%), изоструктурного полученному ранее комплексу кобальта(II) [15] (табл. 1, 4, рис. 6).
Рис. 6.
Фрагмент упаковки комплекса 3 в кристалле. Длины связей и ВС: Ni–O(1) 2.0863(10) Å, Ni–Ow 2.0338(10), 2.0675(10) Å, O(3)…O(2) 2.699 Å, O(3)…O(4) 2.841 Å, O(3)…O(1) 2.804 Å, O(4)…O(1) 2.742 Å, O(4)…O(5) 2.740 Å.
Таким образом, в отличие от кипячения в диоксане, когда часть молекул воды удаляется в результате испарения азеотропной смеси вода–растворитель, при комнатной температуре происходит лишь обмен анионов с сохранением всех молекул воды в комплексе.
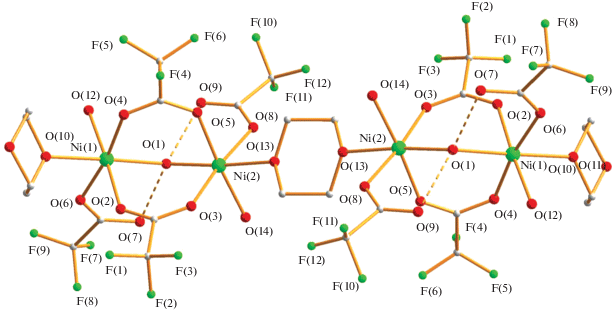
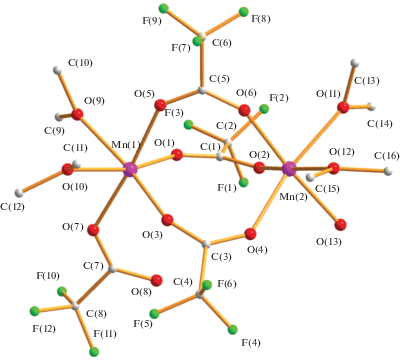
И, наконец, реакция водного ацетата марганца(II) с трифторуксусной кислотой в кипящем диоксане дает полимер {[Mn2(µ-OOСCF3)3(OOCСF3)(OH2)][µ-O(CH2CH2)2O]2}n (4) с выходом 79%. По-видимому, из-за того, что атом марганца(II) (Mn2+, d5) является наиболее электронодефицитным из рассматриваемой серии комплексов с 3d-металлами, по данным РСА (табл. 1, 5), в биядерном металлофрагменте два атома металла расположены на несвязывающем расстоянии Mn…Mn длиной 4.2487(5) Å и соединены тремя OOСCF3-мостиками (Mn(1)–µ-${{{\text{O}}}_{{{\text{OOCC}}{{{\text{F}}}_{3}}}}}$ 2.1241(19)–2.2198(17) Å, Mn(2)–µ-${{{\text{O}}}_{{{\text{OOCC}}{{{\text{F}}}_{3}}}}}$ 2.113(2)–2.1261(19) Å). Длины связей атомов кислорода мостиков с атомом Mn(2) заметно укорочены по сравнению с Mn(1)–µ-${{{\text{O}}}_{{{\text{OOCC}}{{{\text{F}}}_{3}}}}}$ из-за асимметрии лигандного окружения: атом Mn(1) связан с атомами кислорода двух координированных молекул диоксана (Mn(1)–O(9) 2.2198(17) Å, Mn(1)–O(10) 2.2774(17) Å) и атомом кислорода концевого карбоксилат-аниона (Mn(1)–O(7) 2.1142(18) Å), а атом Mn(2) – c атомами кислорода двух диоксанов (Mn(2)–O(11) 2.2321(18) Å, Mn(2)–O(12) 2.2400(18) Å) и молекулы воды (Mn(2)–O(13) 2.170(2) Å) (рис. 7).
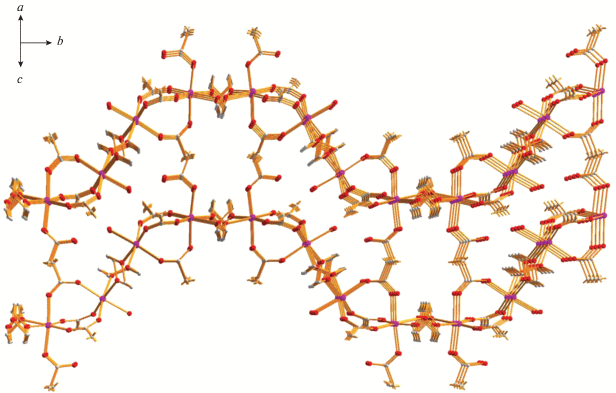
Такие биядерные молекулы образуют 2D-полимер, профиль которого формально “трапецеидальный меандр” (рис. 8, 9). В полимере каждый атом металла связан с двумя молекулами диоксана, и расстояние между ближайшими атомами, параллельно расположенными и лежащими в одной плоскости димеров, составляет: Mn(1)…Mn(1) 6.960 Å, Mn(1)…Mn(2) 7.037 Å, Mn(2)…Mn(2A) 7.139 Å, Mn(2)…Mn(2В) 6.971 Å (рис. 8). В кристалле такие меандры оказываются параллельными и встроенными один в другой за счет образования коротких ВС атомов водорода концевой молекулы воды и атомов кислорода концевого и мостикового анионов (О(13)…О(8А) 2.606 Å, О(13)…О(2А) 2.854 Å), что приводит к достаточно короткому расстоянию между атомами Mn(2)…Mn(2A) 5.538 Å (рис. 9, 10).
Рис. 8.
Строение 2D-полимера, образованного молекулами комплекса 4. Атомы фтора CF3-заместителей для ясности не показаны (цвета атомов: марганец – фиолетовый, кислород – красный, углерод – серый).
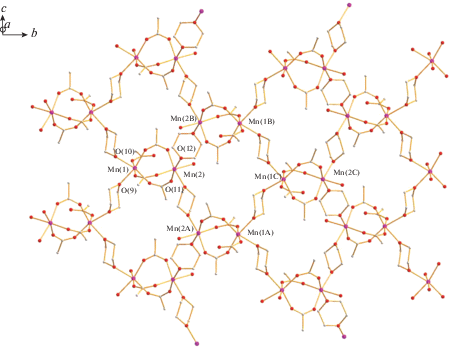
Рис. 9.
Профиль 3D-полимера, образованного молекулами комплекса 4 в кристалле. Атомы фтора CF3-заместителей для ясности не показаны (цвета атомов: марганец – фиолетовый, кислород – красный, углерод – серый).
Отметим, что безводные 1D-КП трифторацетатов марганца(II) [Mn(thf)2(µ-OOCCF3)2]n и {[Mn2(µ-OOCCF3)3(thf)4](µ-OOCCF3)}n (Mn…Mn 4.370 Å) получены при взаимодействии металлического марганца или Mn2(CO)10 с ангидридом трифторуксусной кислоты в ТГФ, а 1D-КП {[Mn(µ-OOCCF3)2{O(H)OCCF3}2](µ-OOCCF3)2}n (Mn…Mn 4.749 Å) – реакцией дихлорида марганца с безводной кислотой при 82°C в течение 2 сут [19, 20].
ЗАКЛЮЧЕНИЕ
Обнаружено, что в зависимости от природы переходного металла трифторацетаты переходных металлов в кипящем бидентатном 1,4-диоксане образуют полимеры различной размерности, формирующиеся как за счет молекулы растворителя, так и за счет образования межмолекулярных ВС. При этом кипячение в диоксане приводит лишь к частичному удалению молекул воды, содержащихся в исходных ацетатах (из-за образования азеотропной смеси растворитель–вода, кипящей при более низкой температуре, чем чистый растворитель), в отличие от известных аналогичных реакций при комнатной температуре, в которых наблюдается лишь обмен аниона слабой кислоты на сильную [18, 20–22]. Заметим, что в тех же реакциях в случае карбоксилатов меди(II) образуются соединения Cu2(OOCR)4[O(CH2CH2)2O]2 (R = Me, But, CF3), не содержащие молекул воды, строение которых определяется природой заместителя R в анионе [23].
Необходимо отметить, что, по данным CCDC, известно лишь несколько трифторацетатных комплексов кобальта(II) с координированным диоксаном, для остальных 3d-металлов соединения как с сольватным, так и со связанным с металлом диоксаном не получены [15, 16, 24]. Соединения этого типа неизвестны также для простейших карбоксилатов с R = Me, But, Ph, что и будет предметом наших дальнейших исследований.
Список литературы
Cotton F.A., Wilkinson G., Murillo C.A., Bochmann M. Advanced Inorganic Chemistry. N.Y.: John Wiley & Sons, Inc., 1999. 493 p.
Mehrotra R.C., Bohra R. Metal carboxylates. London: Acad. Press, 1983. 396 p.
Becht M., Gerfin T., Dahmen K.-H. // Helv. Chim. Acta. 1994. V. 77. P. 1288. https://doi.org/10.1002/hlca.19940770511
Pratt R.C., Mirica L.M., Stack T.D.P. // Inorg. Chem. 2004. V. 43. P. 8030. https://doi.org/10.1021/ic048904z
Tomkowicz Z., Ostrovsky S., Foro S. et al. // Inorg.Chem. 2012. V. 51. P. https://doi.org/6046 10.1021/ic202529p
Mikhalitsyna E.A., Tyurin V.S., Nefedov S.E. et al. // Eur. J. Inorg. Chem. 2012. V. 36. P. 5979. https://doi.org/10.1002/ejic.201200868
Hiroto S., Furukawa K., Shinokubo H., Osuka A. // J. Am. Chem. Soc. 2006. 128. P. 12380. https://doi.org/10.1021/ja062654z
Sinelshchikova A.A., Nefedov S.E., Enakieva Yu.Yu. et al. // Inorg. Chem. 2013. V. 52. P. 999. https://doi.org/10.1021/ic302257g
Еременко И.Л., Новоторцев В.М., Сидоров А.А., Фомина И.Г. // Рос. хим. журнал. 2004. Т. 48. № 1. С. 49.
Беккер X., Домшке Г., Фангхенель Э., Фишер М. Органикум. М.: Мир, 1992. Т. 1. 487 с.
SMART (control) and SAINT (integration) Software. Version 5.0. Bruker AXS Inc., Madison, WI, 1997.
SAINT: Area-Detector Integration Sofware. Bruker: Madison, 603 Wisconsin, USA, 2012.
Sheldrick G.M. SADABS. Program for scaling and Correction of Area Detector Data, University of Göttingen, 1997.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3. https://doi.org/10.1107/S2053229614024218
Uvarova M.A., Nefedov S.E. // Russ. J. Coord. Chem. 2020. V. 46. P. 608. https://doi.org/10.1134/S1070328420090079
Calvo-Perez V., Ostrovsky S., Vega A. et al. // Inorg. Chem. 2006. V. 45. P. 64410. https://doi.org/1021/ic051361o
Tokareva A.O., Tereshchenko D.S., Boltalin A.I. et al. // Russ. J. Coord. Chem. 2006. V. 32. P. 691. https://doi.org/10.1134/S1070328406090077
Morozov I.V., Karpova E.V., Glazunova T.Yu. et al. // Russ. J. Coord. Chem. 2016. V. 42. P. 647. https://doi.org/10.1134/S107032841610002X
Calderazzo F., Englert U., Pampaloni G. et al. // Can. J. Chem. 2001. V. 79. P. 495. https://doi.org/10.1139/cjc-79-5-6-495
Guntlin C.P., Tanja Zund, Kravchyk K.V. et al. // J. Mater. Chem. A. 2017. V. 5. P. 7383. https://doi.org/10.1039/C7TA00862G
Dhanapala B.D., Mannino N.A., Mendoza L.M. et al. // Dalton Trans. 2017. V. 46. P. 1420. https://doi.org/10.1039/C6DT04152C
Olejnik Z., Lis T. // Acta Crystallogr., Sect.C: Cryst. Struct. Commun. 2000. V. 56. P. 1310. https://doi.org/10.1107/S0108270100011215
Uvarova M.A., Nefedov S.E. // Russ. J. Coord. Chem. 2021. V. 47. № 6. https://doi.org.10.31857/S0132344X21060086
CSD, version 5.42 (November 2020).
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии