Журнал неорганической химии, 2021, T. 66, № 2, стр. 250-258
Фазовые диаграммы систем дифторида свинца с трифторидами редкоземельных элементов
П. П. Федоров *
Институт общей физики им. А.М. Прохорова РАН
119991 Москва, ул. Вавилова, 38, Россия
* E-mail: ppfedorov@yandex.ru
Поступила в редакцию 31.03.2020
После доработки 14.07.2020
Принята к публикации 20.07.2020
Аннотация
Методами рентгенофазового анализа отожженных во фторирующей атмосфере и закаленных образцов и дифференциального термического анализа в инертной атмосфере с использованием открытых тонкостенных графитовых тиглей исследованы фазовые равновесия в системах PbF2–RF3 (R = = La–Nd, Sm, Gd–Lu, Y, Sc). Выявлены области устойчивости твердых растворов Pb1 –xRxF2 +x со структурой флюорита, R1 –yPbyF3 –y со структурой тисонита LaF3, а также упорядоченных фаз идеализированного состава Pb4R3F17 с тригональным искажением кубической элементарной ячейки. Рассмотрено изменение топологии систем при изменении ионного радиуса редкоземельных элементов.
ВВЕДЕНИЕ
Фазовые диаграммы являются основой для разработки технологических процессов, в том числе получения функциональных материалов. Фазовые диаграммы фторидов редкоземельных элементов (РЗЭ) с фторидами лития и натрия были изучены американскими исследователями в ходе выполнения атомного проекта [1–5]. К сожалению, при этом не удалось полностью предотвратить пирогидролиз фторидов РЗЭ [6–8], а полученные результаты были представлены несколько схематично. Гидролиз фторидов также не принимался во внимание в работах Г.А. Бухаловой по исследованию фазовых диаграмм фторидных систем [4, 9]. Большой массив фазовых диаграмм систем фторидов РЗЭ с фторидами щелочноземельных металлов MF2–RF3, где M = Mg, Ca, Sr, Ba, был изучен в Институте кристаллографии РАН в 70-х гг. ХХ в. в ходе работ по лазерной программе – поиску и выращиванию монокристаллов активных лазерных сред [6, 8, 10–15]. Кроме того, были скорректированы данные Тома и др. по системам LiF–RF3 и NaF–RF3 [16].
Фазовые диаграммы систем с участием трифторидов РЗЭ представляют интерес и с теоретической точки зрения, так как при постепенном изменении свойств редкоземельного катиона и соответствующего соединения в результате лантаноидного сжатия фазовые диаграммы демонстрируют постепенное изменение метрики фазовой диаграммы, приводящее к качеcтвенным перестройкам топологии – бифуркациям фазовых диаграмм [17, 18]. Фазы переменного состава, образующиеся в системах MF2–RF3, а именно M1 –xRxF2 +x со структурой флюорита и R1 –yMyF3 –y со структурой тисонита LaF3, представляют собой классические объекты так называемой “сильной нестехиометрии” – гетеровалентного изоморфизма с переменным числом ионов в элементарной ячейке [19, 20]. Это объекты с огромной концентрацией структурных дефектов, приводящих к кластерообразованию, упорядочению, резкому изменению физических свойств с концентрацией, стабилизации высокотемпературных модификаций и т.д.
Фторид свинца имеет ряд особенностей, которые затрудняют работу с ним, а именно: малую химическую устойчивость, легкое восстановление до металла, легкий пирогидролиз, высокую летучесть, токсичность [21]. Фторид свинца диморфен. Высокотемпературная модификация со структурой флюорита является аналогом фторидов стронция и бария (пр. гр. $Fm\bar {3}m$), но отличается низкой температурой плавления. Кроме того, у фторида свинца имеется низкотемпературная ромбическая модификация со структурой котунита (пр. гр. Pnma). Аналогичные модификации для фторидов щелочноземельных металлов стабильны только при повышенном давлении. Монокристаллы PbF2, несмотря на сложность их получения, представляют интерес как детекторы черенковского излучения [21, 22].
Системы PbF2–RF3 интересны с точки зрения дизайна твердых электролитов с высокой фтор-ионной проводимостью [21, 24–28]. Высокая электропроводность PbF2 была открыта еще в 1834 г. Фарадеем [23]. Не исчерпан потенциал соответствующих композиций и как материалов фотоники [29–31]. Эти системы важны также для понимания следующих процессов: очистки трифторидов РЗЭ от примеси кислорода с помощью “раскислителя” (oxygen scavenger) PbF2 [32], выращивания монокристаллов оксидных соединений из флюсов, содержащих фторид свинца [33], а также формирования фторидной стеклокерамики [34].
Проводились отдельные исследования фазообразования в системах из фторидов свинца и РЗЭ [24, 35–40]. Полный ряд фазовых диаграмм систем PbF2–RF3 был изучен в работе [41]. Эти данные опубликованы только фрагментарно [6, 20, 21, 34, 41–46].
Цель настоящей работы – полная публикация результатов исследований фазовых равновесий в ряду систем PbF2–RF3.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Первоначальное исследование фазовых равновесий в системе PbF2–YF3 было проведено во время командировки автора в Лабораторию химии твердого тела Университета Бордо, Франция [42]. Синтез, отжиг и ДТА образцов проводили в герметичных золотых или платиновых трубках, заваренных газовой горелкой в токе инертного газа. В ходе дальнейшей работы для исследования полного ряда фазовых диаграмм систем PbF2–RF3 было необходимо найти альтернативу этой дорогостоящей методике.
В качестве исходных веществ использовали порошки фторидов РЗЭ производства Пышминского опытного завода “ГИРЕДМЕТ” или реактивы марки “х. ч.” Новосибирского химического завода, переплавленные во фторирующей атмосфере. Контроль реактивов осуществляли рентгенографически и по температурам фазовых превращений. Температуры плавления и полиморфных превращений соответствовали данным [8]. Использовали фторид скандия производства Опытного завода ФХИ АН УССР (Одесса). Фториды РЗЭ с R = La–Nd имели структуру типа тисонита LaF3 (пр. гр. $P\bar {3}c1$), а фториды с R = Sm–Lu, Y – структуру типа β-YF3 (ромбическая сингония, пр. гр. Pnma), фторид скандия – структуру типа ReO3 (пр. гр. Pm3m). Это соответствует морфотропным переходам в ряду трифторидов РЗЭ [47, 48]. Фторид свинца марки “ос. ч.” обезгаживали при ~200°C с форвакуумной откачкой и переплавляли в атмосфере гелия марки “в. ч.”. Характеристики фторида свинца отвечали закаленной высокотемпературной модификации, параметр решетки PbF2а = 5.940 ± 0.003 Å и температура плавления 825°C хорошо соответствовали данным [21].
В качестве материала для исследования твердофазных равновесий с успехом использовали медь, что соответствовало опыту, накопленному на химфаке МГУ. Твердофазный синтез образцов проводили по методике, отработанной при изучении систем фторидов РЗЭ с фторидами щелочноземельных элементов [10, 15]. Тщательно перетертые навески запаковывали в тонкостенные металлические капилляры, которые вместе с тефлоновой стружкой помещали в никелевые бомбы, завариваемые аргонно-дуговой плавкой. Продолжительность отжигов при температурах от 620 до 850°C составляла от 240 до 7 ч [49]. Закалку проводили в проточной воде. Границы растворимости твердых растворов определяли рентгенографически по параметрам решетки, постоянным в двухфазных областях фазовых диаграмм.
Серьезной проблемой стал выбор методики термического анализа [50]. Дифференциальный термический анализ проводили в вакуумируемой установке, не имевшей керамических деталей, в атмосфере гелия марки “в. ч.”. Использовали дозатор специальной конструкции, который позволял изменять состав анализируемого вещества без вывода установки из рабочего режима. Температуру измеряли термопарами W5Re–W20Re. Калибровку проводили по реперным веществам, указанным в табл. S1 . Точность измерения температуры составляла ±3°C. Температуры фазовых превращений фиксировали по началам термических эффектов. Координаты солидуса и ликвидуса определяли по кривым нагревания и охлаждения соответственно [51].
Первоначально для ДТА использовали открытые платиновые тигли. Однако оказалось, что расплавы, содержащие фторид свинца, взаимодействуют с платиной. Небольшая потеря фтора при термической диссоциации PbF2 приводит к образованию металлического свинца, который растворяется в платине. При этом на термограммах появляются паразитные эффекты около 900°C, соответствующие фазовым превращениям в системе Pb–Pt [52]. В работе [44] эти эффекты были ошибочно отнесены к системе PbF2–NdF3. После ряда опытов в качестве материалов тиглей для ДТА был выбран плотный графит марки Tesla (ЧССР). Тонкостенные (<0.5 мм) тигли вытачивали на токарном станке. Графитовые тигли не смачивались фторидными расплавами и не теряли механических свойств после многократного использования. Методика была проверена при изучении фазовых диаграмм систем PbF2 с фторидами лития и натрия [53].
Расплавы систем PbF2–RF3 в графитовых тиглях не переохлаждаются. Образцы твердых растворов Pb1 –xRxF2 +x после ДТА во многих случаях были получены в виде прозрачных капелек без признаков второй фазы. Однако высокое давление паров фторида свинца приводит к существенным потерям массы при нагреве выше 800°C, в связи с этим проводили коррекцию химического состава после ДТА в предположении, что испаряется только фторид свинца. Результаты проведенного химического анализа подтверждают это предположение (табл. S2 ).
Полученные образцы были исследованы методом рентгенофазового анализа на дифрактометре AFV-202E, Toshiba (CuKα-излучение).
Микрофотографии некоторых сплавов, полученных методом растровой электронной микроскопии, представлены в работе [45].
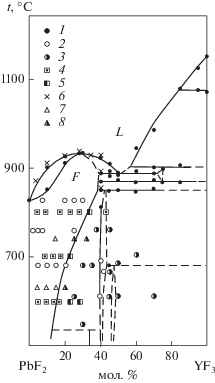
На рис. 1 для сравнения приведены результаты исследования системы PbF2–YF3 с использованием различных экспериментальных методик. Совпадение следует признать хорошим.
Рис. 1.
Сравнение результатов различных методик при изучении фазовых равновесий в системе PbF2–YF3. 1 – ДТА [42]; 2, 3 – соответственно однофазные и двухфазные образцы по данным РФА отожженных и закаленных образцов из работы [42]; 4, 5 – соответственно однофазные и двухфазные образцы по данным [37]; 6, 7, 8 – результаты ДТА, однофазные и двухфазные образцы по данным настоящей работы.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
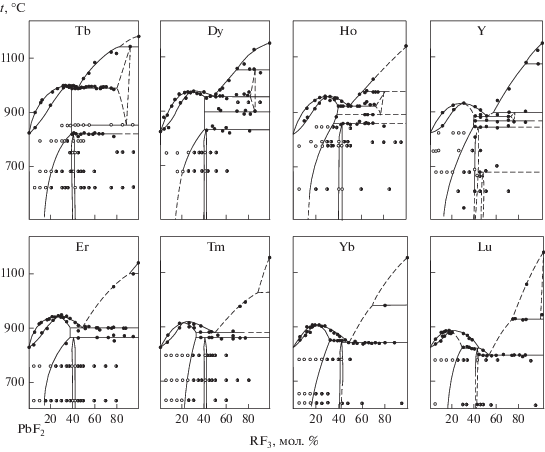
Полученные фазовые диаграммы представлены на рис. 2, 3. Координаты нонвариантных точек даны в табл. 1 и графически – на рис. 4–6. Данные термического анализа табулированы в дополнительных материалах (табл. S3–S15 ).
Рис. 2.
Фазовые диаграммы систем PbF2–RF3, R = La–Gd. Точки – данные ДТА, белые кружки – однофазные образцы, получерные кружки – двухфазные образцы по данным РФА отожженных и закаленных образцов.
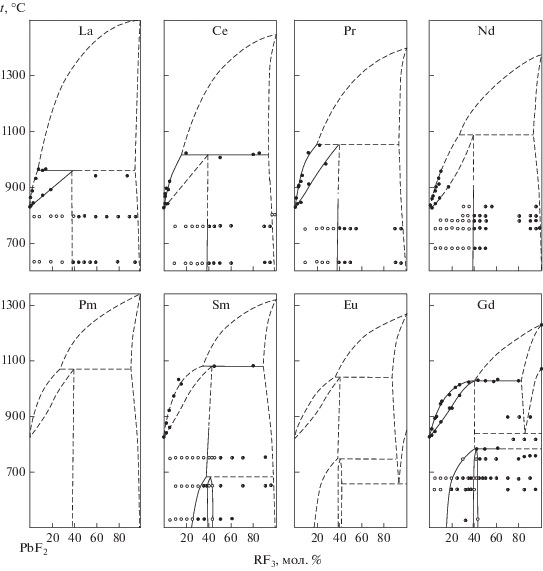
Таблица 1.
Координаты нонвариантных точек в системах PbF2–RF3. Концентрация RF3 – С, мол. %, температура – t, °C
| R | Максимум на ликвидусе | Предельная растворимость RF3 в PbF2 | Эвтектика | Перитектика | Разложение Pb4R3F17 | Устойчивость тисонитовых фаз | Параметры решетки, угловой коэффициент | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| C ± 2% | t, °C | C | C ± 2% | t, °C | C ± 2% | t, °C | t ± 10°C | t1, °C | t2, °C | k, Å/моль | |
| La | – | 38 ± 4 | – | 10 | 960 | – | +0.0031 | ||||
| Ce | – | 38 ± 4 | – | 15 | 1020 | – | –0.0430 | ||||
| Pr | – | 38 ± 4 | – | (20) | (1060) | – | –0.0946 | ||||
| Nd | – | 40 ± 4 | – | (25) | (1085) | – | –0.1412 | ||||
| Pm | – | (42) | – | (29) | (1085) | – | |||||
| Sm | – | 43 ± 3 | – | 33 | 1080 | 680 | –0.2179 | ||||
| Eu | – | (42) | – | (38) | (1060) | ||||||
| Gd | 42 | 1033 | 42 ± 2 | 42 | 1033 | 42 | 1033 | 785 | 840 | –0.2721 | |
| Tb | 36 | 977 | 41 ± 2 | 44 | 991 | – | 819 | 810 | 1140 | –0.3191 | |
| Dy | 30 | 973 | 40 ± 2 | 47.5 | 957 | – | 835 | 900 | 1055 | –0.3405 | |
| Ho | 28 | 960 | 39 ± 2 | 50 | 925 | – | 860 | 890 | 976 | –0.3914 | |
| Er | 28 | 945 | 38 ± 2 | 50 | 900 | – | 865 | – | –0.4265 | ||
| Tm | 22 | 920 | 34 ± 2 | 48 | 880 | – | 860 | – | –0.4521 | ||
| Yb | 22 | 907 | 32 ± 2 | 49 | 842 | – | 850* | – | –0.4464 | ||
| Lu | 16 | 885 | 29 ± 2 | 52.5 | 807 | – | 825* | – | –0.4538 | ||
| Y | 30 | 933 | 39 ± 2 | 51 | 885 | – | 845 | 879 | 900 | –0.3918 | |
| Sc | – | – | – | – | |||||||
Рис. 4.
Изменение составов в системах PbF2–RF3 по ряду РЗЭ. 1 – состав перитектики, 2 – максимальная концентрация твердых растворов Pb1 –xRxF2 +x, 3 – состав максимумов на кривых плавления твердых растворов, 4 – состав эвтектики.
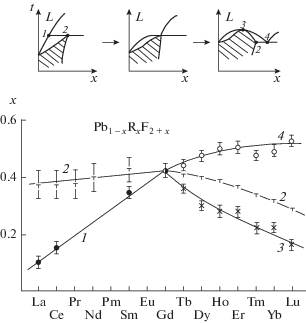
Рис. 5.
Изменение температур нонвариантных равновесий в системах PbF2–RF3 по ряду РЗЭ. 1 – эвтектика, 2 – максимумы на кривых плавления твердых растворов, 3 и 4 – верхние и нижние пределы существования фаз со структурой LaF3 (тисонита), 5 – перитектика, 6 – верхняя граница устойчивости фаз типа Pb4R3F17.
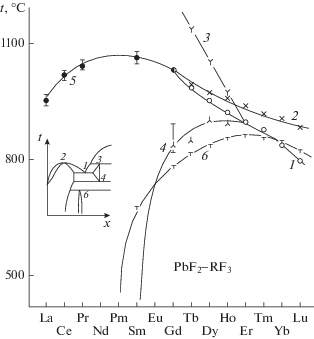
Высокая летучесть фторида свинца не позволила в большинстве случаев экспериментально исследовать кривые ликвидуса фторидов РЗЭ. Более того, тугоплавкие перитектические равновесия в системах из фторидов РЗЭ цериевой группы также изучены неполно. Тем не менее закономерное изменение координат нонвариантных точек в ряду РЗЭ позволило построить экстраполяцией фазовые диаграммы систем для фторидов Pm и Eu.
Твердые растворы Pb1 –xRxF2 +x со структурой флюорита образуются во всех исследованных системах. Это твердые растворы на основе высокотемпературной модификации PbF2. При уменьшении ионного радиуса в ряду РЗЭ [54] происходит переход от перитектического к эвтектическому характеру плавления твердых растворов. Переход осуществляется через образование максимумов на кривых плавления твердых растворов (R = Tb–Lu, Y). Это соответствует бифуркации фазовой диаграммы типа Б1II согласно классификации, представленной в [18]. Фазовые равновесия в системе PbF2–GdF3 с точностью эксперимента соответствуют переходному случаю – совпадению в одной точке координат предельных эвтектической и перитектической точек, а также точки максимума на кривых плавления (рис. 5).
Система PbF2–ScF3 простого эвтектического типа с небольшой областью твердого раствора Pb1 – хScхF2 + х, который характеризуется очень высокой фтор-ионной проводимостью [27, 45], без максимума на кривых плавкости.
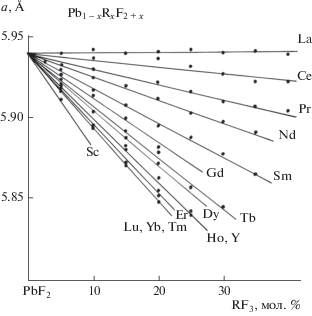
Параметры решетки флюоритовых твердых растворов Pb1 –xRxF2 +x линейно меняются с концентрацией [46] и описываются общим выражением: а = 5.940 + kx (Å). Значения коэффициентов k приведены в табл. 1.
Упорядоченные флюоритоподобные фазы с идеализированной формулой Pb4R3F17 выявлены нами в системах с R = Sm–Lu, Y. Эти фазы имеют небольшую область гомогенности. Термическая устойчивость их повышается с уменьшением ионного радиуса РЗЭ, и они выходят на равновесие с расплавом в конце ряда РЗЭ. Для РЗЭ цериевой группы (R = La–Nd) образование соответствующих фаз не зафиксировано [17]. Эти фазы изоструктурны соответствующим бариевым соединениям, в том числе Ba4Bi3F17 [6, 15, 40, 55, 56] (тригональное искажение кубической флюоритовой элементарной ячейки, параметры решетки а ≈ 0.5√14а0, с ≈ 2√3а0, где а0 – параметр флюоритовой субъячейки, что соответствует фазам типа rhα по классификации [57]). Параметры решетки наиболее корректно определены Грейсом и др. [39]. У французских исследователей присутствует путаница в индексах сверхструктурных отражений на рентгенограммах [37]. Примесь кислорода в соответствующей иттриевой фазе зафиксирована в структурной работе [38].
Образование упорядоченных фаз Pb4R3F17 приводит к уменьшению области концентрационной устойчивости неупорядоченных твердых растворов Pb1 –xRxF2 +x и резкой температурной зависимости их предельных концентраций. Это полностью соответствует правилу Юм-Розери [58].
Процесс упорядочения твердых растворов в этих системах не ограничивается образованием фаз типа Pb4R3F17. Отмечено формирование фаз с тетрагональным искажением флюоритовой субъячейки, состав которых соответствует формулам Pb2YF7 [37] и примерно PbRF5 [42, 40 ]. Эти низкотемпературные фазы, появляющиеся при термической обработке оксофторидных стеклокерамик [30], требуют дальнейшего изучения.
Фазы R1 –yPbyF3 –y со структурой LaF3 (тисонита) представляют собой твердые растворы на основе трифторидов РЗЭ цериевой группы (R = = La–Nd) или их высокотемпературных модификаций (R = Sm–Gd). В работе [59] при выращивании кристаллов определены предельные составы тисонитовых твердых растворов Pr0.905Pb0.095F2.905 и Nd0.89Pb0.11F2.8. При исчезновении полиморфных модификаций трифторидов РЗЭ такой структуры соответствующие области твердых растворов обособляются от ординат компонентов и соответствующие фазы приобретают характер бертоллидов (R = Tb–Ho, Y). Область термической устойчивости этих фаз уменьшается, и они исчезают при дальнейшем уменьшении ионного радиуса РЗЭ катиона. В целом поведение фаз тисонитового типа в этих системах подобно поведению их в системах BaF2–RF3 и СdF2–RF3 [6].
Твердые растворы фторида свинца в модификациях типа α-YF3 и β-YF3 не зафиксированы, за исключением α-LuF3.
Необходимо отметить хорошее (удовлетворительное) совпадение полученных нами результатов с данными предыдущих исследований: по ширине областей твердых растворов – с работами [24, 35, 37], рентгенографическим характеристикам фаз – с работами [37, 39, 40]. Резкое расхождение с нашими результатами данных [36] по растворимости СеF3 в PbF2 связано, по-видимому, с пирогидролизом образцов в цитируемой работе. Данные о фазообразовании в системе PbF2–EuF3 [40] существенно дополняют наше исследование. При этом величины предельной концентрации твердых растворов, полученные в режиме медленного охлаждения [40], не имеют фундаментального значения, так как относятся к неизвестной температуре и не являются характеристикой системы.
Распад твердых растворов с понижением температуры является следствием третьего начала термодинамики [60, 61]. Поскольку в системах PbF2–RF3, где R = La–Nd, в исследованном интервале предельные концентрации твердых растворов Pb1 –xRxF2 +x практически не зависят от температуры, а образование упорядоченных фаз в этих системах не зафиксировано, кривые растворимости (сольвуса), по-видимому, должны иметь аномальный вид с точкой перегиба аналогично случаю, реализующемуся в системе CaF2–LaF3 [62].
Максимумы на кривых плавления твердых растворов характерны для гетеровалентных твердых растворов с переменным числом ионов в элементарной ячейке [20]. Они благоприятны для выращивания монокристаллов высокого качества [63], особенно с учетом высоких, сильно отличающихся от единицы коэффициентов распределения фторидов РЗЭ при кристаллизации PbF2 [20]. Однако осложняющим обстоятельством является сильное испарение и, соответственно, дрейф составов кристаллов в процессе выращивания. Закрытые тигли предпочтительнее для выращивания из расплава кристаллов на основе фторида свинца [59].
Поскольку фторид свинца образует твердые растворы во фторидах РЗЭ цериевой группы, использование его как раскислителя при выращивании соответствующих монокристаллов должно приводить к наличию остаточной примеси свинца в выращенных образцах [41].
Ансамбли наночастиц с составами, отвечающими системам PbF2–RF3, синтезированы в виде включений в оксидных матрицах при формировании оптической стеклокерамики [30, 64–73]. Для получения соответствующих порошков перспективен низкотемпературный синтез с использованием нитратных расплавов [74, 75].
Список литературы
Bergmann P.H. // Handbuch der anorganischen Chemie. Syst. Nummer 39: Seltenerdelemente. Teil C.3: Sc, Y, La und Lanthanide. Fluoride, Oxifluoride und zugehogige Alkalidoppelverbindungen. Berlin: Springer Vlg., 1976.
Thoma R.E., Insley H., Hebert G.M. // Inorg. Chem. 1966. V. 5. № 7. P. 1222.
Thoma R.E., Brunton G.D., Penneman R.A., Keenan T.K. // Inorg. Chem. 1970. V. 9. № 5. P. 1096.
Thoma R.E. // Advances in Molt Salt Chemistry / Eds. Braunstein J., Mamantov G., Smith G.P. N.Y.: Plenum Press, 1975. 275 p.
Thoma R.E., Brunton G.D. // Inorg. Chem. 1966. V. 5. № 11. P. 1937.
Sobolev B.P. The Rare Earth Trifluorides. Part 1. The High Temperature Chemistry of the Rare Earth Trifluorides. Barcelona, 2000. 520 p.
Sobolev B.P., Fedorov P.P., Steynberg D.B. et al. // J. Solid State Chem. 1976. V. 17. № 1/2. P. 191. https://doi.org/10.1016/0022-4596(76)90220-6
Sobolev B.P., Fedorov P.P., Seiranyan K.B., Tkachenko N.L. // J. Solid State Chem. 1976. V. 17. № 1/2. P. 201. https://doi.org/10.1016/0022-4596(76)90221-8
Диаграммы плавкости солевых систем. Справочник / Под ред. Посыпайко В.И., Алексеевой Е.А. М.: Металлургия, 1977. Ч. 1. 416 с., Ч. 2. 304 с.
Olkhovaya L.A., Fedorov P.P., Ikrami D.D., Sobolev B.P. // J. Therm. Anal. 1979. V. 15. P. 355. https://doi.org/10.1007/BF01903660
Sobolev B.P., Fedorov P.P. // J. Less-Common Metals. 1978. V. 60. P. 33. https://doi.org/10.1016/0022-5088(78)90087-5
Fedorov P.P., Sobolev B.P. // J. Less-Common Metals. 1979. V. 63. № 1. P. 31. https://doi.org/10.1016/0022-5088(79)90206-6
Sobolev B.P., Seiranian K.B., Garashina L.S., Fedorov P.P. // J. Solid State Chem. 1979. V. 28. № 1. P. 51. https://doi.org/10.1016/0022-4596(79)90057-4
Sobolev B.P., Seiranian K.B. // J. Solid State Chem. 1981. V. 39. № 2. P. 17.
Sobolev B.P., Tkachenko N.L. // J. Less-Common Metals. 1982. V. 85. P. 155.
Fedorov P.P. // Russ. J. Inorg. Chem. 1999. V. 44. № 11. P. 1703. [Федоров П.П. // Журн. неорган. химии. 1999. Т. 44. № 11. С. 1792.]
Fedorov P.P. // Russ. J. Phys. Chem. 1999. V. 73. № 9. P. 1381. [Федоров П.П. // Журн. физ. химии. 1999. Т. 73. № 9. С. 1545.]
Fedorov P.P. // Russ. J. Phys. Chem. 1999. V. 73. № 9. P. 1387. [Федоров П.П. // Журн. физ. химии. 1999. Т. 73. № 9. С. 1551.]
Fedorov P.P. // Butll. Soc. Cat. Cien. 1991. V. 12. № 2. P. 349.
Fedorov P.P // Russ. J. Inorg. Chem. 2000. V. 45. Suppl. 3. P. S268.
Buchinskaya I.I., Fedorov P.P. // Russ. Chemical Rev. V. 73. № 4. P. 371. [Бучинская И.И., Федоров П.П. // Успехи химии. 2004. Т. 73. № 4. С. 404.]
Appuhn R.D., Brasse F., Deckers T. et al. // Phys. Res. A. 1994. V. 350. P. 208.
Мурин И.В., Иванов-Шиц А.К. Ионика твердого тела. Т. 2. СПб.: Изд-во СПб. гос. ун-та, 2010. 1000 с.
Чернов С.В. Твердые электролиты на основе дифторидов свинца и олова. Автореф. дис. … канд. хим. наук. Л., 1982. 16 с.
Bonne R.W., Schoonman J. // J. Electrocehem. Soc. 1977. V. 124. P. 28.
Sorokin N.I., Fedorov P.P., Sobolev B.P. // Inorg. Mater. 1997. V. 33. № 1. P. 1. [Сорокин Н.И., Федоров П.П., Соболев Б.П. // Неорган. материалы. 1997. Т. 33. № 1. С. 5.]
Trnovcova V., Fedorov P.P., Buchinskaya I.I. et al. // Solid State Ionics. 1999. V. 119. P. 181. https://doi.org/10.1016/S0167-2738(98)00501-3
Popov P.A., Sidorov A.A., Kul’chenkov E.A. et al. // Ionics. 2017. V. 23. № 1. P. 233. https://doi.org/10.1007/s11581-016-1802-2
Dantelle G., Tiwari A., Rahman R. et al. // Opt. Mater. 2009. V. 32. P. 251.
Hu N., Yu H., Zhang M. et al. // Phys. Chem. Chem. Phys. 2011. V. 13. P. 1499.
Sevostjanova T.S., Khomyakov A.V., Mayakova M.N. et al. // Opt. Spectrosc. 2017. V. 123. P. 733. https://doi.org/10.1134/S0030400X17110182
Юшкин Н.П., Волкова Н.В., Маркова Г.А. Оптический флюорит. М.: Наука, 1983. 134 с.
Тимофеева В.А. Рост кристаллов из растворов-расплавов. М.: Наука, 1978. 268 с.
Fedorov P.P., Luginina A.A., Popov A.I. // J. Fluorine Chem. 2015. V. 172. P. 22. https://doi.org/10.1016/j.jfluchem.2015.01.009
Sato M., Utsonomya T. // J. Electrochim. Soc. Jpn. 1965. V. 33. № 1. P. 59.
Besse J.-P., Capestan M. // Bull. Soc. Chim. Fr. 1967. № 4. P. 341.
Dib A., Aleonard S., Roux M.Th. // J. Solid State Chem. 1984. V. 52. P. 29.
Dib A., Aleonard S. // J. Solid State Chem. 1986. V. 64. P. 148.
Greis O., Uwais B.M., Horne W. // Z. Kristallogr. 1989. Bd. 186. S. 104.
Tyagi A.K., Patwe S.J., Achary, Mallia M.B. // J. Solid State Chem. 2004. V. 177. P. 1746.
Федоров П.П. Высокотемпературная химия конденсированного состояния систем с трифторидами редкоземельных элементов как основа получения новых материалов. Дис. … докт. хим. наук. М., 1991. 608 с.
Reau J.M., Fedorov P.P., Rabardel L. et al. // Mater. Res. Bull. 1983. V. 18. № 10. P. 1235. https://doi.org/10.1016/0025-5408(83)90027-2
Fedorov P.P., Zibrov I.P., Sobolev B.P., Shishkin I.V. // Russ. J. Inorg. Chem. 1987. V. 32. P. 1066. [Федоров П.П., Зибров И.П., Соболев Б.П., Шишкин И.В. // Журн. неорган. химии. 1987. Т. 32. № 7. С. 1974.]
Fedorov P.P., Zibrov I.P., Tarasova E.V. et al. // Russ. J. Inorg. Chem. 1988. V. 33. P. 3222. [Федоров П.П., Зибров И.П., Тарасова Е.В. и др. // Журн. неорган. химии. 1988. Т. 33. № 12. С. 3222.]
Fedorov P.P., Trnovcova V., Meleshina V.A. et al. // Inorg. Mater. 1994. V. 30. P. 384. [Федоров П.П., Трновцова В., Мелешина В.А. и др. // Неорган. материалы. 1994. Т. 30. № 3. С. 406.]
Fedorov P.P., Sobolev B.P. // Sov. Phys. Crystallogr. 1992. V. 37. P. 651. [Федоров П.П., Соболев Б.П. // Кристаллография. 1992. Т. 37. № 5. С. 1210.]
Fedorov P.P., Sobolev B.P. // Crystallography Reports. 1995. V. 40. № 2. P. 284. [Федоров П.П., Соболев Б.П. // Кристаллография. 1995. Т. 40. № 2. С. 315.]
Sobolev B.P. // Russ. J. Inorg. Chem. 2020. V. 65. P. 395. [Соболев Б.П. // Журн. неорган. химии. 2020. Т. 65. № 3. С. 373.]https://doi.org/10.1134/S0036023620030158
Fedorov P.P. // Russ. J. Inorg. Chem. 1992. V. 37. № 8. P. 973. [Федоров П.П. // Журн. неорган. химии. 1992. Т. 37. № 8. С. 1891.]
Федоров П.П., Тарасова Е.В., Зибров И.П., Соболев Б.П. // Х Всесоюзное совещание по термическому анализу. 26–28 сентября 1989. Тез. докл. Л., 1989. С. 71.
Fedorov P.P., Medvedeva L.V. // Russ. J. Inorg. Chem. 1989. V. 34. № 10. P. 1528. [Федоров П.П., Медведева Л.В. // Журн. неорган. химии. 1989. Т. 34. № 10. С. 2674.]
Хансен М., Андерко К. Структуры двойных сплавов. Т. 2. М.: Металлургия, 1962. 609 с.
Федоров П.П., Ловецкая Г.А., Зимина Г.В., Соболев Б.П. // Журн. неорган. химии. 1986. Т. 31. № 3. С. 768. [Fedorov P.P., Lovetskaya G.A., Zimina G.V., Sobolev B.P. // Russ. J. Inorg. Chem. 1986. V. 31. № 3. P. 768.]
Shannon R.D. // Acta Crystallogr., Sect. A. 1976. V. 32. P. 751.
Максимов Б.А., Сооланс Х., Дудка А.П. и др. // Кристаллография. 1996. Т. 41. № 1. С. 51.
Dombrovski E.N., Serov T.V., Abakumov A.M. et al. // J. Solid State Chem. 2004. V. 177. P. 312.
Greis O., Haschke J.M. Rare earth fluorides. Handbook on the physics and chemistry of rare earth / Eds. Gscheidner K.A., Eyring L. Amsterdam, 1982. V. 5. Ch. 45. P. 387.
Юм Розери В., Рейнор Г.В. Структура металлов и сплавов. М.: Металлургия, 1959.
Бучинская И.И., Архарова Н.А., Иванова А.Г., Каримов Д.Н. // Кристаллография. 2020. Т. 65. № 1. С. 147.
Fedorov P.P. // Russ. J. Inorg. Chem. 2010. V. 55. P. 1722. [Федоров П.П. // Журн. неорган. химии. 2010. Т. 55. № 11. С. 1825.]https://doi.org/10.1134/S0036023610110100
Laughlin D.E., Soffa W.A. // Acta Mater. 2018. V. 145. P. 49. https://doi.org/10.1016/j.actamat.2017.11.037
Svantner M., Mariani E., Fedorov P.P., Sobolev B.P. // Kristall. Technik-Crystal. Res. Technol. 1979. V. 14. № 3. P. 365. https://doi.org/10.1002/crat.19790140319
Fedorov P.P., Osiko V.V. // Bulk crystal growth of electronic, Optical and optoelectronic materials. Wiley series in materials for electronic and optoelectronic applications / Ed. Capper P. Chichester: John Wiley & Son, Ltd., 2005. P. 339. https://doi.org/10.1002/9780470012086.ch1
Tanabe S., Hayashi H., Hanada T. // J. Am. Ceram. Soc. 2002. V. 85. P. 839.
Tikhomirov V.K., Furniss D., Seddon A.B. et al. // Appl. Phys. Lett. 2002. V. 81. P. 1937.
Dantelle G., Mortier M., Patriarche G., Vivien D. // J. Solid State Chem. 2006. V. 179. P. 1995.
Van den Heuvel W., Tikhomirov V.K., Kirilenko D. et al. // Phys. Rev. B. 2010. V. 82. № 094421.
Luo S.Q., Zhao L.-J., Hu N. et al. // Chin. Phys. Lett. 2011. V. 28. № 034207.
del-Castillo J., Yanes A.C., Mendez–Ramos J. et al. // J. Sol-Gel Sci. Technol. 2010. V. 53. P. 509.
Gugov I., Mueller M., Ruessel C. // J. Solid State Chem. 2011. V. 184. P. 1001.
Shinozaki K., Honma T., Komatsu T. // J. Appl. Phys. 2012. V. 112. № 093506.
Zhao S.L., Wang X.L., Sun X. et al. // Cryst. Eng. Comm. 2013. V. 15. P. 7346.
Nan Hu, Hua Yu, Ming Zhang et al. // Phys. Chem. Chem. Phys. 2011. V. 13. P. 1499. https://doi.org/10.1039/c0cp00903b
Fedorov P.P., Mayakova M.N., Alexandrov A.A. et al. // Inorganics. 2018. V. 6. № 2. P. 38. https://doi.org/10.3390/inorganics6020038
Fedorov P.P., Alexandrov A.A. // J. Fluorine Chem. 2019. V. 227. P. 109374. https://doi.org/10.1016/j.jfluchem.2019.109374
Дополнительные материалы
- скачать ESM.doc
- Supplementary materials
Инструменты
Журнал неорганической химии