Журнал неорганической химии, 2021, T. 66, № 2, стр. 128-133
Бромовисмутаты метилвиологена
П. А. Буйкин a, b, c, А. Б. Илюхин a, В. К. Лауринавичюте d, В. Ю. Котов a, b, *
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
b Научно-исследовательский университет “Высшая школа экономики”
101000 Москва, ул. Мясницкая, 20, Россия
c Высший химический колледж РАН, Российский химико-технологический университет им. Д.И. Менделеева
125047 Москва, Миусская площадь, 9, Россия
d Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: vyukotov@gmail.com
Поступила в редакцию 17.03.2020
После доработки 27.03.2020
Принята к публикации 31.03.2020
Аннотация
Получен из водного раствора и структурно охарактеризован новый бромовисмутат метилвиологена (MV2+) [MV]3[BiBr6]2 · 2H2O (I), изоструктурный известному хлоровисмутату [MV]3[BiCl6]2 · 2H2O. Взаимодействие I с концентрированной HBr приводит к образованию кислого бромовисмутата-бромида метилвиологена [H3O]2[MV][BiBr6]Br · 4H2O (II) и минорной примеси бромовисмутата-трибромида [MV]3[Bi2Br9][Br3]3 (III). Показано, что образующийся в аналогичных условиях кислый бромовисмутат этилвиологена (EtV2+) [H3O][EtV][BiBr6] · 1.34H2O (IV) имеет отличный состав. Термическое разложение II приводит к образованию однофазного [MV][BiBr5], обладающего низким значением оптической ширины запрещенной зоны. Проведено сравнение электрохимических характеристик I и близкого ему по составу иодовисмутата [MV]3[Bi2I11]I.
ВВЕДЕНИЕ
В последние годы большое внимание исследователей привлекает химия органических-неорганических гибридных соединений [1–4]. Существенное внимание уделяется изучению гибридных галовисмутатов [5–7], обладающих полупроводниковыми и пьезоэлектрическими свойствами, а также характерными для данного класса соединений фотохромизмом, термохромизмом и люминесценцией [8–12]. Одни из наиболее изучаемых галовисмутатов – галовисмутаты метилвиологена (MV2+). Хлоровисмутаты метилвиологена характеризуются фотохромизмом [9, 13, 14]. Иодовисмутат [MV][BiI5] [15] и смешанные галовисмутаты метилвиологена [MV][BiCl2I3] [16] и [MV][BiBr3.8I1.2] [17] имеют необычные оптические свойства, связанные с аномально низкими значениями оптической ширины запрещенной зоны (Eg). Узкая энергетическая щель между валентной зоной 5p I и зоной проводимости 6p Bi, связанная с наличием в кристаллической структуре этих соединений линейных цепей с транс-транс-расположением атомов Bi–I–Bi–I [18], обусловливает их черную окраску и потенциальную возможность использования этих соединений в качестве светопоглощающих материалов в солнечной энергетике. Ранее [19] нами был предложен способ нанесения [MV][BiI5] на оксидные подложки, основанный на термическом разложении сольвата [MV]3[Bi2I9]2 · 3DMF · H2O, кристаллизующегося из раствора ДМФА/H2O.
Среди галовисмутатов метилвиологена, содержащих атомы галогена одного вида, наиболее изучены хлоровисмутаты. Известно 12 соединений, в которых отношение MV : Bi изменяется от 3 : 2 до 2 : 3 [9, 13, 14, 17, 20]. Среди иодовисмутатов метилвиологена структурно охарактеризованы четыре соединения с отношением MV : Bi от 3 : 2 до 3 : 4 [15, 19, 21]. И, наконец, известны два полиморфа [MV][BiBr5] [22]. В рамках данной работы мы изучили условия получения новых бромовисмутатов метилвиологена из водных и диметилформамидных растворов, а также их свойства для определения возможности применения этих соединений в качестве прекурсоров для получения [MV][BiBr5].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез [MV]I2. К раствору 4,4'-бипиридина (25.0 г, 0.160 моль, Aldrich, 98%) в 50 мл этанола добавляли CH3I (19.6 мл, 0.315 моль, Sigma-Aldrich, чистота ≥99%) и оставляли перемешиваться в течение суток в закрытом сосуде при комнатной температуре. Образовавшийся осадок отфильтровывали под вакуумом, промывали спиртом и высушивали на воздухе. Выход 62.6 г (90%). 1H ЯMR (D2O, 600 MГц), δ, ppm: 9.06 (d, 4H, Py), 8.54 (d, 4H, Py), 4.51 (s, 6H, CH3).
Синтез [MV]Br2. К раствору [MV]I2 (4.50 г, 10.2 ммоль) в 20 мл H2O добавляли при тщательном перемешивании AgBr (4.98 г, 26.4 ммоль). Выпавший оранжево-красный осадок отфильтровывали, а оставшийся раствор [MV]Br2 упаривали до образования сухого [MV]Br2. Выход 1.70 г (48%).
Синтез I. К раствору [MV]Br2 (1.67 г, 4.83 ммоль) и KBr (6.00 г, 50.4 ммоль) в 30 мл H2O приливали раствор Bi(NO3)3 · 5H2O (0.780 г, 1.61 ммоль) и KBr (4.00 г, 33.6 ммоль) в 7 мл H2O. Выпавший оранжевый осадок [MV]3[BiBr6]2 · 2H2O (I) отфильтровывали под вакуумом, промывали этиловым спиртом и высушивали на воздухе. Выход 1.43 г (45%). Монокристаллы I получены при высыхании раствора, содержащего [MV]Br2 (0.25 г, 0.72 ммоль) и BiBr3 (0.43 г, 0.96 ммоль) в 15 мл смеси ДМФА и H2O, взятых в соотношении 2 : 1. Показано (рис. S1 ), что продукт, образующийся из смеси ДМФА и H2O, в отличие от продукта, выпадающего из водного раствора (рис. S2 ), неоднофазный и содержит неидентифицированную примесь.
Кристаллы II и III (минорная фаза) получены при взаимодействии I (0.50 г, 0.25 ммоль) с 7 мл концентрированной HBr при 90°С с последующим охлаждением раствора до комнатной температуры и выдерживанием его на воздухе практически до полного высыхания.
Кристаллы IV отобраны из продукта взаимодействия раствора [EtV]I2 (0.70 г, 1.50 ммоль) в 10 мл H2O, подкисленного HBr до pH 1, с раствором Bi(NO3)3 · 5H2O (0.780 г, 1.61 ммоль) и KBr (4.00 г, 33.6 ммоль) в 10 мл H2O.
Рентгеноструктурный анализ (РСА). Экспериментальные данные для соединений I–IV получены на дифрактометре Bruker SMART APEX3 (λ(MoKα), графитовый монохроматор) (табл. 1 ). Поглощение I–IV учтено полуэмпирическим методом по эквивалентам (программа SADABS [23]). Псевдомероэдрическое и центросимметричное двойникование в структуре III (два параметра ромбической ячейки практически одинаковы, соотношение доменов 0.30 : 0.28 : 0.22 : 0.20) приводит к невозможности корректного учета поглощения. Структуры определены комбинацией прямого метода и синтезов Фурье. Величины заселенностей разупорядоченных фрагментов получены при изотропном уточнении структур с фиксированными тепловыми параметрами разупорядоченных атомов и в последующих расчетах не уточнялись. Структуры I, II и IV уточнены полноматричным анизотропным МНК. В структуре III анизотропно уточнены лишь атомы Bi и Br. Атомы водорода частично локализованы из разностных синтезов Фурье, частично рассчитаны из геометрических соображений. Все расчеты выполнены по программам SHELXS и SHELXL [24]. Экспериментальные данные для структур I–IV депонированы в Кембриджском банке структурных данных (CCDC 1982671–1982674).
Таблица 1.
Основные кристаллографические данные и результаты уточнения структур I–IV
| Параметр | I | II | III | IV |
|---|---|---|---|---|
| Формула | C36H46Bi2Br12N6O2 | C12H28BiBr7N2O6 | C18H21BiBr9N3 | C14H23.68BiBr6N2O2.34 |
| М | 1971.67 | 1064.71 | 1207.55 | 945.91 |
| T, K | 296(2) | 294(2) | 296(2) | 120(2) |
| Сингония | Триклинная | Тетрагональная | Ромбическая | Моноклинная |
| Пр. гр., Z | P$\bar {1}$, 1 | P$\bar {4}$n2, 2 | Pmn21, 4 | P21/c, 4 |
| a, Å | 8.1691(5) | 9.6292(3) | 21.0339(8) | 18.9675(11) |
| b, Å | 12.4871(7) | 9.6292(3) | 12.0033(4) | 9.8611(6) |
| c, Å | 13.3837(8) | 15.1101(5) | 12.0068(4) | 14.0499(9) |
| α, град | 88.139(2) | 90 | 90 | 90 |
| β, град | 82.580(2) | 90 | 90 | 103.362(2) |
| γ, град | 76.417(2) | 90 | 90 | 90 |
| V, Å3 | 1315.95(14) | 1401.03(10) | 3031.43(18) | 2556.8(3) |
| Dх, г/см3 | 2.488 | 2.524 | 2.646 | 2.457 |
| μ, мм–1 | 15.823 | 16.301 | 17.692 | 16.285 |
| F(000) | 906 | 980 | 2192 | 1734 |
| Размер образца, мм | 0.12 × 0.10 × 0.04 | 0.24 × 0.24 × 0.20 | 0.38 × 0.32 × 0.02 | 0.26 × 0.22 × 0.20 |
| Интервал θ, град | 2.271, 30.080 | 2.508, 30.497 | 2.399, 28.309 | 2.207, 28.282 |
| Пределы h, k, l | –11 ≤ h ≤ 11 | –13 ≤ h ≤ 13 | –28 ≤ h ≤ 28 | –25 ≤ h ≤ 25 |
| –17 ≤ k ≤ 17 | –13 ≤ k ≤ 13 | –16 ≤ k ≤ 16 | –13 ≤ k ≤ 13 | |
| –18 ≤ l ≤ 18 | –19 ≤ l ≤ 21 | –16 ≤ l ≤ 16 | –18 ≤ l ≤ 18 | |
| Число измеренных отражений | 28021 | 20946 | 50683 | 58545 |
| Число независимых отражений, Rint | 7738, 0.0487 | 2151, 0.0450 | 8060, 0.0681 | 6349, 0.0667 |
| Полнота до θ = 25.242° | 100.0% | 99.4% | 99.8 | 99.9% |
| Пропускание max, min | 0.0991, 0.0346 | 0.0998, 0.039 | 0.0962, 0.0364 | 0.7458, 0.3488 |
| Число параметров | 7738/0/268 | 2151/0/72 | 8060/41/143 | 6349/90/308 |
| S | 1.006 | 1.057 | 1.507 | 1.289 |
| R1, wR2 [I > 2σ(I)] | 0.0362, 0.0822 | 0.0206, 0.0404 | 0.0752, 0.2039 | 0.0422, 0.1010 |
| R1, wR2 (все данные) | 0.0611, 0.0908 | 0.0294, 0.0428 | 0.0863, 0.2115 | 0.0615, 0.1090 |
| Параметр Флэка | – | –0.038(8) | – | – |
| ∆ρmax/∆ρmin, е/Å3 | 0.887, –0.984 | 0.375, –0.390 | 5.957, –1.538 | 1.672, –1.586 |
Рентгенофазовый анализ (РФА) осуществляли на дифрактометре Bruker D8 Advance (CuKα, позиционно-чувствительный 1D-детектор LynxEye, геометрия на отражение). Диапазон измерений 2θ = 5°–55° для всех образцов. Полнопрофильный анализ порошков проводили с помощью программы TOPAS 4.2 [25]. Уточнение по Ритвельду выполняли с использованием структурных моделей I и CCDC 829529 [22] (рис. S2 ).
Спектры диффузного отражения регистрировали на спектрофотометре Ocean Optics модель QE65000 в диапазоне частот 11 000–50 000 см–1 при комнатной температуре. Спектры были перестроены в координатах функция Кубелки–Мунка [26]–энергия квантов света. Для получения функции Кубелки–Мунка использовали уравнение:
где F(Rd) – абсолютное отражение слоя образца. Ширину запрещенной зоны оценивали экстраполяцией линейной части соответствующей кривой на F(Rd) = 0.Термогравиметрический анализ образцов проводили с помощью теплоанализатора SDT Q600 V8.3 Build 101 Module DSC-TGA. Образец нагревали со скоростью 10 град/мин от 25 до 320°C с потоком воздуха 250 мл/мин в открытой алюминиевой посуде.
Спектры 1Н ЯМР регистрировали на спектрометре Bruker Avance-III (600.31 МГц) в D2O при 303 K.
Электрохимические измерения проводили в трехэлектродной ячейке, содержащей платиновую пластинку в качестве вспомогательного электрода и пластинку FTO с нанесенной пастой из графитового порошка (30 мг), соединения I (20 мг) и нафьона (10 мкл) в качестве рабочего электрода. Площадь рабочей поверхности электрода составляла 0.7 см2. Электрод сравнения (Ag/AgCl, KClнас) был помещен в насыщенный раствор KCl, а контакт с основным раствором осуществлялся с помощью солевого мостика. Измерения проводили в 0.1 М фосфатном буферном растворе с рН 7.5. Скорость сканирования потенциала составляла 50 мВ/с.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
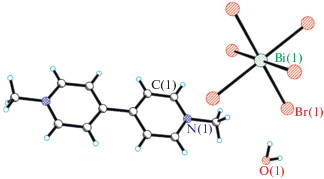
При взаимодействии водных растворов [MV]Br2 и бромовисмутата калия (раствор, содержащий Bi(NO3)3 и KBr) в мольном соотношении 3 : 1 (MV2+ : Bi3+) образуется мелкокристаллический однофазный (по данным РФА, рис. S2a ) продукт I. Детали уточнения по Ритвельду: пр. гр. $P\bar {1},$ a = 8.1771(2), b = 12.5077(3), c = 13.3979(4) Å, α = 88.302(2)°, β = 82.765(2)°, γ = 76.270(2)°, Rexp = = 1.28%, Rwp = 3.75%, Rp = 2.88%, GOF = 2.94. Монокристаллы I получены при высыхании на воздухе раствора BiBr3 и MVBr2 в смешанном растворителе ДМФА/H2O. Структура I представлена кристаллографически независимыми катионами MV2+ и двумя анионами [BiBr6]3– с кристаллографической симметрией –1 (рис. 1). Кратчайший контакт Br…Br (3.75 Å) связывает анионы в 1D-цепочку. Соединение I изоструктурно [MV]3[BiCl6]2 · 2H2O [20].
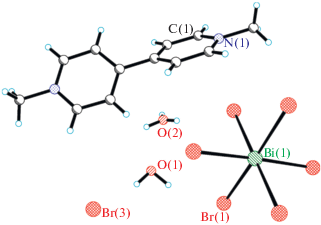
Взаимодействие I с концентрированной HBr приводит к выделению бесцветных кристаллов II в качестве основной фазы. Структура II образована катионами [MV]2+ и H3O+, анионами [BiBr6]3–, Br– и молекулами кристаллизационной воды (рис. 2). Хотя объективно локализовать все атомы H иона H3O+ не удалось (ион разупорядочен вокруг оси 2), расстояния O(2)…O (2.65 Å) и O(2)…Br (3.07 Å) позволяют однозначно выбрать расположение H2O и H3O+. Атом Bi аниона [BiBr6]3– находится в особой точке оси –4, катион MV2+ обладает кристаллографической симметрией 222. Кратчайший контакт Br…Br равен 4.14 Å.
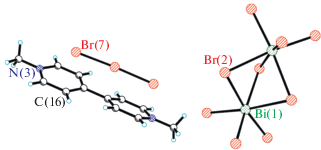
Наряду с фазой II обнаружена также минорная фаза III, образовавшаяся, по-видимому, в результате присутствия небольшого количества Br2 в HBr. Структура III содержит катионы [MV]2+, анионы [Bi2Br9]3– и Br3– (рис. 3). Один из двух кристаллографически независимых катионов разупорядочен около плоскости m. Кратчайшие контакты Br…Br (3.83–3.96 Å) образованы между атомами Br анионов разного типа.
Соединение II нестабильно при выдерживании на воздухе. Бесцветные кристаллы II медленно изменяют свою окраску на красную при комнатной температуре. По данным ТГА (рис. S3 ), соединение II начинает разлагаться при комнатной температуре и имеет максимальную скорость разложения при 110°С. Потеря массы отвечает потере двух молекул HBr и шести молекул H2O (теоретическая потеря массы – 25.35%; наблюдаемая потеря массы – 25.02%) согласно уравнению:
Полученное при разложении II соединение, стабильное до 285°С, является, по данным РФА, бромовисмутатом метилвиологена [MV][BiBr5] (рис. S2 б) [22]. Детали уточнения по Ритвельду: пр. гр. P21/c, a = 5.8626(1), b = 16.2766(4), c = = 10.3915(3) Å, β = 100.656(2)°, Rexp = 1.31%, Rwp = = 2.78%, Rp = 2.19%, GOF = 2.12. Значение оптической ширины запрещенной зоны (Eg) полученного [MV][BiBr5] составляет 2.12 эВ (рис. S4 а), что на ∼0.7 эВ ниже значений Eg для островных бромовисмутатов, не содержащих катионов, обладающих высоким сродством к электрону, и ниже значения для соединения I (Eg = 2.35 эВ) (рис. S4 б). Cтоль низкие значения ширины запрещенной зоны характерны для всех соединений с линейными 1D-анионами $[{\text{Bi}}{{{\text{X}}}_{{\text{5}}}}]_{n}^{{{\text{2}}n--}}$ [15–18, 27]. Возможность получения [MV][BiBr5] из сольвата II наряду с ранее обнаруженной возможностью получения [MV][BiI5] из сольвата [MV]3[Bi2I9]2 · 3DMF · H2O открывает перспективы для нанесения галовисмутатов на оксидные подложки в качестве светопоглощающих материалов.
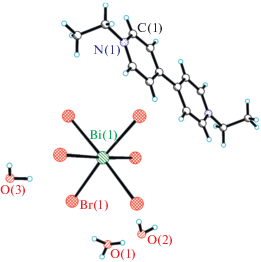
Нами была предпринята попытка получить кислый бромовисмутат этилвиологена (Et – этилвиологен), аналогичный кислому бромовисмутату метилвиологена. Был выделен плохо закристаллизованный образец, содержащий кристаллы кислого бромовисмутата [H3O][EtV][BiBr6] · 1.34H2O (IV). В структуре IV оба кристаллографически независимых катиона этилвиологена EtV2+ имеют симметрию –1 (в одном из них этиловый фрагмент разупорядочен в соотношении 0.70 : 0.30), анион [BiBr6]3– разупорядочен в соотношении 0.81 : 0.19, заселенность позиций атомов O катионов H3O+ и кристаллизационных молекул H2O равна 0.81, 0.72, 0.81 (рис. 4). Около атома O(1) (заселенность 0.81) однозначно локализованы три позиции атомов H. Таким образом, позиции O(2,3) (одна из них или обе) частично заселены ионом оксония. Полученное соединение медленно разлагается при комнатной температуре. Образование при этом продуктов с низкими величинами Eg не наблюдается.
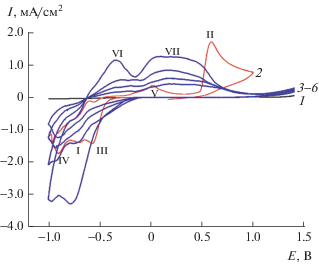
Электрохимическое поведение I, нанесенного в виде пасты на графитовый электрод, в фосфатном буферном растворе близко к наблюдавшемуся для иодовисмутатов метилвиологена, в частности для [MV]3[Bi2I11]I [16], но имеет свои отличия. В области потенциалов от –0.5 до –1.0 В наблюдаются три пика восстановления (I, III и IV на рис. 5). Эти пики для [MV]3[Bi2I11]I отнесены [16] к пикам восстановления висмута и метилвиологена. Особенностью циклических вольтамперограмм I является более раннее начало восстановления (пик III, –0.2 В) по сравнению с [MV]3[Bi2I11]I (–0.45 В). На кривой окисления наблюдаются выраженные пики неправильной формы (VI и VII) в той же области потенциалов, что и пик V для [MV]3[Bi2I11]I. Окисление I происходит при потенциалах более +1.0 В, и в этом отношении он значительно устойчивее иодовисмутата, который окисляется уже при потенциале +0.5 В (пик II, рис. 5). В процессе циклирования I происходит значительное уменьшение токов, по-видимому, связанное с его электрохимическим разложением при восстановлении.
ЗАКЛЮЧЕНИЕ
Получены и структурно охарактеризованы четыре новых гибридных бромовисмутата виологенов. Соединение I изоструктурно хлоровисмутату метилвиологена [MV]3[BiCl6]2 · 2H2O. В структуре III обнаружены полибромид-анионы ${\text{Br}}_{3}^{ - }$ и анионы [Bi2Br9]3–. Установлено, что разложение кислого бромовисмутата-бромида II приводит к образованию ранее известного бромовисмутата [MV][BiBr5] с относительно низким значением оптической ширины запрещенной зоны. Аналогичные продукты при разложении кислого бромовисмутата этилвиологена IV не обнаружены. Принципиальная возможность получения галовисмутатов метилвиологена в результате термического разложения прекурсоров [16] и показанная в данной работе возможность получения в результате термического разложения прекурсора однофазного бромовисмутата [MV][BiBr5] открывают перспективы для нанесения галовисмутатов с низкими значениями ширины запрещенной зоны на оксидные подложки. В то же время реальные методики нанесения светопоглощающих слоев из гибридных галовисмутатов отсутствуют, что требует дальнейших исследований в этой области.
Список литературы
Correa-Baena J.-P., Abate A., Saliba M. et al. // Energy Environ. Sci. 2017. V. 10. № 3. P. 710. https://doi.org/10.1039/C6EE03397K
Semenova A.A., Tarasov A.B., Goodilin E.A. // Mendeleev Commun. 2019. V. 29. № 5. P. 479. https://doi.org/10.1016/j.mencom.2019.09.001
Yan K.Y., Long M.Z., Zhang T.K. et al. // JACS. 2015. V. 137. № 13. P. 4460. https://doi.org/10.1021/jacs.5b00321
Zhidkova M.N., Aysina K.E., Kotov V.Y. et al. // Electrochim. Acta. 2016. V. 219. P. 673. https://doi.org/10.1016/j.electacta.2016.10.065
Adonin S.A., Sokolov M.N., Fedin V.P. // J. Struct. Chem. 2019. V. 60. № 10. P. 1655. https://doi.org/10.1134/S0022476619100111
Buikin P.A., Rudenko A.Y., Ilyukhin A.B. et al. // Russ. J. Coord. Chem. 2020. V. 46. № 2. P. 111. https://doi.org/10.1134/S1070328420020049
Buikin P.A., Rudenko A.Y., Baranchikov A.E. et al. // Russ. J. Coord. Chem. 2018. V. 44. № 6. P. 373. https://doi.org/10.1134/s1070328418060015
García-Fernández A., Marcos-Cives I., Platas-Iglesias C. et al. // Inorg. Chem. 2018. V. 57. № 13. P. 7655. https://doi.org/10.1021/acs.inorgchem.8b00629
Leblanc N., Bi W., Mercier N. et al. // Inorg. Chem. 2010. V. 49. № 13. P. 5824. https://doi.org/10.1021/ic901525p
Lin R.-G., Xu G., Wang M.-S. et al. // Inorg. Chem. 2013. V. 52. № 3. P. 1199. https://doi.org/10.1021/ic301181b
Piecha-Bisiorek A., Mencel K., Kinzhybalo V. et al. // CrystEngComm. 2018. V. 20. № 15. P. 2112. https://doi.org/10.1039/C8CE00140E
Jakubas R., G$\mathop a\limits_, $gor A., Winiarski M.J. et al. // Inorg. Chem. 2020. V. 59(6). P. 3417. https://doi.org/10.1021/acs.inorgchem.9b03193
Xu G., Guo G.-C., Wang M.-S. et al. // Angew. Chem. Int. Ed. 2007. V. 46. № 18. P. 3249. https://doi.org/10.1002/anie.200700122
Leblanc N., Allain M., Mercier N. et al. // Cryst. Growth Des. 2011. V. 11. № 6. P. 2064. https://doi.org/10.1021/cg2003244
Chen Y., Yang Z., Guo C.X. et al. // Eur. J. Inorg. Chem. 2010. № 33. P. 5326. https://doi.org/10.1002/ejic.201000755
Leblanc N., Mercier N., Zorina L. et al. // JACS. 2011. V. 133. № 38. P. 14924. https://doi.org/10.1021/ja206171s
Leblanc N., Mercier N., Allain M. et al. // J. Solid State Chem. 2012. V. 195. P. 140. https://doi.org/10.1016/j.jssc.2012.03.020
Kotov V.Y., Ilyukhin A.B., Korlyukov A.A. et al. // New J. Chem. 2018. V. 42. № 8. P. 6354. https://doi.org/10.1039/c7nj04948j
Buikin P.A., Ilyukhin A.B., Simonenko N.P. et al. // Polyhedron. 2018. V. 154. P. 430. https://doi.org/10.1016/j.poly.2018.08.017
Blachnik R., Jaschinski B., Reuter H. et al. // Z. Kristallogr. 1997. V. 212. № 12. P. 874. https://doi.org/10.1524/zkri.1997.212.12.874
Wang P., Chen Z.-R., Li H.-H. // J. Cluster Sci. 2020. V. 31. P. 943. https://doi.org/10.1007/s10876-019-01699-1
Bi W.H., Leblanc N., Mercier N. et al. // Chem. Mater. 2009. V. 21. № 18. P. 4099. https://doi.org/10.1021/cm9016003
Sheldrick G.M. // SADABS, Göttingen (Germany): Univ. of Göttingen, 1997.
Sheldrick G.M. // Acta Crystallogr., Sect. C. 2015. V. 71. P. 3. https://doi.org/10.1107/s2053229614024218
Caelho A. // TOPAS 4.2, Bruker AXS GmbH, Karlsruhe, Germany, 2009.
Kubelka P., Munk F. // Z. Tech. Phys. 1931. V. 12. P. 593.
Adonin S.A., Gorokh I.D., Novikov A.S. et al. // Chem. Eur. J. 2017. V. 23. № 62. P. 15612. https://doi.org/10.1002/chem.201703747
Дополнительные материалы
- скачать ESM.docx
- Fig. S1. XRD pattern of I (from DMF/H2O)
Fig. S2. X-ray Rietveld refinement profiles for I (from H2O) and [MV][BiBr5]
Fig. S3. DSC-TGA curves for II
Fig. S4. The reflectance spectra of [MV][BiBr5] and I
- скачать I.cif
- Доп. материалы 1
- скачать II.cif
- Доп. материалы 2
- скачать III.cif
- Доп. материалы 3
- скачать IV.cif
- Доп. материалы 4
Инструменты
Журнал неорганической химии