Журнал неорганической химии, 2021, T. 66, № 12, стр. 1679-1683
Исследование процесса протонирования монокарбонильного производного клозо-декаборатного аниона [B10H9CO]–
И. Н. Клюкин a, *, А. В. Колбунова a, b, Н. А. Селиванов a, А. Ю. Быков a, А. П. Жданов a, К. Ю. Жижин a, Н. Т. Кузнецов a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
b Национальный исследовательский университет “Высшая школа экономики”
101000 Москва, ул. Мясницкая, 20, Россия
* E-mail: klukinil@gmail.com
Поступила в редакцию 10.05.2021
После доработки 31.05.2021
Принята к публикации 03.06.2021
Аннотация
В настоящее время химия карбонильных производных клозо-боратных анионов активно развивается. Большой интерес представляет получение протонированных комплексов данных типов кластеров для дальнейшей направленной функционализации. Целью настоящего исследования была разработка подхода к получению протонированного комплекса монокарбонильного производного общего вида [B10H9CO ⋅ Hfac]0. В ходе работы целевой комплекс был получен путем протонирования аниона [B10H9CO]– избытком трифторметансульфониевой кислоты CF3SO3OH. В данной реакции борный кластер протонируется количественно. При добавлении основания процесс протонирования становится обратимым.
ВВЕДЕНИЕ
В настоящее время основным подходом к получению замещенных производных клозо-боратных анионов являются процессы на основе реакций электрофильно-индуцируемого нуклеофильного замещения [1–4]. В качестве электрофильных индукторов могут выступать кислоты Бренстеда или Льюиса [5–9]. При этом в случае клозо-декаборатного аниона можно наблюдать устойчивые промежуточные интермедиаты общего вида [B10H10 ⋅ E]– и [B10H10 ⋅ 2E]0 [10]. Указанные интермедиаты интенсивно изучались теоретически и экспериментально. Наиболее подробно рассмотрена структура и свойства ундекагидро-клозо-декаборатного аниона [B10H11]– [11]. Изучена его структура в кристаллической фазе и в растворе, а также проведены квантово-химические расчеты [12]. Установлено, что в данном анионе при температурах ниже –90°С дополнительный протон локализуется на одной из граней полиэдрического остова, а при повышении температуры – на одном из экваториальных поясов клозо-декаборатного аниона. При большем нагревании происходит миграция дополнительного атома водорода между экваториальными поясами.
Использование суперкислот, таких как трифторметансульфониевая кислота (CF3SO3H), позволяет дважды протонировать клозо-декаборатный анион [13]. При этом можно также протонировать зарядопониженные замещенные производные клозо-декаборатного аниона. Это обстоятельство позволяет получать дизамещенные производные указанного кластера, в том числе и с двумя различными экзополиэдрическими заместителями [14].
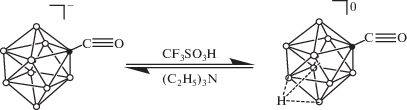
В настоящее время активно изучаются производные клозо-боратных анионов с экзополиэдрическими связями B–C [15–18]. Наиболее хорошо изученными являются монокарбонильные производные общего вида [BnHn–1CO]–, где n = 10, 12 [19–21]. Для данных соединений в наибольшей степени исследованы процессы нуклеофильного присоединения, тогда как процессы введения второго экзополиэдрического заместителя с помощью процессов электрофильно-индуцируемого нуклеофильного замещения подробно не изучены. В настоящей работе исследованы процессы протонирования монокарбонильного производного клозо-декаборатного аниона [B10H9CO]–, подобраны оптимальные условия для получения интермедиата [B10H9CO ⋅ Hfac]0, а также проведена оценка его устойчивости и возможности выступать в качестве синтона для получения бифункциональных производных, содержащих экзополиэдрическую карбонильную группу.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Спектры ЯМР 11B растворов исследуемых веществ в CD2Cl2 и С4D8O записывали на спектрометре Bruker Avance II-300 на частоте 96.32 МГц с внутренней стабилизацией по дейтерию. В качестве внешнего стандарта использовали эфират трехфтористого бора. Исследования выполнены с использованием оборудования ЦКП ФМИ ИОНХ РАН, функционирующего при поддержке государственного задания ИОНХ РАН в области фундаментальных научных исследований.
Протонирование аниона [2-B10H9CO]–. К раствору 50 мг (12 ммоль) ((C4H9)4N)[2-B10H9CO] в 1 мл дейтерированного дихлорметана CD2Cl2 в атмосфере сухого аргона добавляли 0.035 мл (40 ммоль) CF3SO3OH. Полученную смесь выдерживали в течение 10 мин при комнатной температуре. Спектр ЯМР 11B-{1H} (CD2Cl2, м.д.): 26.5 (д, 1B, Bап), –13.7 (д, 1B, Bап), –16.2 (д, 2B, Bэкв), –17.8 (д, 1B, Bэкв), –24.5 (д, 4B, Bэкв), –40.9 (с, 1B, Bзам).
Протонирование аниона [B10H10]2–. К суспензии 50 мг (13 ммоль) (Cs)2[B10H10] в 1 мл дейтерированного тетрагидрофурана С4D8O в атмосфере сухого аргона добавляли 0.035 мл (40 ммоль) CF3SO3OH. Образовавшийся осадок трифлата цезия CsCF3SO3 отфильтровывали. Полученную смесь выдерживали в течение 10 мин при комнатной температуре. Спектр ЯМР 11B-{1H} (C4D8O, м.д.): –23.7 (д, 10B, Bэкв).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
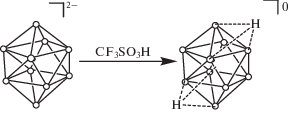
Для получения протонированного комплекса [B10H9CO ⋅ Hfac]0 было использовано несколько подходов. Методика получения ундекагидро-клозо-декаборатного аниона [B10H11]–, основанная на протонировании аниона [B10H10]2– смесью уксусной и трифторуксусной кислот, не приводит к образованию целевого комплекса. В данном случае для образования соответствующего комплекса с дополнительным атомом водорода использовали трифторметансульфониевую кислоту CF3SO3OH (рис. 1).
Рис. 1.
Обратимое протонирование монокарбонильного производного клозо-декаборатного аниона [B10H9CO]–.
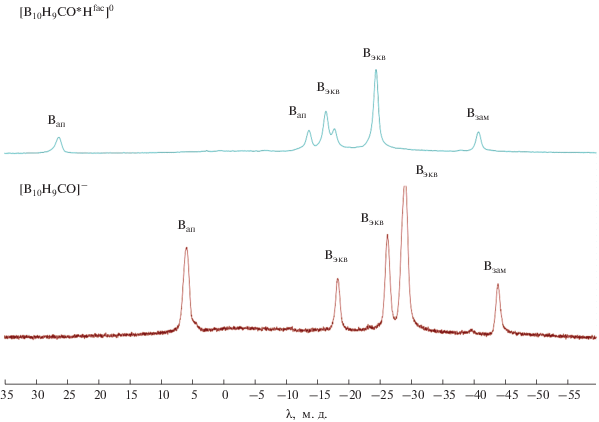
Контроль за ходом процесса осуществляли с помощью 11B ЯМР-спектроскопии (рис. 2). Процесс протонирования монокарбонильного производного клозо-декаборатного аниона происходит в среде дихлорметана при комнатной температуре. Так, в спектре исходного аниона присутствуют сигналы при 5.9 м.д. от двух атомов бора, находящихся в апикальных позициях борного кластера c интегральной интенсивностью I = 2, группа сигналов от атомов экваториального пояса при –18.3 c I = 1, –26.3 c I = 2 и –29.1 м.д. c I = 4 и сигнал от атома бора, связанного с замещенной карбонильной группой, при –44 м.д. c I = 1, тогда как в спектре протонированного комплекса [B10H9CO ⋅ Hfac]0 наблюдается иная картина. Сигнал от атома бора, связанного с карбонильной группой, смещается на 3 м.д. в слабое поле и проявляется при 41 м.д. Аналогично аниону [B10H11]– сигнал от одной из апикальных позиций смещается в слабое поле и проявляется при 27.1 м.д. Атомы экваториального пояса расщепляются на большее количество неэквивалентных между собой атомов и проявляются в виде группы сигналов при –11.9, –13.7, –16.4, –17.8, –24.5 м.д.
Рис. 2.
11B-{1H} ЯМР-спектры монокарбонильного производного клозо-декаборатного аниона [B10H9CO]– и его протонированного аналога [B10H9CO ⋅ Hfac]0.
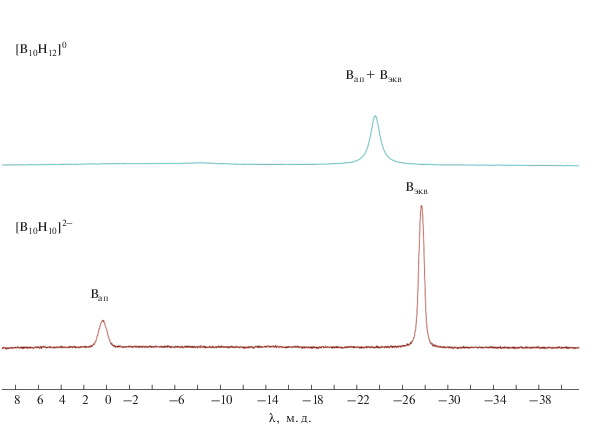
Полученный комплекс [B10H9CO ⋅ Hfac]0 устойчив в дихлорметане CH2Cl2, однако после нескольких дней выдержки при комнатной температуре наблюдаются процессы деструкции с раскрытием клозо-остова. Такое поведение сильно отличается от процесса протонирования клозо-декаборатного аниона [B10H10]2– трифторметансульфониевой кислотой (CF3SO3OH) в среде дихлорметана (рис. 3). В данном случае происходит деструкция борного кластера с образованием замещенных нидо-боранов. Наиболее предпочтительным растворителем для получения [B10H12]0 являются циклические простые эфиры, в частности, тетрагидрофуран. При этом, по данным 11B ЯМР-спектров, образуется дипротонированный анион [B10H10 ⋅ 2Hfac]0 (рис. 4). В настоящей работе мы модифицировали подход к получению [B10H10 ⋅ ⋅ 2Hfac]0. Использование цезиевой соли клозо-декаборатного аниона Cs2[B10H10] позволяет легко избавиться от катионов цезия, так как трифлат цезия CsCF3SO3 нерастворим в тетрагидрофуране C4H8O, в отличие от трифлата тетрабутиламония Bu4NCF3SO3.
Рис. 4.
11B-{1H} ЯМР-спектр клозо-декаборатного аниона [B10H10]2– и его дипротонированного аналога [B10H12]0.
Следует отметить, что процесс протонирования [B10H9CO]– носит обратимый характер. Так, добавление триэтиламина (C2H5)3N в реакционную смесь приводит к образованию исходного монокарбонильного производного. Это служит дополнительным доказательством того, что в данном случае происходят именно процессы протонирования клозо-декаборатного аниона, а не процессы раскрытия кластерного остова с образованием нидо-структур.
ЗАКЛЮЧЕНИЕ
Предложен подход к получению протонированного комплекса [B10H9CO ⋅ Hfac]0 монокарбонильного производного клозо-декаборатного аниона. Данный подход основан на протонировании [B10H9CO]– избытком трифторметансульфониевой кислоты CF3SO3OH. При этом борный кластер протонируется количественно. Процесс протонирования носит обратимый характер, добавление основания в реакционную смесь приводит к образованию исходного монокарбонильного производного.
Список литературы
Mu X., Axtell J.C., Bernier N.A. et al. // Chem. 2019. V. 5. № 9. P. 2461. https://doi.org/10.1016/j.chempr.2019.07.018
Avdeeva V.V., Malinina E.A., Zhizhin K.Y. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 4. P. 514. https://doi.org/10.1134/S0036023620040026
Ali F., Hosmane N.S., Zhu Y. // Molecules. 2020. V. 25. № 4. P. 1. https://doi.org/10.3390/molecules25040828
Jelinek T., Štibr B., Mareš F. et al. // Polyhedron. 1987. V. 6. № 9. P. 1737. https://doi.org/10.1016/S0277-5387(00)86544-4
Laila Z., Yazbeck O., Ghaida F.A. et al. // J. Organomet. Chem. 2020. V. 910. P. 121132. https://doi.org/10.1016/j.jorganchem.2020.121132
Stogniy M.Y., Erokhina S.A., Sivaev I.B. et al. // Phosphorus, Sulfur Silicon Relat. Elem. 2019. V. 194. № 10. P. 983. https://doi.org/10.1080/10426507.2019.1631312
Naoufal D., Bonnetot B., Mongeot H. // Appl. Organomet. Chem. 2003. V. 17. № 4. P. 244. https://doi.org/10.1002/aoc.424
Sivaev I.B., Bregadze V.I., Sjöberg S. // Collect. Czechoslov. Chem. Commun. 2002. V. 67. № 6. P. 679. https://doi.org/10.1135/cccc20020679
Jankowiak A., Baliński A., Harvey J.E. et al. // J. Mater. Chem. C. 2013. V. 1. № 6. P. 1144. https://doi.org/10.1039/c2tc00547f
Klyukin I.N., Kubasov A.S., Limarev I.P. et al. // Polyhedron. 2015. V. 101. P. 215. https://doi.org/10.1016/j.poly.2015.09.025
Shore S.G., Hamilton E.J.M., Bridges A.N. et al. // Inorg. Chem. 2003. V. 42. № 4. P. 1175. https://doi.org/10.1021/ic020540s
Kochnev V.K., Avdeeva V.V., Malinina E.A. et al. // Russ. J. Inorg. Chem. 2014. V. 59. № 7. P. 706. https://doi.org/10.1134/S0036023614070079
Hawthorne M.F., Mavunkal I.J., Knobler C.B. // J. Am. Chem. Soc. 1992. V. 9. № 2. P. 4427.
Ezhov A.V., Vyal’ba F.Y., Kluykin I.N. et al. // Macroheterocycles. 2017. V. 10. № 4–5. P. 505. https://doi.org/10.6060/mhc171254z
Abi-ghaida F., Laila Z., Ibrahim G. // Dalton Trans. 2014. P. 13087. https://doi.org/10.1039/c4dt00772g
Diab M., Mateo A., Al Cheikh J. et al. // Dalton Trans. 2020. V. 49. № 15. P. 4685. https://doi.org/10.1039/C9DT04676C
Klyukin I.N., Novikov A.S., Zhdanov A.P. et al. // Mendeleev Commun. 2020. V. 30. № 1. P. 88. https://doi.org/10.1016/j.mencom.2020.01.029
Klyukin I.N., Novikov A.S., Zhdanov A.P. et al. // Polyhedron. 2020. V. 187. P. 1. https://doi.org/10.1016/j.poly.2020.114682
Wilbur D.S., Chyan M.K., Hamlin D.K. et al. // Bioconjug. Chem. 2007. V. 18. № 4. P. 1226. https://doi.org/10.1021/bc060345s
Wilbur D.S., Chyan M., Nakamae H. et al. // Bioconjug. Chem. 2012. V. 23. P. 409.
Shelly K., Knobler C.B., Hawthorne M.F. // Inorg. Chem. 1992. V. 31. № 13. P. 2889. https://doi.org/10.1021/ic00039a041
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии