Журнал неорганической химии, 2021, T. 66, № 12, стр. 1672-1678
Твердый раствор Ti0.8B0.1P0.1O2 со структурой анатаза
М. Н. Смирнова a, *, М. А. Копьева a, Г. Е. Никифорова a, А. Д. Япрынцев a, Г. Д. Нипан a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: smirnova_macha1989@mail.ru
Поступила в редакцию 20.05.2021
После доработки 10.06.2021
Принята к публикации 14.06.2021
Аннотация
Гомогенный твердый раствор состава Ti1 –x(BP)x/2O2 (0 ≤ х ≤ 0.2) со структурой анатаза получен методом сжигания геля с поливиниловым спиртом. Возможность совместного замещения атомов титана на бор и фосфор в структуре анатаза оценена при исследовании образцов серии Ti1 –x(BP)x/2O2 (0 ≤ х ≤ 1, шаг х = 0.1) методами рентгенофазового анализа и ИК-спектроскопии. На основе полученных данных построена диаграмма системы TiO2–B2O3–P2O5, описывающая фазовые равновесия с участием твердого раствора Ti1 –x(BP)x/2O2 (0 ≤ х ≤ 0.2), Ti5P4O20, TiP2O7, BPO4 и расплава. Анализ спектров поглощения Ti0.9B0.05P0.05O2 и Ti0.8B0.1P0.1O2 в диапазоне 290–1000 нм показал, что эквимолярное введение B и P в анатаз смещает край полосы поглощения в красную область. Определены удельная поверхность, скелетная плотность и размер частиц образца Ti0.8B0.1P0.1O2 со структурой анатаза.
ВВЕДЕНИЕ
Разработка безопасных методов обеззараживания воды, основанных на использовании каталитических систем на основе оксида титана (TiO2), является актуальной задачей современного фотокатализа [1, 2]. Несмотря на высокую востребованность данного подхода, его применение неизбежно связано с образованием в воде токсичных неорганических примесей в результате вымывания каталитических добавок. Теоретический анализ показывает, что проблема может быть решена при двойном замещении Ti в анатазе на B и P [3]. Добавление простых оксидов бора и фосфора [4] не приводит к эффективному фотокатализу в видимой области излучения по сравнению с активностью чистого TiO2 при ультрафиолетовом излучении [5]. Возможность осуществления совместного замещения Ti4+ на B3+ и P5+ в TiO2 экспериментально подтверждена [6, 7], но количественно не исследована. В результате анодного оксидирования титана в органическом электролите, содержащем триэтилборат (C2H5O)3B и трибутилфосфат (C4H9O)3PO, после отжига при 450°C были получены нанотрубки TiO2, допированные 2.57 ат. % B и 2.87 ат. % P (XPS-анализ) [6]. Золь-гель методом при использовании (C3H7O)4Ti, H3BO3 и H3PO4 после отжига ксерогеля при 400, 500, 600 и 700°C получены образцы анатаза, содержащие B и P (XPS-анализ), для которых улучшилась фотокаталитическая активность в видимой части спектра по сравнению с чистым TiO2 [7]. Одинарное замещение на бор в результате золь-гель синтеза с использованием Ti(C4H9O)4 и H3BO3 позволило получить однофазный анатаз при исходном отношении B : Ti = = 0.1, сохранявший гомогенность в интервале температур 400–500°C [8]. В интервале 600–700°C выделялся B2O3, а при 800°C вместо примеси B2O3 образовывалась высокотемпературная модификация TiO2 – рутил [8]. Твердофазный синтез (добавка 5 мол. % B2O3 к TiO2) при 1200°C приводил к образованию гомогенного рутила [9]. Сообщается о получении анатаза золь-гель методом в широком интервале исходных отношений (B : Ti = 0.1–0.8, отжиг при 600°C, появление рутила при 650°C), но XPS-анализ образца B : Ti = = 0.6 показал, что реальное содержание бора составляет 3.48 ат. % [10]. При гомогенном допировании 3 мас. % B оксида титана (золь-гель синтез, отжиг при 500°C) обнаружен концентрационный градиент: в объеме анатаза отношение B : Ti = = 0.068 (метод ICP), а на поверхности – 0.469 (XPS) [11]. В неоднофазном образце 12 мас. % B, содержащем B2O3/H3BO3, отношение B : Ti для анатаза составило 0.273 (ICP) и 0.693 (XPS) [11]. Отношение B : Ti = 0.6 соответствовало исходному (EDX) для гомогенного образца 8 мас. % B–TiO2, полученного золь-гель гидротермальным методом и отожженного при 500°C [12]. При соосаждении с помощью NH4OH из раствора Ti(C4H9O)4 с H3BO3 и отжиге при 500oC образовывалась смесь анатаза и рутила, содержащая до 15 мас. % B [13].
Замещение титана на фосфор в TiO2 осложняется образованием на воздухе соединений TiP2O7 и (TiO)2P2O7 [14] (или Ti2O(PO4)2 [15]), а при низком парциальном давлении кислорода или в атмосфере галогена – Ti5O4(PO4)4, Ti31O24(PO4)24, Ti4O3(PO4)3 и TiPO4 [16]. В результате золь-гель синтеза с Ti(C4H9O)4 и H3PO4 после отжига при 900°C анатаз оставался однофазным для исходного P : Ti = 0.1 (ICP – 0.1061, FTIR – 0.0938, XPS – 0.1992) и переходил в рутил при 1000°C [17]. Более низкие температуры (600oC) позволяли сохранять гомогенность до отношения P : Ti = 0.3 [18]. Однофазный анатаз с отношением P : Ti = 0.1 (прекурсоры Ti(C4H9O)4 и H3PO4) кристаллизовался в результате гидротермального синтеза при 200°C [19]. Введение P в TiO2 позволяет повысить температуру полиморфного перехода анатаз–рутил на сотни градусов [20].
Настоящее исследование нацелено на установление предельного замещения титана на бор и фосфор в TiO2 при сохранении структуры анатаза, а также на оценку возможности использования твердого раствора Ti1 –x(BP)x/2O2 в качестве фотокатализатора.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для получения образцов состава Ti1 – x(BP)x/2O2 (0 ≤ x ≤ 1) в качестве исходных реагентов использовали тетрабутилат титана (C4H9O)4Ti, борную кислоту Н3ВО3 и дигидроортофосфат аммония NH4H2РO4. Рассчитанное количество (C4H9O)4Ti прикапывали к водному раствору смеси Н3ВО3 и NH4H2PO4 и добавляли 2 мл разбавленной азотной кислоты. Полученный раствор приливали к горячему раствору поливинилового спирта. Раствор упаривали досуха, образовавшийся порошок переносили в керамический тигель и прокаливали при 620°С.
Рентгенофазовый анализ порошков выполняли на дифрактометре Bruker Advance D8 (излучение CuKα) в интервале углов 2θ = 10°–70° с шагом сканирования 0.0133°. Обработку результатов проводили с помощью программного пакета Diffrac.eva.
ИК-спектры образцов регистрировали с использованием спектрометра Perkin Elmer Spectrum 65 FT-IR в области 4000–400 см–1 с разрешением 2 см–1.
Элементный CHN-анализ проводили с помощью анализатора серии EA 3000 EuroVector.
Спектры диффузного отражения в диапазоне 200–1000 нм регистрировали с помощью модульной оптической системы Ocean Optics (дейтериево-галогеновый источник DH-2000-BAL, интегрирующая сфера ISP-80-8-R диаметром 80 мм, детектор QE650000). В качестве образца сравнения использовали стандарт WS-1 (Ocean Optics) из политетрафторэтилена.
Удельную поверхность S образцов измеряли методом низкотепературной адсорбции азота с использованием прибора АТХ-06 (Катакон, Россия), основываясь на модели Брунауэра–Эммета–Теллера, пятиточечным методом в диапазоне относительных давлений p/p0 = 0.05–0.25. Образцы дегазировали в токе азота при 200°C в течение 1 ч.
Скелетную плотность определяли с помощью гелиевого пикнометра Thermo Fisher Scientific Pyctomatic ATC (США). Образец помещали в кювету, заполненную гелием. Объем, не занятый атомами гелия, принимался за скелетный объем, и при известной массе образца рассчитывали плотность.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
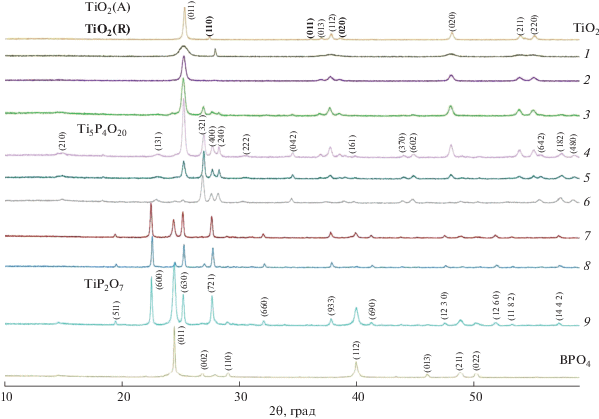
Дифрактограммы образцов Ti1 –x(BP)x/2O2 (0 ≤ ≤ x ≤ 1) представлены на рис. 1. При эквимолярном замещении Ti на B и P ограниченный твердый раствор со структурой анатаза распространяется до состава Ti0.8B0.1P0.1O2, при этом исчезает примесь рутила (рис. 1, кривая 2). Рефлекс около 28o для состава Ti0.9B0.05P0.05O2 (рис. 1, кривая 1), вероятно, связан с образованием сассолина (H3BO3). В интервале составов Ti0.7B0.15P0.15O2–Ti0.5B0.25P0.25O2 наряду с анатазом образуется Ti5P4O20 (рис. 1, кривые 3–6), а для Ti0.4B0.3P0.3O2 появляется примесь BPO4 (рис. 1, кривая 6). В результате дальнейшего замещения Ti0.3B0.35P0.35O2–Ti0.1B0.45P0.5O2 исчезает анатаз, вместо Ti5P4O20 образуется TiP2O7 и увеличивается содержание тетрагональной фазы BPO4 (рис. 1, кривые 7–9), которая, как показали эксперименты, не растворяет в заметных количествах TiO2. При добавлении B2O3 к смеси TiP2O7 и Ti5P4O20 увеличивается содержание фазы Ti5P4O20, что свидетельствует об ограниченной растворимости в ней B2O3 при температуре 620°C.
Рис. 1.
Рентгенофазовый анализ образцов TiO2, BPO4 и Ti1 – x(BP)x/2O2, где 1 – x = 0.9 (1), 0.8 (2), 0.7 (3), 0.6 (4), 0.5 (5), 0.4 (6), 0.3 (7), 0.2 (8), 0.1 (9).
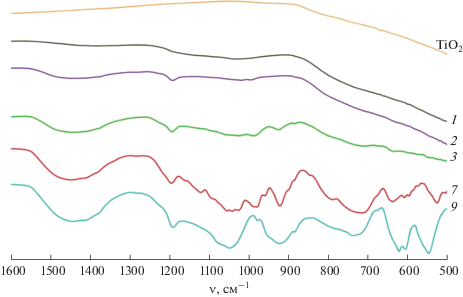
Спектры отдельных образцов в информативной ИК-области пропускания 500–1600 см–1 приведены на рис. 2. В спектрах TiO2 и Ti0.9B0.05P0.05O2 отсутствуют заметные пики (рис. 2, кривая 1). Для Ti0.8B0.1P0.1O2 (рис. 2, кривая 2) появляются пики асимметричных и симметричных валентных колебаний B–O при 1450 и 880 см–1 соответственно, а также пик деформационных колебаний B–O–H при 1190 см–1 [21, 22], сохраняющиеся в спектрах 3, 7 и 9. Пики асимметричных и симметричных валентных колебаний группы PO4 при 1010 и 990 см–1 (рис. 2, кривая 2) [23], начиная с Ti0.7B0.15P0.15O2 (рис. 2, кривая 3), дополняют пик асимметричных валентных колебаний P–O–P при 925 см–1 [17]. В случае Ti0.3B0.35P0.35O2 (рис. 2, кривая 7) асимметричные и симметричные валентные колебания PO4 представлены наборами пиков в интервалах 1020–1160 и 950–1000 см–1, а асимметричным деформационным колебаниям PO4 соответствуют пики из интервала 525–635 см–1 [23]. Кроме того, пик при 1040 см–1 и набор пиков в интервале 700–850 см–1 отвечают колебаниям P–O [17] и непрерывным цепям –Ti–O– в матрице Ti–O–P [17, 23]. В спектре (рис. 2, кривая 9) пики –Ti–O– исчезают и появляются пики, характерные для кристаллического BPO4 (545, 605, 620, 940 и 1080 см–1) [24, 25].
Рис. 2.
ИК-спектры образцов TiO2 и Ti1 – x(BP)x/2O2, где 1 – x = 0.9 (1), 0.8 (2), 0.7 (3), 0.3 (7), 0.2 (8).
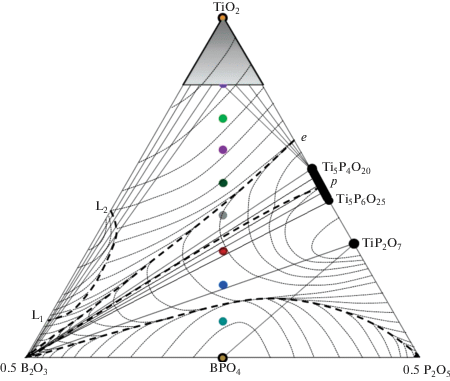
На рис. 3 представлена диаграмма, построенная на основе полученных экспериментальных данных и диаграмм плавкости граничных бинарных систем TiO2–B2O3 [26], TiO2–P2O5 [27] и B2O3–P2O5 [28, 29], описывающая фазовые равновесия в тройной системе TiO2–B2O3–P2O5. В соответствии с экспериментальной триангуляцией область гомогенности твердого раствора со структурой анатаза (залита серым на рис. 3) ограничена линией, связывающей составы Ti0.8B0.2O2–Ti0.8B0.1P0.1O2–Ti0.8P0.2O2. Выше 700°C в результате полиморфного превращения твердый раствор со структурой анатаза TiO2(A) переходит в твердый раствор со структурой рутила TiO2(R), в котором содержание бора и фосфора падает с ростом температуры. Области двухфазных равновесий твердого раствора TiO2 с B2O3 и Ti5P4O20 на рис. 3 заштрихованы. Трехфазное равновесие TiO2–B2O3–Ti5P4O20 при перемещении по ноде TiO2–BPO4 переходит в равновесие B2O3 с фазой переменного состава Ti5P4O20–Ti5P6O25 [27] (заштрихованная область на рис. 3) и последовательно в равновесия Ti5P6O25–B2O3–TiP2O7, TiP2O7–B2O3–BPO4 и TiP2O7–BPO4–P2O5. Все тройные эвтектики системы (три с расплавом на основе B2O3 и одна с расплавом на основе P2O5) являются вырожденными. На рис. 3 тонкими штриховыми изотермическими кривыми представлена схема проекции поверхности ликвидуса на треугольник составов. Поверхность первичной кристаллизации BPO4 ограничена толстой штриховой линией 0.5B2O3–0.5P2O5, поверхность конгруэнтно плавящейся фазы TiP2O7 (1500°C [27]) заключена между линиями 0.5B2O3–0.5P2O5 и 0.5B2O3–p (перитектическое плавление Ti5P6O25 при 1260°C [27]), а поверхность кристаллизации фазы переменного состава Ti5P4O20–Ti5P6O25 находится между линиями 0.5B2O3–p и 0.5B2O3–e (эвтектика Ti5P4O20–TiO2(R) при 1180°C [27]). На поверхности кристаллизации TiO2(R), ограниченной линией 0.5B2O3–e, располагается купол расслаивания (кривая L1–L2 на рис. 3), распространяющийся из системы TiO2–B2O3 (1400°C [26]).
Для граничного состава твердого раствора Ti0.8B0.1P0.1O2 была оценена возможность использования его в качестве фотокатализатора. Прежде всего было определено содержание возможных примесей C, H и N в полученном образце. Как видно из табл. 1, содержание C не превысило 0.1%, содержание H составило ~0.5%, что указывает на наличие адсорбированной на поверхности образца Ti0.8B0.1P0.1O2 воды и гидроксильных групп.
Таблица 1.
Результаты C, H, N-анализа образцов TiO2 и Ti0.8B0.1P0.1O2
| Состав образцов | N, % | C, % | H, % |
|---|---|---|---|
| TiO2 | 0.01 | 0.07 | 0.06 |
| Ti0.8B0.1P0.1O2 | 0.03 | 0.02 | 0.43 |
Результаты исследования оптических свойств образцов Ti0.9B0.05P0.05O2 и Ti0.8B0.1P0.1O2 в УФ-видимом диапазоне излучений представлены в виде спектров поглощения, полученных из спектров диффузного отражения с помощью преобразования Кубелки–Мунка [30], на рис. 4а. Видно, что край полосы поглощения Ti0.8B0.1P0.1O2 сдвинут в красную область по отношению к Ti0.9B0.05P0.05O2. Методом Тауца путем экстраполяции прямолинейных участков кривых (F(R) hν)1/2 = B(hν – E) (до нулевого значения функции), где F(R) = (1–R)2/2R, R – коэффициент отражения, hν – энергия фотона, B – постоянная и E – оптическая ширина запрещенной зоны, определены E(Ti0.9B0.05P0.05O2) = = 3.25 эВ и E(Ti0.8B0.1P0.1O2) = 3.15 эВ (рис. 4б). В обоих образцах отсутствует TiO2-рутил (рис. 1), заметно влияющий на поглощение TiO2-анатаза [31, 32].
Рис. 4.
Спектры поглощения (а) и ширина запрещенной зоны (б) для Ti0.9B0.05P0.05O2 и Ti0.8B0.1P0.1O2.
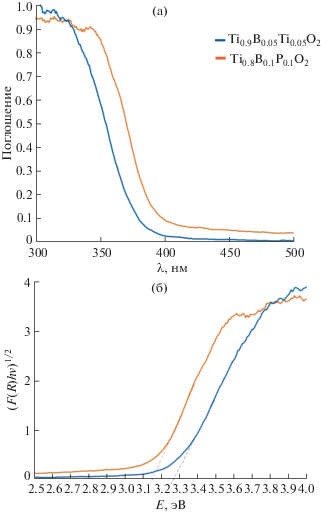
Ранее [6, 7] отмечалось, что отжиг при 600°C образцов TiO2, совместно допированных B и P, сдвигает полосу поглощения в красную область спектра [7], и при содержании 1 ат. % B и 1 ат. % P наблюдается поглощение в видимой части спектра и сжатие запрещенной зоны [6]. Согласно полученным нами данным, эквимолярное увеличение концентрации от 1.7 ат. % B и 1.7 ат. % P до 3.3 ат. % B и 3.3 ат. % P приводит к дополнительному сдвигу полосы поглощения в красную часть спектра и уменьшению ширины запрещенной зоны.
Сравнительный анализ морфологических особенностей Ti0.8B0.1P0.1O2 и TiO2 показал, что B,P-замещенный образец обладает меньшим размером частиц, более развитой поверхностью и высокой плотностью (табл. 2).
ЗАКЛЮЧЕНИЕ
Методом сжигания геля с поливиниловым спиртом впервые получен гомогенный твердый раствор со структурой анатаза, в котором до 20% атомов титана замещены на эквимолярную смесь бора и фосфора.
Методами рентгенофазового анализа и ИК-спектроскопии установлен фазовый состав образцов Ti1 –x(BP)x/2O2 (0 ≤ х ≤ 1, шаг х = 0.1) и с привлечением данных по граничным бинарным системам построена фазовая диаграмма квазитройной системы TiO2–B2O3–P2O5.
Сопоставлены области поглощения в УФ-видимом диапазоне и морфологические особенности (удельная поверхность, плотность и размер частиц) Ti0.8B0.1P0.1O2 (анатаз) и TiO2 (анатаз с примесью рутила). Показано, что подход, основанный на двойном одновременном замещении катионов титана в TiO2 на бор и фосфор, может быть рассмотрен в качестве перспективного для создания безопасных эффективных фотокаталитических систем для обеззараживания воды.
Список литературы
Serikov T.M., Ibrayev N.K., Isaikina O.Y., Savilov S.V. // Russ. J. Inorg. Chem. 2021. V. 66. № 1. P. 117. [Сериков Т.М., Ибраев Н.Х., Исайкина О.Я., Савилов С.В. // Журн. неорган. химии. 2021. Т. 66. № 1. С. 107. https://doi.org/10.31857/S0044457X21010074]https://doi.org/10.1134/S0036023621010071
Zherebtsov D.A., Kulikovskikh S.A., Viktorov V.V. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 2. P. 165. [Жеребцов Д.А., Куликовских С.А., Викторов В.В. и др. // Журн. неорган. химии. 2019. Т. 64. № 2. С. 132. https://doi.org/10.1134/S0044457X19020235]https://doi.org/10.1134/S0036023619020220
Li L., Meng F., Hu X. et al. // PLOS ONE. 2016. V. 11. № 4. P. e0152726. https://doi.org/10.1371/journal.pone.0152726
Yang K., Dai Y., Huang B. // Catalysts. 2020. V. 10. № 9. P. 972. https://doi.org/10.3390/catal10090972
Dozzi M.V., Silli E. // J. Photochem. Photobiol. C: Photochem. Rev. 2013. V. 13. P. 13. https://doi.org/10.1016/j.jphotochemrev.2012.09.002
Zhou X., Jin B., Zhang S. et al. // Electrochim. Commun. 2012. V. 12. P. 127. https://doi.org/10.1016/j.elecom.2012.03.020
Basha M.H., Gopal N.O., Nimbalkar D.B. et al. // J. Mater. Sci: Mater. Electron. 2017. V. 28. № 1. P. 987. https://doi.org/10.3367/UFNe.2018.01.038279
Chen D., Yang D., Wang Q. et al. // Ind. Eng. Chem. Res. 2006. V. 45. № 12. Р. 4110. https://doi.org/10.1021/ie0600902
Kitagawa H., Kunisada T., Yamada Y. et al. // J. Alloys Compd. 2010. V. 508. P. 582. https://doi.org/10.1016/j.jallcom.2010.08.125
Min Z., Ying D., Shijin Z. et al. // Rare Metals. 2011. V. 3. P. 243. https://doi.org/10.1007/s12598-011-0278-5
Quiñones D.H., Rey A., Alvarez P.M. et al. // Appl. Catal. B: Environ. 2015. V. 178. P. 74. https://doi.org/10.1016/j.apcatb.2014.10.036
Simsek E.B. // Appl. Catal. B: Environ. 2017. V. 200. P. 309. https://doi.org/10.1016/j.apcatb.2016.07.016
Niu P., Wu G., Chen P. et al. // Front. Chem. 2020. V. 8. P. 172. https://doi.org/10.3389/fchem.2020.00172
Wang Y.N., Bian J.J. // Ceram. Int. 2015. V. 41. P. 4683. https://doi.org/10.1016/j.ceramint.2014.12.015
Brandel V., Dacheux N. // J. Solid State Chem. 2004. V. 177. P. 4755. https://doi.org/10.1016/j.jssc.2004.08.008
Schöneborn M., Glaum R., Reinauer F. // J. Solid State Chem. 2008. V. 181. P. 1367. https://doi.org/10.1016/j.jssc.2008.02.039
Li F., Jiang Y., Xia M. et al. // J. Phys. Chem C. 2009. V. 113. P. 18314. https://doi.org/10.1021/jp902558z
Yu H.-F. // J. Phys. Chem. Solids. 2007. V. 68. P. 600. https://doi.org/10.1016/j.jpcs.2007.01.050
Guo S., Han S., Haifeng M. et al. // Mater. Res. Bull. 2013. V. 48. P. 3082. https://doi.org/10.1016/j.materresbull.2013.04.056
Zheng R., Lin L., Xie J. et al. // J. Phys. Chem. C. 2008. V. 112. P. 15502. https://doi.org/10.1021/jp806121m
Peak D., Luther G.W., Sparks D.L. // Geochim. Cosmochim. Acta. 2003. V. 67. № 14. P. 2551. https://doi.org/10.1016/S0016-7037(03)00096-6
Medvedev E.F., Komarevskaya A.Sh. // Glass and Ceramics. 2007. № 2. P. 42. [Медведев Е.Ф., Комаревская А.Т. // Стекло и керамика 2007. № 2. С. 8.]https://doi.org/10.1007/s10717-007-0010-y
Benmokhtar S., Eljazouli A., Chaminade J.P. et al. // J. Solid State Chem. 2007. V. 180. P. 2713. https://doi.org/10.1016/j.jssc.2007.07.028
Chen S., Ye M., Chen H.-H. et al. // J. Inorg. Organomet. Polym. 2009. V. 19. № 12. P. 139. https://doi.org/10.1007/s10904-008-9245-5
Zhang C., Lin C., Li C. et al. // J. Phys. Chem. C. 2008. V. 112. P. 2183. https://doi.org/10.1021/jp710046x
Pavlikov V.N., Yurchenko V.A., Tresvyatskii S.G. // Russ. J. Inorg. Chem. 1976. V. 21. № 1. [Павликов В.Н., Юрченко В.А., Трехсвятский С.Г. // Журн. неорган. химии. 1976. Т. 21. № 1. С. 233.]
Malshikov A.E., Bondar I.A. // Inorg. Mater. 1989. V. 25. № 6. Р. 829. [Мальшиков А.Е., Бондарь И.А. // Изв. АН СССР. Неорган. материалы. 1989. Т. 25. № 6. С. 984.]
Ananthanarayanan K.P., Mohanty C., Gielisse P.J. // Cryst. Growth. 1973. V. 20. P. 63. https://doi.org/10.1016/0022-0248(73)90038-9
Schmidt M., Ewald B., Prots Yu. et al. // Z. Anorg. Allg. Chem. 2004. V. 630. P. 655. https://doi.org/10.1002/zaac.200400002
Makula P., Pacia M., Macyk W. // J. Phys. Chem. Lett. 2018. V. 9. P. 6814. https://doi.org/10.1021/acs.jpclett.8b02892
Irie H., Watanabe Y., Hashimoto K. // Chem. Lett. 2003. V. 32. P. 772. https://doi.org/10.1246/cl.2003.772
Liu G., Yan X., Chen Z. et al. // J. Mater. Chem. 2009. V. 19. № 12. P. 6590. https://doi.org/10.1039/b902666e
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии