Журнал неорганической химии, 2021, T. 66, № 11, стр. 1514-1518
Синтез производных клозо-додекаборатного аниона на основе сложных эфиров аминокислот
А. В. Бурденкова a, А. П. Жданов b, *, И. Н. Клюкин c, Н. А. Селиванов c, А. Ю. Быков c, К. Ю. Жижин c, Н. Т. Кузнецов c
a Национальный исследовательский университет “Высшая школа экономики”
101000 Москва, ул. Мясницкая, 20, Россия
b Нижегородский государственный университет им. Н.И. Лобачевского
603022 Нижний Новгород, пр-т Гагарина, 20, Россия
c Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: zhdanov@igic.ras.ru
Поступила в редакцию 19.04.2021
После доработки 03.06.2021
Принята к публикации 15.06.2021
Аннотация
Предложен новый метод синтеза N-борилированных аминокислот на основе реакций нуклеофильного замещения в анионе [B12H11IPh]–. В качестве нуклеофилов были использованы эфиры глицина и L-фенилаланина. Строение продуктов определено методами мультиядерной ЯМР-спектроскопии, ИК-спектроскопии поглощения и ESI-масс-спектрометрии.
ВВЕДЕНИЕ
Кластерные анионы бора находят широкое применение в качестве компонентов фотовольтаических устройств [1–6], катализаторов [7, 8], биосенсоров [9, 10], молекулярных магнитов [11, 12]. Одной из наиболее важных областей применения клозо-боратных анионов является бор-нейтронозахватная терапия злокачественных опухолей [13–18].
Основной интерес исследователей сконцентрирован на разработке методов направленной функционализации кластерных анионов бора. Так, наряду с процессами электрофильного [19–21] и нуклеофильного замещения [22, 23] атомов водорода кластера в качестве эффективного метода функционализации может рассматриваться процесс ипсо-замещения [24–26].
Одним из типов подобных групп являются ионы галония, способные вступать в реакции с рядом нуклеофильных реагентов. Подобный подход удалось распространить на иодониевые производные карборанов [27], которые вступают в реакции с различными нуклеофилами с селективным замещением арилгалониевого заместителя. Монокарбораны и кластерные анионы бора обладают отрицательным зарядом, и арилиодониевые цвиттер-ионы на их основе отличаются от производных нейтральных карборанов по реакционной способности и селективности процессов. Получение производных гипервалентного иода через окисление иодо-клозо-боратов описано в литературе [28]. Следует отметить, что данный подход обладает рядом недостатков, так как приводит к образованию продуктов окисления кластерного фрагмента. Значительно повысить выход целевых клозо-боратов позволяет использование гипервалентных соединений иода [29, 30]. Иодониевые производные способны вступать в реакции замещения групп PhI с рядом нуклеофилов (пиридины, тиомочевины, цианид-ион, азид-ион и др.) [31–35]. В работах [36, 37] показана возможность использования фенилиодониевых производных клозо-додекаборатного аниона и замещенных аналогов для направленного введения в кластер различных функциональных групп.
Таким образом, использование иодониевых функциональных заместителей в качестве уходящих (ипсо-) групп представляет собой достаточно мощный инструмент для создания новых борсодержащих соединений с заданным набором свойств. В связи с этим целью настоящей работы стало создание новых замещенных производных клозо-додекаборатного аниона и природных аминокислот на основе процессов нуклеофильного замещения в анионе [B12H11IPh]–.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Элементный анализ на углерод, водород и азот осуществляли на автоматическом газовом анализаторе CHNS-3 FA 1108 Elemental Analyser (Carlo Erba). Определение бора методом ICPMS проводили на атомно-эмиссионном спектрометре с индуктивно связанной плазмой iCAP 6300 Duo в ЦКП “Исследовательский научно-аналитический центр ФГУП “ИРЕА”.
ИК-спектры синтезированных соединений записывали на ИК-Фурье-спектрометре Инфралюм ФТ-08 (НПФ АП “Люмекс”) в области 4000–400 см–1 с разрешением 1 см–1. Образцы готовили в виде таблеток с бромидом калия.
Спектры ЯМР (1H,11B,13C) растворов исследуемых веществ в CD3CN записывали на спектрометре Bruker AvanceII-300 на частотах 300.3, 96.32 и 75.49 МГц соответственно с внутренней стабилизацией по дейтерию. В качестве внешних стандартов использовали тетраметилсилан или эфират трехфтористого бора.
ESI-масс-спектры растворов исследуемых веществ в CH3CN записывали на спектрометре Bruker MicrOTOF-Q (Bruker Daltonik, Germany). Условия ионизации: Apollo II electrospray ionization source, Ion spray voltage +(–)4500 V, температура 200°C, поток 3 мкл/мин.
Фенилиодододекаборат тетрафенилфосфония (Ph4P)[B12H11IPh]. К (Ph4P)2[B12H12] (2.0 г, 2.4 ммоль) добавляли 15 мл ацетонитрила и 2 мл трифторуксусной кислоты. К полученному раствору прибавляли PhI(OAc)2 (0.77 г, 2.4 ммоль) и перемешивали реакционную массу в атмосфере сухого аргона при умеренном нагревании (до 40°С) в течение 2 ч. После этого раствор концентрировали на роторном испарителе и перекристаллизовывали продукт из смеси ацетонитрила и диэтилового эфира. Полученный твердый продукт промывали ледяной уксусной кислотой и диэтиловым эфиром, затем сушили в вакууме масляного насоса. Выход 1.45 г (88%).
ЯМР 11B {CD3CN, м.д.}: –12.1 (с, 1B, B–I); –15.5 (м, 11B, B–H); ЯМР 1H {CD3CN, м.д.}: 7.98, 7.74, 7.65 (20H, аром., Ph4P); 7.76, 7.38, 7.15 (м, 5H, аром., C6H5I); 2.25–0.15 (уш.м, 11H, B–H).
Производное этилового эфира глицина (Ph4P)[B12H11NH2CH2COOEt]. Готовили смесь (NH2CH2COOEt) · HCl (0.47 г, 3.4 ммоль) и 4-диметиламинопиридина (0.43 г, 3.4 ммоль) в безводном тетрагидрофуране (ТГФ, 20 мл). Полученную суспензию перемешивали в атмосфере сухого аргона при комнатной температуре до полного переосаждения гидрохлорида диметиламинопиридиния (~0.5 ч), затем осадок отфильтровывали, а к маточному раствору добавляли (Ph4P)[B12H11IPh] (0.50 г, 0.7 ммоль). Полученную реакционную массу нагревали при 80°С в течение 4 ч в атмосфере сухого аргона. По окончании реакции полученный раствор упаривали на роторном испарителе, твердый остаток перекристаллизовывали из смеси метанола и диэтилового эфира. Полученный порошок растворяли в дихлорметане и промывали раствором 0.1 М HCl. Органическую фазу отделяли, промывали водой до нейтральной реакции, сушили над безводным сульфатом натрия, а затем концентрировали на роторном испарителе. Продукт сушили в вакууме. Выход 0.29 г (70%).
ИК-спектр (KBr, см–1, отдельные полосы): 3320, 3258 (ν(N–H)); 2485 (ν(B–H)); 1745 (ν(C=O)); 1042 (δ(B–B–H)). ЯМР 11B (CD3CN, м.д.): –7.7 (с, 1B, B–N); –16.5 (м, 11B, B–H); ЯМР 1H (CD3CN, м.д.): 7.96, 7.75, 7.71 (20H, аром., Ph4P); 6.86 (уш.с, 2Н, NH2); 4.28 (кв, 2H, COO–CH2–CH3, J = 7 Гц); 3.99 (д, 2H, CH2COO, J = 6 Гц); 1.29 (т, 3H, COO–CH2–CH3, J = 7 Гц); 2.20–0.16 (уш.м, 11H, B–H). ЯМР 13C (CD3CN, м.д.): 171.0 (СOO); 135.4, 134.7, 130.3, 118.3 (Ph4P); 61.5 (COO–CH2–CH3); 45.4 (CH2–COO); 14.5 (COO–CH2–CH3). MS(ESI)–: m/z = 285.2 ([B12H11NH2CH2COOEt] {CH3CN}–).
Производное этилового эфира фенилаланина (Ph4P)[B12H11NH2CH(CH2C6H5)COOEt] получали по аналогичной методике. Готовили смесь PhCH2CH(NH2)COOEt · HCl (0.83 г, 3.6 ммоль) и 4-диметиламинопиридина (0.44 г, 3.6 ммоль) в безводном ТГФ (20 мл). Полученную суспензию перемешивали в атмосфере сухого аргона при комнатной температуре до полного переосаждения гидрохлорида диметиламинопиридиния (~0.5 ч). Затем осадок отфильтровывали, а к маточному раствору добавляли (Ph4P)B12H11IPh (0.50 г, 0.7 ммоль). Колбу продували аргоном, полученную реакционную массу нагревали при перемешивании до 80°С в течение 4 ч. По окончании реакции полученный раствор упаривали на роторном испарителе, а твердый остаток перекристаллизовывали из смеси метанола и диэтилового эфира. Полученный сырой продукт растворяли в дихлорметане и промывали раствором 0.1 М HCl. Органическую фазу отделяли, промывали водой до нейтральной реакции и сушили над безводным сульфатом натрия, а затем концентрировали на роторном испарителе. Продукт сушили в вакууме. Выход 0.33 г (75%).
ИК-спектр (KBr, см–1, отдельные полосы): 3301, 3240 (ν(N–H)); 2470 (ν(B–H)); 1750 (ν(C=O)); 1055 (δ(B–B–H)). ЯМР 11B (CD3CN, м.д.): –7.2 (с, 1B, B–N); –16.8 (сл.м, 11B, B–H). ЯМР 1H (CD3CN, м.д.): 7.95, 7.76, 7.69 (20H, аром., Ph4P); 7.45–7.25 (м, 5H, CH2–C6H5); 6.86 (уш.с, 2Н, NH2); 4.36 (м, 1H, NH–CH–COO), 4.28 (кв, 2H, COO–CH2–CH3, J = 7 Гц); 3.33 (д, 2H, CH2–C6H5, J = 7 Гц), 1.28 (т, 3H, COO–CH2–CH3, J = 7 Гц), 1.90–0.10 (уш.м, 11H, B–H). ЯМР 13C (CD3CN, м.д.): 170.9 (СOO), 135.2, 134.5, 130.0, 118.4 (Ph4P); 137.1, 130.9, 129.6, 128.1 (–CH2–Ph), 62.7 (COO–CH2–CH3), 56.8 (CH–COO), 40.1 (CH–CH2–Ph), 14.5 (COO–CH2–CH3). MS(ESI)–: m/z = 334.1 ([B12H11NH2CHCH2C6H5COOEt]–).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
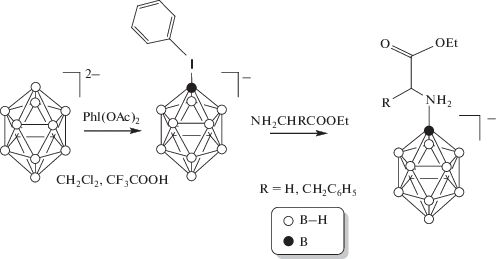
Предложен синтез фенилиодониевого производного клозо-додекаборатного аниона в безводной среде. Реакцию аниона [B12H12]2– с PhI(OAc)2 проводили в смеси ацетонитрила и трифторуксусной кислоты (рис. 1). Контроль за ходом реакции осуществляли на основе данных 11B ЯМР-спектроскопии. Так, спектр 11В ЯМР солей аниона [B12H11IPh]– представлен двумя сигналами: δ1 = –12.5 м.д. и δ2 = –15.6 м.д. с соотношением интегральных интенсивностей 1 : 11. Строение заместителя в производном определяли с помощью спектроскопии 1H ЯМР. Так, в спектре соединения (PBu4)[B12H11IPh] наряду с сигналами протонов от тетрабутиламмониевого катиона наблюдаются сигналы в области ароматических протонов при 7.76, 7.39, 7.16 м.д. (м, 5H, аром., C6H5I), что соответствует фенильному заместителю при атоме иода. Кроме того, в спектре присутствуют сигналы от атомов водорода, связанных с борным остовом. Они проявляются в виде уширенного мультиплета в области 2.20–0.16 (ум. м, 11Н, В–Н).
На второй стадии получали производные на основе сложных эфиров аминокислот, которые были использованы в качестве нуклеофильных реагентов.
Поскольку сложные эфиры аминокислот в виде свободных оснований неустойчивы, нами были использованы соответствующие гидрохлориды. При этом депротонированные формы эфиров получали in situ под действием органических оснований в среде тетрагидрофурана (ТГФ). Использование триэтиламина в качестве основания приводило к образованию существенного количества побочного продукта хлорирования додекаборатного аниона, что, очевидно, связано с растворимостью гидрохлорида в ТГФ. Поэтому нами было принято решение использовать в качестве основания 4-диметиламинопиридин, гидрохлорид которого легко удаляется из реакционной массы фильтрованием.
Добавление к раствору сложного эфира (Ph4P)[B12H11IPh] приводит к замещению фенилиодониевой группы на остаток аминокислоты. Реакция протекает уже при комнатной температуре, однако скорость данного процесса невелика. Нагревание до 80°С реакционной массы позволяет достичь полной конверсии исходного иодониевого производного за 4 ч. Следует отметить, что изученный процесс чувствителен к наличию в системе воды и хлорид-ионов, что приводит к побочным процессам и снижает выход целевого продукта.
Контроль за ходом реакции осуществляли на основе данных 11B ЯМР-спектроскопии. Так, спектры 11В ЯМР целевых производных аммониевого типа представлены в виде двух сигналов в области –7.2…–7.7 м.д. (c, 1B, B–N) и –16.5…–16.8 м.д. (м, 11B, B–H). Введение более электроотрицательной аммониевой группы приводит к смещению сигнала от замещенного атома бора в более слабое поле по сравнению со спектром исходного иодониевого производного.
Строение функциональных групп в полученных продуктах определяли с помощью 1H и 13С ЯМР-спектроскопии. Так, в спектре 1H ЯМР соединения (Ph4P)[B12H11NH2CH2COOEt] наряду с сигналами протонов катиона наблюдаются сигналы протонов аминокислотного остатка. Аммониевая группа представлена уширенным синглетом при 6.86 м.д. (2Н, NH2), протоны метиленовой группы проявляются в виде дублета при 3.99 м.д. (2H, CH2COO, J = 6 Гц). Такое расщепление сигнала характерно для производных аминокислот с жесткой пространственной структурой [38]. В спектре 13С ЯМР соединения (Ph4P)[B12H11CH2COOEt] наблюдаются сигналы атомов углерода карбонильной группы при 171.0 м.д. и метиленовой группы при 45.4 м.д. В ИК-спектре данного соединения появляются полосы поглощения валентных колебаний связи N–H при 3320 и 3258 см–1, полосы поглощения валентных колебаний связи C=O при 1745 см–1, полосы поглощения фенилиодониевого фрагмента исчезают. Замена экзополиэдрического заместителя слабо сказывается на положении и форме полосы валентных колебаний связи бор–водород.
Кроме того, образование целевых соединений подтверждено методом ESI-масс-спектрометрии. Так, в анионной части масс-спектров продуктов присутствуют интенсивные пики ионов {[B12H11NH2CH2COOEt] · CH3CN}– при 285.2 а. е. м. для соединения (Ph4P) [B12H11NH2CH(CH2C6H5)COOEt] и ионов [B12H11NH2CHCH2C6H5COOEt]– при 334.1 а. е. м. для соединения (Ph4P)[B12H11NH2CH2COOtBu].
Список литературы
Duchêne L., Kühnel R.-S., Rentsch D. et al. // Chem. Commun. 2017. V. 53. № 30. P. 4195. https://doi.org/10.1039/C7CC00794A
Fisher S.P., Tomich A.W., Lovera S.O. et al. // Chem. Rev. 2019. V. 119. № 14. P. 8262. https://doi.org/10.1021/acs.chemrev.8b00551
Zhdanova K.A., Zhdanov A.P., Ezhov A.V. et al. // Macroheterocycles. 2014. V. 7. № 4. P. 394. https://doi.org/10.6060/mhc140494z
Ezhov A.V., Vyal’ba F.Y., Kluykin I.N. et al. // Macroheterocycles. 2017. V. 10. № 4–5. P. 505. https://doi.org/10.6060/mhc171254z
Mukherjee S., Thilagar P. // Chem. Commun. 2016. V. 52. № 6. P. 1070. https://doi.org/10.1039/C5CC08213G
Duchêne L., Kim D.H., Song Y.B. et al. // Energy Storage Mater. 2020. V. 26. № July 2019. P. 543. https://doi.org/10.1016/j.ensm.2019.11.027
Wang Z., Liu Y., Zhang H. et al. // J. Colloid Interface Sci. 2020. V. 566. P. 135. https://doi.org/10.1016/j.jcis.2020.01.047
Wang L., Sun W., Duttwyler S. et al. // J. Solid State Chem. 2021. V. 299. № March. P. 122167. https://doi.org/10.1016/j.jssc.2021.122167
Qi B., Wu C., Li X. et al. // ChemCatChem. 2018. V. 10. № 10. P. 2285. https://doi.org/10.1002/cctc.201702011
Qi B., Wu C., Xu L. et al. // Chem. Commun. 2017. V. 53. № 86. P. 11790. https://doi.org/10.1039/C7CC06607D
Shakirova O.G., Lavrenova L.G., Bogomyakov A.S. et al. // Russ. J. Inorg. Chem. 2015. V. 60. № 7. P. 786. https://doi.org/10.1134/S003602361507013X
Malinina E.A., Kochneva I.K., Polyakova I.N. et al. // Inorg. Chim. Acta. 2018. V. 479. P. 249. https://doi.org/10.1016/j.ica.2018.04.059
Feakes D.A., Shelly K., Knobler C.B. et al. // Proc. Natl. Acad. Sci. 2006. V. 91. № 8. P. 3029. https://doi.org/10.1073/pnas.91.8.3029
Abi-Ghaida F., Clément S., Safa A. et al. // J. Nanomater. 2015. V. 2015. № 9. P. 1. https://doi.org/10.1155/2015/608432
Satapathy R., Dash B.P., Mahanta C.S. et al. // J. Organomet. Chem. 2015. V. 798. P. 13. https://doi.org/10.1016/j.jorganchem.2015.06.027
Bogdanova E.V., Stogniy M.Y., Chekulaeva L.A. et al. // New J. Chem. 2020. V. 44. № 37. P. 15836. https://doi.org/10.1039/d0nj03017a
Ali F., Hosmane N., Zhu Y. // Molecules. 2020. V. 25. № 4. P. 1. https://doi.org/10.3390/molecules25040828
Evamarie Hey-Hawkins C.V.T. // Boron-Based Compounds: Potential and Emerging Applications in Medicine, John Wiley & Sons Ltd, 2018.
Srebny H.-G., Preetz W., Marsmann H.C. // Z. Naturforsch., B: Chem. Sci. 1984. P. 189.
Knoth W.H., Miller H.C., Sauer J.C. et al. // Inorg. Chem. 1964. V. 3. № 2. P. 159. https://doi.org/10.1021/ic50012a002
Alam F., Soloway A.H., Barth R.F. et al. // J. Med. Chem. 1989. V. 32. № 10. P. 2326. https://doi.org/10.1021/jm00130a017
Bregadze V.I., Sivaev I.B., Dubey R.D. et al. // Chem. Eur. J. 2020. V. 26. № 61. P. 13832. https://doi.org/10.1002/chem.201905083
Peymann T., Knobler C.B., Hawthorne F.M. // Inorg. Chem. 2000. V. 39. № 6. P. 1163. https://doi.org/10.1021/ic991105+
Peymann T., Knobler C.B., Hawthorne M.F. // Inorg. Chem. 1998. V. 37. № 7. P. 1544. https://doi.org/10.1021/ic9712075
Himmelspach A., Finze M., Vöge A. et al. // Z. Anorg. Allg. Chem. 2012. V. 638. № 3–4. P. 512. https://doi.org/10.1002/zaac.201100458
Naoufal D., Assi Z., Abdelhai E. et al. // Inorg. Chim. Acta. 2012. V. 383. P. 33. https://doi.org/10.1016/j.ica.2011.10.033
Gona K.B., Gómez-Vallejo V., Padro D. et al. // Chem. Commun. 2013. V. 49. № 98. P. 11491. https://doi.org/10.1039/c3cc46695g
Marshall W.J., Jr R.J.Y., Grushin V.V. // Organometallics. 2001. V. 20. P. 523. https://doi.org/10.1021/om0008575
Miller H.C., Hertler W.R., Muetterties E.L. et al. // Inorg. Chem. 1965. V. 4. № 8. P. 1216. https://doi.org/10.1021/ic50030a028
Kaszyński P., Ringstrand B. // Angew. Chem. Int. Ed. 2015. V. 54. № 22. P. 6576. https://doi.org/10.1002/anie.201411858
Ringstrand B., Kaszynski P., Franken A. // Inorg. Chem. 2009. V. 48. № 15. P. 7313. https://doi.org/10.1021/ic9007476
Zurawiński R., Jakubowski R., Domagała S. et al. // Inorg. Chem. 2018. V. 57. № 16. P. 10442. https://doi.org/10.1021/acs.inorgchem.8b01701
Ali M.O., Lasseter J.C., Żurawiński R. et al. // Chem. Eur. J. 2019. V. 25. № 10. P. 2616. https://doi.org/10.1002/chem.201805392
Rzeszotarska E., Novozhilova I., Kaszyński P. // Inorg. Chem. 2017. V. 56. № 22. P. 14351. https://doi.org/10.1021/acs.inorgchem.7b02477
Sun Y., Zhang J., Zhang Y. et al. // Chem. Eur. J. 2018. V. 24. № 41. P. 10364. https://doi.org/10.1002/chem.201801602
Tokarz P., Kaszyński P., Domagała S. et al. // J. Organomet. Chem. 2015. V. 798. P. 70. https://doi.org/10.1016/j.jorganchem.2015.07.035
Nelyubin A.V., Selivanov N.A., Bykov A.Y. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 6. P. 795. https://doi.org/10.1134/S0036023620060133
Rattle H.W.E. // Annu. Rep. NMR Spectrosc. 1981. P. 1. https://doi.org/10.1016/S0066-4103(08)60408-1
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии