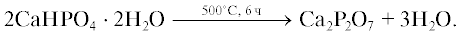Журнал неорганической химии, 2021, T. 66, № 11, стр. 1507-1513
Влияние размера пор на биологическую активность резорбируемых макропористых керамических материалов на основе β-Ca3(PO4)2, полученных методом фотополимеризации
П. В. Евдокимов a, b, *, С. А. Тихонова b, А. К. Киселева b, Я. Ю. Филиппов b, Е. С. Новоселецкая b, А. Ю. Ефименко b, В. И. Путляев b
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
b Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: pavel.evdokimov@gmail.com
Поступила в редакцию 27.04.2021
После доработки 04.06.2021
Принята к публикации 05.06.2021
Аннотация
Исследовано влияние размера пор макропористых керамических материалов на основе β-Ca3(PO4)2 на их биологическую активность. Определены условия получения макропористой керамики с пористостью >50% и заданным размером пор. Изучено влияние компонентов фотоотверждаемой эмульсии на размер пор в итоговой макропористой керамике. Продемонстрирована биологическая совместимость макропористых керамических материалов на основе β-Ca3(PO4)2 в медико-биологических тестах in vitro. Установлено влияние размера пор макропористых керамических материалов на пролиферацию и жизнеспособность мультипотентных мезенхимных стромальных клеток.
ВВЕДЕНИЕ
Одним из востребованных направлений в области современного медицинского материаловедения является разработка персонифицированных материалов для регенерации костных дефектов [1], предназначенных для восстановления поврежденных тканей, их окружения и функционала. В идеале такие имплантаты должны обладать контролируемой скоростью резорбции для возможности их применения в различных клинических случаях [2].
Идея смоделировать кость с помощью материала, который был бы подобен ей по химическому составу [3], архитектонике [4] и механическим функциям [5], до сих пор считается актуальной. Регенеративные методы лечения используют конструкции тканевой инженерии для попытки восстановления биологических функций отдельных тканей (костная ткань, кожа, мышцы и т.д.). Создание подобных конструкций для лечения костных дефектов особенно важно, если размер дефекта превосходит критический и для восстановления костной ткани собственных возможностей организма недостаточно [6].
Остеокондуктивная биокерамика с открытой пористостью – перспективный материал для различных областей медицины, где возникает потребность в остеопластике [7]. Остекондуктивные свойства требуют создания материалов с открытой пористостью не менее 40% [8]. Значительная пористость заметно изменяет механические свойства биокерамического имплантата [9], понижая прочность и другие механические характеристики, необходимые для манипуляций во время проведения операции по имплантированию материала. В литературе представлено большое количество способов получения пористых керамических материалов: вспенивание суспензий [10], прямая [11] и обратная [12] репликация, метод выгорающих добавок [13] и др. Для эффективного врастания новообразованной костной ткани в такой материал необходимо наличие взаимопересекающихся между собой пор размером не менее 100–500 мкм и связывающих их каналов диаметром не менее 50 мкм [14–18].
Несмотря на большое число работ, продемонстрировавших влияние общей пористости материалов на скорость и объем врастания новой костной ткани, до сих пор нет единого мнения относительно оптимального значения пористости. Было показано, что наличие значительной пористости у материала положительно влияет на остеогенез за счет повышения общей проницаемости материала, а также за счет увеличения площади взаимодействия материала с новообразующейся костной тканью, что способствует увеличению адсорбционных свойств для костно-индуцирующих факторов [19, 20]. В основном разделяют два класса пор, необходимых для костно-замещающих материалов: микропоры (<10 мкм) и макропоры (>100 мкм) [21, 22]. При этом было показано, что имплантаты с порами >300 мкм демонстрируют высокий остеогенез [15, 23]. Помимо объема пор и их размера на остеогенез влияет кривизна поверхности, которая может также влиять на активность остеокластов [24–27].
Цель настоящей работы – изучение влияния размера пор на биологическую активность макропористых керамических материалов на основе трикальциевого фосфата, а также разработка метода получения макропористых керамических материалов с управляемой пористостью, основанного на фотополимеризации прямых эмульсий под действием ультрафиолетового излучения, содержащих в водной фазе порошок трикальциевого фосфата, и последующей термической обработке композита.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для получения фотоотверждаемых эмульсий использовали следующие реактивы: трикальциевый фосфат (ТКФ) Ca3(PO4)2, ПЭГДА-700 (полиэтиленгликоль диакрилат молекулярной массы 700 Да, Sigma Aldrich, Германия), дистиллированную воду, парафиновое масло (Sigma Aldrich, Германия), полиакриловую кислоту (Sigma Aldrich, Германия), эмульгатор – полиэтоксилированное касторовое масло (Sigma Aldrich, Германия), фотоинициатор дифенил(2,4,6-триметилбензоил)фосфин оксид (Sigma Aldrich, Германия).
ТКФ синтезировали твердофазным методом из карбоната кальция CaCO3 (99.0%, Sigma Aldrich, Германия) и пирофосфата кальция (ПФК) Ca2P2O7, ПФК – термическим разложением монокальциевого фосфата моногидрата (брушита) CaHPO4 ⋅ 2H2O.
Брушит CaHPO4 · 2H2O осаждали по реакции (1) сливанием растворов с эквимолярным содержанием Ca(NO3)2 · 4H2O (99.0%, Sigma Aldrich, Германия) и (NH4)2HPO4, (99.0%, Fluka Analytical, Германия) с последующим перемешиванием в течение 15 мин.
(1)
$\begin{gathered} {\text{Ca}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{{\text{2}}}}{\text{ + }}{{\left( {{\text{N}}{{{\text{H}}}_{{\text{4}}}}} \right)}_{{\text{2}}}}{\text{HP}}{{{\text{O}}}_{{\text{4}}}}{\text{ + 2}}{{{\text{H}}}_{{\text{2}}}}{\text{O = }} \\ {\text{ = }}\,\,{\text{CaHP}}{{{\text{O}}}_{{\text{4}}}}{{\cdot 2}}{{{\text{H}}}_{{\text{2}}}}{\text{O + 2N}}{{{\text{H}}}_{{\text{4}}}}{\text{N}}{{{\text{O}}}_{{\text{3}}}}{\text{,}} \\ \end{gathered} $Полученный осадок отфильтровывали на воронке Бюхнера, высушивали и подвергали термической обработке при 500°С. В процессе термической обработки протекала реакция постепенной дегидратации брушита, которую можно выразить уравнением (2):
ПФК и карбонат кальция CaCO3 в мольном соотношении 1 : 1 смешивали в планетарной мельнице Pulverisette (Fritsch, Германия) в течение 15 мин, соотношение мелющие тела : порошок : ацетон = 5 : 1 : 1 по массе. После помола полученные смеси высушивали на воздухе, а затем подвергали термической обработке при 900оС в течение 6 ч. В процессе термообработки протекала следующая реакция:
(3)
${\text{C}}{{{\text{a}}}_{{\text{2}}}}{{{\text{P}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{7}}}} + {\text{CaC}}{{{\text{O}}}_{{\text{3}}}} \to {\text{ C}}{{{\text{a}}}_{{\text{3}}}}{{\left( {{\text{P}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{{\text{2}}}}{\text{ + C}}{{{\text{O}}}_{{\text{2}}}} \uparrow {\text{.}}$Для приготовления эмульсий необходимое количество эмульгатора растворяли в дистиллированной воде и смешивали с равным количеством раствора ПЭГДА с фотоинициатором, после чего добавляли в смесь порошок ТКФ (30 об. %), парафиновое масло (50 об. %) и перемешивали на лабораторном планетарном миксере SpeedMixer DAC 150 (Германия).
Композиты получали путем заполнения фотоотверждаемой эмульсией прозрачной силиконовой формы с цилиндрическим отверстием и последующего УФ-облучения в течение 20 мин. Макропористые керамические образцы получали в виде цилиндров (диаметр 6 мм, высота 12 мм) путем термической обработки композитов состава полимер–порошок ТКФ–парафиновое масло.
Рентгенографические исследования порошков проводили на дифрактометре Rigaku D/Max-2500 с вращающимся анодом (Япония). Съемку вели в режиме на отражение (геометрия Брегга–Брентано) с использованием CuKα-излучения (средняя длина волны 1.54183 Å).
Распределение частиц по размерам осуществляли методом статического светорассеяния с использованием лазерного дифракционного анализатора Analysette 22 MicroTec plus (Fritsch, Германия). Результаты получали с помощью программы MassControl из частотного распределения доплеровского смещения лазерного луча.
Исследование микроструктуры композитов и керамики проводили на растровом электронном микроскопе (РЭМ) с автоэмиссионным источником Leo Supra 50VP (Carl Zeiss, Германия).
Термогравиметрический и дифференциальный термический анализ композитов осуществляли на синхронном термоанализаторе STA 409 PC Luxx (Netzsch, Германия) с вертикальной загрузкой образцов. Измерения проводили в воздушной атмосфере.
Для исследований in vitro в работе использовали ASC52telo, мультипотентные мезенхимные стромальные клетки (МСК), иммортализованные с помощью человеческой теломеразы (hTERT) (ATCC® SCRC-4000TM). МСК культивировали с использованием базальной среды DMEM low glucose (Gibco, США) с добавлением 10% фетальной бычьей сыворотки (HyClone, США), 1% раствора пенициллина/стрептомицина (HyClone, США), 1% GlutaMAX-1 (Gibco, США). Культивирование проводили при условиях поддержания 5% CO2 и 37°С. Среду меняли каждые 3 дня.
Исследуемые материалы были простерилизованы в сухожаре при 180°С в течение 60 мин в пакетах из крафт-бумаги “СтериТ®” (производство “Винар НПФ”, Россия). Качество стерилизации контролировали с помощью индикаторов “СтериТЕСТ-Вл” (производство “Винар НПФ”, Россия). Далее перед посадкой клеток образцы помещали в среду для культивирования и инкубировали в течение 1 ч. Затем среду отбирали и проводили посадку клеток.
Для оценки пролиферации МСК высаживали на материал из расчета 40 тыс. клеток на лунку, после чего проводили инкубирование в течение 15 мин при 37°C, затем добавляли питательную среду по краю лунки. Далее оценивали жизнеспособность клеток на 1-, 4- и 7-й день культивирования с помощью MTT-теста. Для этого тетразолиевый краситель 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-тетразолиум бромид (MTT) (Панэко, Россия) растворяли в натрий-фосфатном буфере (Панэко, Россия) для получения раствора с концентрацией 5 мг/мл. Затем данный раствор в стерильных условиях пропускали через фильтр с размером пор 0.22 мкм. В каждой временной точке среду для культивирования меняли на бессывороточную среду и добавляли стерильный раствор MTT в соотношении 4 : 1, затем инкубировали в течение 2 ч при вышеописанных условиях культивирования. По истечении срока инкубации в каждую лунку добавляли диметилсульфоксид (AppliChem, США) в соотношении к последней смеси 2 : 3 и переносили конечный раствор в лунки 96-луночного планшета по 250 мкл. Измерения оптической плотности раствора проводили на спектрофотометре EnVision Multilabel Plate Readers (PerkinElmer, США) при λ = 595 и 630 нм.
Образцы с клетками фиксировали в 10%-ном нейтральном формалине и отмывали в фосфатном буфере (Панэко, Россия). Затем проводили дегидратацию с помощью последовательной обработки восходящими концентрациями этилового спирта. В конце к образцам добавляли гексаметилдисилазан (ЭКОС-1, Россия) на 30 мин, после чего отбирали всю жидкость и высушивали в вытяжном шкафу при комнатной температуре.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
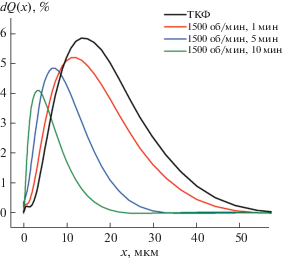
По данным РФА (рис. 1), твердофазным методом синтезирован однофазный ТКФ. Полученный порошок подвергали дополнительному помолу в среде ацетона с использованием ПАВ для модификации поверхности, которое использовали в качестве наполнителя для приготовления фотоотверждаемых эмульсий. Согласно данным динамического светорассеяния, использование ПАВ позволяет стабилизировать частицы и избежать образования агломератов при использовании высоких скоростей и длительного времени размола. В последующих экспериментах использовали порошок ТКФ со средним размером частиц 3 мкм (табл. 1) с достаточно узким распределением (рис. 2).
Рис. 1.
Рентгенограмма β-Ca3(PO4)2, синтезированного при 900°С. Штрих-диаграмма соответствует файлу # 70-2065 базы ICDD PDF-2.
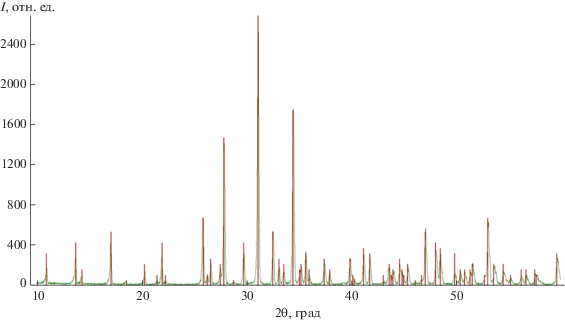
Таблица 1.
Средний размер частиц порошка ТКФ при разных режимах помола
| Скорость, об/мин | Средний размер частиц, мкм | |||||
|---|---|---|---|---|---|---|
| помол без ПАВ | помол с ПАВ | |||||
| 1 мин | 5 мин | 10 мин | 1 мин | 5 мин | 10 мин | |
| 500 | 12 ± 9 | 12 ± 7 | 12 ± 7 | 10 ± 11 | 7 ± 8 | 7 ± 4 |
| 1500 | 12 ± 6 | 7 ± 4 | 3 ± 2 | 8 ± 9 | 4 ± 2 | 3 ± 2 |
| 3000 | 8 ± 4 | 4 ± 4 | 6 ± 5 | 6 ± 4 | 3 ± 3 | 3 ± 2 |
Рис. 2.
Дифференциальные кривые распределения по размерам частиц ТКФ, измельченного в планетарной мельнице при разном времени помола.
Макроэмульсии являются сложными, кинетически нестабильными системами. Наличие капель дисперсной фазы большого диаметра (в диапазоне от 10 до 1000 мкм) приводит к разделению фаз со временем. Фотоотверждаемая “керамическая” макроэмульсия имеет сложный состав: дисперсионная среда представляет собой суспензию порошка ТКФ в воде, что накладывает дополнительные сложности в формулировке стабильной макроэмульсии. С увеличением содержания эмульгатора (от 0.05 до 1 мас. %) происходит уменьшение среднего размера капель масла в исследуемых эмульсиях от 500 до 14 мкм, что в итоге приводит к повышению их вязкости, при этом все эмульсии остаются стабильными и не расслаиваются спустя 1 нед. (рис. 3).
Рис. 3.
Внешний вид суспензий с различным содержанием эмульгатора: а – сразу после получения суспензий, б – неделю спустя (увеличение содержания эмульгатора от 0 до 1 мас. % слева направо).

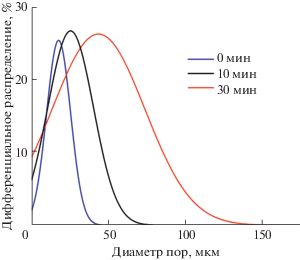
Полученные эмульсии склонны к укрупнению капель дисперсионной фазы из-за первичной коалесценции, а также оствальдовского созревания крупных капель за счет поглощения капель меньшего размера. Для определения стабильности эмульсии во времени и возможности сохранения капель масла заданного размера при хранении было исследовано влияние времени выдержки эмульсии до УФ-облучения на размер и распределение пор по размерам в итоговых керамических образцах. Для этого эмульсию с 0.25 вес. % эмульгатора помещали в силиконовую форму для изготовления композитов цилиндрической формы и подвергали УФ-облучению спустя различные промежутки времени: 0 (сразу после заполнения формы), 10 и 30 мин. На рис. 4 представлены данные РЭМ для керамических материалов, полученных из указанных композитов. Отчетливо видно увеличение размера пор, которое сопровождается ростом толщины керамического каркаса. На рис. 5 представлены данные по распределению пор по размерам в керамических материалах. Происходит увеличение среднего размера пор, а также уширение распределения пор по размерам с общей долей пор >55%.
Рис. 4.
Данные РЭМ для макропористых керамических материалов на основе ТКФ, полученных УФ-полимеризацией эмульсии, содержащей 0.25 вес. % эмульгатора, спустя различные промежутки времени.

Рис. 5.
Распределение пор по размерам для керамических материалов полученных из фотоотверждаемых эмульсий с различной задержкой перед УФ-полимеризацией.
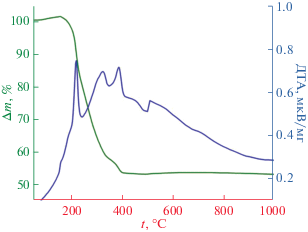
Исследование процессов удаления органической составляющей из полученных композитов масло–гидрогель/ТКФ с помощью дифференциального термического анализа (рис. 6) показало, что использование эмульсий позволяет получить непрерывную сетку масляной фазы, которая при термической обработке не влияет на каркас гидрогель/ТКФ, что позволяет легко удалить парафиновое масло из композита. В свою очередь, высокопористый композитный каркас имеет достаточно тонкие стенки (от 10 до 200 мкм), что позволяет использовать более щадящие температурные программы для удаления полимера несмотря на большое количество экзотермических эффектов во время нагревания.
Рис. 6.
Данные ТГ/ДТА для композитного материала масло–гидрогель/ТКФ, полученного методом фотополимеризации.
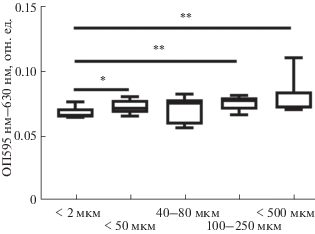
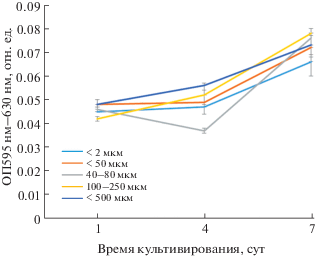
Согласно результатам эксперимента по оценке пролиферации и жизнеспособности клеток с помощью МТТ-теста, все образцы поддерживали деление клеток на протяжении всего времени эксперимента (рис. 7). При этом в конечной точке эксперимента статистически значимые различия наблюдались для образцов с размером пор <50 мкм с диапазоном 100–250 мкм и <500 мкм по сравнению с контрольным образцом с размером пор <2 мкм (рис. 8, 9). По данным РЭМ, морфология клеток керамических образцов со средним размером пор 100–250 мкм отличается от контроля, у них больше отростков и, по-видимому, более активна синтетическая функция, что, скорее всего, будет существенно влиять на дифференцировку клеток in vivo. При наличии пор больших размеров (~500 мкм) в керамических образцах морфология МСК сходна с контролем, поскольку клетки распластываются по всей поверхности поры.
Рис. 7.
Пролиферация МСК на поверхности образцов с разным размером пор в течение 7 сут. Данные представлены в виде медианы (25.75%). Статистическая значимость при p < 0.05 согласно тесту Краскела–Уоллиса с применением критерия Данна для учета множественных сравнений.
ЗАКЛЮЧЕНИЕ
Представленные условия создания фотоотверждаемых дисперсных систем на основе ТКФ позволяют получить стабильные макроэмульсии для получения макропористой керамики. Варьирование концентрации эмульгатора позволяет управлять размером пор в конечной керамике на основе β-Ca3(PO4)2. Варьирование среднего размера пор в керамических материалах на основе трикальциевого фосфата влияет на пролиферацию и морфологию мультипотентных мезенхимных стромальных клеток. Макропористые керамические материалы с порами 100–250 мкм продемонстрировали наибольшее влияние на пролиферацию и жизнеспособность МСК.
Список литературы
Zhu G., Zhang T., Chen M. et al. // Bioact. Mater. 2021. V. 6. № 11. P. 4110. https://doi.org/10.1016/j.bioactmat.2021.03.043
Xie C., Ye J., Liang R. et al. // Adv. Healthc. Mater. 2021. P. 2100408. https://doi.org/10.1002/adhm.202100408
Larionov D.S., Kuzina M.A., Evdokimov P.V. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 3. P. 312. https://doi.org/10.1134/S0036023620030079
Curry A.S., Pensa N.W., Barlow A.M. et al. // Matrix Biol. 2016. V. 52–54. P. 397. https://doi.org/10.1016/j.matbio.2016.02.011
Prasadh S., Wong R.C.W. // Oral Sci. Int. 2018. V. 15. № 2. P. 48. https://doi.org/10.1016/S1348-8643(18)30005-3
Porter J.R., Ruckh T.T., Popat K.C. // Biotechnol. Prog. 2009. https://doi.org/10.1002/btpr.246
Woodard J.R., Hilldore A.J., Lan S.K. et al. // Biomaterials. 2007. V. 28. № 1. P. 45. https://doi.org/10.1016/j.biomaterials.2006.08.021
Chang B.S., Lee C.K., Hong K.S. et al. // Biomaterials. 2000. V. 21. № 12. P. 1291. https://doi.org/10.1016/S0142-9612(00)00030-2
Studart A.R., Gonzenbach U.T., Tervoort E. et al. // J. Am. Ceram. Soc. 2006. V. 89. № 6. P. 1771. https://doi.org/10.1111/j.1551-2916.2006.01044.x
Huo W., Zhang X., Chen Y. et al. // Ceram. Int. 2019. V. 45. № 1. P. 1464. https://doi.org/10.1016/j.ceramint.2018.09.095
Schelm K., Fey T., Dammler K. et al. // Adv. Eng. Mater. 2019. V. 21. № 6. P. 1801362. https://doi.org/10.1002/adem.201801362
Capasso I., Liguori B., Verdolotti L. et al. // Sci. Rep. 2020. V. 10. № 1. P. 612. https://doi.org/10.1038/s41598-019-55582-0
Lopes R.A., Segadães A.M. // Mater. Sci. Eng. A. 1996. V. 209. № 1–2. P. 149. https://doi.org/10.1016/0921-5093(95)10146-2
Kuboki Y., Jin Q., Kikuchi M. et al. // Connect. Tissue Res. 2002. V. 43. № 2–3. P. 529. https://doi.org/10.1080/03008200290001104
Tsuruga E., Takita H., Itoh H. et al. // J. Biochem. 1997. V. 121. № 2. P. 317. https://doi.org/10.1093/oxfordjournals.jbchem.a021589
Karageorgiou V., Kaplan D. // Biomaterials. 2005. V. 26. № 27. P. 5474. https://doi.org/10.1016/j.biomaterials.2005.02.002
Klawitter J.J., Bagwell J.G., Weinstein A.M. et al. // J. Biomed. Mater. Res. 1976. V. 10. № 2. P. 311. https://doi.org/10.1002/jbm.820100212
Eggli P.S., Moller W., Schenk R.K. // Clin. Orthop. Relat. Res. 1988. V. 232. P. 127. https://doi.org/10.1097/00003086-198807000-00017
Hing K.A. // Philos. Trans. R. Soc., A Sci. 2004. V. 362. № 1825. P. 2821. https://doi.org/10.1098/rsta.2004.1466
Hing K.A. // Int. J. Appl. Ceram. Technol. 2005. V. 2. № 3. P. 184. https://doi.org/10.1111/j.1744-7402.2005.02020.x
Gauvin R., Chen Y.C., Lee J.W. et al. // Biomaterials. 2012. V. 33. № 15. P. 3824. https://doi.org/10.1016/j.biomaterials.2012.01.048
Karageorgiou V., Kaplan D. // Biomaterials. 2005. V. 26. № 27. P. 5474. https://doi.org/10.1016/j.biomaterials.2005.02.002
Weber F.E. // Tissue Eng. Part B. Rev. 2019. V. 25. № 5. P. 375. https://doi.org/10.1089/ten.teb.2019.0047
Zadpoor A.A. // Biomater. Sci. 2015. V. 3. № 2. P. 231. https://doi.org/10.1039/C4BM00291A
Reddi A.H. // Cell. 1997. V. 89. № 2. P. 159. https://doi.org/10.1016/S0092-8674(00)80193-2
Zhang Q., Lin S., Zhang T. et al. // Cell Prolif. 2017. V. 50. № 4. P. E12356. https://doi.org/10.1111/cpr.12356
Xiao D., Zhang J., Zhang C. et al. // Acta Biomater. 2020. V. 106. P. 22. https://doi.org/10.1016/j.actbio.2019.12.034
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии