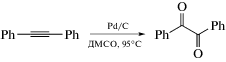Журнал неорганической химии, 2021, T. 66, № 11, стр. 1519-1522
Окисление дифенилацетилена в присутствии гетерогенных углеродсодержащих катализаторов на основе палладия, графена и оксида графена
С. С. Шаповалов a, *, А. С. Попова a, b, Ю. В. Иони a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
b Российский университет дружбы народов
117198 Москва, ул. Миклухо-Маклая, 6, Россия
* E-mail: schss@yandex.ru
Поступила в редакцию 21.04.2021
После доработки 07.07.2021
Принята к публикации 08.07.2021
Аннотация
Разработаны эффективные методы окисления дифенилацетилена в 1,2-дифенилдикетон (бензил) в ДМСО как на коммерчески доступных гетерогенных углеродсодержащих палладиевых катализаторах, так и на композитных материалах Pd-графен и Pd-оксид графена.
ВВЕДЕНИЕ
Производные 1,2-дикетонов являются важными составляющими биологически активных молекул и природных продуктов [1], они широко применяются для синтеза различных органических материалов [2]. В частности, производные бензила, также известные как диарил-1,2-дикетоны, нашли применение в качестве противоопухолевых агентов [3], светочувствительных компонентов в фотоотверждаемых покрытиях и полимерах [4], ингибиторов коррозии [5] и т.д.
Получение таких соединений широко изучено. Наиболее простым и предпочтительным методом является окисление 1,2-диалкиларинов. Однако этот способ имеет ряд недостатков: жесткие условия и длительное время реакции, низкий выход, большинство окислителей применимы только для самого распространенного дифенилацетилена [6, 7].
Несмотря на то, что каталитическое окисление дифенилацетилена достаточно широко изучено [8], применению гетерогенных катализаторов уделено гораздо меньше внимания. Ранее сообщалось об использовании металлов, закрепленных на углероде, в качестве катализаторов окисления дифенилацетилена диметилсульфоксидом (ДМСО) [9] и пиридин-N-оксидом [10]. Составы Pd/C и Pt/C оказались наиболее активными, а Rh/C, Ru/C, Ni/C, Ir/C, Au/C не катализируют реакцию. Следует отметить специфичность данного окисления: использование толуола в качестве растворителя не приводит к образованию 1,2-дикетонов. Предложенный каталитический цикл [9] предполагает образование комплексов Pd(II) и диметилсульфида.
Цель настоящей работы – изучение закономерностей протекания реакции окисления дифенилацетилена в ДМСО с гетерогенными катализаторами, содержащими палладий на графене и его оксиде без добавления дополнительных окислителей, кроме кислорода воздуха. Эти носители [11, 12] широко используются для создания катализаторов на основе наночастиц благородных металлов [13–24].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Химические реактивы (10% палладий на угле (влажность 50%), 3% палладий на активированном угле, 1% палладий на активированном угле, 1% палладий на активированном угле (4–8 mesh, размер частиц 2.36–4.75 мм), все реактивы фирмы Acros Organics) и растворители (ООО “Химмед”) получали из коммерческих источников и использовали без дополнительной очистки. Для контроля полноты прохождения реакции использовали пластины для тонкослойной хроматографии (ТСХ) Macherey-Nagel c УФ-индикатором F254. ИК-спектры снимали на ИК-Фурье-спектрометре Bruker Alpha с приставкой Platinum ATR для получения спектров нарушенного полного внутреннего отражения (НПВО).
Для получения наночастиц палладия на поверхности оксида графена использовали раствор PdCl2 в разбавленной соляной кислоте, который добавляли при перемешивании к дисперсии оксида графена и восстанавливали избытком сухого NaBH4 с последующим центрифугированием (6000 об/мин) [24].
Для восстановления образцов Pd/оксид графена в Pd/графен образцы редиспергировали в изопропаноле посредством ультразвуковой обработки и нагревали в автоклаве при температуре ~300°С в течение 24 ч (рабочее давление 100 атм) [24].
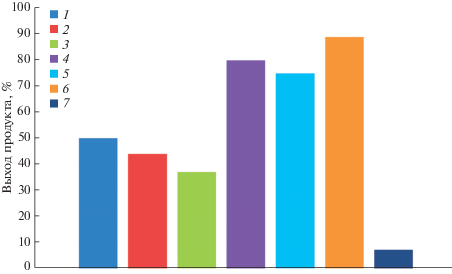
Навески катализатора (мольное содержание палладия приведено в табл. 1) и дифенилацетилен (0.2 ммоль) растворяли в 1 мл ДМСО, полученную суспензию нагревали на масляной бане при температуре 95°С, контроль за протеканием реакции осуществляли с помощью ТСХ (система толуол : гептан = 1 : 1).
Таблица 1.
Окисление дифенилацетилена в присутствии Pd/C
| Катализатор | Количество Pd, мол. % | Время нагрева, ч | Выход, % |
|---|---|---|---|
| 4% Pd/графен | 10 | 973 | 50 |
| 1% Pd/графен | 10 | 973 | ‒ |
| 4% Pd/оксид графена | 10 | 806 | 44 |
| 4% Pd/оксид графена | 5 | 950 | 37 |
| 1% Pd/C | 10 | 25.5 | 80 |
| 3% Pd/C | 10 | 49.5 | 75 |
| 10% Pd/C | 10 | 49.5 | 89 |
| 1% 2.36–4.75 мм Pd/C | 10 | 145.5 | 7 |
Полученный бензил выделяли с помощью колоночной хроматографии (длина колонки 25 см, диаметр 2 см, элюент – смесь толуола и гептана в соотношении 1 : 1) на силикагеле. Фракцию, содержащую продукт, упаривали досуха и взвешивали.
ИК-спектр, см–1 (НПВО): 3060 о.сл, ш, 1670 ср, 1596 сл, 1449 сл, 1324 о.сл, 1265 сл, 1210 ср, 1175 сл, 1098 о.сл, 1072 о.сл, 1024 о.сл, 1000 о.сл, 936 о.сл, 872 сл, 792 о.сл, 733 о.с, ш, 717 о.сл, 701 о.сл, 684 сл, 642 о.с, 615 о.сл, 466 о.сл.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Окисление толана или дифенилацетилена проводили при температуре 95°С в ДМСО на воздухе (схема 1). В качестве катализаторов использовали как ряд композиционных 2D-материалов Pd/графен и Pd/оксид графена, так и коммерчески доступные образцы палладия, нанесенного на сажу. Как упоминалось ранее, основная часть продукта образуется в течение 24 ч [8–10]. В нашем случае большое время нагревания обусловлено необходимостью обеспечить полную конверсию дифенилацетилена (табл. 1). Стоит отметить селективность данного процесса: образуется только 1,2-дифенилдикетон со следовыми количествами 2,3-дифенил-1-инденона, окрашивающими продукт реакции в ярко-желтый цвет.
Для образца 1% Pd/графен образуются следовые количества бензила и конверсии толана не происходит. При использовании образца с большей концентрацией палладия (4% Pd/графен) реакция протекает более активно и выход продукта составляет 50%. Следует отметить, что замена графена на его оксид в качестве носителя не приводит к существенному увеличению эффективности катализатора и выход бензила для 4% Pd/оксид графена даже через 800 ч не превышает 44%.
Наиболее эффективными катализаторами данной реакции оказались коммерчески доступные образцы палладия, закрепленного на саже: существенно снижается время достижения максимальной конверсии толана, и в случае образцов 1% Pd/C и 10% Pd/C удается достичь выхода бензила до 80 и 89% соответственно. Однако катализатор, содержащий крупные углеродные частицы (2.36–4.75 мм), показывает очень низкую активность (выход целевого продукта составляет всего 7%). Это свидетельствует о том, что изменение морфологии нанокомпозитов палладий-графен и палладий-оксид графена может привести к увеличению выхода реакции (рис. 1).
ЗАКЛЮЧЕНИЕ
Гетерогенные катализаторы, содержащие палладий, нанесенный на ряд углеродсодержащих носителей, эффективны в реакции окисления дифенилацетилена в ДМСО до 1,2-дифенилдикетона. Реакция обладает высокой селективностью. Нанокомпозиты палладий-графен и палладий-оксид графена показывают умеренную каталитическую активность, но уступают коммерчески доступному катализатору (10% Pd/уголь).
Список литературы
Singh S.K., Saibaba V., Ravikumar V. et al. // Bioorg. Med. Chem. 2004. V. 12. P. 1881. https://doi.org/10.1016/j.bmc.2004.01.033
Mahabusarakam W., Deachathai S., Phongpaichit S. et al. // Phytochemistry. 2004. V. 65. P. 1185. https://doi.org/10.1016/j.phytochem.2004.03.006
Alkahraman Y.M.S.A., Yasinzai M., Singh G.S. // Arch. Pharm. Res. 2012. V. 35. P. 1009. https://doi.org/10.1007/s12272-012-0608-7
Marder S., Zesheng A., Barlow S. et al. Pat. 2008. US2008/223444.
Meyer-Luckel H., Paris S., Kielbassa A.M. Pat. 2006. US2006/167129.
Yuan L.-Z., Hamze A., Alami M. et al. // Synthesis. 2017. V. 49. P. 504. https://doi.org/10.1055/s-0036-1588608
Xue J.-W., Zeng M., Hou X. et al. // Asian J. Org. Chem. 2018. V. 7. P. 212. https://doi.org/10.1002/ajoc.201700556
Nobuta T., Tada N., Hattori K. et al. // Tetrahedron Lett. 2011. V. 52. № 8. P. 875. https://doi.org/10.1016/j.tetlet.2010.12.029
Mori Sh., Takubo M., Yanase T. et al. // Adv. Synth. Catal. 2010. V. 352. P. 1630. https://doi.org/10.1002/adsc.201000173
Sawama Y., Takubo M., Mori Sh. et al. // Eur. J. Org. Chem. 2011. P. 3361. https://doi.org/10.1002/ejoc.201001641
Зиатдинов А.М., Саенко Н.С., Скрыльник П.Г. // Журн. неорган. химии. 2020. Т. 65. № 1. С. 131. https://doi.org/10.31857/S0044457X20010213
Зиатдинов А.М., Саенко Н.С., Скрыльник П.Г. // Изв. АН. Сер. хим. 2017. Т. 66. № 5. С. 837. https://doi.org/10.1007/s11172-017-1816-6
Nishina Y., Miyata J., Kawai R. et al. // RSC Adv. 2012. V. 2. P. 9380. https://doi.org/10.1039/C2RA21185H
Khan M., Shaik M.R., Adil S.F. et al. // Sci. Rep. 2020. V. 10. № 11728. https://doi.org/10.1038/s41598-020-68124-w
Blandez F., Esteve-Adell I., Alvaro M. et al. // Catal. Sci. Technol. 2015. V. 5. P. 2167. https://doi.org/10.1039/c4cy01486c
Kuniyil M., Kumar J.V.S., Adil S.F. et al. // Catalysts. 2019. V. 9. P. 469. https://doi.org/10.3390/catal9050469
Scheuermann G.M., Rumi L., Steurer P. et al. // JACS. 2009. V. 131. P. 8262. https://doi.org/10.1021/ja901105a
Bong S., Uhm S., Kim Y.-R. et al. // Electrocatalysis. 2010. V. 1. P. 139. https://doi.org/10.1007/s12678-010-0021-2
Wei Z., Pan R., Hou Y. et al. // Sci. Rep. 2015. V. 5. P. 15664. https://doi.org/10.1038/srep15664
Santra S., Hota P.K., Bhattacharyya R. et al. // ACS Catal. 2013. V. 3. P. 2776. https://doi.org/10.1021/cs400468h
Premi C., Jain N. // RSC Adv. 2016. V. 6. P. 74961. https://doi.org/10.1039/C6RA09996C
Rana S., Maddila S., Yalagala K. et al. // Appl. Catal. A. Gen. 2015. V. 505. P. 539. https://doi.org/10.1016/j.apcata.2015.07.018
Yang Q., Quan Z., Wu S. et al. // Tetrahedron. 2015. V. 71. P. 6124. https://doi.org/10.1016/j.tet.2015.06.103
Иони Ю.В., Воронов В.В., Наумкин А.В. и др. // Журн. неорган. химии. 2015. Т. 60. № 6. С. 783. https://doi.org/10.1134/S0036023615060066
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии