Журнал неорганической химии, 2021, T. 66, № 10, стр. 1450-1456
Фазовые равновесия в трехкомпонентной взаимной системе Na+,Ba2+||Br–,${\mathbf{WO}}_{{\mathbf{4}}}^{{{\mathbf{2}}--}}$
М. А. Сухаренко a, *, И. К. Гаркушин a, В. Т. Осипов a, А. В. Радченко a
a Самарский государственный технический университет
443100 Самара, ул. Молодогвардейская, 244, Россия
* E-mail: sukharenko_maria@mail.ru
Поступила в редакцию 25.02.2021
После доработки 15.05.2021
Принята к публикации 17.05.2021
Аннотация
В трехкомпонентной взаимной системе Na+,Ba2+||Br–,${\text{WO}}_{4}^{{2 - }}$ проведено разбиение на симплексы конверсионным методом, рассчитаны основные термодинамические характеристики (изменения энтальпии и энергии Гиббса) в точке конверсии для стандартных условий. Определено направление протекания реакции обмена в трехкомпонентной взаимной системе и стабильные продукты данной реакции. Описано химическое взаимодействие и построено древо фаз системы. Для стабильных и секущих элементов проведен прогноз числа и состава кристаллизующихся фаз. Методами ДТА и РФА подтверждено разбиение системы Na+,Ba2+||Br–,${\text{WO}}_{4}^{{2 - }}$ на симплексы: определена стабильная диагональ квадрата составов, установлены кристаллизующиеся фазы, выявлены температура плавления и состав квазидвойной эвтектики. Экспериментальное исследование системы проведено методом ДТА. Определены температуры плавления и составы сплавов, отвечающих тройным точкам нонвариантных равновесий. Фазовые равновесия описаны для каждого стабильного элемента тройной взаимной системы, построено древо кристаллизации. Проекция фазового комплекса системы на квадрат составов представлена четырьмя полями кристаллизации исходных веществ, доминирующим из которых является поле кристаллизации вольфрамата бария.
ВВЕДЕНИЕ
Вольфрамат бария находит широкое применение в различных областях промышленности, медицине, науке. Так, например, кристаллы вольфрамата бария со структурой шеелита используются в качестве нелинейно-оптических и лазерных сред. Структура этих кристаллов допускает введение активаторных ионов Nd3+ в концентрациях, достаточных для получения лазерной генерации на длинах волн 1030–1085 и 1310–1360 нм с низким порогом накачки и высокими мощностями излучения как в импульсном, так и в непрерывном режиме при комнатной температуре [1].
Вольфрамат бария образует кристаллы тетрагональной сингонии. Кристаллы вольфрамата бария и стронция используются как высокоэффективные материалы для ВКР-лазеров [2]. Перовоскитоподобный вольфрамат бария-натрия обладает протонной проводимостью [3], поэтому может быть использован в различных электрохимических устройствах.
Наночастицы вольфрамата бария находят широкое применение [4, 5] в лучевой терапии. Обнаружено, что наночастицы BaWO4 более эффективно усиливают образование гидроксильных радикалов при облучении, чем наночастицы CaWO4. При искусственном тестировании наночастицы BаWO4 показали более низкую токсичность, чем наночастицы CaWO4.
Разработка новых материалов функционального назначения и изучение их свойств невозможны без детального исследования фазовых диаграмм [1–10]. Благодаря ценным свойствам и широкой области применения вольфрамата бария и других щелочных и щелочноземельных элементов, исследование фазовых диаграмм солевых композиций на его основе и разработка способов его получения являются важной задачей современного материаловедения [11–13].
ТЕОРЕТИЧЕСКИЙ АНАЛИЗ
Трехкомпонентная взаимная система Na+,Ba2+||Br–,${\text{WO}}_{4}^{{2 - }}$ состоит из четырех индивидуальных веществ, термические и термодинамические свойства которых приведены в табл. 1 [14]. Элементами огранения трехкомпонентной взаимной системы Na+,Ba2+||Br–,${\text{WO}}_{4}^{{2 - }}$ являются четыре двухкомпонентные системы: NaBr–BaBr2, NaBr–Na2WO4, Na2WO4–BaWO4, BaBr2–BaWO4 [15–18] эвтектического типа. Данные по температурам плавления и составам двойных эвтектик приведены в табл. 2.
Таблица 1.
Термические и термодинамические свойства индивидуальных веществ
| Вещество | M, г/моль | tпл, °С | Полиморф-ный переход, °С | ΔfH°, кДж/моль | ΔfG°, кДж/моль |
ΔmH, кДж/моль | ΔmS, Дж/моль K |
Ссылка |
|---|---|---|---|---|---|---|---|---|
| NaBr | 102.89 | 747.0 | – | –361.4 | –349.4 | 26.2 | 86.9 | [14] |
| Na2WO4 | 293.83 | 698.0 | α→β 576, β→γ 589 |
–1470.0 | –1356.1 | 31.4 | 159.5 | [14] |
| BaBr2 | 297.14 | 857.0 | –757.8 | –738.6 | 32.2 | 150.7 | [14] | |
| BaWO4 | 385.16 | 1475.0 | –1698.7 | –1591.6 | 96.9 | 146.4 | [14] |
Таблица 2.
Фазовые равновесия в трехкомпонентной взаимной системе Na+,Ba2+||Br–,${\text{WO}}_{4}^{{2 - }}$
| Элементы диаграммы | Фазовое равновесие |
|---|---|
| Поля | |
| е1Е1е5Е2е2 | ж ⇄ NaBr |
| e1E1e3 | ж ⇄α-Na2WO4 |
| e2E2e4 | ж ⇄ BaBr2 |
| E3E1e5E2e4 | ж ⇄ BaWO4 |
| Линии | |
| е1Е1 | ж ⇄ α-Na2WO4 + NaBr |
| E3E1 | ж ⇄ BaWO4 + α-Na2WO4 |
| E1e5E2 | ж ⇄ NaBr + BaWO4 |
| е2Е2 | ж ⇄ NaBr + BaBr2 |
| e4Е2 | ж ⇄ BaWO4 + BaBr2 |
| Точки | |
| Е1 | ж ⇄ NaBr + BaWO4 + α-Na2WO4 |
| Е2 | ж ⇄ NaBr + BaBr + BaWO4 |
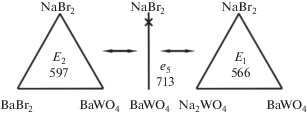
Разбиение на симплексы трехкомпонентной взаимной системы Na+,Ba2+||Br–,${\text{WO}}_{4}^{{2 - }}$ проведено термодинамическим методом. В точке полной конверсии K протекает реакция обмена:
По данным, представленным в табл. 1, проведен термодинамический расчет для ${{\Delta }_{r}}H_{{{\text{298}}}}^{^\circ }$ и ${{\Delta }_{r}}G_{{{\text{298}}}}^{^\circ }{\text{:}}$
Таким образом, для стандартных условий получаем:
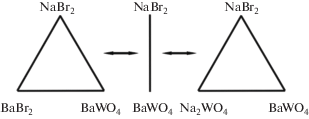
Как видно из расчетов, реакция протекает в прямом направлении. Продуктами реакции является стабильная пара солей NaBr и BaWO4. Секущая NaBr–BaWO4 представляет собой общий элемент двух стабильных треугольников: NaBr–BaBr2–BaWO4 и NaBr–Na2WO4–BaWO4. На рис. 1 приведено древо фаз трехкомпонентной взаимной системы Na,Ba||Br,WO4. На основании полученного древа фаз проведен прогноз числа и состава кристаллизующихся фаз в каждом симплексе системы. В стабильном треугольнике NaBr–BaBr2–BaWO4 кристаллизующимися фазами являются соли, лежащие в вершинах треугольника: NaBr, BaBr2, BaWO4. В стабильном треугольнике NaBr–Na2WO4–BaWO4 кристаллизуются три твердые фазы: NaBr, BaWO4, α-Na2WO4 (ограниченный твердый раствор на основе α-фазы).
ОБЪЕКТЫ И МЕТОДЫ
Из четырех двухкомпонентных систем в литературе приведены данные по трем системам [16–18].
Двухкомпонентная система NaBr–Na2WO4. По этой системе имеются следующие данные [16]: образование двойной эвтектики с температурой плавления 556°С и составом 75% Na2WO4 + 25% (NaBr)2. Твердые фазы – NaBr, Na2WO4.
Экспериментально нами получены следующие данные: двойная эвтектика образуется при 569°С и составе 75% Na2WO4 + 25% (NaBr)2. Твердые фазы – NaBr, Na2WO4. Для дальнейших исследований приняты экспериментальные данные.
Двухкомпонентная система NaBr–BaBr2. По системе имеются следующие данные [17]: происходит образование эвтектики с температурой плавления 600°С и составом 57.1% BaBr2 + 42.9% (NaBr)2. Твердые фазы – NaBr, BaBr2.
Двухкомпонентная система Na2WO4–BaWO4. В системе образуется эвтектика при температуре 680°С и составе 96% Na2WO4 + 4% BaWO4. Твердые фазы – BaWO4 и α-Na2WO4 [18].
Исследование фазовых равновесий в трехкомпонентной взаимной системе Na+,Ba2+||Br–,${\text{WO}}_{4}^{{2 - }}$ и элементах ее огранения проводили с помощью дифференциального термического анализа (ДТА) на установке с верхним подводом термопар [19]. Установка включает печь шахтного типа, в которую опускаются платиновые микротигли (изделия № 108-1, 108-2, 108-3 по ГОСТ 13498-68) с исследуемым составом и индифферентным веществом – свежепрокаленным Al2O3 марки “ч. д. а.”. Холодные спаи термостатировали при 0°С с помощью сосуда Дьюара с тающим льдом. Сигнал от термопар поступал на АЦП и преобразовывался в цифровой сигнал с выводом на компьютер. Фиксировали температурную и дифференциальную кривые [19]. Градуировку термопар осуществляли по известным температурам плавления полиморфных модификаций безводных неорганических солей [14]. Исследования проводили до 750°С.
Скорость нагрева (охлаждения) образцов составляла 10–15 град/мин, точность измерения температур ±2.5°С, точность взвешивания составов на аналитических весах ±0.0001 г. Составы всех смесей, приведенные в настоящей работе, выражены в молярных концентрациях эквивалентов, температуры – в градусах Цельсия. Масса исходных смесей составляла 0.3 г.
Рентгенофазовый анализ (РФА) проводили с помощью метода Дебая–Шерера (метод порошка) на дифрактометре ARL X’TRA. Прибор сконструирован по принципу вертикальной геометрии Брэгга–Брентано. Съемку дифрактограмм осуществляли в CuKα-излучении с никелевым β-фильтром. Режим съемки образца: напряжение на трубке 35 кВ, ток рентгеновской трубки 10 мА, скорость съемки 1 град/мин, угловые отметки через ${{\theta }} = 1^\circ .$ Образцы для РФА отжигали в течение 2 ч в платиновых тиглях при температуре на 10–20°С ниже температур конечного затвердевания расплавов, затем закаляли во льду, перетирали в агатовой ступке и запрессовывали в кюветы. Идентификацию фаз осуществляли по межплоскостным расстояниям d (нм) и относительным интенсивностям I/I0 (%) рефлексов с использованием картотеки ICDD и программы PCPDFWIN. Съемку рентгенограмм проводили в лаборатории РФА кафедры физики СамГТУ.
В работе использовали реактивы следующих марок: NaBr “х. ч.” (ТУ 6-09-5331-87, содержание основного вещества 99.9%), BaBr2 “х. ч.” (ТУ 6-09-3633-79, содержание основного вещества 99.9%), Na2WO4 “ч.” (ГОСТ 18289-78, содержание основного вещества 99.0 мас. %), BaWO4 “ч.” (ГОСТ 4463-76, содержание основного вещества 99.0%). Температуры плавления исходных солей, кроме BaWO4, определенные методом ДТА (при точности измерения ±2.5°С), равны: NaBr – 747°С, BaBr2 – 857°С, Na2WO4 – 698°C, т.е. влияние имеющихся примесей на температуры плавления исходных солей незначительно. Поэтому были приняты литературные данные для всех четырех солей [19]. Исходные реактивы были предварительно высушены и после охлаждения в сухом боксе помещены в бюксы, а бюксы – в эксикатор с осушителем (силикагель).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
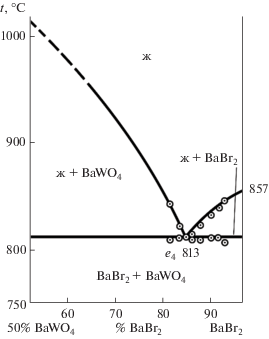
Двухкомпонентная система BaBr2–BaWO4 экспериментально изучена методом ДТА. Т–х‑диаграмма системы представлена на рис. 2. В ходе исследования выявлены температура плавления и состав сплава двойной эвтектики e4: 813°C, 13.5% BaWO4, 86.5% BaBr2.
Двухкомпонентная система NaBr–Na2WO4 исследована методом ДТА с целью уточнения данных [20]. Выявлены координаты двойной эвтектики e1: температура плавления 564°C, состав 25% (NaBr)2 + 75% α-NaWO4. Данные эксперимента расходятся с литературными данными. В дальнейших исследованиях использовали данные, полученные авторами.
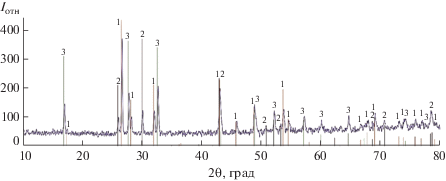
Для подтверждения древа фаз был проведен рентгенофазовый анализ образца произвольного состава, принадлежащего нестабильной диагонали (66.6% Na2WO4 +33.4% BaBr2). Смесь из 1.9925 г Na2WO4 и 1.0075 г BaBr2 гомогенизировали в ацетоне, помещали в печь шахтного типа, расплавляли, снижали температуру до 540°С и выдерживали в течение 2 ч. Дифрактограмма закаленного во льду образца показана на рис. 3. В нем установлены следующие твердые фазы: BaWO4, NaBr и α-Na2WO4 (ОТР на основе вольфрамата натрия), являющиеся вершинами стабильного треугольника.
Рис. 3.
Дифрактограмма образца исходного состава 33.4% BaBr2 + 66.6% Na2WO4 (1 – BaWO4, 2 – NaBr, 3 – α‑Na2WO4).
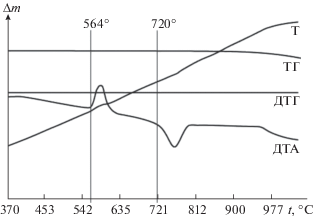
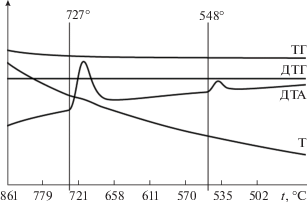
Подтверждение экзотермического характера реакции обмена (термодинамического варианта разбиения) проведено термогравиметрическим методом (образец состава 50% Na2WO4 + 50% BaBr2, точка конверсии трехкомпонентной взаимной системы Na+,Ba2+||Br–,${\text{WO}}_{4}^{{2 - }}$). Дериватограммы нагрева и охлаждения смеси 0.4972 г Na2WO4 и 0.5028 г BaBr2 приведены на рис. 4 и 5. Определена температура начала реакции – 564°C.
Последним вариантом подтверждения разбиения является экспериментальное исследование стабильной диагонали NaBr–BaWO4.
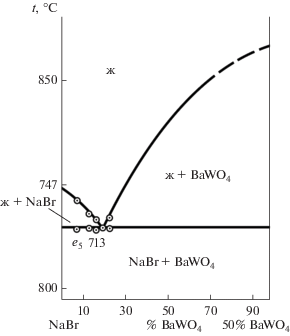
Квазибинарная система NaBr–BaWO4 была исследована методом ДТА. Т–х‑диаграмма стабильной секущей NaBr–BaWO4 приведена на рис. 3. Выявлены характеристики сплава, отвечающего квазидвойной эвтектике: температура плавления 713°С, состав 10% BaWO4 + 90% (NaBr)2.
Трехкомпонентная взаимная система Na+,Ba2+||Br–,${\text{WO}}_{4}^{{2 - }}.$ Квадрат составов трехкомпонентной взаимной системы Na+,Ba2+||Br–,${\text{WO}}_{4}^{{2 - }}$ приведен на рис. 7, он состоит из двух стабильных треугольников: NaBr–NaWO4–BaWO4 и NaBr–BaBr2–BaWO4, разделенных стабильной диагональю – квазибинарной системой NaBr–BaWO4.
Рис. 7.
Проекция фазового комплекса трехкомпонентной взаимной системы Na+,Ba2+||Br–,${\text{WO}}_{4}^{{2 - }}$ на квадрат составов.
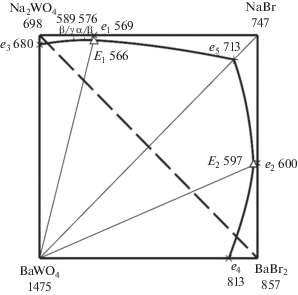
Стабильный треугольник NaBr–Na2WO4–BaWO4. Все элементы огранения стабильного треугольника являются эвтектическими системами с температурами плавления двойных эвтектик: е1 569°С, е3 680°С, е5 713°С. Состав и температура плавления тройной эвтектики выявлены постепенным добавлением вольфрамата бария к составу самой низкоплавкой двойной эвтектики е1. Температура плавления тройного эвтектического сплава Е1 566°С, ее состав – 25.0% (NaBr)2 + + 74.5% Na2WO4 + 0.5% BaWO4.
Стабильный треугольник NaBr–BaBr2–BaWO4 исследован аналогичным образом. К составу самой низкоплавкой двойной эвтектики e2 600°С постепенно добавляли наиболее тугоплавкий компонент – BaWO4. Выявили температуру плавления и состав тройного эвтектического сплава E2: 597°C, 42.5% (NaBr)2 + 56.5% BaBr2 + 1.0% BaWO4.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Трехкомпонентная взаимная система Na+,Ba2+||Br–,${\text{WO}}_{4}^{{2 - }}$ является необратимо-взаимной системой со сдвигом равновесия в сторону пары солей NaBr–BaWO4. Данные термодинамического расчета подтверждены экспериментальными исследованиями методами ДТА и РФА. На дифрактограмме образца состава 66.6% Na2WO4 + + 33.4% BaBr2 присутствуют следующие твердые фазы: BaWO4, NaBr и α-Na2WO4 (ОТР). Наличие в образце вольфрамата натрия говорит о том, что не весь Na2WO4 прореагировал, поскольку в исходной смеси был взят с избытком. Таким образом, экспериментально установлено, что бромид натрия и вольфрамат бария являются стабильными продуктами реакции обмена трехкомпонентной взаимной системы Na+,Ba2+||Br–,${\text{WO}}_{4}^{{2 - }}.$ Экспериментальное изучение системы NaBr–BaWO4 методом ДТА показало, что данная система является эвтектической. Фазовая диаграмма (рис. 6) представлена четырьмя полями: выше линии ликвидуса – однофазное поле жидкого состояния (ж), ниже линии солидуса – поле совместного существования двух твердых фаз – NaBr + BaWO4, а также два двухфазных поля – ж + NaBr и ж + + BaWO4. По пересечению ветвей первичной кристаллизации и эвтектической прямой выявлены состав и температура плавления квазидвойного эвтектического сплава. Квазидвойной эвтектике соответствует фазовое равновесие ж ⇄ NaBr + + BaWO4.
Был проведен термогравиметрический анализ образца состава точки полной конверсии К (50% Na2WO4 + 50% BaBr2). Выявленная температура начала реакции (564°C) ниже температуры плавления наиболее низкоплавкой тройной эвтектики Е1 (566°C). В процессе нагрева потеря массы участвующих в реакции веществ незначительна (рис. 4 и 5).
В треугольнике NaBr–BaBr2–BaWO4 кристаллизуются три твердые фазы: бромид натрия, бромид бария и вольфрамат бария. Эти фазы подтверждают прогноз числа и состава кристаллизующихся фаз (рис. 1). В стабильном треугольнике NaBr–Na2WO4–BaWO4 кристаллизуются три твердые фазы: бромид натрия, вольфрамат натрия в α-модификации (ОТР), вольфрамат бария, что, в свою очередь, также подтверждает прогноз числа и состава кристаллизующихся фаз.
Проекция ликвидуса трехкомпонентной взаимной системы Na+,Ba2+||Br–,${\text{WO}}_{4}^{{2 - }}$ на квадрат составов представлена четырьмя полями кристаллизации: бромида натрия, бромида бария, вольфрамата натрия (в α-модификации), вольфрамата бария (рис. 7). Самое большое поле кристаллизации принадлежит вольфрамату бария – наиболее тугоплавкому компоненту. В табл. 2 приведены уравнения фазовых реакций для различных элементов фазовой диаграммы трехкомпонентной взаимной системы Na+,Ba2+||Br–,${\text{WO}}_{4}^{{2 - }}.$ Полученные данные позволили построить древо кристаллизации трехкомпонентной взаимной системы Na+,Ba2+||Br–,${\text{WO}}_{4}^{{2 - }}$ (рис. 8). Видно, что самая низкоплавкая эвтектика Е1 566°С принадлежит стабильному треугольнику NaBr–Na2WO4–BaWO4.
ЗАКЛЮЧЕНИЕ
Термодинамическим методом проведено разбиение на симплексы трехкомпонентной взаимной системы Na+,Ba2+||Br–,${\text{WO}}_{4}^{{2 - }},$ которое подтверждено экспериментальными данными ДТА и РФА. Построены древо фаз и древо кристаллизации системы.
Правильность теоретического разбиения на симплексы и древо фаз системы экспериментально подтверждены методами РФА и ДТА. Проведено экспериментальное исследование стабильных треугольников трехкомпонентной взаимной системы Na+,Ba2+||Br–,${\text{WO}}_{4}^{{2 - }}$ методом ДТА. Выявлены координаты тройных эвтектических сплавов.
Список литературы
Garkushin I.K., Ragrina M.S., Sukharenko M.A. // Russ. J. Inorg. Chem. 2018. V. 63. № 1. P. 98. https://doi.org/10.1134/S0036023618010084 [Гаркушин И.К., Рагрина М.С., Сухаренко М.А. // Журн. неорг. химии. 2018. Т. 63. № 1. С. 94. https://doi.org/10.7868/S0044457X18010130]
Sang S.H., Guo X.F., Zhang T.T. et al. // Russ. J. Inorg. Chem. 2021. V. 66. № 3. P. 374. https://doi.org/10.1134/S0036023621030141
Mamedov F.M., Babanly D.M., Amiraslanov I.R. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 11 P. 1747. https://doi.org/10.1134/S0036023620110121
Aliev I.I., Mamedova N.A., Sadygov F.M. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 10. P. 1585. https://doi.org/10.1134/S0036023620100010
Asadov M.M., Akhmedova N.A., Mamedova S.R. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 7. P. 1061. https://doi.org/10.1134/S0036023620070013
Likhacheva S.S., Egorova E.M., Garkushin I.K. // Russ. J. Inorg. Chem. 2020. V. 65. № 7. P. 1047. https://doi.org/10.1134/S0036023620070141
Soliev L. // Russ. J. Inorg. Chem. 2020. V. 65. № 2. P. 212. https://doi.org/10.1134/S0036023620020187
Danilov V.P., Frolova E.A., Kondakov D.F. et al. // Russ. J. Inorg. Chem 2019. V. 64. № 9. P. 1165. https://doi.org/10.1134/S0036023619090067
Mazunin S.A., Noskov M.N., Elsukov A.V. // Russ. J. Inorg. Chem. 2019. V. 64. № 2. P. 257. https://doi.org/10.1134/S003602361902013X
Rasulov A.I., Akhmedova P.A., Gamataeva B.Yu. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 1. P. 135. https://doi.org/10.1134/S0036023619010169
Kochkarov Z.A., Zhizhuev R.A., Kharaev A.M. // Russ. J. Inorg. Chem. 2019. T. 64. № 3. P. 393. https://doi.org/10.1134/S0036023619030112
Kochkarov Z.A., Sokurova Z.A., Kochkarov Z.Z. // Russ. J. Inorg. Chem. 2018. T. 63. № 7. P. 944. https://doi.org/10.1134/S0036023618070094
Garkushin I.K., Burchakov A.V., Sukharenko M.A. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 7. P. 1398. https://doi.org/10.1134/S003602362009003X
Термические константы веществ. Вып. IX–X. Таблицы принятых значений: Na, Ba / Под ред. Глушко В.П. М., 1981. 297 с.
Диаграммы плавкости солевых систем. Ч. III / Под ред. Посыпайко В.И., Алексеевой Е.А. М.: Металлургия, 1977. 204 с.
Диаграммы плавкости солевых систем. Ч. I / Под ред. Посыпайко В.И., Алексеевой Е.А. М.: Металлургия, 1977. 416 с.
Воскресенская Н.К., Евсеева Н.Н., Беруль С.И., Верещитина И.П. Справочник по плавкости систем из безводных неорганических солей. Т. 1. Двойные системы. М.–Л.: АН СССР, 1961. 848 с.
Гаркушин И.К., Игнатьева Е.О., Бехтерева Е.М., Бамбуров В.Г. Физико-химическое взаимодействие в системах из галогенидов, хроматов, молибдатов и вольфраматов лития, натрия и калия. Екатеринбург: РИО УрО РАН, 2013. 169 с.
Мощенский Ю.В. Дифференциальный сканирующий колориметр ДСК-500 // Приборы и техника эксперимента. 2003. № 6. С. 143.
Ковба Л.М. Рентгенография в неорганической химии. М.: Изд-во МГУ, 1991. 256 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии