Журнал неорганической химии, 2021, T. 66, № 10, стр. 1434-1440
Термодинамические свойства Sm2Hf2O7
А. В. Гуськов a, *, П. Г. Гагарин a, В. Н. Гуськов a, А. В. Тюрин a, К. С. Гавричев a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: a.gus@igic.ras.ru
Поступила в редакцию 12.04.2021
После доработки 26.04.2021
Принята к публикации 27.04.2021
Аннотация
Гафнат самария со структурой пирохлора синтезирован обратным осаждением с конечным отжигом образца при 1823 K и идентифицирован с помощью рентгенофазового и химического анализа, а также электронной микроскопии. Методами релаксационной и адиабатической калориметрии выполнены измерения молярной теплоемкости в интервале температур 4–347 K и рассчитаны температурные зависимости энтропии, приращения энтальпии и приведенной энергии Гиббса. Определен общий вид аномалии Шоттки в области низких температур.
ВВЕДЕНИЕ
Среди многочисленных соединений лантаноидов пирохлоры Ln2M2O7 (M = Zr, Hf) выделяются высокой химической стойкостью и отсутствием фазовых переходов вплоть до температур разупорядочения и превращения в дефектный флюорит при 1800–2700 K [1–4]. Эти свойства и относительно низкая теплопроводность [5] вызывают интерес исследователей к пирохлорам Ln2M2O7 как веществам, перспективным для разработки керамических материалов для термобарьерных (Thermal Barrier Coatings, TBC) и коррозионно-защитных (Environmental Barrier Coatings, EBC) покрытий для газотурбинных энергетических установок [6–9]. Эти вещества могут применяться также в качестве компонентов твердых электролитов для твердооксидных топливных элементов (Solid Oxide Fuel Cells, SOFC) [10, 11], сцинтилляторов [12–14], диэлектриков [15] и др. Устойчивость к ионизирующему излучению позволяет использовать их в атомной промышленности [16, 17]. Практическое применение требует исследований совместимости этих веществ с другими материалами и коррозионно-активными средами, что представляется объемной и затратной задачей, существенно ограничить которую можно с помощью математического моделирования фазовых и химических процессов [8]. Это возможно в том случае, если известны термодинамические функции и энтальпии образования участвующих в процессах веществ.
Одним из перспективных двойных оксидов со структурой пирохлора является гафнат самария Sm2Hf2O7. Образование гафната самария со структурой пирохлора (Fd3m) и его разупорядочение при высоких температурах с переходом в структурный тип дефектного флюорита (Fm3m) впервые были обнаружены в работе [18]. Более детальные исследования системы Sm2O3–HfO2 [19] подтвердили существование пирохлора Sm2Hf2O7 в широкой концентрационной области (22–43 мол. % Sm2O3 при 1550–2573 K). Определена зависимость параметра флюоритной ячейки (или 1/2 параметра пирохлорной ячейки) от состава: a (Å) = 5.128 + 0.0045x (15 < x < 40, x – мол. % сесквиоксида самария в системе Sm2O3–HfO2). Установлено [20], что параметр кристаллической решетки стехиометрического гафната самария равен 10.556 Å, область гомогенности при температуре 2373 K составляет 31–38 мол. % Sm2O3 и параметр решетки а в области гомогенности изменяется от 10.506 до 10.628 Å соответственно. По данным [21], параметр решетки стехиометрического Sm2Hf2O7 равен 10.568 Å и энтальпия образования из элементов $\Delta H_{f}^{^\circ }$ (298.15 K) = –4139.2 кДж моль–1. Необходимо отметить, что гафнат самария, как и другие цирконаты и гафнаты лантаноидов, способен образовывать наноразмерную метастабильную низкотемпературную фазу со структурой разупорядоченного флюорита (Fm3m), которая в результате отжига при температурах выше 1300–1800 K необратимо превращается в кристаллическую устойчивую фазу структурного типа пирохлора (Fd3m) [22–24], пригодную для термодинамических исследований. Термодинамические свойства гафната самария изучены в работе [25], где на основе выполненного методом калориметрии сброса измерений приращения энтальпии в области 730–1672 K были рассчитаны термодинамические функции в интервале температур 298–1700 K, но низкотемпературная теплоемкость в области 0–300 K до сих пор остается не исследованной.
Цель настоящей работы – измерение молярной теплоемкости двойного высокотемпературного оксида Sm2Hf2O7, расчет энтропии, приращения энтальпии и приведенной энергии Гиббса в широком интервале температур (4–347 K), а также оценка вида аномалии Шоттки.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Гафнат самария получали совместным осаждением стехиометрической смеси гидроксидов гафния и самария в растворе аммиака (25–28 мас. % NH4OH, ос. ч., ООО “Химмед”) из водных растворов хлоридов гафния и самария, полученных растворением сесквиоксида самария (99.99 мас. %) и диоксида гафния (99.99 мас. %, ООО “Ланхит”) в соляной кислоте (35–38 мас. %, ос. ч. 20-4, ООО “Ланхит”). Для расчетов стехиометрических отношений компонентов использовали моляльные концентрации и весовой метод смешивания исходных компонентов аналогично [26]. Полученный осадок обезвоживали при 368 K (95°С) и ступенчато отжигали с окончательным прокаливанием на воздухе при 1823 K. Полученный образец идентифицировали методом рентгенофазового анализа (РФА) на дифрактометре Bruker D8 Advance (CuKα-излучение, λ = 1.5418 Å, Ni-фильтр, LYNXEYE детектор, геометрия на отражение) в интервале углов 2θ = 10°–80°. Состав и чистоту образца определяли с помощью химического анализа (оптико-эмиссионный спектрометр с индуктивно связанной плазмой Agilent 725). Морфологию образца исследовали на электронном микроскопе Gross Beam Zeiss NVision 40. Теплоемкость измеряли на низкотемпературном (16–347 K) адиабатическом калориметре БКТ-3 (Termis, Russia) с программным обеспечением НЕАТ с использованием в качестве криогенных жидкостей жидких гелия и азота. Масса образца составляла 3.65924 ± 0.00005 г. Молекулярную массу гафната самария (769.6958 г/моль) рассчитывали из значений атомных масс элементов, рекомендованных в [27]. Измерения молярной теплоемкости в интервале температур 4–17 K проводили с помощью автоматизированного комплекса для измерения физических свойств Quantum Design PPMS-9. Образец для измерений был приготовлен в соответствии с рекомендациями [28]: порошок гафната самария смешивали с медной стружкой в медном стаканчике диаметром 3 мм, края которого были загнуты вовнутрь, и прессовали в таблетку высотой ~1 мм. Сглаживание экспериментальных данных по температурной зависимости теплоемкости проводили по методике [29].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
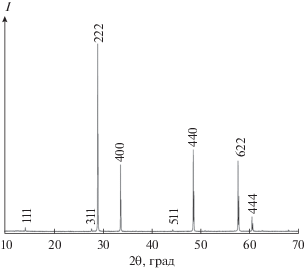
Для проведения термических и термодинамических исследований был приготовлен образец гафната самария, имеющий, по данным химического анализа, состав Sm2Hf1.97O6.93 (величина индекса при кислороде рассчитана исходя из соотношения оксидов металлов). Как показано ранее [30], такое отклонение от стехиометрического состава не может оказать существенного влияния на величину молярной теплоемкости для состава с идеальной стехиометрией. Дифракционные исследования (рис. 1) показали отсутствие посторонних фаз и хорошую закристаллизованность образца структурного типа пирохлора (Fd3m), которая подтверждается электронной микроскопией (рис. 2).
Рассчитанное значение параметра кубической решетки а = 10.580 Å удовлетворительно соответствует величинам, приведенным в [19–23], близко к величинам 10.574 [31] и 10.5769 Å [32]. Оценка по Дебаю–Шереру размеров областей когерентного рассеяния по ширине дифракционных отражений показала, что их размеры превышают 100 нм и находятся вне интервала существования наноразмерных частиц.
Температурную зависимость молярной теплоемкости гафната самария при низких температурах определяли методами релаксационной (RC, в интервале 4.1–18.7 K, 27 точек) и адиабатической калориметрии (AC, в области 16.6–347.1 K, 117 точек). Экспериментальные данные приведены в табл. 1. Анализ полученной температурной зависимости показал, что аномалии, характерные для структурных превращений, отсутствуют во всем температурном интервале 4.1–347.1 K.
Таблица 1.
Экспериментальная зависимость молярной теплоемкости Sm2Hf2O7 (пирохлор) от температуры по данным релаксационной и адиабатической калориметрии, р = 101.3 кПа
| T, К | Cp, Дж моль–1 K–1 | T, К | Cp, Дж моль–1 K–1 | T, К | Cp, Дж моль–1 K–1 | T, К | Cp, Дж моль–1 K–1 |
|---|---|---|---|---|---|---|---|
| Релаксационная калориметрия | |||||||
| 4.13 | 0.946 | 6.09 | 0.753 | 9.17 | 1.105 | 14.73 | 2.910 |
| 4.36 | 0.807 | 6.45 | 0.767 | 9.79 | 1.232 | 15.63 | 3.297 |
| 4.60 | 0.854 | 6.84 | 0.781 | 10.96 | 1.566 | 16.55 | 3.888 |
| 4.87 | 0.812 | 7.25 | 0.824 | 11.62 | 1.741 | 17.60 | 4.486 |
| 5.14 | 0.781 | 7.69 | 0.854 | 12.34 | 1.953 | 18.70 | 4.897 |
| 5.44 | 0.758 | 8.15 | 0.914 | 13.08 | 2.251 | ||
| 5.75 | 0.754 | 8.65 | 0.999 | 13.88 | 2.554 | ||
| Адиабатическая калориметрия | |||||||
| 16.68 | 3.862 | 64.64 | 68.26 | 109.8 | 118.8 | 220.4 | 201.3 |
| 17.74 | 4.455 | 66.40 | 70.34 | 110.5 | 118.7 | 224.8 | 203.8 |
| 18.72 | 5.636 | 68.16 | 73.22 | 113.4 | 121.9 | 229.1 | 206.3 |
| 19.75 | 6.654 | 69.92 | 74.87 | 114.3 | 123.0 | 233.5 | 208.8 |
| 20.81 | 7.579 | 71.89 | 77.41 | 117.1 | 125.4 | 237.9 | 211.3 |
| 22.57 | 9.538 | 74.08 | 80.32 | 118.1 | 126.2 | 242.4 | 213.9 |
| 24.32 | 11.62 | 76.26 | 82.92 | 122.0 | 129.8 | 246.7 | 216.4 |
| 26.07 | 13.90 | 78.45 | 85.41 | 132.2 | 138.6 | 251.0 | 218.5 |
| 27.81 | 16.13 | 80.65 | 88.03 | 137.8 | 144.4 | 255.2 | 221.5 |
| 29.55 | 18.60 | 82.86 | 91.32 | 141.4 | 146.8 | 259.5 | 223.5 |
| 31.28 | 20.91 | 84.56 | 93.03 | 145.0 | 149.4 | 263.7 | 225.1 |
| 33.01 | 23.61 | 85.08 | 93.23 | 148.5 | 153.0 | 267.9 | 226.3 |
| 34.73 | 25.82 | 87.24 | 96.03 | 152.1 | 154.8 | 272.1 | 228.7 |
| 36.46 | 28.24 | 87.34 | 95.78 | 155.7 | 158.5 | 276.2 | 229.0 |
| 38.18 | 31.04 | 89.58 | 98.37 | 159.2 | 161.0 | 280.3 | 232.0 |
| 39.91 | 33.27 | 89.65 | 98.67 | 162.8 | 163.8 | 284.4 | 233.6 |
| 41.63 | 35.87 | 92.08 | 101.3 | 166.4 | 166.1 | 288.4 | 233.2 |
| 43.35 | 38.27 | 94.47 | 103.8 | 169.9 | 169.0 | 292.4 | 236.0 |
| 45.06 | 41.05 | 94.74 | 103.6 | 173.5 | 171.3 | 296.4 | 236.1 |
| 46.82 | 43.18 | 96.93 | 106.3 | 177.2 | 174.2 | 300.3 | 237.4 |
| 48.55 | 45.81 | 97.18 | 106.5 | 180.7 | 175.9 | 304.7 | 238.9 |
| 50.35 | 48.15 | 97.31 | 105.7 | 184.3 | 177.9 | 311.0 | 240.5 |
| 52.07 | 50.59 | 99.35 | 109.0 | 187.9 | 181.0 | 318.4 | 242.8 |
| 53.80 | 52.83 | 99.66 | 108.8 | 191.5 | 183.4 | 325.7 | 244.2 |
| 55.53 | 55.46 | 99.72 | 108.9 | 195.0 | 185.8 | 332.9 | 246.2 |
| 57.25 | 58.02 | 102.42 | 111.8 | 198.6 | 188.1 | 340.0 | 247.6 |
| 59.00 | 60.52 | 102.64 | 112.0 | 202.6 | 190.7 | 347.1 | 248.3 |
| 62.77 | 66.36 | 102.89 | 112.2 | 207.1 | 193.4 | ||
| 64.64 | 68.26 | 106.09 | 114.8 | 211.5 | 196.1 | ||
| 66.40 | 70.34 | 106.65 | 114.9 | 216.0 | 198.7 | ||
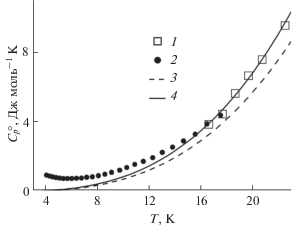
В области самых низких температур (4–25 K), представленной на рис. 3, наблюдается пологий минимум на кривой теплоемкости при ~6 K. Его присутствие свидетельствует о существовании магнитного превращения при температурах <4 K, характерного для однотипных соединений самария Sm2Zr2O7 и Sm2Ti2O7 [33, 34]. В силу малых значений температуры вклад магнитных превращений в приращение энтальпии незначителен и сравним с общей неопределенностью величины приращения энтальпии при температуре 298.15 K, тогда как энтропия может достигать существенной величины ~11.5 Дж моль–1 K–1 (2Rln2) [34]. Реальная температурная зависимость теплоемкости в этой области (0–4 K) нуждается в экспериментальных измерениях, к сожалению, недоступных для наших исследований.
Рис. 3.
Температурная зависимость молярной теплоемкости Sm2Hf2O7 (пирохлор) в интервале температур 4–25 K: 1 – адиабатическая и 2 – релаксационная калориметрия, 3 – уравнение (3), 4 – аппроксимация по уравнению (1).
Результаты экспериментальных измерений молярной теплоемкости гафната самария были сглажены с помощью уравнения:
На рис. 3 эта зависимость показана кривой 4, она адекватно описывает экспериментальные результаты выше 16 K. Для дальнейших расчетов проведена корректировка сглаженных данных с учетом значений теплоемкости в интервале температур 4–18 K (точки 2 на рис. 3). В табл. 2 приведены результаты расчетов термодинамических функций гафната самария в области температур 4–347 K без учета значений функций ниже 4 K.
Таблица 2.
Термодинамические функции Sm2Hf2O7 (пирохлор) в области 4–347 K (без учета значений функций ниже 4 K), p = 101.3 кПа
| T, K | $C_{p}^{ \circ }$, Дж моль1 K–1 | S°(T) – S°(4 K), Дж моль–1 K–1 | H°(T) – H°(4 K), Дж моль–1 | Ф°(T)*, Дж моль–1 K–1 |
|---|---|---|---|---|
| 4 | 0.9596 | 0 | 0 | 0 |
| 5 | 0.849 | 0.205 | 0.904 | 0.02399 |
| 6 | 0.795 | 0.356 | 1.726 | 0.0683 |
| 7 | 0.798 | 0.479 | 2.522 | 0.1188 |
| 8 | 0.861 | 0.590 | 3.351 | 0.1710 |
| 9 | 0.983 | 0.698 | 4.273 | 0.2235 |
| 10 | 1.168 | 0.811 | 5.349 | 0.2765 |
| 11 | 1.415 | 0.934 | 6.640 | 0.3304 |
| 12 | 1.726 | 1.070 | 8.210 | 0.3860 |
| 13 | 2.102 | 1.223 | 10.12 | 0.4442 |
| 14 | 2.544 | 1.395 | 12.45 | 0.5056 |
| 15 | 3.055 | 1.587 | 15.25 | 0.5709 |
| 16 | 3.634 | 1.803 | 18.59 | 0.641 |
| 17 | 4.284 | 2.042 | 22.55 | 0.716 |
| 20 | 6.746 | 2.899 | 38.50 | 0.928 |
| 25 | 12.62 | 5.020 | 86.50 | 1.457 |
| 30 | 19.18 | 7.890 | 165.8 | 2.228 |
| 35 | 26.15 | 11.37 | 279.0 | 3.233 |
| 40 | 33.36 | 15.33 | 427.7 | 4.453 |
| 45 | 40.67 | 19.68 | 612.8 | 5.865 |
| 50 | 47.93 | 24.34 | 834.0 | 7.446 |
| 60 | 61.99 | 34.33 | 1384 | 11.03 |
| 70 | 75.17 | 44.89 | 2071 | 15.07 |
| 80 | 87.38 | 55.73 | 2884 | 19.43 |
| 90 | 98.69 | 66.69 | 3816 | 24.04 |
| 100 | 109.2 | 77.60 | 4856 | 28.8 |
| 110 | 119.0 | 88.50 | 5997 | 33.7 |
| 120 | 128.3 | 99.30 | 7234 | 38.7 |
| 130 | 137.1 | 109.9 | 8562 | 43.8 |
| 140 | 145.5 | 120.4 | 9975 | 48.8 |
| 150 | 153.5 | 130.7 | 11 475 | 53.9 |
| 160 | 161.2 | 140.8 | 13 045 | 59.0 |
| 170 | 168.6 | 150.8 | 14 695 | 64.1 |
| 180 | 175.7 | 160.7 | 16 415 | 69.2 |
| 190 | 182.6 | 170.4 | 18 205 | 74.2 |
| 200 | 189.2 | 179.9 | 20 065 | 79.3 |
| 210 | 195.5 | 189.3 | 21 985 | 84.3 |
| 220 | 201.5 | 198.5 | 23 975 | 89.2 |
| 230 | 207.3 | 207.6 | 26 015 | 94.2 |
| 240 | 212.7 | 216.5 | 28 115 | 99.1 |
| 250 | 217.8 | 225.3 | 30 275 | 103.9 |
| 260 | 222.6 | 234.0 | 32 475 | 108.8 |
| 270 | 227.0 | 242.4 | 34 725 | 113.5 |
| 280 | 231.1 | 250.8 | 37 015 | 118.3 |
| 290 | 234.8 | 258.9 | 39 345 | 123.0 |
| 298.15 | 237.5 ± 1.2 | 265.5 ± 3.2 | 41 265 ± 230 | 126.8 ± 1.4 |
| 300 | 238.1 | 267.0 | 41 705 | 127.7 |
| 310 | 241.0 | 274.8 | 44 105 | 132.3 |
| 320 | 243.4 | 282.5 | 46 525 | 136.8 |
Отличительной особенностью поведения теплоемкости кристаллических соединений лантаноидов (за исключением лантана и лютеция) является существование аномалии Шоттки, возникающей в результате взаимодействия 4f-неспаренных электронов с электрическим полем кристалла [35, 36]. В общем виде при отсутствии структурных превращений общая величина теплоемкости может быть записана в виде:
(2)
${{C}_{p}} = {{С}_{{{\text{lat}}}}} + {{C}_{{{\text{exc}}}}} = {{С}_{{{\text{lat}}}}} + {{C}_{{{\text{mag}}}}} + {{C}_{{{\text{Sch}}}}},$(3)
${{C}_{{{\text{lat}}}}} = (1 - f){{C}_{p}}({\text{L}}{{{\text{a}}}_{{\text{2}}}}{\text{H}}{{{\text{f}}}_{{\text{2}}}}{{{\text{O}}}_{7}}) + f{{C}_{p}}({\text{G}}{{{\text{d}}}_{{\text{2}}}}{\text{H}}{{{\text{f}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{7}}}}),$Температурная зависимость полученной разности приведена на рис. 4 (кривая 1) и близка к приведенным в [34] расчетным значениям аномалии Шоттки для Sm2Zr2O7 и Sm2Ti2O7 (кривые 2 и 3 соответственно). Отметим, что в работе [34] расчеты выполнены для формулы SmXO3.5 (X = Ti, Zr) и приведены в графическом виде.
Рис. 4.
Разность ΔCp = Cp – Clat (уравнение (3)) для Sm2Hf2O7 (1) и расчетные значения вклада аномалии Шоттки из работы [34] для Sm2Zr2O7 (2) и Sm2Ti2O7 (3).
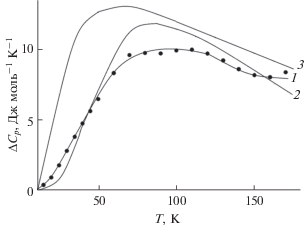
Выполненная оценка аномального вклада Шоттки как разности мольной теплоемкости Sm2Hf2O7 и решеточного вклада, рассчитанного на основе уравнения (3) и решеточных теплоемкостей гафнатов лантана и гадолиния [26, 39], показала, что она имеет существенные значения уже начиная с 10 K, за счет чего аномальный вклад в энтропию имеет значительную величину уже при очень низких температурах.
ЗАКЛЮЧЕНИЕ
Молярная теплоемкость гафната самария структурного типа пирохлора измерена в интервале температур 4–347 K, термодинамические функции рассчитаны без учета значений ниже 4 K. Величины функций при 298.15 K составляют $C_{{p,m}}^{^\circ }$(298.15 K) = 235.5 ± 1.2 Дж моль–1 K–1, S°(298.15 K) – S°(4.0 K) = 265.5 ± 3.2 Дж моль–1 K–1, Φ°(298.15 K) = 126.8 ± 1.4 Дж моль–1 K–1 и H°(298.15 K) – H°(4.0 K) = 41265 ± 230 Дж моль–1. Определен общий вид аномалии Шоттки и показано, что аномалия вносит существенный вклад в теплоемкость во всем измеренном интервале температур. Полученные результаты могут быть использованы для термодинамического моделирования фазовых равновесий с участием гафната самария и разработки технологий синтеза керамических материалов на его основе.
Список литературы
Michel D., Perez Y., Jorba M., Collongues R. // Mater. Res. Bull. 1974. V. 9. P. 1457.
Rushton M.J.D., Grimes R.W., Stanek C.R., Owens S. // J. Mater. Res. 2004. V. 19. P. 1603. https://doi.org/10.1557/JMR.2004.0231
Durán P. // Ceramurgia Int. 1977. V. 3. P. 137. https://doi.org/10.1016/0390-5519(77)90059-x
Jiang C., Stanek C.R., Sickafus K.E., Uberuaga B.P. // Phys. Rev. 2009. V. B79. P. 104203. https://doi.org/10.1103/PhysRevB.79.104203
Pan W., Phillpot S.R., Wan C. et al. // MRS Bull. 2012. V. 37. P. 917. https://doi.org/10.1557/mrs.2012.234
Vaßen R., Jarligo M.O., Steinke T. et al. // Surf. Coat. Technol. 2010. V. 205. P. 938. https://doi.org/10.1016/j.surfcoat.2010.08.151
Clarke D.R., Phillpot S.R. // Mater. Today. 2005. V. 8. P. 22. https://doi.org/10.1016/s1369-7021(05)70934-2
Poerschke D.L., Jackson R.W., Levi C.G. // Annu. Rev. Mater. Res. 2017. V. 47. P. 297. https://doi.org/10.1146/annurev-matsci-010917-105000
Liang P., Dong S., Zeng J. et al. // Ceram. Int. 2019. V. 45. P. 22432. https://doi.org/10.1016/j.ceramint.2019.07.235
Yamamura H. // Solid State Ionics. 2003. V. 158. P. 359. https://doi.org/10.1016/s0167-2738(02)00874-3
Shlyakhtina A.V., Shcherbakova L.G. // Solid State Ionics. 2011. V. 192. P. 200. https://doi.org/10.1016/j.ssi.2010.07.013
Ji Y., Jiang D., Shi J. // J. Mater. Res. 2005. V. 20. P. 567. https://doi.org/10.1557/jmr.2005.0073
Lecoq P., Korzhik M. // IEEE Trans. Nuclear Sci. 2002. V. 49. P. 1651. https://doi.org/10.1109/tns.2002.801487
Brixner L.H. // Mater. Res. Bull. 1984. V. 19. P. 143. https://doi.org/10.1016/0025-5408(84)90084-9
Navrotsky A., Ushakov S.V. Thermodynamics of oxide systems relevantto alternative gate dielectrics. // Materials Fundamentals of Gate Dielectrics / Eds. Demkov A., Navrotsky A. New York: Springer, 2005. P. 57.
Risovany V.D., Zakharov A.V., Muraleva E.M. et al. // J. Nucl. Mater. 2006. V. 355. P. 163. https://doi.org/10.1016/j.jnucmat.2006.05.029
Ewing R.C., Weber W.J., Lian J. // J. Appl. Phys. 2004. V. 95. P. 5949. https://doi.org/10.1063/1.1707213
Isupova E.N., Glushkova V.B., Keler K.E. // Izv. Akad. Nauk SSSR. Neorg. Mater. 1968. V. 4. P. 1330. [Исупова Е.Н., Глушкова В.Б., Келер К.Е. // Изв. АН СССР. Неорган. материалы. 1968. Т. 4. С. 1330.]
Duran P. // J. Am. Ceram Soc. 1979. V. 62. P. 9. https://doi.org/10.1111/j.1151-2916.1979.tb18794.x
Shevchenko A.V., Lopato L.M., Nazarenko L.V. // Izv. Acad. Nauk SSSR. Neorg. Mater. 1984. V. 20. P. 1862. [Шевченко А.В., Лопато Л.М., Назаренко Л.В. // Изв. АН СССР. Неорган. материалы. 1984. Т. 20. С. 1862.]
Paputsky Yu.N., Krzizanovskaya V.A., Glushkova V.B. // Izv. Akad. Nauk SSSR. Neorg. Mater. 1974. V. 10. P. 1551. [Папутский Ю.Н., Кржижановская В.А., Глушкова В.Б. // Изв. АН СССР. Неорган. материалы. 1974. Т. 10. С. 1551.]
Арсеньев П.А., Глушкова В.Б., Евдокимов А.А. и др. Соединения редкоземельных элементов. Цирконаты, гафнаты, ниобаты, танталаты, антимонаты. М.: Наука, 1985. 261 с.
Andrievskaya E.R. // J. Eur. Ceram. Soc. 2008. V. 28. P. 2363. https://doi.org/10.1016/jeurceramsoc.2008.01.009
Popov V.V., Menushenkov A.P., Yaroslavtsev A.A. et al. // J. Alloys Compd. 2016. V. 689. P. 669. https://doi.org/10.1016/j.jallcom.2016.08.019
Kandan R., Prabhakara Reddy B., Panneerselvam G., Mudali U.K. // J. Therm. Anal. Calorim. 2017. V. 131. P. 2687. https://doi.org/10.1007/s10973-017-6802-6
Guskov V.N., Tyurin A.V., Guskov A.V. et al. // Ceram. Int. 2020. V. 46. P. 12822 https://doi.org/10.1016/j.ceramint.2020.02.052
Wieser M.E. // Pure Appl. Chem. 2006. V. 78. P. 2051. https://doi.org/10.1351/pac200678112051
Shi Q., Snow C.L., Boerio-Goates J., Woodfield B.F. // J. Chem. Thermodyn. 2010. V. 42. P. 1107. https://doi.org/10.1016/j.jct.2010.04.008
Ryumin M.A., Nikiforova G.E., Tyurin A.V. et al. // Inorg. Mater. 2020. V. 56. P. 97. [Рюмин М.А., Никифорова Г.Е., Тюрин А.В. и др. // Неорган. материалы. 2020. Т. 56. С. 102.]https://doi.org/10.1134/S00201685200101148
Gagarin P.G., Guskov A.V., Guskov V.N. et al. // Ceram. Int. 2021. V. 47. P. 2892. https://doi.org/10.1016/j.ceramint.2020.09072
Shlyakhtina A.V., Knotko A.V., Boguslavskii M.V. et al. // Solid State Ionics. 2007. V. 178. P. 59. https://doi.org/10.1016/j.ssi.2006.11.001
Kutty K.V.G., Rajagopalan S., Mathews C.K., Varadaraju U.V. // Mater. Res. Bull. 1994. V. 29. P. 759. https://doi.org/10.1016/0025-5408(94)90201-1
Gagarin P.G., Tyurin A.V., Guskov V.N. et al. // Inorg. Mater. 2017. V. 53. P. 619. [Гагарин П.Г., Тюрин А.В., Гуськов В.Н. и др. // Неорган. материалы. 2017. Т. 53. С. 632.]https://doi.org/10.1134/S0020168517060048
Singh S., Saha S., Dhar S.R. et al. // Phys. Rev. B: Condens. Matter Mater. Phys. 2008. V. 77. P. 054408. https://doi.org/10.1103/PhysRevB.77.054408
Westrum E.F. // J. Therm. Anal. 1985. V. 30. P. 1209. https://doi.org/10.1007/bf01914288
Durand A.M., Klavins P., Corruccini L.R. // J. Phys. Condens. Matter. 2008. V. 20. P. 235208. https://doi.org/10.1088/0953-8984/20/23/235208
Chirico R.D., Westrum E.F. // J. Chem. Thermodyn. 1980. V. 12. P. 71. https://doi.org/10.1016/0021-9614(80)90118-4
Gavrichev K.S., Tyurin A.V., Guskov V.N. et al. // Russ. J. Inorg. Chem. 2020. V. 65. P. 655. [Гавричев К.С., Тюрин А.В., Гуськов В.Н. и др. // Журн. неорган. химии. 2020. Т. 65. С. 651.]https://doi.org/10.1134/S0036023620050083
Guskov V.N., Gagarin P.G., Guskov A.V. et al. // Russ. J. Inorg. Chem. 2019. V. 64. P. 1436. [Гуськов В.Н., Гагарин П.Г., Гуськов А.В. и др. // Журн. неорган. химии. 2019. Т. 64. С. 1210.]https://doi.org/10.1134/S0036023619110068
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии