Журнал неорганической химии, 2021, T. 66, № 10, стр. 1380-1386
Автоклавный синтез высокодисперсных порошков никеля
О. В. Белоусов a, b, *, Р. В. Борисов a, b, **, Н. В. Белоусова b, Г. М. Зеер b, А. С. Романченко a
a Институт химии и химической технологии СО РАН
660036 Красноярск, Академгородок, 50/24, Россия
b Сибирский федеральный университет
660041 Красноярск, пр-т Свободный, 79, Россия
* E-mail: ov_bel@icct.ru
** E-mail: roma_boris@list.ru
Поступила в редакцию 19.03.2021
После доработки 12.04.2021
Принята к публикации 21.04.2021
Аннотация
Исследовано восстановление двухвалентного никеля гидразингидратом из аммиачно-щелочных растворов при повышенных температурах. Предложена методика синтеза высокодисперсных порошков никеля. Методом сканирующей электронной микроскопии исследована морфология полученных объектов в зависимости от условий синтеза, показана возможность образования как игольчатых, так и сферических частиц. В результате низкотемпературной адсорбции азота определена удельная поверхность синтезированных порошков металлического никеля, которая в зависимости от условий получения (концентрация исходной соли в растворе, pH и температура) находится в диапазоне 5–20 м2/г. По данным рентгенографического анализа, полученные порошки представляют собой смесь двух фаз: никеля (до 99%) и гидроксида никеля. С помощью рентгеновской фотоэлектронной спектроскопии установлено, что порошки состоят из ядра никеля(0), покрытого несколькими атомными слоями гидроксида никеля.
ВВЕДЕНИЕ
В настоящее время существенно вырос интерес к разработке экологически безопасных методов получения дисперсных порошков цветных и благородных металлов с заданными структурными характеристиками и, как следствие, к созданию функциональных материалов на их основе [1–4]. Данные материалы широко используются в самых разнообразных областях. Так, материалы, содержащие наночастицы никеля, применяются в качестве магнитных сенсоров, в системах записи и хранения информации [5, 6], в составе катализаторов процессов органического синтеза и переработки нефтепродуктов [7], в качестве металлов-цементаторов в гидрометаллургических процессах [8], в медицине, биологии и других областях [9].
Среди многообразия методов получения дисперсных порошков наиболее распространенным является химическое восстановление из растворов соответствующих солей [10–17]. Этот метод позволяет плавно управлять структурными характеристиками получаемых порошков и обеспечивать их необходимую химическую чистоту. В работах [13–17] показана возможность получения дисперсных порошков из растворов в открытых системах с применением различных восстановителей и стабилизаторов. Так, наночастицы никеля могут быть синтезированы восстановлением солей в присутствии полиакрилатов натрия гидразингидратом [10, 11] или борогидридом натрия [13, 16, 17]. Варьирование концентрации стабилизатора и температуры синтеза приводит к изменению размеров частиц никеля. В работе [16] исходные магнитные наночастицы никеля были получены в водных растворах восстановлением сульфата никеля со сверхстехиометрическим количеством NaBH4, а затем покрыты слоем золота с образованием частиц “ядро–оболочка”. Авторами детально исследованы магнитные характеристики данных материалов и отмечено присутствие фаз Au–Ni и Ni(OH)2.
Наиболее часто восстановителем соединений никеля выступает выделяемый при разложении водород, который в открытой системе улетучивается, что приводит к использованию восстановителей в многократном стехиометрическом избытке. Проведение процессов в закрытых системах позволяет не только с высокой эффективностью использовать реагенты и снизить негативную нагрузку на окружающую среду, но и стандартизировать условия экспериментов [18–24]. Автоклавные процессы активно внедряются не только в гидрометаллургию цветных и благородных металлов, но и в биологические и химические исследования [21]. В работе [22] ультратонкие парамагнитные частицы никеля были получены в автоклавных условиях при температуре 142°С сольвотермическим методом. Никелевую соль восстанавливали гидразингидратом в присутствии поверхностно-активных веществ или стабилизатора и щелочи в тефлоновом автоклаве. В работе [23] было исследовано восстановление Ni(OH)2 до ультрадисперсного металлического порошка Ni с размерами 10 нм в гидротермальных условиях этиленгликолем. Восстановление протекало мягко при температуре ~160°C без загрязнения окружающей среды [23]. В работе [24] была проведена оценка восстановления никеля гидразином с помощью микроволнового излучения в присутствии воды и этиленгликоля, а также стабилизирующего агента, который оказывает выраженное влияние на морфологию и магнитные свойства продукта. При 140°С в этиленгликоле в присутствии стабилизатора отмечено образование наностержней никеля диаметром 4–6 нм, а в отсутствие стабилизатора при 100°С получены частицы сферической формы [24].
Таким образом, химические методы активно используются для синтеза наночастиц никеля и функциональных материалов на его основе. Представляет интерес получение частиц никеля высокой чистоты без стабилизирующих частиц, с одной стороны, и проведение экологически чистого процесса восстановления – с другой.
Цель настоящей работы – разработка методики синтеза дисперсных магнитных порошков никеля в закрытых системах при температурах свыше 90°С и исследование структурных характеристик получаемых порошков.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В данной работе использовали NiCl2 · 6H2O “х. ч.”, N2H4 ⋅ 2HCl “х. ч.”, соляную кислоту “ос. ч. 20-4”, аммиак водный “ос. ч. 23-5”, гидроксид натрия “х. ч.”, 64%-ный N2H4 ⋅ H2O “х. ч.”, аргон газообразный (сорт высший). Эксперименты проводили в лабораторных фторопластовых автоклавах объемом 30–200 см3, конструкция которых описана в работах [25, 26].
Синтез дисперсных магнитных порошков никеля осуществляли при температурах до 155°С по следующей схеме. Навеску NiCl2 · 6H2O помещали во фторопластовый автоклав и растворяли в водном растворе гидроксида аммония. В автоклав добавляли 10%-ный раствор гидроксида натрия, гидразингидрат и перемешивали. Воздух удаляли продувкой аргоном, автоклав герметизировали и помещали в нагретый до требуемой температуры термостат на заданное время с постоянным перемешиванием в вертикальной плоскости. После эксперимента автоклав разбирали, жидкую фазу отбирали на анализ, а твердую многократно промывали дистиллированной водой, сушили при 100°С и взвешивали. Сведением материального баланса по жидкой и твердой фазам рассчитывали выход.
Рентгеновские дифрактограммы регистрировали в диапазоне углов 2θ от 30° до 90° с шагом 0.02° на настольном дифрактометре Proto AXRD (Proto Manufacturing, Канада) с использованием CuKα-излучения с накоплением в точке 3 с.
Исследования морфологических особенностей проводили на сканирующем электронном микроскопе JSM 7001F фирмы JEOL (Япония) с системой микроанализаторов фирмы Oxford Instruments (Великобритания). Разрешение микроскопа до 1.2 нм при ускоряющем напряжении 30 кВ, ускоряющее напряжение от 0.5 до 30 кВ, увеличение от 10 до 1 000 000 раз, ток пучка до 200 нА.
Регистрацию изотерм адсорбции азота для исследуемых материалов выполняли с помощью анализатора ASAP-2420 (Micromeritics, USA) при 77 K. Расчет удельной поверхности осуществляли методом BET.
Рентгеновские фотоэлектронные спектры (РФЭС) записывали на спектрометре SPECS с полусферическим энергоанализатором PHOIBOS 150 MCD9 при возбуждении монохроматизированным излучением MgKα анода рентгеновской трубки (1253.6 эВ) при энергии пропускания энергоанализатора 20 эВ (обзорные спектры) или 10 эВ (узкие сканы). Обработку спектров выполняли с помощью программного пакета CasaXPS.
Содержание никеля в растворах определяли методом атомно-абсорбционной спектроскопии на спектрометре AAnalyst-400 (Perkin Elmer, США).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Стандартный окислительно-восстановительный потенциал для полуреакции
(1)
${{{\text{N}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{4}}}}{\text{ + 4O}}{{{\text{H}}}^{{\text{--}}}}{\text{ = }}{{{\text{N}}}_{{\text{2}}}}{\text{ + 4}}{{{\text{H}}}_{{\text{2}}}}{\text{O + 4}}{{{\text{e}}}^{{\text{--}}}}$а для полуреакции
(2)
${\text{N}}{{{\text{i}}}^{{{\text{2 + }}}}}{\text{ + 2}}{{{\text{e}}}^{{\text{--}}}} = {\text{Ni}}$E° = –0.25 B.
Следовательно, восстановление двухвалентного никеля до металла гидразином в щелочной среде термодинамически возможно и может быть схематично записано следующим уравнением:
(3)
$\begin{gathered} {\text{2NiC}}{{{\text{l}}}_{{\text{2}}}}\,\,{{\cdot}}\,\,{\text{6}}{{{\text{H}}}_{{\text{2}}}}{\text{O + }}{{{\text{N}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{4}}}} \cdot {{{\text{H}}}_{{\text{2}}}}{\text{О + 4NaOH = }} \\ {\text{ = }}\,\,{\text{2Ni + 4NaCl + }}{{{\text{N}}}_{{\text{2}}}}{\text{ + 17}}{{{\text{H}}}_{{\text{2}}}}{\text{О}}{\text{.}} \\ \end{gathered} $Первоначально подбирали условия, при которых твердая фаза обладает магнитными свойствами при выходе не менее 90%. Для этого варьировали такие параметры, как восстановитель (N2H4 ⋅ H2О, N2H4 ⋅ 2HCl), время и температура процесса восстановления, концентрация гидроксида аммония и гидроксида натрия. Установлено, что избыток восстановителя от стехиометрического значения (уравнение (3)) должен составлять не менее 20%. При этом необходимо учитывать расход восстановителя на протекание процесса (4) в связи с неполным удалением кислорода из газовой фазы и наличием растворенного кислорода в жидкой фазе:
(4)
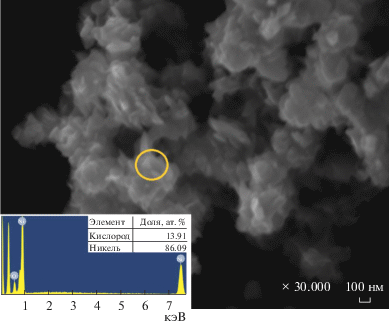
${{{\text{N}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{4}}}}{\text{ + }}{{{\text{O}}}_{{\text{2}}}}{\text{ = }}{{{\text{N}}}_{{\text{2}}}}{\text{ + 2}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}{\text{.}}$При использовании в качестве восстановителя N2H4 ⋅ 2HCl выход составляет 20–65%. Синтез при температуре 90°С в течение 30–120 мин не приводит к удовлетворительным результатам, выход металла составляет не более 30%, а ферромагнитные свойства выражены слабо или отсутствуют. Повышение температуры синтеза до 105–115°С увеличивает выход металла до 45–65%. Рентгенофазовый анализ (РФА) осадка (рис. 1), синтезированного восстановлением гидразином солянокислым в течение 60 мин при 105°С, показал, что твердая фаза представляет собой смесь никеля и кристаллического гидроксида никеля, доля которого составляет до 40 мас. %. Для данного осадка характерна высокая удельная поверхность (50 м2/г). В то же время электронно-микроскопические исследования (рис. 2а) показали, что размер частиц лежит в диапазоне 50–250 нм. Методом рентгеноспектрального анализа установлено, что атомное соотношение никеля и кислорода в различных точках составляет приблизительно 1 : 1, что соответствует доле кислорода ~20 мас. % и согласуется с данными РФА (~14 мас. % кислорода).
Рис. 1.
Фрагменты дифрактограмм осадков: 1, 2 – 105°С, 60 мин, N2H4 · 2HCl, исходный и после обработки NH4OH в автоклаве; 3 – образец 2; 4 – образец 6.
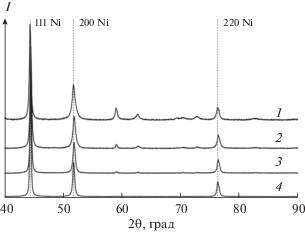
Рис. 2.
СЭМ-изображения частиц: а – восстановление N2H4 · 2HCl, 105°С, 60 мин; б – восстановление гидразингидратом в среде NH4OH (без добавления NaOH), 110°С, 30 мин.

При контакте таких материалов в закрытой системе (в среде Ar, 60°С) с разбавленными растворами аммиака (1 моль/л) раствор окрашивается в фиолетовый цвет:
(5)
$\begin{gathered} {\text{Ni}}{{\left( {{\text{OH}}} \right)}_{{\text{2}}}}{\text{ + 6N}}{{{\text{H}}}_{{\text{4}}}}{\text{OH = }} \\ {\text{ = }}\,\,\left[ {{\text{Ni}}{{{\left( {{\text{N}}{{{\text{H}}}_{{\text{3}}}}} \right)}}_{{\text{6}}}}} \right]{{\left( {{\text{OH}}} \right)}_{{\text{2}}}}{\text{ + 6}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}{\text{.}} \\ \end{gathered} $При этом уменьшается доля фазы гидроксида никеля, что подтверждают рентгенофазовый анализ (рис. 1) и данные рентгеноспектрального анализа, которые показывают уменьшение доли кислорода до 16 ат. %. Удельная поверхность в результате растворения фазы гидроксида никеля существенно не меняется (45 м2/г).
Дальнейшие эксперименты проводили с использованием гидразин-гидрата с избытком 20–50% от стехиометрического значения. При создании щелочной среды в растворе добавлением гидроксида натрия без гидроксида аммония процесс восстановления в интервале температур 90–125°С не происходит. В случае обратной ситуации − в отсутствие гидроксида натрия при концентрации гидроксида аммония <2 моль/л и температуре <90°С − осадок покрывает стенки автоклава по типу “зеркала”, при концентрации NH4OH > 3 моль/л выход твердой фазы в расчете на никель превышает 100%, что говорит об образовании соединений никеля, например кислородсодержащих. Сканирующей электронной микроскопией установлено образование частиц дискообразной и игольчатой формы (рис. 2б) с широким распределением по размерам (70–500 нм). При варьировании мольного соотношения NH4OH : NaOH в диапазоне от 32 : 1 до 1 : 1 экспериментально установлено, что в интервале температур 110–155°С наибольший выход осадка, обладающего ферромагнитными свойствами, достигается при соотношении ~16 : 1.
Влияние температуры процесса восстановления в диапазоне 70–155°С на выход и характеристики осадков никеля показано в табл. 1. Установлено, что в автоклавных гидротермальных условиях при 100–155°С степень осаждения металлического никеля в течение 1 ч составляет не менее 80 при 20%-ном избытке гидразингидрата от стехиометрического значения (уравнение (3)). Удельная поверхность порошков при одинаковой продолжительности синтеза с увеличением температуры возрастает от 8.8 м2/г при 100°С до 21.3 м2/г при 155°С. Данный факт может быть связан с тем, что при более высоких температурах образуется большее количество зародышей. Увеличение продолжительности синтеза приводит к незначительному увеличению выхода продукта и заметному сокращению удельной поверхности, что обусловлено укрупнением частиц в растворе в результате процессов перекристаллизации [25, 27]. РФА показал, что при использовании в качестве восстановителя гидразингидрата при температуре 100°С формируются две фазы: никеля (89 мас. %) и гидроксида никеля (11 мас. %) (рис. 1, кривая 3). Для данного образца характерно присутствие игольчатых кристаллов среди сферических частиц. Первые представлены, вероятно, гидроксидом никеля (рис. 3). Согласно рентгеноспектральному анализу, доля кислорода в различных точках составляет 2–5 мас. %.
Таблица 1.
Условия некоторых экспериментов и удельные поверхности осадков при восстановлении гидразингидратом
| № образца | t, °С | Время, мин |
Sпов, м2/г |
Выход, % |
|---|---|---|---|---|
| 1 | 70 | 60 | <1.0 | <10 |
| 2 | 100 | 60 | 8.8 | 78 |
| 3 | 110 | 30 | 8.9 | 78 |
| 4 | 110 | 60 | 10.2 | 90 |
| 5 | 110 | 240 | 8.8 | 93 |
| 6 | 125 | 60 | 15.1 | 88 |
| 7 | 140 | 60 | 21.3 | 87 |
| 8 | 140 | 120 | 19.2 | 89 |
| 9 | 140 | 240 | 17.0 | 93 |
| 10 | 155 | 60 | 21.6 | 83 |
Увеличение температуры синтеза до 110°С и выше приводит к образованию магнитных осадков никеля с долей гидроксида никеля, согласно рентгенографическим данным, менее 1 мас. % (рис. 1, кривая 4). Методом сканирующей электронной микроскопии показано (рис. 4а), что для данных осадков никеля (табл. 1) характерна сферическая форма частиц. Более мелкие частицы (50–100 нм) образуют сферические агрегаты диаметром 200–300 нм. При увеличении продолжительности синтеза с 60 до 240 мин формируются более крупные частицы (70–140 нм), агрегированные в глобулы размерами 300–700 нм (рис. 4б).
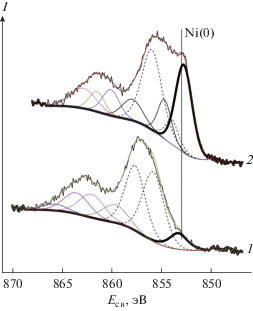
Согласно РФЭС (рис. 5), синтезируемые образцы представлены частицами металлического никеля, покрытыми тонким слоем гидроксида никеля. В рентгеновском фотоэлектронном спектре исходного образца (образец 6, табл. 1) присутствует слабый пик при 852.9 эВ, отвечающий металлическому никелю. Остальные компоненты соответствуют мультиплетному набору Ni(II)–OH [28]. После травления поверхности образца аргоном в течение 7 мин интенсивность данного пика значительно возрастает, что говорит об удалении слоя гидроксида никеля. Поскольку образец представляет собой тонкодисперсный порошок, подобным травлением полностью удалить гидроксидный слой невозможно. Металлический никель просвечивает на исходном образце без травления, поэтому можно предположить, что слой гидроксида составляет всего несколько атомных слоев.
ЗАКЛЮЧЕНИЕ
Установлены некоторые особенности восстановления хлорида никеля(II) в автоклавах в щелочных средах. Подобраны условия, при которых выход твердой фазы составляет >80% при избытке восстановителя 20% от стехиометрического значения. Удельная поверхность порошков никеля в данных условиях лежит в диапазоне 5–20 м2/г и зависит от условий получения, преимущественно от температуры и продолжительности синтеза. Методом РФА установлено, что полученные порошки представляют собой смесь двух фаз: никеля (до 99%) и гидроксида никеля. По данным РФЭС, частицы состоят из металлического никеля, покрытого несколькими атомными слоями гидроксида никеля, что согласуется с результатами фазового анализа.
Список литературы
Jia M., Choi C., Wu T.S. et al. // Chem. Sci. 2018. V. 9. № 47. P. 8775. https://doi.org/10.1039/C8SC03732A
Ismail M., Khan M.I., Khan S.B. et al. // J. Mol. Liq. 2018. V. 260. P. 78. https://doi.org/10.1016/j.molliq.2018.03.058
Jamila N., Khan N., Bibi A. Arabian et al. // J. Chem. 2020. V. 13. № 8. P. 6425. https://doi.org/10.1016/j.arabjc.2020.06.001
Gour A., Jain N.K. // Artif. Cells, Nanomedicine, Biotechnology. 2019. V. 47. № 1. P. 844. https://doi.org/10.1080/21691401.2019.1577878
Thanigai Arul K., Manikandan E., Ladchumananandasivam R. et al. // Polymer Int. 2016. V. 65. № 12. P. 1482. https://doi.org/10.1002/pi.5242
Wang S., Chen K., Wang M. et al. // J. Mater. Chem. C. 2018. V. 6. № 17. P. 4737. https://doi.org/10.1039/C7TC05970A
Yin W., Venderbosch R.H., Yakovlev V.A. et al. // Energies. 2020. V. 13. № 1. P. 285. https://doi.org/10.3390/en13010285
Bolshakova O.V., Bolshakov S.V., Belousova N.V. et al. // Tsvetnye Metally. 2018. № 6. P. 77. https://doi.org/10.17580/tsm.2018.06.11
Hajimohammadjafartehrani M., Hosseinal S.H., Dehkohneh A. et al. // Int. J. Biol. Macromol. 2019. V. 127. P. 330. https://doi.org/10.1016/j.ijbiomac.2019.01.050
Logutenko O.A., Titkov A.I., Vorob’ev A.M. et al. // Russ. J. Gen. Chem. 2018. V. 88 № 2. P. 288. https://doi.org/10.1134/S1070363218020160
Besner S., Kabashin A.V., Winnik F.M. et al. // Appl. Phys. A. 2008. V. 93. № 4. P. 955. https://doi.org/10.1007/s00339-008-4773-y
Yousefi S.R., Ghanbari D., Salavati-Niasari M. et al. // J. Mater Sci.-Mater Electron. 2016. V. 27. P. 1244. https://doi.org/10.1007/s10854-015-3882-6
Логутенко О.А., Титков А.И., Воробьев А.М. и др. // Химия в интересах устойчивого развития. 2016. Т. 24. № 5. С. 619. https://doi.org/10.15372/KhUR20160504
Gubin S.P., Koksharov Y.A., Khomutov G.B. et al. // Russ. Chem. Rev. 2005. V. 74. № 6. P. 489.
Zhu Z., Guo X., Wu S. et al. // Ind. Eng. Chem. Res. 2011. V. 50. № 24. P. 13848. https://doi.org/10.1021/ie2017306
Zakharov Y.A., Pugachev V.M., Bogomyakov A.S. et al. // J. Phys. Chem. C. 2020. V. 124. № 1. P. 1008. https://doi.org/10.1021/acs.jpcc.9b07897
Soloveva A.Y., Eremenko N.K., Obraztsova I.I. et al. // Russ. J. Inorg. Chem. 2018. V. 63. P. 444. https://doi.org/10.1134/S0036023618040204
Borisov R.V., Belousov O.V., Zhizhaev A.M. // Russ. J. Inorg. Chem. 2020. V. 65. № 10. P. 1623. https://doi.org/10.1134/S0036023620100034
Fesik E.V., Buslaeva T.M., Mel’nikova T.I. et al. // Inorg. Mater. 2018. V. 54. № 12. P. 1299. https://doi.org/10.1134/S0020168518120038
Fesik E.V., Buslaeva T.M., Mel’nikova T.I. et al. // Russ. J. Phys. Chem. A. 2019. V. 93. № 6. P. 1011. https://doi.org/10.1134/S0036024419060098
Shafique M.K., Muhmood T., Lin S. et al. // Mater. Res. Express. 2019. V. 6. № 10. P. 108001.
Du H., Wang Y., Yuan H. et al. // Electrochim. Acta. 2016. V. 196. P. 84. https://doi.org/10.1016/j.electacta.2016.02.190
Zhang F., Chen Y., Zhao J. et al. // Chem. Lett. 2004. V. 33. № 2. P. 146. https://doi.org/10.1246/cl.2004.146
Kashid S.B., Raut R.W., Malghe Y.S. // Mater. Chem. Phys. 2016. V. 170. P. 24. https://doi.org/10.1016/j.matchemphys.2015.12.014
Borisov R.V., Belousov O.V., Zhizhaev A.M. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 3. P. 308. https://doi.org/10.1134/S0036023618030038
Belousov O.V., Ryumin A.I., Belousova N.V. et al. // Russ. J Appl. Chem. 2020. V. 93. № 7. P. 1054. https://doi.org/10.1134/S1070427220070162
Belousov O.V., Dorokhova L.I., Solov’ev L.A. et al. // Russ. J. Phys. Chem. A. 2007. V. 81. № 8. P. 1303. https://doi.org/10.1134/S0036024407080237
Grosvenor A.P., Biesinger M.C., Smart R.S. et al. // Surf. Sci. 2006. V. 600. № 9. P. 1771. https://doi.org/10.1016/j.susc.2006.01.041
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии