Журнал неорганической химии, 2021, T. 66, № 10, стр. 1371-1379
Взаимодействие фторида кадмия с фторидами других элементов
a Институт общей физики им. А.М. Прохорова РАН
119991 Москва, ул. Вавилова, 38, Россия
* E-mail: ppfedorov@yandex.ru
Поступила в редакцию 10.03.2021
После доработки 22.04.2021
Принята к публикации 27.04.2021
Аннотация
Исследовано взаимодействие фторида кадмия с фторидами других элементов. На диаграмме обобщенный момент катиона–электроотрицательность выделены две области образования соединений. Фторид кадмия является амфотерным соединением с точки зрения теории кислот и оснований Льюиса. В системах фторида кадмия с фторидами редкоземельных элементов образуются гетеровалентные твердые растворы со структурами флюорита, тисонита (в том числе бертоллидные фазы в системах CdF2–RF3, R = Tb–Tm, Y) и α-YF3. Следует ожидать образования соединений фторида кадмия с фторидами франция, радия, фторидами трех- (Al, Fe, Ni), четырех- (Hf, Si, Ge, Re, Ir) и пятивалентных (Ta, Mo, V) элементов, с гексафторидом урана.
ВВЕДЕНИЕ
В работе [1] предложена диаграмма обобщенный момент М = Z/r (отношение заряда катиона Z к ионному радиусу r)–электроотрицательность Х, на которой выделяются области образования соединений в бинарных системах с одним постоянным катионом типа AlCl3–MCln. Методика опробована для ряда хлоридов [1–3] и фторидов магния [4], свинца [5], индия [6], галлия [7]. Методика позволяет систематизировать имеющиеся данные и осуществлять прогнозирование фазообразования в еще не изученных системах. Эта же диаграмма использована для оценки стеклообразования во фторидных системах [8].
Фторид кадмия кристаллизуется в структуре типа флюорита. Кадмий – самый маленький катион, фторид которого образует эту структуру. CdF2 может рассматриваться как легкоплавкая (tпл = 1075°C) модель фторида кальция (tпл = = 1418°C). Фторид кадмия химически активен, легко восстанавливается до металла, легко гидролизуется [9–12].
Фторид кадмия, как и оксид, обладает высоким давлением пара. Совокупность химических свойств позволяет использовать его для очистки шихты от кислородсодержащих примесей при выращивании монокристаллов тугоплавких фторидов из расплава (как “scavendger”) вследствие улетучивания фторида и оксида кадмия [13].
Нелегированный фторид кадмия является диэлектриком с шириной запрещенной зоны 7.6 эВ, однако при легировании легко приобретает полупроводниковые свойства [14]. Монокристаллы CdF2, легированные галлием и индием, обладают фоторефрактивными свойствами и являются эффективными материалами для динамической голографии [15–19]. Материалы на основе CdF2 являются люминофорами, в том числе проявляют эффект электролюминесценции [20, 21], а также активными средами твердотельных лазеров [22]. Один из лучших известных фтор-ионных проводников – твердый раствор Cd1 –xPbxF2 [23–26]. Твердые растворы Cd1 –xRxF2 +x также обладают высокой фтор-ионной проводимостью [27, 28]. Фторид кадмия – компонент фторидных стекол [29, 30] и оптических сред видимого и ИК-диапазонов [31–33]. Монокристалл состава Cd0.67Pb0.33F2 – эффективный радиатор черенковского излучения [34].
Целью настоящей работы является систематизация данных об образовании соединений в системах CdF2–MFn. Приведены также подробные данные о фазовых равновесиях в системах фторида кадмия с фторидами редкоземельных элементов (РЗЭ).
МЕТОДИКА
Диаграмму М–Х строили так же, как и в работах [5–7]. Использовали ионные радиусы по системе Шеннона для КЧ = 8 [35], величины электроотрицательности взяты по системе С.С. Бацанова [36].
Данные о фазовых диаграммах получены из работ [22, 37–56]. Нами изучены фазовые диаграммы систем фторида кадмия с фторидами лития, натрия [37], магния [38], свинца [5, 24], марганца [39], фторидов РЗЭ (La = Lu, Y, Sc) [22, 38, 40–44], индия [45]. Методика исследования аналогична таковой для систем PbF2–RF3 [57]. В качестве исходных веществ использовали трифториды РЗЭ марки “х. ч.” и фторид кадмия марки “ос. ч.”, переплавленные в графитовых тиглях во фторирующей атмосфере продуктов пиролиза тефлона. Трифторид самария нельзя переплавлять таким образом, так как при этом происходит частичное восстановление самария и потеря фтора. Для очистки SmF3 использовали только прогревание порошка при 200–250°С с форвакуумной откачкой непосредственно перед проведением дифференциального термического анализа (ДТА). Образцы фторида кадмия после переплавки получались прозрачные, с желтоватым оттенком. Дополнительную очистку осуществляли путем направленной кристаллизации расплава, в результате которой желтая окраска оттеснялась в конечную часть слитка. Температура плавления желтой фракции CdF2 не отличалась от бесцветной и была равна 1075 ± 5°С. Эксперименты ДТА проводили на ваккумированной установке, не имеющей деталей из пористой керамики, в инертной атмосфере гелия высокой чистоты. Использовали открытые тонкостенные графитовые тигли, масса навесок составляла 1–1.5 г, термопары W5% Re–W20% Re. Калибровку термопар осуществляли по температурам плавления LiF, NaF, YF3, CaF2 и температуре полиморфного превращения YF3. Потери в массе за счет испарения CdF2 в среднем составляли 2%, не превышая 3%. Состав образцов дополнительно контролировали рентгенофлюоресцентным анализом на установке VRA-20.
Расшифровку термограмм проводили по методике [58, 59]. Для построения диаграмм состояния в основном использовали кривые нагревания. Скорость нагрева составляла 20–30 град/мин. За температуру эффекта принимали температуру начала отклонения дифференциальной кривой от линии фона с учетом поправки на калибровку термопар. Для нонвариантных превращений, например эвтектики, фиксировали разность температур между началом и максимумом пика, которую затем вычитали из температуры пика для корректировки температур конца моновариантных процессов (например, ликвидуса). Установлено, что расплав фторида кадмия не переохлаждается в графитовых тиглях, поэтому температуры ликвидуса флюоритовых твердых растворов также определяли по кривым охлаждения.
Для установления фазообразования в твердом состоянии проводили отжиги смесей, запакованных в никелевые капилляры и помещенных в герметично заваренную бомбу, в которой создавалась фторирующая атмосфера за счет помещенных туда тефлона и порошка BaF2 ⋅ HF. Продолжительность отжигов экспоненциально увеличивалась при понижении температуры и составляла, в частности, 32 ч при 900°С и 1176 ч при 700°С [60]. Рентгенофазовый анализ отожженных и закаленных образцов проводили на дифрактометрах AFV-202E, HZG-4 (излучение CuKα) и ДРОН-1 (излучение CоKα).
Кроме того, при построении диаграммы М–Х использовали данные о синтезе отдельных бинарных соединений фторида кадмия с фторидами других элементов [61–84]. В работе не рассматривались оксофториды, например СdUO2F4 [85]; кристаллогидраты, например CdTiF6 ⋅ 6H2O [86]; тройные соединения, например Cs4Ni3CdF12 [87].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Системы CdF2–MF. Системы фторида кадмия с фторидами лития и натрия носят эвтектический характер [37]. В системе CdF2–NaF образуется гетеровалентный твердый раствор Cd1 –xNaxF2 –x с содержанием до 10 мол. % NaF. Имеет место образование соединений MCdF3 типа перовскита с калием, рубидием, цезием [46–50, 80]. Синтезированы аналогичные соединения с аммонием и таллием [47]. Аналогичное соединение должно существовать и с фторидом франция. Кроме того, описаны и изучены соединения M2CdF4 (M = K, Rb, Cs) и M3Cd2F7 (M = K, Rb) [47].
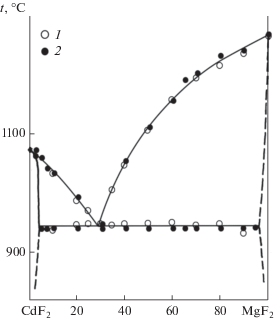
В системах CdF2–MF2 с фторидами щелочноземельных элементов образуются соединения с самым маленьким (СdBeF4) [52] и самым большим (Cd2BaF6) [51] катионами. В системах с изоструктурными соединениями со структурой флюорита (M = Сa, Sr, Pb) образуются непрерывные твердые растворы [5, 51]. В системе CdF2–СaF2 температуры ликвидуса и солидуса изменяются монотонно. В системах с SrF2 и PbF2, в которых реализуется большая разница в ионных радиусах катионов и, соответственно, в параметрах кристаллической решетки, на кривых плавления образуются минимумы, что дает возможность выращивать из расплава монокристаллы высокого оптического качества [5, 31, 32, 34]. Фторид кадмия практически не растворяется в соединениях со структурой рутила (фториды Mg, Co, Ni, Mn) [38, 54, 39 ], однако в соответствующих системах CdF2–MF2 образуются флюоритовые твердые растворы на основе CdF2, ширина которых изменяется от 3.5 мол. % для M = Mg [38] до 80 мол. % для M = Mn [39] в зависимости от ионного радиуса M2+. Система CdF2–MgF2 представлена на рис. 1. При охлаждении твердый раствор Cd1 –xMnxF2 претерпевает неравновесное упорядочение с образованием флюоритоподобных фаз [39]. Флюоритоподобные соединения CdMF4 образуются в системах с дифторидами меди [61], серебра [62] и палладия [63]. Данные ЯМР 19F указывают на образование доменов тетрагональной фазы Pb2CdF6 в монокристалле Pb0.67Cd0.33F2, что указывает на возможность низкотемпературного образования соответствующего соединения в твердом состоянии [5, 25].
Системы CdF2–MF3. Описаны соединения CdGaF5 [56], CdCrF5 [55], CdMnF5 [64], CdCoF5 [65] и Cd(BF4)2 [84]. В бинарных системах CdF2 с фторидами скандия [38] и индия [27, 45] соединения не образуются.
Фазовые диаграммы систем CdF2–RF3, где R – редкоземельные элементы, представлены на рис. 2 по нашим данным, изменение температур нонвариантных превращений по ряду РЗЭ приведено на рис. 3. Данные ДТА табулированы в приложении 1 , в приложении 2 приведены некоторые результаты рентгенофазового исследования. Зависимость предельной ширины твердых растворов Cd1 –xRxF2 +x флюоритовой структуры великолепно описывается [88] гауссианом:
где x – мольная доля RF3, r – ионный радиус R3+, согласно [35], для КЧ = 8. Концентрационные зависимости параметров решетки флюоритовых твердых растворов Cd1 –xRxF2 +x даны в [89]. Кроме того, в системах CdF2–RF3 образуются твердые растворы со структурой типа LaF3 – тисонита на основе трифторидов La–Nd, а также высокотемпературных модификаций трифторидов Sm–Gd. При исчезновении соответствующих модификаций РЗЭ такой структуры вследствие морфотропного перехода [90] тисонитовые фазы переменного состава сохраняются на фазовых диаграммах и приобретают характер бертоллидов [91] (R = Tb–Tm, Y). Кроме того, зафиксированы твердые растворы на основе высокотемпературных модификаций RF3 со структурой типа α-YF3 (α-UO3) [92, 93]. Твердые растворы на основе трифторидов РЗЭ со структурой β-YF3 и соответствующие полиморфные модификации не образуются. Упорядоченные фазы в системах CdF2–RF3 отсутствуют, в отличие, например, от систем, образованных фторидом кальция с фторидами редкоземельных элементов [94].Рис. 2.
Фазовые диаграммы систем CdF2–RF3. Точки – данные ДТА, белые кружки – однофазные образцы, получерные кружки – двухфазные образцы по данным РФА отожженных и закаленных образцов.
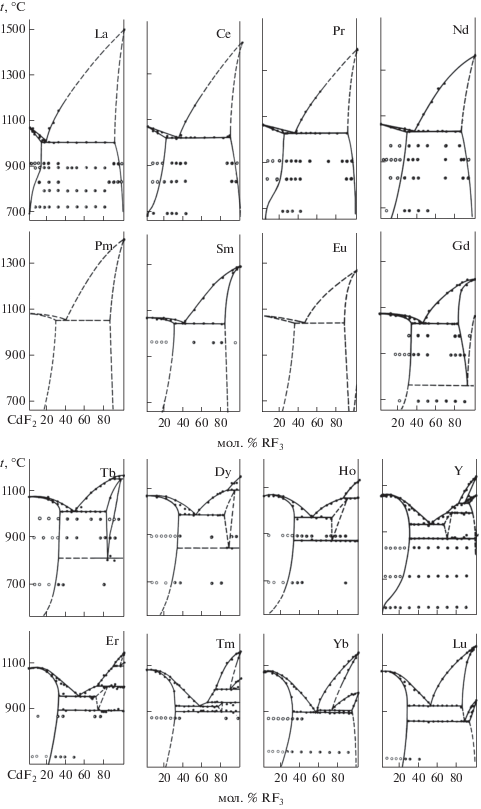
Рис. 3.
Изменение температур нонвариантных равновесий в ряду систем CdF2–RF3. 1 – эвтектики между флюоритовыми Сd1 –xRxF2 +x и тисонитовыми R1 –yCdyF3 –y твердыми растворами; 2 и 3 – соответственно верхняя и нижняя границы существования фаз тисонитовой структуры; 4 – метатектическое разложение высокотемпературных твердых растворов α-R1 –yCdyF3 –y; 5, 6 – эвтектики между Сd1 –xRxF2 +x и R1 –yCdyF3 –y; 7 – температура эвтектоидного распада.
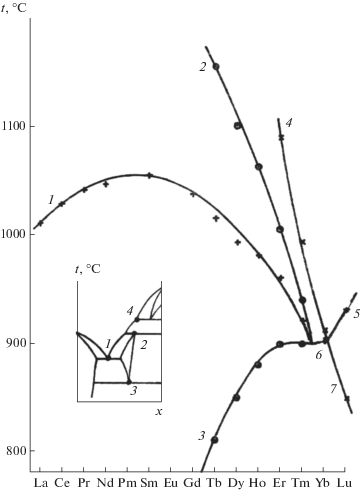
Фазовые диаграммы систем в ряду систем CdF2–RF3 при изменении ионного радиуса R3+ претерпевают трансформации фазовых равновесий, соответствующих бифуркациям типа А1I и А1II [95].
В системах CdF2–MF4 с фторидами четырехвалентных элементов синтезированы соединения CdMF6 для тетрафторидов Ti [70], Zr [76, 77] (полифорфизм), Th [75], Sn [66, 72], Pb [68], Nb [74], Cr [71], Mn [69], Pt [73], Pd [67], Rh [81], Tb [77]. Кроме того, описано соединение CdTb2F8 [77]. Информация [77] об отсутствии соединений в системе CdF2–UF4 нуждается в проверке.
В системах CdF2–MF5 с фторидами пятивалентных элементов синтезированы соединения Cd(MF6)2 для пентафторидов As [78], Sb [82, 83], Bi [84], Au [79]. Кроме того, описано соединение CdNbF7 [74].
Диаграмма обобщенный момент–электроотрицательность. Построенная нами диаграмма обобщенный момент катиона М–его электроотрицательность Х приведена на рис. 4.
Рис. 4.
Диаграмма обобщенный момент катиона М–электроотрицательность Х для группы систем CdF2–MFn. 1 – в системе образуется соединение, 2 – соединения не образуются, 3 – данных нет, 4 – базовый катион Cd2+.
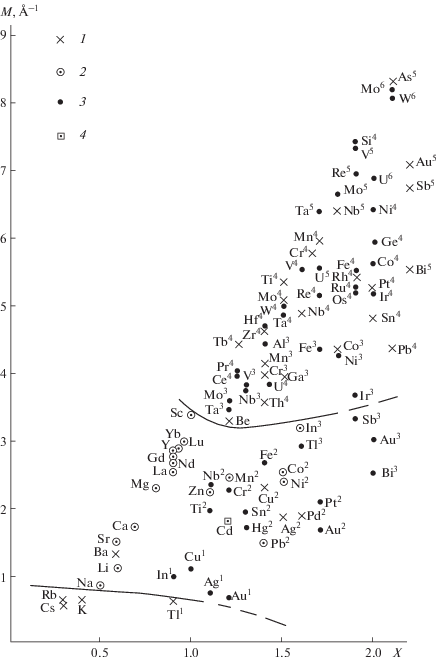
С точки зрения образования соединений в бинарных системах фторид кадмия может играть двоякую роль. На диаграмме М–Х выделяются две области образования соединений. В нижней области кадмий является комплексообразователем. Соответствующие соединения следует классифицировать как фторкадмиаты щелочных металлов, таллия, аммония. В верхней области на диаграмме М–Х кадмий в кристаллических структурах играет вспомогательную роль, подстраиваясь под кристаллохимию более активных трех-, четырех- и пятивалентных элементов-комплексообразователей. Образующиеся соединения следует интерпретировать как фторметаллаты (фторцирконат, фторгаллат и т.д.) кадмия. Между этими областями комплексообразования находится промежуточная полоса. В ней сосредоточены фигуративные точки систем, в которых соединения не образуются или образующиеся соединения (CdCuF4, CdAgF4, Cd2BaF6 и др.) могут быть классифицированы как двойные соли. Заметим, что бертоллидные фазы, образующиеся в ряде систем с трифторидами редкоземельных катионов, не могут рассматриваться как соединения.
С точки зрения обобщенной теории кислот и оснований Льюиса, такое поведение CdF2 свидетельствует о том, что фторид кадмия является амфотерным соединением, как и другие фториды [4, 5] и хлориды [3] двухвалентных металлов. Именно с этой точки зрения надо рассматривать поведение кадмия во фторидных стеклах [29, 30].
Построенная диаграмма М–Х позволяет сделать ряд прогнозов и предсказать существование большого количества новых, еще не открытых соединений с участием фторида кадмия. Должны существовать соединения с фторидами франция и радия. С фторидами одновалентных серебра, меди, золота образование соединений маловероятно, как и с экзотическим фторидом одновалентного индия [6]. С фторидами двухвалентных железа и хрома, а также трехвалентных таллия и висмута соединения образовываться не должны. Очень интересны системы с фторидами двухвалентного олова, а также с фторидами трехвалентных иридия, сурьмы и золота. Не вызывает сомнений существование соединений CdМF5 с трифторидами Al, Fe, Ni. Должны образовываться многочисленные соединения фторида кадмия с фторидами многовалентных металлов, в том числе с тетрафторидами гафния, германия, рения, иридия, кремния, пентафторидами тантала, молибдена, ванадия, фторидами урана разной валентности и др.
Фторид кадмия может рассматриваться как кристаллохимический аналог фторида кальция, хотя и не полный. В частности, в системах CdF2–RF3 не фиксируются упорядоченные флюоритоподобные фазы, широко представленные в системах CаF2–RF3. Тем не менее наличие соединения Cd2BaF6 заставляет еще раз обратить внимание на систему CaF2–BaF2 [96], в которой образование аналогичного соединения не зафиксировано. Изоструктурная фаза образуется в тройной системе Cd–Ba–Zn [33]. Очевидна необходимость дополнительных высокотемпературных исследований системы CaF2–BaF2.
Список литературы
Федоров П.П., Федоров П.И. // Журн. неорган. химии. 1973. Т. 18. № 1. С. 205.
Федоров П.И., Федоров П.П. // Журн неорган. химии. 1974. Т. 19. № 1. С. 215.
Федоров П.П., Федоров П.И. // Журн. неорган. химии. 1975. Т. 20. № 4. С. 1088.
Федоров П.П., Ольховая Л.А. // Журн. неорган. химии. 1981. Т. 21. № 1. С. 218.
Бучинская И.И., Федоров П.П. // Успехи химии. 2004. Т. 73. № 4. С. 404. [Buchinskaya I.I., Fedo-rov P.P. // Russ. Chem. Rev. 2004. V. 73. P. 371.] https://doi.org/10.1070/RC2004v073n04ABEH000811
Davidovich R.V., Fedorov P.P., Popov A.I. // Rev. Inorg. Chem. 2016. V. 36. № 3. P. 105. https://doi.org/10.1515/revic-2015-0019
Davidovich R.V., Fedorov P.P., Popov A.I. // Rev. Inorg. Chem. 2017. V. 37. P. 147. https://doi.org/10.1515/revic-2017-0010
Федоров П.П. // Неорган. материалы. 1997. Т. 33. № 12. С. 1415. [Fedorov P.P. // Inorg. Mater. 1997. V. 33. № 12. P. 1197.]
Voda M., Nistor S.V., Ghiordanescu V. // J. Cryst. Growth. 1992. V. 199. P. 339.
Бучинская И.И., Каримов Д.Н., Закалюкин Р.М., Гали С. // Кристаллография. 2007. Т. 52. № 1. С. 173. [Buchinskaya I.I., Karimov D.N., Zakalyikin R.M., Gali S. // Cryst. Rep. 2007. V. 52. P. 170.]
Гавричев К.С., Федоров П.П., Тюрин А.В. и др. // Журн. неорган. химии. 2009. Т. 54. № 9. С. 1515. [Gavrichev K.S., Fedorov P.P., Tyurin A.V. et al. // Russ. J. Inorg. Chem. 2009. V. 54. P. 1445.] https://doi.org/10.1134/S0036023609090174
Попов П.А., Федоров П.П., Осико В.В. // Физика тв. тела. 2010. Т. 52. № 3. С. 469. [Popov P.A., Fedorov P.P., Osiko V.V. // Phys. Solid State. 2010. V. 52. P. 504]. https://doi.org/10.1134/S1063783410030091
Юшкин Н.П., Волкова Н.В., Маркова Г.А. Оптический флюорит. М.: Наука, 1983. 134 с.
Prener J.S., Kingsley J.D. // J. Chem. Phys. 1963. V. 38. № 3. P. 667.
Ryskin A.I., Shcheulin A.S., Kaziarska B. et al. // Appl. Phys. Letters. 1995. V. 65. № 4. P. 31. https://doi.org/10.1063/1.115482
Fu C.-R., Song K.S. // J. Phys. C: Cond. Matter. 1997. V. 9. P. 3575.
Ryskin A.I., Shcheulin A.S., Miloglyadov E.V. et al. // J. Appl. Phys. 1998. V. 83. № 4. P. 2215. https://doi.org/10.1063/1.366959
Koziarska-Glinka B., Langer J.M., Suchocki A., Arizmendi L. // Opt. Mater. 1998. V. 101. P. 313.
Linke R.A., Shcheulin A.S., Ryskin A.I. et al. // Appl. Phys. B. 2001. V. 72. P. 677.
Lambe J., Donald D.K., Vassell W.C., Cole T. // Appl. Phys. Lett. 1966. V. 8. № 1. P. 16.
Скоробогатов Б.С., Дубовик М.Ф., Азаров В.В., Кольнер Л.Б. // Оптика и спектроскопия. 1967. Т. 22. № 6. С. 981.
Каминский А.А., Курбанов К., Саттарова М.А., Федоров П.П. // Изв. АН СССР. Неорган. материалы. 1985. Т. 21. № 5. С. 702. [Kaminskii A.A., Kurbanov K., Sattarova M.A., Fedorov P.P. // Inorg. Mater. 1985. V. 21. P. 609.]
Мурин И.В., Чернов С.В. // Изв. АН СССР. Неорган. материалы. 1982. Т. 18. № 4. С. 168.
Trnovcová V., Fedorov P.P., Buchinskaya I.I. et al. // Solid State Ionics. 1999. V. 119. P. 181. https://doi.org/10.1016/S0167-2738(98)00501-3
Мацулев А.И., Иванов Ю.Н., Лившиц А.И. и др. // Журн. неорган. химии. 2000. Т. 45. № 2. С. 296. [Matsulev A.N., Ivanov Yu.N., Livshits A.I. et al. // Russ. J. Inorg. Chem. 2000. V. 45. P. 240.]
Buchinskaya I.I., Fedorov P.P. // EPL (Europhys Lett.) 2008. V. 83. Art. 16001.
Lagassie P., Grannec J., El-Omari M., Reau J.-M. // Chim. Miner. 1987. V. 24. № 3. P. 328.
Сорокин Н.И., Федоров П.П., Иванов-Шиц А.К., Соболев Б.П. // Физика тв. тела. 1988. Т. 30. № 5. С. 1537. [Sorokin N.I., Fedorov P.P., Ivanov-Shits A.K., Sobolev B.P. // Soviet Phys. – Solid State. 1988. V. 30. P. 890].
Matecky M., Poulain M., Poulain M. // Mater. Res. Bull. 1982. V. 17. № 10. P. 1275.
Федоров П.П. // Кристаллография. 1997. Т. 42. № 6. С. 1141. [Fedorov P.P. // Crystallogr. Rep. 1997. V. 42. P. 1064.]
Бучинская И.И., Федоров П.П. // Кристаллография. 2004. Т. 49. № 2. С. 334. [Buchinskaya I.I., Fedorov P.P. // Crystallogr. Rep. 2004. V. 49. P. 279.] https://doi.org/10.1134/1.1690431
Каримов Д.Н., Бучинская И.И., Сорокин Н.И. и др. // Неорган. материалы. 2019. Т. 55. Р. 534. [Karimov D.N., Buchinskaya I.I., Sorokin N.I. et al. // Inorg. Mater. 2019. V. 55. P. 495.]
Alimov O.K., Doroshenko M.E., Pierpoint K.A. et al. // Opt. Mater. 2019. V. 94. P. 113. https://doi.org/10.1016/j.optmat.2019.05.011
Васильченко В.Г., Мотин Ю.Д., Кречко Ю.А. и др. // Неорган. материалы. 1993. Т. 29. № 6. С. 739.
Shannon R.D. // Acta Crystallogr., Sect. A. 1976. V. 32. P. 751.
Бацанов C.C. // Журн. неорган. химии. 1973. Т. 18. С. 205.
Федоров П.П., Ловецкая Г.А., Зимина Г.В., Соболев Б.П. // Журн. неорган. химии. 1986. Т. 31. № 3. С. 768.
Федоров П.П., Саттарова М.А., Спиридонов Ф.М., Соболев Б.П. // Журн. неорган. химии. 1987. Т. 32. № 1. С. 163. [Fedorov P.P., Sattarova M.A., Spiridonov F.M. et al. // Russ. J. Inorg. Chem. 1987. V. 32. № 1. P. 90].
Федоров П.П., Саттарова М.А., Ольховая Л.А. и др. // Высокочистые вещества. 1991. № 3. С. 191.
Федоров П.П., Жмурова З.И., Соболев Б.П. // Журн. неорган. химии. 1984. Т. 29. № 9. С. 2346.
Федоров П.П., Саттарова М.А., Шершнева И.И. и др. // Журн. неорган. химии. 1984. Т. 29. № 10. С. 2714.
Kaminskii A.A., Kurbanov K., Sarkisov S.E. et al. // Phys. Status Solidi A. 1985. V. 90. P. k55. https://doi.org/10.1002/pssa.2210900156
Федоров П.П., Саттарова М.А., Жмурова З.И. и др. // Кристаллография. 1986. Т. 31. № 1. С. 194. [Fedorov P.P., Sattarova M.A., Zhmurova Z.I. et al. // Sov. Phys. – Crystallography. 1986. V. 31. P. 115].
Саттарова М.А. Исследование диаграмм состояния систем фторида кадмия с трифторидами редкоземельных элементов. Дис. … канд. хим. наук. Душанбе, 1986. 159 с.
Иванов С.П., Бучинская И.И., Федоров П.П. // Неорган. материалы. 2000. Т. 36. С. 484. [Ivanov S.P., Buchinskaya I.I., Fedorov P.P. // Inorg. Mater. 2000. V. 36. P. 392.] https://doi.org/10.1007/BF02758088
Cousseins J.-C. // Comt. Rend C. 1966. V. 263. P. 585.
Cousseins J.-C., Pina Perez C. // Rev. Chim. Miner. 1968. V. 5. P. 147.
Беляев И.Н., Дорошенко А.К. // Журн. неорган. химии. 1968. Т. 13. № 6. С. 1655.
Беляев И.Н., Дорошенко А.К. // Журн. прикл. химии. 1969. Т. 17. № 12. С. 2704.
Darlington C.N.W. // J. Phys. C. 1984. V. 17. P. 2859.
Kozak A. de, Samouel M., Cretien A. // Rev. Chim. Miner. 1971. V. 8. P. 805.
Samouel M., Kozak A. de // Rev. Chim. Miner. 1972. V. 9. P. 815.
O’Horo M.P., White W.B. // J. Am. Ceram. Soc. 1971. V. 54. P. 588.
Икрами М.Б., Сидоров В.С., Ручкин Е.Д. // Журн. неорган. химии. 1988. Т. 33. № 4. С. 1074. [Ikrami M.B., Sidorov V.S., Ruchkin E.D. // Russ. J. Inorg. Chem. 1988. V. 33. P. 609.]
Kozak A.de // C.R. Acad. Sci. 1969. № 25. P. 2184.
Chassaing J., Zulien P. // C.R. Acad. Sci. 1972. V. 284. P. 871.
Федоров П.П. // Журн. неорган. химии. 2021. Т. 66. № 2. С. 250. [Fedorov P.P. // Russ. J. Inorg. Chem. 2021. V. 66. № 2. P. 245]. https://doi.org/10.1134/S0036023621020078
Федоров П.П., Медведева Л.В. // Журн. неорган. химии. 1989. Т. 34. № 10. С. 2674. [Fedorov P.P., Medvedeva L.V. // Russ. J. Inorg. Chem. 1989. V. 34. № 10. P. 1528.]
Fedorov P.P. // Z. Anorg. Allg. Chem. 2002. B. 628. S. 2954.
Федоров П.П. // Журн. неорган. химии. 2010. Т. 55. № 11. С. 1825. [Fedorov P.P. // Russ. J. Inorg. Chem. 2010. V. 55. № 11. P. 1722.] https://doi.org/10.1134/S0036023610110100
Gredin P. // Eur. J. Solid State Inorg. Chem. 1993. V. 30. P. 789.
Odenthal R.H., Hoppe R. // Z. Anorg. Allg. Chem. 1971. B. 325. S. 92.
Müller B. // J. Fluorine Chem. 1982. V. 20. P. 291.
Muller U., Hoppe R. // Z. Anorg. Allg. Chem. 1990. B. 583. S. 205.
Fleischer T., Hoppe R. // Z. Anorg. Allg. Chem. 1982. B. 490. S. 111.
Moehs P.J., Hatndler H.M. // Inorg. Chem. 1968. V. 7. № 10. P. 2115.
Henkel H., Hoppe R. // Z. Anorg. Allg. Chem. 1968. B. 359. № 3–4. S. 160.
Homann R.H., Hoppe R. // Z. Anorg. Allg. Chem. 1969. B. 368. № 5. S. 271.
Hoppe R., Siebert G. // Z. Anorg. Allg. Chem. 1970. B. 376. № 3. S. 261.
Odenthal R.H., Hoppe R. // Z. Anorg. Allg. Chem. 1971. B. 384. № 2. S. 104.
Siebert G., Hoppe R. // Z. Anorg. Allg. Chem. 1972. B. 391. № 2. S. 126.
Hoppe R., Wilhelm V., Muller B. // Z. Anorg. Allg. Chem. 1972. B. 392. S. 1.
Wilhelm V., Hoppe R. // Z. Anorg. Allg. Chem. 1975. Bd. 414. S. 130.
Chassaing J., Monteil C., Bizot D. // J. Solid State Chem. 1982. V. 43. № 3. P. 327.
Изосимова М.Г., Лившиц А.И., Бузник В.М. // Неорган. материалы. 1987. Т. 23. № 12. С. 2056.
Бaбицына А.А., Емельянова Т.А., Чернов А.П. // Журн. неорган. химии. 1989. Т. 34. № 12. С. 3145.
Lagreau E., El-Chozzi M. // J. Fluorine Chem. 1988. V. 89. P. 223.
Tavcar G., Benkic P., Zemva B. // Inorg. Chem. 2004. V. 43. № 4. P. 1452.
Mazej Z., Goreshnik E. // Solid State Sci. 2006. V. 8. P. 671.
Wu G.Q., Hoppe R. // Z. Anorg. Allg. Chem. 1984. B. 514. S. 92.
Wilhelm V., Hoppe R. // Z. Anorg. Allg. Chem. 1974. B. 407. S. 13.
Gantar D. // J. Chem. Soc., Dalton Trans. 1987. P. 2379.
Frlec B. // Vestn. Slov. Kem. Drus. 1987. V. 34. P. 317.
Radan K., Lozinsek M., Goreshnik E., Zemva B. // J. Fluorine Chem. 2011. V. 132. P. 767.
Игнатьев Ю.А., Константинов С.В., Соколов И.П., Селезнев В.П. // Тр. МХТИ. 1982. Вып. 125. С. 106.
Петраковский Э.А., Абакумова В.С., Кочарова А.Г. // Cб. тр. Ин-та физики CO АН СССР. 1984. С. 116.
Dance J.M., Darriet J., Tressaud A., Hagenmuller P. // Z. Anorg. Allg. Chem. 1984. B. 508. S. 93.
Fedorov P.P. // Russ. J. Inorg. Chem. 2000. V. 45. Suppl. 3. P. S268.
Федоров. П.П., Соболев Б.П. // Кристаллография. 1992. Т. 37. № 5. С. 1210. [Fedorov P.P., Sobolev B.P. // Sov. Phys. Crystallogr. 1992. V. 37. P. 651.]
Федоров П.П., Соболев Б.П. // Кристаллография. 1995. Т. 40. № 2. С. 315. [Fedorov P.P., Sobolev B.P. // Crystallogr. Rep. 1995. V. 40. P. 284.]
Соболев Б.П., Александров В.Б., Федоров П.П. и др. // Кристаллография. 1976. Т. 21. № 1. С. 96. [Sobolev B.P., Aleksandrov V.B., Fedorov P.P. et al. // Sov. Phys. – Crystallogr. 1976. V. 21. № 1. P. 49.]
Соболев Б.П., Федоров П.П. // Кристаллография. 1973. Т. 18. № 3. С. 624. [Sobolev B.P., Fedorov P.P. // Sov. Phys. – Crystallogr. 1973. V. 18. P. 392].
Федоров П.П., Сорокин Н.И. // Неорган. материалы. 2017. Т. 53. № 12. С. 1337. [Fedorov P.P., Sorokin N.I. // Inorg. Mater. 2017. V. 53. № 12. P. 1307.] https://doi.org/10.1134/S0020168517120044
Fedorov P.P., Izotova O.E., Alexandrov V.B., Sobolev B.P. // J. Solid State Chem. 1974. V. 9. № 4. P. 368. https://doi.org/10.1016/0022-4596(74)90096-6
Федоров П.П. // Журн. физ. химии. 1999. Т. 73. № 9. С. 1545. [Fedorov P.P. // Russ. J. Phys. Chem. 1999. V. 73. № 9. P. 1381.]
Федоров П.П., Бучинская И.И., Ивановская Н.А. и др. // Докл. РАН. 2005. Т. 401. № 5. С. 652. [Fedorov P.P., Buchinskaya I.I., Ivanovskaya N.A. et al. // Dokl. Phys. Chem. 2005. V. 401. P. 53. https://doi.org/10.1007/s10634-005-0024-5
Дополнительные материалы
- скачать ESM_1.docx
- Приложение 1.
- скачать ESM_2.docx
- Приложение 2.
Инструменты
Журнал неорганической химии