Журнал неорганической химии, 2019, T. 64, № 11, стр. 1191-1197
Окисление комплекса железа с NHC-лигандом молекулярным иодом
С. С. Шаповалов 1, *, О. Г. Тихонова 1, И. В. Скабицкий 1, А. В. Колос 1, С. Г. Сахаров 1, Ю. В. Торубаев 1
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: schss@yandex.ru
Поступила в редакцию 17.04.2019
После доработки 24.04.2019
Принята к публикации 13.05.2019
Аннотация
Комплекс (η5-C5H5)2Fe2(CO)4 (I) реагирует с 1,3-диметилимидазолий-2-карбоксилатом с Me2ImCO2 с образованием асимметричного биядерного карбенового комплекса железа (η5-C5H5)2Fe2(CO)3(Me2Im) (II) (Me2Im – 1,3-диметилимидазол-2-илиден). Реакция окисления II элементарным иодом протекает по двум механизмам: симметричному и асимметричному с образованием четырех продуктов: (η5-C5H5Fe(CO)2(Me2Im)I (III), (η5-C5H5)Fe(CO)2I (IV), (η5-C5H5Fe(CO)2(Me2Im)I3 (V) и ферроцен (VI). В каждом случае формируются две пары продуктов реакции, два из которых содержат NHC-лиганд: нейтральный комплекс железа III и ионный комплекс V. Подобраны оптимальные условия синтеза, позволяющие получать преимущественно один из этих комплексов. С помощью квантово-химического расчета рассчитана геометрия и энергии переходных состояний предполагаемого механизма реакций.
ВВЕДЕНИЕ
Электрофильная атака галогенов по связи металл–металл в координационных соединениях часто приводит к расщеплению этой связи и в случае симметричных димеров, например [(η5-C5Me5)Fe(CO)2]2 [1], к образованию одного продукта реакции. При окислении асимметричных биядерных комплексов, например в случае предварительного замещения СO-групп различными лигандами, количество продуктов увеличивается. Так, при бромировании фосфинового комплекса Mn2(CO)9(PPh3) образуются Mn(CO)5Br, а также цис- и транс-Mn(CO)4Br(PPh3) [2]. В то же время известны биядерные комплексы, не разрушающиеся под действием галогенов. При взаимодействии элементарного иода (хлора) с фосфиновым комплексом MoRu(CO)6(dppm)2 (dppm – бис-дифенилметан), содержащим мостиковую CO‑группу, связь металл–металл сохраняется. Продукт этой реакции представляет собой ионное соединение [(CO)2Mo(dppm)2(μ-X)(μ-CO)Ru(CO)2]+[Mo(CO)4X3]−, катион которого включает в себя мостиковый атом галогена [3].
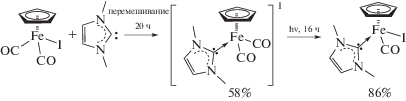
В случае недоступности соответствующего димера порядок введения лигандов в комплекс может быть изменен. Так, для получения фосфинового иодида (η5-C5Me5)Fe(dppe)I (dppe – 1,2-бис(дифенилфосфино)этан) сначала вводят атом иода, а затем фосфин в структуру комплекса. Замещение CO-групп на dppe в комплексе (η5-C5Me5)Fe(CO)2I происходит фотохимически [1]. Окисление полученного (η5-C5Me5)Fe(dppe)I феррициний-катионом приводит к образованию 17е-парамагнитного комплекса (η5-C5Me5)Fe(dppe)+PF6− [4]. Однако в случае термической реакции соответствующего хлорсодержащего комплекса (η5-C5H5)Fe(CO)2Cl c dppe получается только ионный комплекс (η5-C5H5)Fe(CO)(dppe)+Cl– [5]. Нейтральный иодидный комплекс железа, содержащий N-гетероциклический карбен (NHC) в качестве лиганда, образуется в две стадии из C5H5Fe(CO)2I (схема 1 ) [6]:
Схема 1 .
На первой стадии (η5-C5H5)Fe(CO)2I реагирует со свободным карбеном Me2Im (Me2Im – 1,3-диметилимидазол-2-илиден) с образованием катионного комплекса (η5-C5H5)Fe(CO)2(Me2Im)+I–. Дальнейшая длительная фотохимическая реакция ионного комплекса приводит к образованию нейтрального комплекса (η5-C5H5)Fe(CO)(Me2Im)I. Подобные комплексы железа, содержащие как карбонильные лиганды [7], так и координированный NHC-лиганд [8], имеют широкое применение в гомогенном катализе. В настоящей работе мы исследовали альтернативный подход к получению (η5-C5H5)Fe(CO)(Me2Im)I: окисление биядерного карбенового комплекса железа молекулярным иодом.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все операции, связанные с синтезом и выделением соединений, проводили в атмосфере аргона в абсолютированных растворителях. Соединение Me2ImCO2 получали по методике [9]. Коммерческие вещества [(η5-C5H5)Fe(CO)2]2 (I) и I2 использовали без дополнительной очистки. Химический анализ выполняли с помощью ЕА3000 CHNS-анализатора (EuroVector). Для ИК-спектроскопии использовали ИК-Фурье-спектрометр Bruker Alpha с приставкой Platinum ATR. Для регистрации спектров ЯМР 1Н, 13С – спектрометр Bruker Avance 300.
Синтез (η5-C5H5)2Fe2(CO)3(Me2Im) (II). Коричневый раствор 0.305 г (0.862 ммоль) [(η5-C5H5)Fe(CO)2]2 и 0.238 г (1.700 ммоль) Me2ImCO2 в смеси толуола (10 мл) и ацетонитрила (10 мл) кипятили в течение 3 ч. Затем растворители удаляли при пониженном давлении, масляный остаток экстрагировали толуолом (25 мл). Зеленый раствор фильтровали, концентрировали до 1/4V и выдерживали при температуре –26°С в течение 24 ч. Зеленые кристаллы промывали пентаном (2 × 5 мл) и сушили. Кристаллы, пригодные для РСА, были выращены диффузией паров пентана в бензольный раствор комплекса.
Выход: зеленые кристаллы, 0.205 г, 57%. Результаты элементного анализа представлены ниже.
ИК-спектр (НПВО, ν, см–1): 3170 (сл.), 3117 (сл., ш.), 2947 (сл., ш.), 1920 (оч.с.), 1880 (сл.), 1698 (оч.с., ш.), 1575 (сл.), 1543 (сл.), 1448 (ср.), 1416 (сл.), 1394 (сл.), 1352 (ср.), 1297 (сл.), 1219 (ср.), 1175 (сл.), 1110 (сл.), 1062 (сл., ш.), 1019 (сл.), 999 (сл.), 926 (сл.), 857 (сл.), 839 (ср.), 831 (ср.), 818 (c.), 749 (сл.), 724 (ср.), 684 (c.), 659 (оч.с., ш.), 599 (ср.), 588 (c.), 559 (оч.с.), 511 (ср.), 468 (ср.), 452 (ср.), 443 (ср.), 427 (сл.), 419 (ср.), 408 (ср.).
Реакция (η5-C5H5)2Fe2(CO)3(Me2Im) с I2 в толуоле, синтез (η5-C5H5)Fe(CO)(Me2Im)I (III). К зеленому раствору 0.292 г (0.692 ммоль) (C5H5)2Fe2(CO)3(Me2Im) в толуоле (10 мл) прикапывали малиновый раствор 0.180 г (0.709 ммоль) I2 в толуоле (10 мл) в течение 1 ч при охлаждении смесью изопропанол–жидкий азот. Окраска раствора изменялась на коричневую. Реакционную смесь перемешивали в течение 1 ч, затем растворители удаляли при пониженном давлении. Коричнево-зеленый остаток экстрагировали CH2Cl2 (10 мл), продукт осаждали гексаном (7 мл) и переосаждали из системы CH2Cl2/гексан. Соединения III, (η5-C5H5)Fe(CO)2I (IV) и ферроцен (VI) были выделены из оставшегося зеленого раствора с помощью колоночной хроматографии (элюэнты: гексан, бензол, CH2Cl2 соответственно). Монокристалл, пригодный для РСА, был получен диффузией паров пентана в насыщенный раствор II в CH2Cl2. Выход: зеленый порошок, 0.100 г, 39%. Ниже представлены результаты элементного анализа:
ЯМР 1H (CDCl3, δ, м.д.): 4.09 (s, 6H, 2Me), 4.48 (s, 5H, C5H5), 7.01 (s, 2H, CH); ЯМР 13C (CDCl3, δ, м.д.): 40.9, 80.1, 124.3, 185.7, 223.8.
ИК-спектр (НПВО, ν, cм–1): 3167 (оч.сл.), 3105 (оч.сл., ш.), 2946 (оч.сл., ш.), 2041 (оч.сл.), 1993 (оч.сл.), 1918 (оч.с., ш.), 1576 (оч.сл.), 1453 (оч.сл.), 1425 (оч.сл.), 1397 (оч.сл.), 1371 (оч.сл.), 1356 (оч.сл., ш.), 1305 (оч.сл.), 1224 (оч.сл.), 1116 (оч.сл.), 1081 (оч.сл.), 1001 (оч.сл.), 840 (оч.сл.), 818 (оч.сл., ш.), 750 (оч.сл.), 727 (оч.сл., ш.), 680 (оч.сл.), 558 (оч.сл.), 533 (оч.сл.), 469 (оч.сл.), 433 (оч.сл.), 422 (оч.сл.).
Реакция (η5-C5H5)2Fe2(CO)3(Me2Im) с I2 в СH2Cl2, синтез (η5-C5H5)Fe(CO)2(Me2Im)I3 (V). К зеленому раствору 0.191 г (0.453 ммоль) (C5H5)2Fe2(CO)3(Me2Im) в CH2Cl2 (10 мл) прикапывали малиновый раствор 0.120 г (0.472 ммоль) I2 в CH2Cl2 (5 мл). Окраска раствора изменялась на коричневую. Реакцию контролировали с помощью ИК-спектроскопии. К коричневому раствору добавляли гексан (10 мл) и концентрировали до 1/2V. Темно-зеленый раствор отфильтровывали, коричневый масляный остаток промывали гексаном (2 × 3 мл), сушили, растворяли в MeCN. Продукт V был закристаллизован в виде трииодида диффузией паров Et2O в насыщенный раствор соединения в MeCN. Соединения III, (η5-C5H5)Fe(CO)2I (IV) и ферроцен (VI) были выделены из темно-зеленого раствора с помощью колоночной хроматографии (элюэнты: гексан, бензол, CH2Cl2 соответственно).
Выход: коричневое масло, 0.098 г, 54%.
ЯМР 1H (CD3CN, δ, м.д.): 3.76 (s, 6H, 2Me), 5.29 (s, 5H, C5H5), 7.29 (s, 2H, CH).
ИК-спектр (НПВО, ν, см–1): 3167 (оч.сл.), 3093 (оч.сл., ш.), 2952 (оч.сл.), 2037 (оч.с.), 1990 (оч.с.), 1577 (оч.сл.), 1460 (сл.), 1424 (оч.сл.), 1399 (оч.сл.), 1375 (оч.сл., ш.), 1359 (оч.сл.), 1227 (сл.), 1127 (оч.сл.), 1082 (оч.сл.), 1059 (оч.сл.), 1004 (оч.сл.), 863 (оч.сл.), 732 (оч.сл., ш.), 678 (сл.), 611 (сл.), 580 (сл.), 558 (сл.), 505 (оч.сл.), 472 (оч.сл.), 438 (оч.сл.), 411 (оч.сл.).
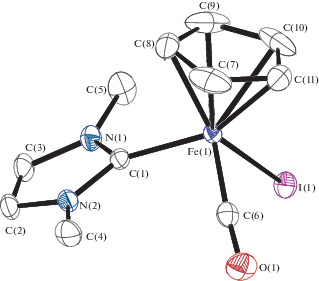
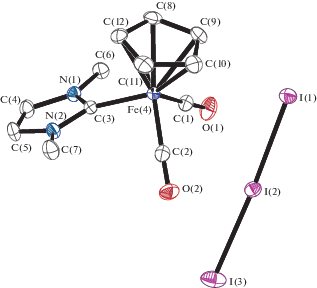
РСА выполняли на дифрактометре Bruker APEX II CCD. Кристаллографические данные и параметры уточнения структуры соединений III и V приведены в табл. 1. Поглощение учтено методом множественного измерения эквивалентных отражений по программе SADABS [10]. Структуры III и V определены прямым методом и уточнены методом наименьших квадратов относительно F 2 в анизотропном приближении для неводородных атомов с использованием пакета программ SHELX-2014 [11] и OLEX2 [12]. Координаты разупорядоченных атомов циклопентадиенильного лиганда в комплексе III уточнены в анизотропном приближении c ограничением равенства расстояний и ограничением “жестких связей” для тепловых параметров (инструкции SAME и DELU). Положения атомов Н рассчитаны геометрически. Координаты атомов и другие параметры структур III и V депонированы в Кембриджском банке структурных данных (№ 1910061, 1910062 соответственно, http://www.ccdc.cam.ac.uk/data_request/cif). Основные длины связей и валентные углы приведены в подписях к рис. 1, 2.
Таблица 1.
Кристаллографические данные и параметры уточнения структуры комплексов III и V
| Параметр | III | V |
|---|---|---|
| Брутто-формула | C11H13N2OFeI | C12H13FeI3N2O2 |
| M | 371.98 | 653.79 |
| Излучение, λ, Å | MoKα, 0.71073 | MoKα, 0.71073 |
| Температура съемки, K | 150 | 120 |
| Сингония | Моноклинная | Орторомбическая |
| Пр. гр. | P21/n | Pbca |
| а, Å | 7.3700(5) | 10.9064(7) |
| b, Å | 12.2094(8) | 15.5051(10) |
| c, Å | 13.8458(9) | 20.9548(15) |
| α, град | 90 | 90 |
| β, град | 93.2750(9) | 90 |
| γ, град | 90 | 90 |
| V, Å3 | 1243.86(14) | 3543.6(4) |
| Z | 4 | 8 |
| ρ(выч), г/cм–3 | 1.986 | 2.451 |
| μ, мм–1 | 3.674 | 6.080 |
| F(000) | 720.0 | 2400.0 |
| Интервал сканирования θ, град | 4.452–61.062 | 3.888–59.998 |
| Тип сканирования | ω | |
| Независимых отражений (N1) | 3804 (Rint = 0.0208) | 5165 (Rint = 0.0421) |
| отражений с I > 2σ(I) (N2) | 3433 | 4456 |
| Число уточняемых параметров | 193 | 183 |
| GOОF (F2) | 1.052 | 1.036 |
| R1 для N2 | 0.0186 | 0.0234 |
| wR2 для N1 | 0.0432 | 0.0525 |
| Δρmax/Δρmin, e Å–3 | 0.35/–0.52 | 1.66/–1.52 |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
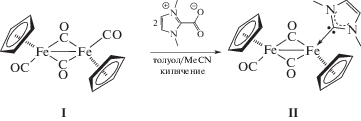
Для введения карбенового лиганда в структуру мономерного комплекса железа были проведены реакции 1,3-диметилимидазолий-2-карбоксилата (Me2ImCO2) с комплексами типа (η5-C5H5)Fe(CO)2L (L = I, Cl) и (η5-C5H5)Fe(CO)2(MeCN)+PF$_{6}^{ - }$ при нагревании в смеси толуол–ацетонитрил (1 : 1). В качестве продукта каждой из этих реакций был выделен димерный комплекс [(η5-C5H5)Fe(CO)2]2 (I). Это свидетельствует о том, что гетероциклический цвиттер-ион выступает в качестве восстановителя.
Поскольку стратегия последовательного введения NHC-лиганда в иодид не привела к ожидаемому результату, был реализован подход получения карбенового иодсодержащего комплекса железа из димерного исходного комплекса. Для этого была проведена реакция I с двумя эквивалентами диметилимидазолий-2-карбоксилата при нагревании в смеси толуол–ацетонитрил (1 : 1). В результате реакции был получен монозамещенный биядерный комплекс железа (η5-C5H5)2Fe2(CO)3(Me2Im) (II) в качестве единственного продукта, причем замещения еще одной карбонильной группы не происходило (схема 2 ).
Схема 2 .
В ИК-спектре комплекса II наблюдаются полосы при 1920 и 1698 cм–1, соответствующие валентным колебаниям терминальной и мостиковых карбонильных групп. Введение карбенового лиганда в структуру комплекса смещает частоту колебаний мостиковой CO-группы в коротковолновую область спектра на ∼60 см–1 (частоты колебаний СО-групп [(η5-C5H5)Fe(CO)2]2 в спектре НПВО составляют 1976, 1953, 1933 и 1758 см–1, что соответствует транс-изомеру [13]). Такое смещение свидетельствует о большей σ-донорной способности NHC-лиганда по сравнению с изоструктурным фосфиновым комплексом [(η5-C5H5)(μ-η5:κ1-C5H4CH2PPh2)Fe2(μ-CO)2(CO)], полученным в результате фотохимической реакции Ph2PCH2PPh2 с [(η5-C5H5)Fe(CO)2]2 (частота колебаний мостиковой СО-группы соответствует 1727 см–1) [14].
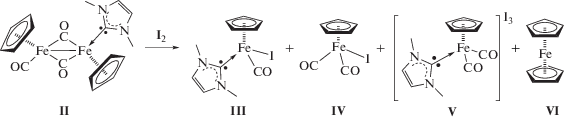
Биядерный монозамещенный карбеновый комплекс II окисляется молекулярным иодом с образованием четырех продуктов реакции (схема 3 ):
Схема 3 .
Выделенные нейтральные комплексы [(η5-C5H5)Fe(CO)(Me2Im)I (III) и [(η5-C5H5)Fe(CO)2I (IV) содержат координированный иодидный лиганд и имеют структуру “трехногой табуретки”. Комплекс III был получен ранее [6] при фотохимическом декарбонилировании ионного комплекса [(η5-C5H5)Fe(CO)2(Me2Im)+I–, в настоящей работе его строение установлено методом РСА. Катионный дикарбонильный комплекс [(η5-C5H5)Fe(CO)2(Me2Im)]I3 (V), содержащий координированный 1,3-диметилимидазол-2-илиден, был выделен c трииодидным анионом. Кроме того, в качестве четвертого продукта реакции был выделен ферроцен (VI) (рис. 1).
По данным РСА, в комплексе III длина связи Fe–Csp2 составляет 1.963(2) Å, Fe–I – 2.6554(3) Å. В комплексе Fe(CO)3(Me2Im)I2 [15] длина связи Fe–Csp2 составляет 1.984(4) Å, Fe–I – 2.665(1) и 2.667(1) Å.
В ИК-спектре комплекса V частоты колебаний CO-групп составляют 2037 и 1990 см–1. Для изоструктурного фосфинового катиона [(η5-C5H5)Fe(CO)2(PH2Mes*)+ (Mes* = 2,4,6-C6H$_{2}^{{\text{t}}}$Bu3) соответствующие значения равны 2065 и 2021 см–1 [16], что также свидетельствует о большей σ-донорной способности NHC-лиганда. По данным РСА, в комплексе V длина связи Fe–CNHC составляет 1.969(3) Å (рис. 2).
Образование полигалогенидов распространено для p-элементов [17–19], реакции галогенирования координационных соединений также часто приводят к формированию аниона ${\text{I}}_{3}^{ - }$. Например, при длительном взаимодействии димера [(η5-C5Me5)Mo(CO)3]2 с иодом основным продуктом реакции является ионный комплекс [(η5-C5Me5)2Mo2(µ-I)4]+${\text{I}}_{3}^{ - }$ [20]. Окисление комплекса двухвалентной платины [Me2Pt(µ-dmpm)2PtMe2] (dmpm – Me2PCH2PMe2) под действием галогенов приводит к переносу метильной группы с одного атома металла на соседний и образованию смешановалентного комплекса [Me3Pt(µ-dmpm)2(µ-I)PtI]+${\text{I}}_{3}^{ - }$ [21].
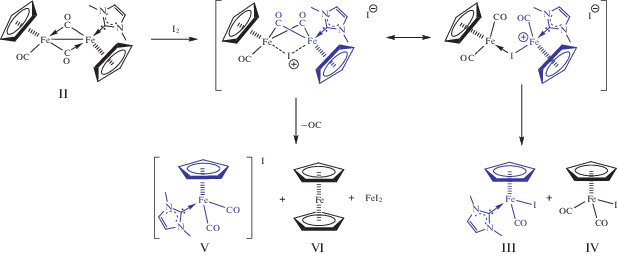
По аналогии с приведенным механизмом иодирования комплекса [(η5-C5H5)Fe(CO)2]2 [22] был предположен механизм реакции иодирования карбенового биядерного комплекса II (схема 4 ). Электрофильная атака по связи железо–железо приводит к образованию ионного димера, содержащего мостиковый атом иода. Далее могут реализоваться две возможности: нуклеофильная атака с образованием двух нейтральных комплексов с иодидными лигандами (III и IV) или асимметричное расщепление с образованием продуктов (V и VI). Образование комплекса IV, содержащего карбеновый лиганд, обусловлено предпочтительной атакой нуклефила I– по более электрофильному атому железа. Оставшийся фрагмент [(η5-C5H5)Fe(CO)I] претерпевает декарбонилирование и разлагается на ферроцен и иодид железа. Похожее диспропорционирование комплексов состава [(η5-C5R5)FeX]2 на галогениды двухвалентного железа и соответствующие замещенные ферроцены отмечается в [23].
Схема 4 .
Исходя из вышеизложенного механизма, можно предположить возможное влияние на выбор одного из путей протекания реакции условий ее проведения. Так, полярный растворитель будет обеспечивать асимметрическое расщепление исходного комплекса, стабилизируя первое переходное состояние, а неполярный растворитель будет способствовать протеканию реакции по второму пути.
Если провести аналогию между описываемым симметричным и асимметричным расщеплением и гомо- и гетеролитическим разрывом связи, то можно распространить факторы, определяющие тип разрыва, и на реакцию иодирования. При варьировании таких факторов, как природа растворителя и температура проведения реакции, нами была проведена серия экспериментов, подтверждающих предположение о правомерности применения аналогии (результаты представлены в табл. 2).
Список литературы
Diaz C., Cabezas N., Mendizabal F. // Bol. Soc. Chil. Quím. 2002. V. 47. P. 213.
Kramer G., Patterson J., Poë A. // J. Chem. Soc., Dalton Trans. 1979. P. 1165.
Khorasani-Motlagh M., Safari N., Pamplin C.B. // Inorg. Chem. Commun. 2003. V. 6. № 9. P. 1175.
Tilset M., Fjeldahl I., Hamon J.-R. et al. // J. Am. Chem. Soc. 2001. V. 123. P. 9984.
Sellmann D., Kleinschmidt E. // Angew. Chem. Int. Ed. 1975. V. 14. № 8. P. 571.
Mercs L., Labat G., Neels A. et al. // Organometallics. 2006. V. 25. P. 5648.
Itazaki M., Kensuke U., Nakazawa H. // Angew. Chem. 2009. V. 48. P. 3313.
Riener K., Haslinger S., Raba A. et al. // Chem. Rev. 2014. V. 114. № 10. P. 5215.
Voutchkova A.M., Appelhans L.N., Chianese A.R. et al. // J. Am. Chem. Soc. 2005. V. 127. P. 17624.
Sheldrick G.M. SADABS. Göttingem(Germany): Univ. of Göttingem, 2005.
Sheldrick G.M. // Acta Crystallogr. 2008. V. A64. P. 112.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Crystallogr. 2009. V. 42. P. 339.
Bryan R.F., Greene P.T., Newlands M.J. et al. // J. Chem. Soc. (A). 1970. P. 3068.
Alvarez C.M., Galan B., García M.E. // Organometallics. 2003. V. 22. P. 5504.
Li B., Liu T., Popescu C.V. et al. // Inorg. Chem. 2009. V. 48. P. 11283.
Alvarez M.A., García M.E., García-Vivo D. et al. // Inorg. Chem. 2012. V. 51. P. 3698.
Chernov’yants M.S., Burykin I.V., Starikova Z.A. et al. // Russ. J. Inorg. Chem. 2016. V. 61. P. 217. https://doi.org/10.1134/S0036023616020054
Gorokh I.D., Adonin S.A., Sokolov M.N. et al. // Inorg. Chim. Acta. 2018. V. 469. P. 583.
Adonin S.A., Udalova L.I., Abramov P.A. et al. // Chem. Eur. J. 2018. V. 24. P. 14707.
Desai J.U., Gordon J.C., Kraatz H.-B. et al. // Inorg. Chem. 1994. V. 33. P. 3752.
Ling S.S.M., Puddephatt R.J., Manojlovic-Muir L. // J. Organomet. Chem. 1983. V. 255. P. C11.
Haines R.J., du Preez A.L. // J. Chem. Soc. (A). 1970. P. 2341.
Bowyer W.J., Geiger W.E., Boekelheide V. et al. // Organometallics. 1984. P. 1079.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии