Журнал неорганической химии, 2019, T. 64, № 11, стр. 1184-1190
Синтез и строение комплексов Ar3Sb(ONCHC6H4NO2-2)2 · 0.5C6H6, Ar3Sb(ONCHC6H4NO2-3)2 · 2C6H6 и Ar3Sb(OC(O)CH2C6H4F-3)2 (Ar = C6H3OMe-2-Br-5)
Е. В. Артемьева 1, *, В. В. Шарутин 1, О. К. Шарутина 1
1 Национальный исследовательский Южно-Уральский государственный университет
454080 Челябинск, пр-т Ленина, 76, Россия
* E-mail: katriona-art@yandex.ru
Поступила в редакцию 21.11.2018
После доработки 17.12.2018
Принята к публикации 13.05.2019
Аннотация
Изучены реакции трис(5-бром-2-метоксифенил)сурьмы с 2-, 3-нитробензальдоксимами и 3-фторфенилуксусной кислотой в присутствии трет-бутилгидропероксида, продуктами которых являются соединения общей формулы (2-MeO-5-Br-C6H3)3SbХ2, Х = ONCHC6H4NO2-2 (I), ONCHC6H4NO2-3 (II), OC(O)CH2C6H4F-3 (III). Согласно данным рентгеноструктурного анализа, I и II кристаллизуются в форме сольватов (с 0.5C6H6 и 2C6H6 соответственно). Атомы Sb в молекулах I–III имеют тригонально-бипирамидальную координацию с атомами углерода арильных радикалов в экваториальной плоскости и атомами кислорода оксиматных и карбоксилатных лигандов в аксиальных положениях. Аксиальные углы ОSbО составляют 173.47(18)° (1), 170.71(9)° (2), 173.96(10)° (3), углы OSbC варьируют в пределах 86.2(2)°–95.1(2)° (1), 81.31(13)°–94.35(12)° (2), 83.12(12)°–96.50(13)° (3). Интервалы длины связей Sb–C составляют 2.097(6)–2.109(6) Å (1), 2.115(4)–2.137(4) Å (2) и 2.119(4)–2.122(3) Å (3), расстояния Sb–O равны 2.050(5), 2.055(5) Å (1), 2.058(3), 2.093(3) Å (2), 2.111(3), 2.110(3) Å (3).
ВВЕДЕНИЕ
Арильные комплексы сурьмы с диоксиматными и дикарбоксилатными лигандами являются биологически активными соединениями. Было доказано их противоопухолевое, антилейшманиозное и антибактериальное действие [1–11]. В литературе описано использование таких соединений в качестве фотокатализаторов или реагентов в органическом синтезе [12].
Известно, что соединения общей формулы Ar3SbХ2 можно получить по реакциям дигалогенидов или диалкоксидов триарилсурьмы с натриевыми или калиевыми производными карбоновых кислот и оксимов [4, 13–16]; при использовании карбоновых кислот и оксимов в присутствии триэтиламина [8, 13, 14, 17, 18]. Показано, что взаимодействие пентаарилсурьмы с некоторыми кетоксимами также приводит к образованию диоксиматов триарилсурьмы [19]. Кроме того, диоксиматы и дикарбоксилаты триарилсурьмы получают по реакциям окислительного присоединения, которые представляют собой удобный одностадийный метод синтеза. Так, например, были получены фенильные [9, 20] и толильные [20–22] производные сурьмы.
В настоящей работе мы продолжили изучение окислительного метода синтеза арильных соединений сурьмы(V), выбрав в качестве объекта исследования трис(5-бром-2-метоксифенил)сурьму, производные которой недостаточно хорошо исследованы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез сольвата бис(2-нитробензальдоксимато)трис(5-бром-2-метоксифенил)сурьмы с бензолом (2-MeO-5-Br-C6H3)3Sb(ONCHC6H4NO2-2)2 · ⋅ 0.5C6H6 (I). К раствору 0.10 г (0.14 ммоль) трис(5-бром-2метоксифенил)сурьмы и 0.049 г (0.28 ммоль) 2-нитробензальдоксима в 30 мл бензола с добавлением 5 мл гептана прибавляли 0.019 г (0.14 ммоль) 70%-ного водного раствора трет-бутилгидропероксида. Выдерживали смесь 24 ч при 20°С. После испарения растворителя получили желтые кристаллы массой 0.140 г (96%), т. пл. 119°С.
ИК-спектр (ν, см–1): 1608, 1574, 1524, 1472, 1342, 1283, 254, 1180, 1146, 1092, 1049, 1016, 966, 883, 849, 806, 743, 696, 621, 551, 519, 442, 407.
ЯMР 1H (CDCl3), δ: 3.80 (с, OCH3, 9H), 6.92 (с, СН, 2Н), 7.41–8.34 (протоны Ph).
ЯМР 13C (CDCl3), δ: 56.14 (OCH3), 113.10–138.41 (C Ph), 145.22 (CHNO).
Найдено, %: С 43.46, Н 3.01. Для C38H31Br3N4O9Sb вычислено, %: С 43.50, Н 2.98.
Синтез сольвата бис(3-нитробензальдоксимато)трис(5-бром-2-метоксифенил)сурьмы с бензолом (2-MeO-5-Br-C6H3)3Sb(ONCHC6H4NO2-3)2 ⋅ ⋅ 2С6Н6 (II). К раствору 0.2 г (0.28 ммоль) трис(5-бром-2-метоксифенил)сурьмы и 0.098 г (0.56 ммоль) 3-нитробензальдоксима в 30 мл бензола с добавлением 5 мл гептана прибавляли 0.038 г (0.28 ммоль) 70%-ного водного раствора трет-бутилгидропероксида. Выдерживали смесь 24 ч при 20°С. После испарения растворителя получили желтые кристаллы массой 0.28 г (84%), т. пл. 120°С.
ИК-спектр (ν, см–1): 3080, 2932, 2843, 2359, 1574, 1530, 1474, 1375, 1352, 1281, 1254, 1180, 1148, 1094, 1076, 1049, 1016, 966, 837, 806, 735, 704, 677, 650, 621, 563, 540, 445, 403.
ЯMР 1H (CDCl3), δ: 3.83 (с, OCH3, 9H), 6.96 (с, СН, 2Н), 7.36–8.05 (протоны Ph).
ЯМР 13C (CDCl3), δ: 56.05 (OCH3), 112.96–146.61 (C Ph), 148.46 (CHNO).
Найдено, %: С 48.35, Н 3.49. Для C47H40Br3N4O9Sb вычислено, %: С 48.40, Н 3.46.
Синтез бис(3-фторфенилацетато)трис(5-бром-2-метоксифенил)сурьмы (2-MeO-5-Br-C6H3)3Sb(OC(O)CH2C6H4F-3)2 (III). К раствору 0.1 г (0.14 ммоль) трис(5-бром-2метоксифенил)сурьмы и 0.045 г (0.28 ммоль) 3-фторфенилуксусной кислоты в 30 мл диэтилового эфира прибавляли 0.019 г (0.14 ммоль) 70%-ного водного раствора трет-бутилгидропероксида. Выдерживали смесь 24 ч при 20°С. Образовавшийся осадок перекристаллизовали из дихлорметана с добавлением изооктана. После испарения растворителя получили бесцветные кристаллы массой 0.143 г (97%), т. пл. 180°С.
ИК-спектр (ν, см–1): 3098, 3063, 3007, 2980, 2940, 2841, 1657,1614, 1589, 1572, 1473, 1439, 1377, 1294, 1269, 1254, 1180, 1142, 1093, 1047, 1016, 962, 937, 922, 908, 889, 871, 823, 810, 781, 768, 752, 726, 683, 650, 623, 538, 523, 440, 403.
ЯMР 1H (CDCl3), δ: 3.28 (с, CH2, 4H), 3.71 (с, OCH3, 9H), 6.86–7.91 (протоны Ph).
ЯМР 13C (CDCl3), δ: 42.93 (OCH3), 55.79 (CH2), 113.64–163.78 (C Ph), 173.45 (COO).
Найдено, %: С 45.03, Н 3.10. Для C37H30Br3F2O7Sb вычислено, %: С 45.07, Н 3.07.
Рентгеноструктурный анализ (РСА) кристаллов соединений I−III проведен на автоматическом четырехкружном дифрактометре D8 QUEST фирмы Bruker (MoKα-излучение, λ = 0.71073 Å, графитовый монохроматор).
Сбор, первичная обработка данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT-Plus [23]. Все расчеты по определению и уточнению структуры выполнены по программам SHELXL/PC [24]. Структуры соединений I–III определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Положения атомов водорода рассчитаны геометрически и включены в уточнение по модели “наездника”. Основные кристаллографические данные и результаты уточнения структур представлены в табл. 1.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнение структур соединений I–III
| Параметр | I | II | III |
|---|---|---|---|
| Эмпирическая формула | C38H31Br3N4O9Sb | C47H40Br3N4O9Sb | C37H30Br3F2O7Sb |
| Fw | 1049.15 | 1166.31 | 986.09 |
| T, K | 293.15 | 293.15 | 293.15 |
| Сингония, пр. гр. | Триклинная, P$\bar {1}$ | Триклинная, P$\bar {1}$ | Триклинная, P$\bar {1}$ |
| a, Å | 12.639(15) | 13.080(18) | 10.718(6) |
| b, Å | 13.59(2) | 13.720(11) | 12.539(7) |
| c, Å | 14.655(17) | 15.449(14) | 14.479(9) |
| α, град | 92.03(6) | 76.20(3) | 106.10(2) |
| β, град | 106.01(3) | 65.54(5) | 97.50(4) |
| γ, град | 111.29(5) | 71.46(6) | 95.73(3) |
| V, Å3 | 2229(5) | 2374(4) | 1834.6(17) |
| Z | 2 | 2 | 2 |
| ρвыч, г/см3 | 1.563 | 1.631 | 1.785 |
| μMo, мм–1 | 3.360 | 3.164 | 4.077 |
| F(000) | 1030.0 | 1156.0 | 964.0 |
| Размер кристалла, мм | 0.61 × 0.53 × 0.11 | 0.46 × 0.23 × 0.22 | 0.62 × 0.25 × 0.04 |
| 2θ, град | 6.1–49.24 | 5.84–48.32 | 5.94–51 |
| Интервалы индексов отражений | –14 ≤ h ≤ 14, –15 ≤ k ≤ 15, –17 ≤ l ≤ 17 |
–15 ≤ h ≤ 15, –15 ≤ k ≤ 15, –17 ≤ l ≤ 17 |
–12 ≤ h ≤ 12, –15 ≤ k ≤ 15, –17 ≤ l ≤ 17 |
| Измерено отражений | 44 507 | 41 643 | 35 591 |
| Независимых отражений | 7414 (Rint = 0.0464) | 7534 (Rint = 0.0330) | 6730 (Rint = 0.0538) |
| Число уточняемых параметров | 499 | 580 | 455 |
| GOOF | 1.033 | 1.027 | 1.017 |
| R-факторы по F2 > 2σ(F2) | R1 = 0.0587, wR2 = 0.1768 | R1 = 0.0294, wR2 = 0.0673 | R1 = 0.0319, wR2 = 0.0736 |
| R-факторы по всем отражениям | R1 = 0.0710, wR2 = 0.1926 | R1 = 0.0377, wR2 = 0.0719 | R1 = 0.0448, wR2 = 0.0808 |
| Остаточная электронная плотность (min/max), e/Å3 | 1.75/–1.24 | 0.92/–1.09 | 0.55/–0.66 |
Основные длины связей и валентные углы приведены в табл. 2.
Таблица 2.
Основные длины связей и валентные углы в молекулах соединений I–III
| Связь | d, Å | Угол | ω, град |
|---|---|---|---|
| I | |||
| Sb(1)–С(1) | 2.109(6) | O(5)Sb(1)O(4) | 173.47(18) |
| Sb(1)–С(11) | 2.106(6) | C(1)Sb(1)C(21) | 116.2(3) |
| Sb(1)–С(21) | 2.097(6) | C(11)Sb(1)C(21) | 121.4(3) |
| Sb(1)–О(4) | 2.050(5) | C(1)Sb(1)C(11) | 122.4(2) |
| Sb(1)–O(5) | 2.055(5) | N(1)O(4)Sb(1) | 108.4(3) |
| О(4)–N(1) | 1.374(7) | O(4)N(1)C(37) | 113.0(5) |
| O(5)–N(3) | 1.366(7) | N(3)O(5)Sb(1) | 104.9(3) |
| N(1)–C(37) | 1.244(8) | O(5)N(3)C(47) | 113.3(5) |
| N(3)–C(47) | 1.241(9) | ||
| II | |||
| Sb(1)–С(1) | 2.119(3) | O(5)Sb(1)O(4) | 170.71(9) |
| Sb(1)–С(11) | 2.137(4) | C(1)Sb(1)C(21) | 109.43(16) |
| Sb(1)–С(21) | 2.115(4) | C(11)Sb(1)C(21) | 125.09(14) |
| Sb(1)–О(4) | 2.093(3) | C(1)Sb(1)C(11) | 125.41(14) |
| Sb(1)–O(5) | 2.058(3) | N(1)O(4)Sb(1) | 112.8(2) |
| О(4)–N(1) | 1.355(4) | O(4)N(1)C(37) | 112.3(3) |
| O(5)–N(2) | 1.387(4) | N(2)O(5)Sb(1) | 108.23(18) |
| N(1)–C(37) | 1.293(5) | O(5)N(2)C(47) | 112.8(3) |
| N(2)–C(47) | 1.269(4) | ||
| III | |||
| Sb(1)–С(1) | 2.122(3) | O(6)Sb(1)O(4) | 173.96(10) |
| Sb(1)–С(11) | 2.119(4) | C(1)Sb(1)C(11) | 115.2(2) |
| Sb(1)–С(21) | 2.121(4) | C(1)Sb(1)C(21) | 123.4(1) |
| Sb(1)–О(4) | 2.111(3) | C(11)Sb(1)C(21) | 121.3(2) |
| Sb(1)–O(6) | 2.110(3) | C(1)Sb(1)C(11) | 115.17(14) |
| О(4)–C(38) | 1.321(5) | C(38)O(4)Sb(1) | 116.1(2) |
| O(6)–C(48) | 1.266(5) | C(48)O(6)Sb(1) | 120.8(3) |
| O(5)–C(38) | 1.206(5) | ||
| O(7)–C(48) | 1.217(5) | ||
Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 1822064, 1822069, 1828141 для соединений I, II, III; deposit@ccdc.cam.ac.uk; http://www.ccdc.cam.ac.uk).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Известно, что в реакциях окислительного присоединения в качестве окислителя можно использовать как пероксид водорода, так и органические пероксиды [25]. Преимуществом органических пероксидов, в частности трет-бутилгидропероксида, является их хорошая растворимость в органических растворителях.
Установлено, что трис(5-бром-2-метоксифенил)сурьма реагирует с 2- и 3-нитробензальдоксимами в присутствии трет-бутилгидропероксида при мольном соотношении реагентов 1 : 2 : 1 в бензольно-гептановом растворе с образованием диоксиматов трис(5-бром-2-метоксифенил)сурьмы, которые были выделены в форме сольватов (2-MeO-5-Br-C6H3)3Sb(ONCHC6H4NO2-2)2 · 0.5C6H6 (I), (2-MeO-5-Br-C6H3)3Sb(ONCHC6H4NO2-3)2 · 2C6H6 (II). Аналогично протекает реакция с 3-фторфенилуксусной кислотой в диэтиловом эфире, продуктом которой является дикарбоксилат трис(5-бром-2-метоксифенил)сурьмы (2-MeO-5-Br-C6H3)3Sb(OC(O)CH2C6H4F-3)2 (III).
Отметим, что диоксиматы трис(5-бром-2-метоксифенил)сурьмы в настоящей работе синтезированы впервые.
Соединения I–III охарактеризованы методами ИК, ЯМР 1H, ЯМР 13C спектроскопии и РСА.
В ИК-спектрах исследуемых комплексов присутствуют полосы поглощения при 442 (I), 445 (II) и 440 см–1 (III), относящиеся к колебаниям фрагмента SbC3 [26]. При 407 (I), 403 см–1 (II, III) имеют место полосы, отвечающие колебаниям связи Sb–O [27]. Полосы в областях 1016–1049 и 1254–1283 см−1 характеризуют связи CAr–Br и CAr−OCH3 соответственно.
В спектрах I и II найдены характеристические полосы в областях 1574 см–1 (связи C=N), 966 см–1 (связи N–O) в оксиматных группах. Наблюдаются интенсивные полосы поглощения, характеризующие асимметричные колебания (1524, 1530 см−1) и симметричные колебания (1342, 1352 см−1) связи C–NO2, деформационные колебания NO2-групп (696, 704 см−1). В спектрах 2- и 3-нитробензальдоксимов аналогичные полосы расположены при 1572, 1618 см–1 (C=N), 978, 982 см–1 (N–O); 1522, 1537 см–1 (NO2as), 1346, 1350 (NO2sy) и 694, 708 см−1 (NO2 δ).
В ИК-спектре III имеют место полосы поглощения валентных колебаний связей С=O при 1657 см–1 и С–F при 1254 см−1.
В спектрах ЯМР 1H присутствует синглет групп OCH3 при δ: 3.80 м.д. (I), δ 3.83 м.д. (II) и δ 3.71 м.д. (III), а также сигналы ароматических протонов в областях 7.41–8.34 м.д. (I), 7.36–8.05 м.д. (II) и 6.86–7.91 м.д. (III). При δ 6.92 м.д. и δ 6.96 м.д. наблюдается синглет протонов групп CHN (I, II), при δ 3.28 м.д. – синглет протонов CH2 (III). В спектрах ЯМР 13C сигнал групп OCH3 наблюдается при δ 56.14 м.д. (I), δ 56.05 м.д. (II) и δ 42.93 м.д. (III), сигналы атомов углерода арильных радикалов – в областях 113.10–138.41 м.д. (I), 112.96–146.61 м.д. (II) и 113.64–163.78 м.д. (III). В спектрах I, II присутствуют сигналы CHN при δ 145.22 м.д. и δ 148.46 м.д., в спектре III – сигналы CH2 – при δ 55.79 м.д., COO – при δ 173.45 м.д.
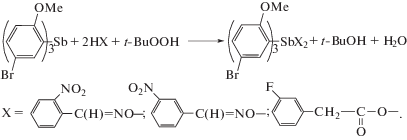
По данным РСА, атомы сурьмы в молекулах соединений I–III имеют тригонально-бипирамидальную координацию с атомами кислорода оксиматных и карбоксилатных лигандов в аксиальных положениях и с атомами углерода арильных радикалов в экваториальной плоскости (рис. 1–3). Cоединения I и II кристаллизуются в форме сольватов с бензолом.
Рис. 1.
Структура соединения I, атомы показаны в виде термальных эллипсоидов для вероятности 40%. Атомы водорода и сольватные молекулы бензола не приведены.
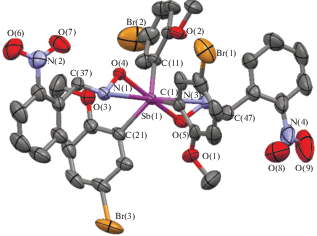
Рис. 2.
Структура соединения II, атомы показаны в виде термальных эллипсоидов для вероятности 40%. Атомы водорода и сольватные молекулы бензола не приведены.
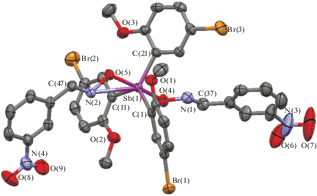
Рис. 3.
Структура соединения III, атомы показаны в виде термальных эллипсоидов для вероятности 40%. Атомы водорода не приведены.
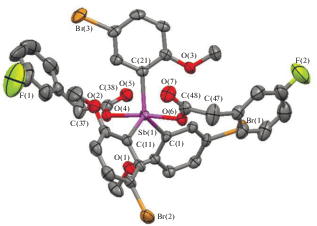
Аксиальные углы ОSbО составляют 173.47(18)° (I), 170.71(9)° (II), 173.96(10)° (III). Углы OSbC варьируют в пределах 86.2(2)°–95.1(2)° (I), 81.31(13)°–94.35(12)° (II), 83.12(12)°–96.50(13)° (III). Суммы валентных углов CSbC в экваториальной плоскости практически равны 360°, при этом значения отдельных углов отличаются от теоретического 120° на ≈4° (I), ≈11° (II) и ≈7° (III). В молекуле II экваториальные углы лежат в пределах 109.43(16)°–125.41(14)°. Отметим, что такой большой интервал значений углов не является типичным для молекул диоксиматов триарилсурьмы [4, 12, 19] и не наблюдается в молекуле I. Однако в молекуле (o-Tol)3Sb(ONCHC6H4NO2-2)2, имеющей схожее строение, интервал значений углов CSbC составляет 12° [28].
Атомы сурьмы отклоняются от экваториальной плоскости на 0.014(6) Å (I), 0.034(4) Å (II) и 0.041(3) Å (III). Интервалы длин связей Sb–C составляют 2.097(6)–2.109(6) Å (I), 2.115(4)–2.137(4) Å (II) и 2.119(4)–2.122(3) Å (III). Расстояния Sb–O (2.050(5), 2.055(5) Å (I), 2.058(3), 2.093(3) Å (II), 2.110(3), 2.111(3) Å (III)) близки к сумме ковалентных радиусов атомов сурьмы и кислорода (2.07 Å [29]) и меньше, чем средние значения экваториальных связей. Отметим, что диоксиматы триарилсурьмы относятся к немногим соединениям с тригонально-бипирамидальной координацией центрального атома, в молекулах которых аксиальные связи короче экваториальных. Для дикарбоксилатов триарилсурьмы такое отклонение от правил Гиллеспи [30] не характерно.
Как и в других диоксиматах триарилсурьмы [19–24, 28], в молекулах I, II наблюдаются очень короткие расстояния Sb···N (атом азота иминокси-группы) (2.744(6), 2.805(6) Å (I) и 2.820(4), 2.901(4) Å (II)), что составляет 72–76% от суммы ван-дер-ваальсовых радиусов этих атомов (3.8 Å [29]) и может свидетельствовать о наличии внутримолекулярной координации атома сурьмы с атомом азота. Возможность дополнительной координации атома металла с гетероатомами, присутствующими в лигандах, в молекулах арильных производных сурьмы была доказана методами РСА, ЯМР, а также с помощью теоретических расчетов [30–33].
В молекуле III карбоксилатные лиганды проявляют анизобидентатные свойства, координируясь к атому сурьмы карбонильным атомом кислорода; расстояния Sb···O(5) и Sb···O(7) равны 3.085(4) и 3.169(4) Å. Кроме того, в молекулах I–III присутствуют короткие контакты MeO···Sb: 3.053(8)–3.166(8) Å (I), 3.078(4)–3.152(4) Å (II), 3.178(3)–3.185(3) Å (III).
Для дикарбоксилатов триарилсурьмы характерна, как правило, цис-ориентация карбоксилатных лигандов относительно фрагмента SbC3, когда угол между плоскостями карбоксильных групп не превышает 15° [9]. При наличии внутримолекулярных взаимодействий Sb···O=С такая ориентация приводит к существенному увеличению одного из экваториальных углов со стороны контактов, например, до 150.25°–161.47° [16, 34–36]. Особенностью строения молекулы III является нарушение типичной ориентации карбоксилатных групп, поскольку угол между соответствующими плоскостями составляет 62.08(3)°. Внутримолекулярные контакты осуществляются со стороны разных экваториальных углов: Sb···O(5) со стороны угла C(1)SbC(21), Sb···O(7) – со стороны C(11)SbC(21). Следствием этого является небольшой интервал значений экваториальных углов (115.2(2)°–123.4(1)°). Отметим, что в других ранее описанных дикарбоксилатах трис(5-бром-2-метоксифенил)сурьмы наблюдаются такие же структурные особенности [37].
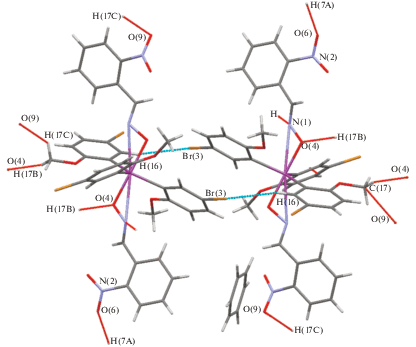
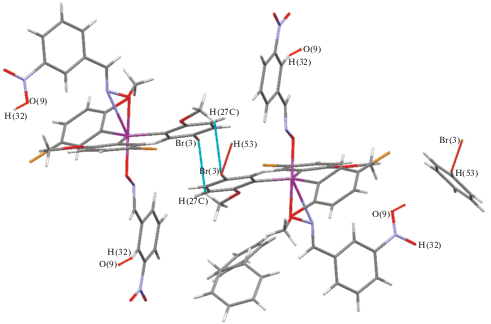
Структурная организация кристалла I обусловлена системой слабых межмолекулярных водородных связей типа НМе···О(NO2) (2.50, 2.52 Å), НМе···О(−N=C) (2.39 Å), HAr···Br (3.00 Å), HAr···N(=C) (2.66 Å) (рис. 4). Аналогичные контакты наблюдаются в кристалле II: HAr'···О(NO2) (2.68 Å), НМе···Br (3.00, 2.98 Å), Br···H(C6H6) (2.98 Å) (рис. 5).
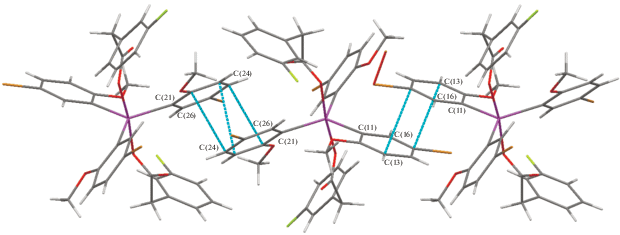
В кристалле III наряду с межмолекулярными водородными связями HAr···О(=C) (2.53 Å), Br···H(C6H4F) (2.94 Å), наблюдаются π–π-взаимодействия между параллельными плоскостями арильных колец соседних молекул (рис. 6), расстояния между плоскостями [C(21)−C(26)] − 3.299(6), [C(11)−C(16)] − 3.344(6) Å. Коротких контактов с атомами фтора в структуре не наблюдается.
ЗАКЛЮЧЕНИЕ
Впервые синтезированы диоксиматы трис(5-бром-2-метоксифенил)сурьмы и структурно охарактеризованы бис(2-нитробензальдоксимато)трис(5-бром-2-метоксифенил)сурьма, бис(3-нитробензальдоксимато)трис(5-бром-2-метоксифенил)сурьма и бис(3-фторфенилацетато)трис(5-бром-2-метоксифенил)сурьма. Особенностью молекул полученных диоксиматов трис(5-бром-2-метоксифенил)сурьмы является сокращение расстояний Sb···N. В молекуле дикарбоксилата трис(5-бром-2-метоксифенил)сурьмы не соблюдается типичная для дикарбоксилатов триарилсурьмы цис-ориентация карбоксилатных лигандов относительно экваториальной плоскости. Структурная организация кристаллов обусловлена слабыми водородными связями, в основном с участием атомов брома и атомов кислорода функциональных групп.
Список литературы
Iftikhar T., Rauf M.K., Sarwar S. et al. // J. Organomet. Chem. 2017. V. 851. P. 89. https://doi.org/10.1016/j.jorganchem.2017.09.002
Yu L., Ma Y.Q., Wang G.C., Li J.S. // Heteroat. Chem. 2004. V. 15. № 1. P. 32. https://doi.org/10.1002/hc.10208
Sharma P., Perez D., Cabrera A. et al. // Acta Pharm. Sinica. 2008. V. 29. № 8. P. 881. https://doi.org/10.1111/j.1745-7254.2008.00818.x
Yin H., Quan L., Li L. // Inorg. Chem. Commun. 2008. V. 11. № 10. P. 1121. https://doi.org/10.1016/j.inoche.2008.06.017
Saleem L., Altaf A.A., Badshah A. et al. // Inorg. Chim. Acta. 2018. V. 474. P. 148. https://doi.org/10.1016/j.ica.2018.01.036
Mushtaq R., Rauf M.K., Bolte M. et al. // Appl. Organomet. Chem. 2017. V. 31. № 5. P. 1. https://doi.org/10.1002/aoc.3606
Islam A., Da Silva J.G., Berbet F.M. // Molecules. 2014. V. 19. № 5. P. 6009. https://doi.org/10.3390/molecules19056009
Ali M.I., Rauf M.K., Badshah A. et al. // Dalton Trans. 2013. V. 42. № 48. P. 16733. https://doi.org/10.1039/c3dt51382c
Duffin R.N., Blair V.L., Kedzierski L., Andrews P.C. // Dalton Trans. 2018. V. 47. № 3. P. 971. https://doi.org/10.1039/C7DT04171C
Sun R.-Z., Guo Y.-C., Liu W.-M. et al. // Chinese J. Struct. Chem. 2012. V. 31. № 5. P. 655.
Ma Y.Q., Yu L., Li J.S. // Heteroat. Chem. 2002. V. 13. № 4. P. 299. https://doi.org/10.1002/hc.10033
Zhang X.Y., Cui L.S., Zhang X. et al. // J. Mol. Struct. 2017. V. 1134. P. 742. https://doi.org/10.1016/j.molstruc.2017.01.039
Agnihotri S., Raj P., Singhal K. // Synt. React. Inorg. Met.-Org. Chem. 2002. V. 32. № 3. P. 449. https://doi.org/10.1081/SIM-120003788
Bajpai K., Srivastava R.C. // Synt. React. Inorg. Met.-Org. Chem. 1981. V. 11. № 1. P. 7. https://doi.org/10.1080/00945718108059270
Geng H., Hong M., Yang Y. et al. // J. Coord. Chem. 2015. V. 68. № 16. P. 2938. https://doi.org/10.1080/00958972.2015.1060322
Wen L., Yin H., Li W., Wang D. // Inorg. Chim. Acta. 2010. V. 363. № 4. P. 676. https://doi.org/10.1016/j.ica.2009.11.022
Chaudhari K., Jain V., Sagoria V., Tiekink E. // J. Organomet. Chem. 2007. V. 692. № 22. P. 4928. https://doi.org/10.1016/j.jorganchem.2007.07.033
Yu L., Ma Y.Q., Liu R.C. et al. // Polyhedron. 2004. V. 23. № 5. P. 823. https://doi.org/10.1016/j.poly.2003.12.002
Sharutin V.V., Sharutina O.K., Molokova O.V. et al. // Russ. J. Coord. Chem. 2002. V. 28. № 8. P. 544. [Шарутин В.В., Шарутина О.К., Молокова О.В. и др. // Коорд. химия. 2002. Т. 28. № 8. С. 581.]https://doi.org/10.1023/A:1019701511840
Sharutin V.V., Molokova O.V., Sharutina O.K. et al. // Russ. J. Gen. Chem. 2004. V. 74. P. 1485. [Шарутин В.В., Молокова О.В., Шарутина О.К. и др. // Журн. общ. химии. 2004. Т. 74. № 10. С. 1600.]https://doi.org/10.1007/s11176-005-0041-4
Sharutin V.V., Sharutina O.K., Artem’eva E.V., Makerova M.S. // Russ. J. Gen. Chem. 2016. V. 86. № 12. P. 2671. doi 10.1134/S1070363216120161 [Шарутин В.В., Шарутина О.К., Артемьева Е.В., Макерова М.С. // Журн. общ. химии. 2016. Т. 86. № 12. С. 2039.
Artem'eva E.V., Makerova M.S., Sharutin V.V., Sharutina O.K. // Bull. SUSU. Ser. Chem. 2017. V. 9. № 2. P. 50. https://doi.org/10.14529/chem170207
Bruker (2000) SMART. Bruker Molecular Analysis Research Tool, Versions 5.625 Bruker AXS, Madison, Wisconsin, USA.
Bruker (2000) SAINTPlus Data Reduction and Correction Program Versions 6.02a, Bruker AXS, Madison, Wisconsin, USA.
Гущин A.B. Получение органических производных сурьмы(V), висмута(V) и применение их в органическом синтезе. Дис. … докт. хим. наук. Нижний Новгород, 1998. 282 с.
Doak G.O., Long G.G., Freedman L.D. // J. Organomet. Chem. 1965. V. 4. № 1. P. 82. https://doi.org/10.1016/S0022-328X(00)82370-0
Gupta A., Sharma R.K., Bohra R. et al. // Polyhedron. 2002. V. 21. № 23. P. 2387. https://doi.org/10.1016/S0277-5387(02)01155-5
Sharutin V.V., Sharutina O.K., Artemeva E.V., Makerova M.S. // Bull. SUSU. S. Chem. 2016. V. 8. № 2. P. 61. https://doi.org/10.14529/chem160207
Бацанов С.С. // Журн. неорган. химии. 1991. Т. 36. № 12. С. 3015. [Batsanov S.S. // Russ. J. Inorg. Chem. 1991. V. 36. № 12. P. 1681.]
Gillespie R.J., Hargittai I. The VSEPR Model of Molecular Geometry. Boston–London: Allyn and Bacon, 1991.
Tokunaga T., Seki H., Yasuike S. et al. // Tetrahedron. 2000. V. 56. № 45. P. 8833. https://doi.org/10.1016/S0040-4020(00)00813-9
Tokunaga T., Seki H., Yasuike S. et al. // Tetrahedron Lett. 2000. V. 41. № 7. P. 1031. https://doi.org/10.1016/S0040-4039(99)02189-9
Minkin V.I., Minyaev R.M., Milov A.A., Gribanova T.N. // Russ. Chem. Bull. 2001. V. 50. № 11. P. 2028. [Минкин В.И., Минаев Р.М., Милов А.А., Грибанова Т.Н. // Изв. АН. Сер. хим. 2001. Т. 50. № 11. С. 1938.]https://doi.org/10.1023/A:1015072528309
Qin W., Yasuike S., Kakusawa N. et al. // J. Organomet. Chem. 2008. V. 693. № 1. P. 109. https://doi.org/10.1016/j.jorganchem.2007.10.030
Yin H.D., Wen L.Y., Cui J.C., Li W.K. // Polyhedron. 2009. V. 28. № 14. P. 2919. https://doi.org/10.1016/j.poly.2009.06.065
Sharutin V.V., Senchurin V.S., Sharutina O.K. et al. // Russ. J. Gen. Chem. 2009. V. 79. № 10. P. 2131. [Шарутин В.В., Сенчурин В.С., Шарутина О.К. и др. // Журн. общ. химии. 2009. Т. 79. № 10. С. 1636.]https://doi.org/10.1134/S1070363209100107
Sharutin V.V., Sharutina O.K., Tolstoguzov D.S. // Russ. J. Gen. Chem. 2014. V. 84. № 9. P. 1754. [Шарутин В.В., Шарутина О.К., Толстогузов Д.С. // Журн. общ. химии. 2014. Т. 84. № 9. С. 1516.]https://doi.org/10.1134/S1070363214090199
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии