Журнал неорганической химии, 2019, T. 64, № 11, стр. 1206-1209
Синтез, характеристики и ЭПР-спектроскопическое исследование металлохелатов Mn(II), Cu(II) c продуктом конденсации 2-(7-бромо-2-оксо-5-фенил-3Н-1,4-бенздиазепин-1-ил)ацетогидразида и 2,3-диоксоиндола
И. И. Сейфуллина 1, Л. С. Скороход 1, *, А. В. Пуля 1, Н. Н. Ефимов 2, Е. А. Уголкова 2, В. В. Минин 2
1 Одесский национальный университет им. И.И. Мечникова
65082 Одесса, ул. Дворянская, 2, Украина
2 Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: lborn@ukr.net
Поступила в редакцию 10.04.2019
После доработки 26.04.2019
Принята к публикации 13.05.2019
Аннотация
Методом самосборки из систем М(СН3СОО)2–2-(7-бромо-2-оксо-5-фенил-3Н-1,4-бенздиазепин-1-ил)ацетогидразид (Hydr)–2,3-диоксоиндол (HIz)–пропан-2-ол (М = Mn, Cu) выделены комплексы [Mn(HydrHIz)2] ⋅ 2H2O (I) и [Cu(HydrHIz)2] (II), где HydrHIz – гидразон – продукт конденсации гидразида и изатина. Комплексы охарактеризованы данными элементного анализа, электропроводности, ИК-спектроскопии. Состав и строение координационных узлов в I, II определены методом магнитной восприимчивости, ЭПР-спектроскопии.
ВВЕДЕНИЕ
Впервые в результате систематического исследования комплексообразования солей Cu(II), Mn(II) с 2-(7-бромо-2-оксо-5-фенил-3Н-1,4-бенздиазепин-1-ил)ацетогидразидом и продуктами его конденсации с пировиноградной кислотой и салициловым альдегидом синтезированы комплексы различного состава, исследованы их спектральные и магнитные свойства. С помощью рентгеновской спектроскопии поглощения и ЭПР-спектроскопии определен состав координационной сферы и геометрия координационного полиэдра [1–3]. В продолжение этих исследований в качестве карбинолсодержащего соединения для получения лиганда – продукта конденсации – нами выбран 1Н-индол-2,3-дион (изатин). Известно, что 1Н-индол-2,3-дион и его производные применяются в качестве лекарственных средств, красителей, пестицидов, стимуляторов роста растений, аналитических реагентов. Широкий спектр биологической активности и фармакологического действия изатина обусловлен его способностью образовывать изатинсвязывающие белки. Особый интерес вызывают эндогенные регуляторы белок-белковых взаимодействий, которые при комплексообразовании с ионами “металлов жизни” могут рассматриваться как прототипы новых лекарств [4–9].
Получение лиганда – продукта конденсации изатина и 2-(7-бромо-2-оксо-5-фенилнил-ЗН-1,4-бенздиазепин-1-ил)ацетогидразида (известного транквилизатора дневного типа гидазепама) – открывает перспективы создания нового лекарственного препарата, проявляющего синергизм действия биологически активных составляющих [10–20].
Ранее нами [21] в процессе самосборки из системы Zn(CH3COO)2–Hydr–изатин (HIz) был выделен комплекс [Zn(HydrHIz)2], где HydrHIz (гидразон) – продукт конденсации Hydr и HIz. Комплекс охарактеризован методами элементного анализа, термогравиметрии, ИК-спектроскопии и масс-спектрометрии, а также величинами электропроводности. Локальное окружение центрального атома в координационном узле установлено методом рентгеновской спектроскопии поглощения (анализ EXAFS и XANES). К “металлам жизни” наряду с цинком относятся марганец и медь. Поэтому целесообразно было продолжить исследования в данном направлении, выбрав в качестве комплексообразователей указанные ионы металлов, которые в организме присутствуют в виде координационных соединений [22] и могут быть исследованы методом ЭПР.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Комплекс [Mn(HydrHIz)2] ⋅ 2H2O (I) синтезировали взаимодействием изопропанольных растворов Hydr (0.002 моль в 20 мл) и HIz (0.002 моль в 20 мл). Реакционную смесь кипятили с обратным холодильником на водяной бане в течение 0.5 ч, затем добавляли раствор Mn(CH3COO)2 ⋅ ⋅ 4H2O в этаноле (0.001 моль в 10 мл) и дополнительно кипятили еще 0.5 ч. После охлаждения мелкокристаллический осадок комплекса I отделяли на фильтре Шотта, промывали изопропанолом, этанолом и сушили при 85°С до постоянной массы. Выход I составил 27%.
| Mn | C | H | N | Br | |
| Найдено, %: | 4.73; | 53.28; | 3.28; | 12.31; | 14.03. |
| Вычислено, %: | 4.91; | 53.52; | 3.39; | 12.49; | 14.27. |
Комплекс [Cu(HydrHIz)2] (II) получали по той же методике, что и I, но на втором этапе синтеза добавляли этанольный раствор Cu(CH3COO)2 ⋅ ⋅ 3H2O (0.001 моль в 10 мл) и дополнительно кипятили 1 ч, охлаждали и отделяли мелкокристаллический осадок комплекса II. Выход II составил 25%.
| Cu | C | H | N | Br | |
| Найдено, %: | 5.74; | 54.49; | 3.06; | 12.70; | 14.19. |
| Вычислено, %: | 5.81; | 54.87; | 3.11; | 12.80; | 14.63. |
Элементный анализ. Содержание углерода, водорода и азота определяли на C,H,N-анализаторе, брома – меркурометрически [23], марганца и меди – методом атомно-эмиссионной спектроскопии с индуктивно-связанной плазмой (ICP) на приборе Optima-2100 DV фирмы Perkin–Elmer.
Молярную электропроводность 1 × 10–3 М растворов I и II в ДМСО измеряли с помощью цифрового измерителя “Экономикс-эксперт”, тип электролита определяли в соответствии с таблицами, приведенными в работе [24].
ИК-спектры поглощения (400–4000 см–1) образцов I, II, таблетированных с KBr, записывали на спектрофотометре Shimadzu FIIR-84005S.
Магнетохимические измерения I, II проводили на SQUID-магнитометре MPMS XL (Quantum Design) в интервале температур 5–300 K в магнитном поле 5 кЭ. При вычислении молярной магнитной восприимчивости (χм) вводили поправку на диамагнетизм атомов по аддитивной схеме Паскаля [25]. Эффективный магнитный момент рассчитывали по формуле: µэф = $\sqrt {\left( {{{3k} \mathord{\left/ {\vphantom {{3k} {N{{{\mu }}_{{\text{B}}}}}}} \right. \kern-0em} {N{{{\mu }}_{{\text{B}}}}}}} \right){\chi }T} \approx \sqrt {8{\chi }T} ,$ где k – постоянная Больцмана, N – число Авогадро, µB – магнетон Бора.
Спектры ЭПР комплексов I, II регистрировали на радиоспектрометре E-680 X Elexsys фирмы Bruker в X-диапазоне.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Из результатов химического анализа следует, что в условиях самосборки М(СН3СОО)2, Hydr и HIz в изопропанол-этанольной среде образуются комплексы I (М = Mn) и II (М = Сu), в которых лиганд является продуктом конденсации Hydr и HIz, при этом реализуется соотношение М : HydrHIz = 1 : 2. Комплексы I, II представляют собой мелкокристаллические порошки, нерастворимые в изопропаноле, ацетонитриле, растворимые в ДМФА, ДМСО, этаноле (при слабом нагревании).
По результатам измерения электропроводности 1 × 10–3 М растворов I, II в ДМСО, они являются неэлектролитами. Молярная электропроводность I составляет 8.4 Ом–1 см2 моль–1, II – 11.6 Ом–1 см2 моль–1.
Способ координации лиганда в комплексах I, II определяли методом ИК-спектроскопии, сравнивая характеристические частоты полос поглощения в ИК-спектрах исходных Hydr, HIz и комплексов. Так, в ИК-спектре HIz наблюдается интенсивная полоса ν(С=О) при 1728 см–1 с плечом 1728 см–1, что указывает на присутствие в молекуле изатина двух карбонильных (С=О) групп. В сравнении с ним в ИК-спектрах I, II появляется одна интенсивная полоса ν(С=О), которая смещается в низкочастотную область: 1682 см–1 (I), 1681 см–1 (ІІ). Отмеченные изменения в ИК-спектрах І, ІІ в области колебаний ν(С=О), а также отсутствие полос поглощения аминогруппы Hydr (ν(NH) = 3337 см–1, ν(NH2) = 3429 см–1) и появление новой полосы азометиновой группы ν(С=N) при 1612 см–1 (I, II) указывают на то, что лиганд в комплексах І, ІІ является продуктом конденсации аминогруппы Hydr и карбонила изатина – гидразоном. Азот азометиновой группы гидразона включается в координацию с ионом металла-комплексообразователя, что подтверждается появлением полосы ν(М–N) при 470 см–1 (І, ІІ). Также наблюдаются полосы ν(С–О) при 1186 (I), 1188 см–1 (ІІ) и ν(М–О) при 550 (І), 551см–1 (ІІ).
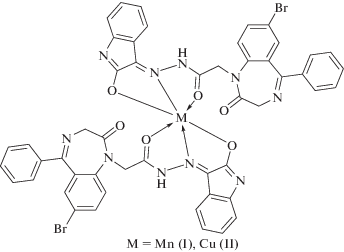
Таким образом, сравнительный анализ ИК-спектров показал, что лиганд в бис-хелатах І, ІІ тридентатно координирован с образованием октаэдрических полиэдров [MO4N2], что подтверждается данными измерения магнитной восприимчивости (μэф = 6.00 (І), 1.92 М.Б. (ІІ) при 293 K). Для них предложены следующие схемы строения:
Их достоверность была подтверждена в ходе ЭПР-спектроскопического исследования.
Рис. 1.
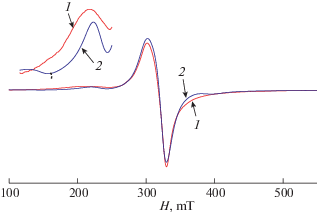
Спектр ЭПР поликристаллического образца I, Т = 293 K: 1 – эксперимент, 2 – теория. g = 2.0, D = = 0.0281 cм–1, E = 0.0047 cм–1.
В результате анализа ЭПР-спектра I (рис. 1, поликристаллы, Т = 293 K) установлено, что он описывается спиновым гамильтонианом (СГ) димерного комплекса:
(1)
$\begin{gathered} \hat {H} = \beta ({{g}_{x}}{{S}_{x}}{{H}_{x}} + {{g}_{y}}{{S}_{y}}{{H}_{y}} + {{g}_{z}}{{H}_{z}}{{S}_{z}}) + \\ + \,\,D\left( {S_{z}^{2} - S{{(S + 1)} \mathord{\left/ {\vphantom {{(S + 1)} 3}} \right. \kern-0em} 3}) + E\left( {S_{x}^{2} - S_{y}^{2}} \right)} \right), \\ \end{gathered} $Спектр этого комплекса в этаноле при 293 K (рис. 2) описывается изотропным СГ спина S = = 1/2, включающим в себя зеемановское и сверхтонкое взаимодействие:
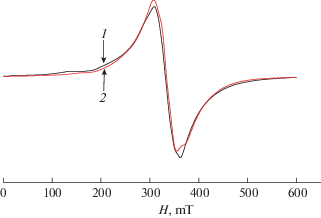
где g – компонента g-тензора, а – компонента тензора сверхтонкой структуры (СТС), S = 5/2, проекция оператора ядерного спина центрального атома марганца І = 5/2.Рис. 2.
Спектр ЭПР образца I в этаноле, Т = 293 K: 1 – эксперимент, 2 – теория. g =1.99, a = 8.062 × 10–3 см–1.
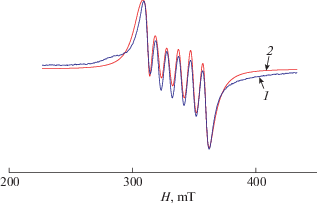
В спектре ЭПР комплекса ІІ в поликристаллическом состоянии при 293 K (рис. 3), S = 1, наблюдается “запрещенный” переход в половинном магнитном поле, соответствующий Δms = ±2. Такие переходы характерны для парамагнитных систем со спином S ≥ 1 типа обменно-связанного димера.
Спектр комплекса ІІ описывается суммой димерного комплекса с СГ (1) для полного спина S = 1 (расчетные параметры: С1 = 13%, gz = 2.24, gx = 2.10, gy = 2.10, D = 0.154 см–1, Е = 0.009 см–1) и ромбически искаженным СГ(3) для S = 1/2 мономера, включающим в себя зеемановское взаимодействие (расчетные параметры: С1/2 = 87%, gz = = 2.24, gx = 2.06, gy = 2.07):
(3)
$\Delta \hat {H} = \beta ({{g}_{x}}{{S}_{x}}{{H}_{x}} + {{g}_{y}}{{S}_{y}}{{H}_{y}} + {{g}_{z}}{{H}_{z}}{{S}_{z}}),$Параметры спектров ЭПР поликристаллических образцов І, ІІ определяли с использованием метода Белфорда (eigenfield method) [26]. Параметры спектра ЭПР соединения І в этаноле находили методом наилучшего приближения между экспериментальным и теоретическим спектрами путем минимизации функционала ошибки:
(4)
$F = \sum\limits_i {{{{{{\left( {Y_{i}^{T} - Y_{i}^{E}} \right)}}^{2}}} \mathord{\left/ {\vphantom {{{{{\left( {Y_{i}^{T} - Y_{i}^{E}} \right)}}^{2}}} N}} \right. \kern-0em} N}} ,$Список литературы
Пуля А.В., Сейфуллина И.И., Скороход Л.С. и др. // Журн. неорган. химии. 2015. Т. 60. № 1. С. 54.
Пуля А.В., Сейфуллина И.И., Скороход Л.С. и др. // Журн. неорган. химии. 2016. Т. 61. № 1. С. 41.
Пуля А.В., Сейфуллина И.И., Скороход Л.С. и др. // Журн. неорган. химии. 2017. Т. 62. № 2. С. 197.
Бунеева О.А., Гнеденко О.В., Медведева М.В. и др. // Биомедицинская химия. 2016. Т. 62. № 2. С. 160. https://doi.org/10/18097/PBMC20166202160
Бунеева О.А., Гнеденко О.В., Медведева М.В. и др. // Биомедицинская химия. 2016. Т. 62. № 6. С. 720. https://doi.org/10/18097/PBMC20166206720
Ершов П.В., Яблоков Е.О., Мезенцев Ю.В. и др. // Биомедицинская химия. 2017. Т. 63. № 2. С. 170. https://doi.org/10.18097/PBMC20176302170
Ершов П.В., Мезенцев Ю.В., Яблоков Е.О. и др. // Биоорганическая химия. 2018. Т. 44. № 2. С. 176. https://doi.org/10.18097/PBMC20176302170
Swathy S.S., Joseyphus R.S., Nisha V.P. et al. // Arab. J. Chem. 2016. V. 9. P. S1847. https://doi.org/10.1016/j.arabjc.2012.05.004
Shebl M., El-ghamry M.A., Khalil S.E., Kishk M.A. // Spectrochim. Acta. Part A: Mol. Biomol. Spectrosc. 2014. V. 126. P. 232. https://doi.org/10.1016/j.saa.2014.02.014
Shakir M., Hanif S., Sharwani M.A. et al. // J. Photochem. Photobiol. B: Biol. 2016. V. 157. P. 39. https://doi.org/10.1016/j.jphotobiol.2016.01.019
Khan A., Jasinski J.P., Smoleaski V.A. et al. // Inorg. Chim. Acta. 2016. V. 449. P. 119. https://doi.org/10.1016/j.ica.2016.05.013
Tehrani K.E., Hashemi M., Hassan M. et al. // Chin. Chem. Lett. 2016. V. 27. № 2. P. 221. https://doi.org/10.1016/j.cclet.2015.10.027
Muralisankar M., Sujith S., Bhuvanesh N.S.P., Sreekanth A. // Polyhedron. 2016. V. 118. P. 103. https://doi.org/10.1016/j.poly.2016.06.017
Lian Z.-M., Sun J., Zhu H-L. // J. Mol. Struct. 2016. V. 1117. P. 8. https://doi.org/10.1016/j.molstruc.2016.03.036
Teng Y.-O., Zhao H-Y., Wang J. et al. // Eur. J. Med. Chem. 2016. V. 112. P. 145. https://doi.org/10.1016/j.ejmech.2015.12.050
Sobhani S., Asadi S., Salimi M., Zarifi F. // J. Organomet. Chem. 2016. V. 822. P. 154. https://doi.org/10.1016/j.jorganchem.2016.08.021
El-Sawaf A.K., El-Essawy F., Nassar A.A., El-Samanody El-S.A. // J. Mol. Struct. 2018. V. 1157. P. 381. https://doi.org/10.1016/j.molstruc.2017.12.075
Brkić D.R., Božić A.R., Marinković A.D. et al. // Spectrochim. Acta. Part A: Mol. Biomol. Spectr. 2018. V. 196. P. 16. https://doi.org/10.1016/j.saa.2018.01.080
Almutairi M.S., Zakaria A.S., Ignasius P.P. et al. // J. Mol. Struct. 2018. V. 1153. P. 333. https://doi.org/10.1016/j.molstruc.2017.10.025
Xia J.-J. // J. Struct. Chem. 2014. V. 55. №. 1. P. 130. https://doi.org/10.1134/S0022476614010211
Пуля А.В., Сейфуллина И.И., Скороход Л.С. и др. // Журн. общей химии. 2018. Т. 88. № 2. С. 294.
Авцын А.П., Жаворонков А.А., Риш М.А., Строчкова Л.С. Микроэлементозы человека: этиология, классификация, органопатология. М.: Медицина, 1991. 461 с.
Cheng F.W. // Microchem. J. 1959. V. 24. № 6. P. 989. https://doi.org/10.1016/0026-265x(59)90085-0
Geary W.J. // Coord. Chem. Rev. 1971. V. 7. P. 81. https://doi.org/10.1016/S0010-8545(00)80009-0
Kahn O. Molecular magnetism. New York: VCH Publishers, 1993. 380 p.
Belford G.G., Belford R.L., Burkhalter J.F. // J. Magn. Res. 1973. V. 11. P. 251.
Ракитин Ю.В., Ларин Г.М., Минин В.В. Интерпретация спектров ЭПР координационных соединений. М.: Наука, 1993. 399 с.
Лебедев Я.С., Муромцев В.И. ЭПР и релаксация cтабилизированных радикалов. М.: Химия, 1972. С. 25.
Wilson R., Kivelson D. // J. Chem. Phys. 1966. V. 44. № 1. P. 154.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии