Журнал неорганической химии, 2019, T. 64, № 11, стр. 1210-1214
Низкотемпературная теплоемкость гафната лантана
В. Н. Гуськов 1, *, П. Г. Гагарин 1, А. В. Гуськов 1, А. В. Тюрин 1, К. С. Гавричев 1
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: guskov@igic.ras.ru
Поступила в редакцию 09.04.2019
После доработки 23.04.2019
Принята к публикации 13.05.2019
Аннотация
Методом адиабатической калориметрии измерена изобарная теплоемкость гафната лантана структурного типа пирохлора в области температур 0–346 K. Рассчитаны термодинамические функции: энтропия, приращение энтальпии и приведенная энергия Гиббса, которые могут быть использованы для моделирования физико-химических процессов с участием гафната лантана и оптимизации процессов его приготовления.
ВВЕДЕНИЕ
Гафнаты лантаноидов Ln2Hf2O7 характеризуются высокими температурами плавления, отсутствием структурных фазовых превращений в широком интервале температур, химической инертностью [1]. Как и цирконаты, гафнаты считаются перспективными веществами для разработки на их основе термобарьерных материалов [2], твердых электролитов [3–5], люминесцентного [6] и матричного материала для иммобилизации радиоактивных отходов [7] и др.
Фазовые равновесия в большинстве систем Ln2O3–HfO2 изучены достаточно схематично из-за низких скоростей установления равновесия при температурах <1700–1800 K и сложностей при проведении экспериментальных исследований при более высоких температурах [8]. Тем не менее система La2O3–HfO2 при температурах >1900 K изучена достаточно подробно. В системе найдено единственное соединение – La2Hf2O7. В отличие от более тяжелых гафнатов лантаноидов, La2Hf2O7 плавится конгруэнтно при температуре 2560 K. Соединение La2Hf2O7 кристаллизуется в структурном типе пирохлора (Fd3m) с параметром кубической ячейки a = 10.776 Å [8] (по данным [9], a = 10.779 Å). Гафнат лантана характеризуется широкой областью гомогенности от 3 мол. % при 1600 K до 12 мол. % при 2500 K и максимальной температурой плавления ~2600 K [9]. Согласно [10], температура конгруэнтного плавления равна 2733 K. Кристаллохимические характеристики гафната лантана впервые были исследованы в работе [11] и показано, что полученный твердофазным синтезом при 2050 K La2Hf2O7 имеет структурный тип пирохлора, а = 10.774 Å, а размеры кристаллов составляют 0.7–8 мкм. В [12] параметр кристаллической ячейки пирохлора а = = 10.7709 Å. Более поздние исследования [13] показали, что параметр кубической решетки пирохлора La2Hf2O7 линейно зависит от атомного соотношения лантана и гафния в образце: а, Å = = 0.4721(La/Hf, ат.) + 10.301. В этой же работе отмечено, что при использовании способа соосаждения гидроксидов для синтеза прокаливанием на воздухе при температуре 1400 K образуется флюоритная фаза (Fm3m), тогда как для получения гафната со структурой пирохлора требуется длительный (~50 ч) отжиг при 1723 K. В случае, если синтез осуществляют из расплава, последующее охлаждение приводит к образованию структуры пирохлора без перехода во флюоритную модификацию. Особенности образования пирохлора из наноразмерного флюорита при нагревании исследованы в работах [14, 15]. Показано, что прокаливание гидроксидного прекурсора при 900–1500 K приводит к образованию нанокристаллической флюоритной структуры. Дальнейшее нагревание способствует росту частиц до микронных размеров и постепенному формированию структуры пирохлора.
Энтальпия образования La2Hf2O7 структурного типа пирохлора из оксидов, приведенная в работах [13, 16] по результатам калориметрии растворения в расплаве молибдата натрия при 975 K, составила $\Delta H_{{f,ox}}^{^\circ }$ (кДж/моль) = –107.0 ± 5.0. Изобарная теплоемкость гафната лантана при 57–302 K впервые была измерена в [17].
Цель настоящей работы – измерение теплоемкости гафната лантана в области низких температур (0–346 K) и расчет температурных зависимостей термодинамических функций от 0 K до комнатных температур, в том числе при стандартных условиях. Эти данные необходимы для термодинамического моделирования как фазовых равновесий в системе La2O3–HfO2, так и равновесий в других системах с участием La2Hf2O7 структурного типа пирохлора. Теплоемкость диамагнитного гафната лантана может быть в дальнейшем использована для выявления аномалий теплоемкости парамагнитных гафнатов лантаноидов [18, 19].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Гафнат лантана синтезировали “обратным” осаждением стехиометрической смеси гидроксидов лантана и гафния в растворе аммиака согласно [20]. Исходными веществами служили сексвиоксид лантана La2O3 (99.99%) и диоксид гафния HfO2 (99.9%) (ООО “ЛАНХИТ”), предварительно растворенные в соляной кислоте. Прекурсор подвергали промежуточному ступенчатому отжигу с последующим прокаливанием при 1773 K. Температуры промежуточных ступеней отжига определяли на основе анализа кривых ДСК/ТГ прекурсора, полученных на установке синхронного термического анализа STA 449 F1 Jupiter Netzsch в атмосфере газообразного аргона высокой чистоты (99.995%). Общий вид кривых ДСК и ТГ совпадает в целом с результатами работы [15], а последовательность формирования кристаллической структуры аналогична описанной нами в [21]. Полученный образец идентифицировали методом рентгенофазового анализа на дифрактометре Bruker D8 Advance (CuKα-излучение, λ = = 1.5418 Å, Ni-фильтр, LYNXEYE-детектор, геометрия на отражение) в интервале углов 2θ = 10°–80°. Химический состав определяли рентгеноспектральным (Zeiss EVO 50 SEM с РСМА-анализатором e2v Sirius SD IXRF) и химическим (оптико-эмиссионный спектрометр с индуктивно-связанной плазмой Agilent 725) анализом. Морфологию образца исследовали с помощью электронного микроскопа Gross Beam Zeiss NVision 40. Измерения изобарной теплоемкости проводили методом адиабатической калориметрии в низкотемпературном калориметре БКТ-3 АОЗТ “Термис” с программным обеспечением “НЕАТ” и с использованием жидкого гелия и азота в качестве криогенных жидкостей. В работе [21] приведено подробное описание методики. Масса образца составила 2.17387 ± 0.00005 г. Молекулярную массу гафната лантана 746.78933 г/моль определяли на основе данных [22]. Сглаживание экспериментальных результатов проводили ортонормированными полиномами по методике [23].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
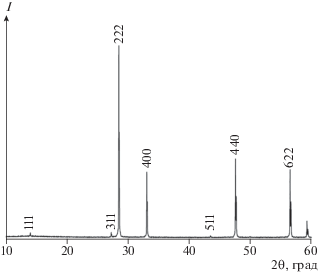
Для проведения измерений получен однофазный образец гафната лантана, который, по результатам дифракционных исследований (рис. 1), имел структуру пирохлора с параметром кубической решетки a = 10.772(1) Å, хорошо совпадающим с рекомендованным в кристаллографической базе данных значением a = 10.7728(3) Å [24]. Образец, по данным рентгеноспектрального анализа, содержал 50.3 ± 0.2 ат. % лантана, примеси обнаружены не были. Химический анализ подтвердил его состав 50.20 ± 0.30 ат. % La. Образец представлял плотную хорошо сформированную структуру, состоящую из кристаллических блоков с размерами >100–200 нм (рис. 2). Синтезированный образец гафната лантана, таким образом, не является наноразмерным и пригоден для получения воспроизводимых термодинамических величин.
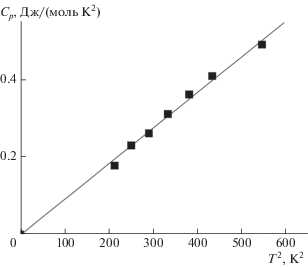
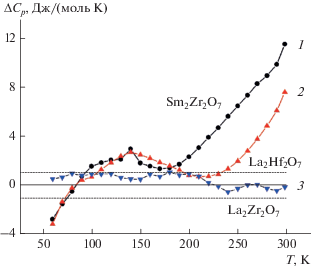
Измерения теплоемкости были выполнены в области температур 15–346 K в пяти сериях при 117 значениях температуры. Экспериментальные результаты приведены в табл. 1. Сглаженные ортонормированными полиномами значения теплоемкости и рассчитанные термодинамические функции содержатся в табл. 2. Экстраполяция температурной зависимости теплоемкости к нулю Кельвина выполнена по закону кубов Дебая = = AT 3. Значение A = 0.000926 Дж/(моль K4) получено из линейности функции Cp/T vs T2 (рис. 3). Температурная зависимость теплоемкости имеет гладкую S-образную форму, что свидетельствует об отсутствии структурных превращений в изученном диапазоне температур. Сравнение полученной температурной зависимости изобарной теплоемкости гафната лантана с измерениями, выполненными авторами [17], показало, что данные этой работы завышены в области 250–300 K и несколько ниже наших значений при температурах <75 K (рис. 4, кривая 2). Необходимо отметить, что аналогичное поведение температурной зависимости теплоемкости было выявлено нами и в работе [25] при изучении цирконата самария, выполненном на той же экспериментальной установке. На рис. 4 (кривые 1 и 2) продемонстрировано аналогичное отклонение данных [17, 25] в области выше 250 K от полученных нами значений для La2Hf2O7 и Sm2Zr2O7 [28]. Мы полагаем, что бóльшая достоверность данных настоящей работы основана и на удовлетворительном согласии наших величин для La2Zr2O7 [28] со значениями, приведенными в работе [27], которые используются в качестве справочных.
Таблица 1.
Экспериментальные данные по измерению изобарной теплоемкости La2Hf2O7 в области 15–346 K
| T, K | Cp, Дж/(моль K) | T, K | Cp, Дж/(моль K) | T, K | Cp, Дж/(моль K) |
|---|---|---|---|---|---|
| Серия 1 | 221.92 | 193.70 | 39.75 | 30.04 | |
| 82.49 | 84.13 | 226.20 | 195.60 | 41.53 | 32.15 |
| 85.03 | 87.07 | 230.44 | 197.40 | 43.30 | 34.29 |
| 87.15 | 89.47 | 234.59 | 199.30 | 45.04 | 36.44 |
| 89.28 | 91.87 | 238.86 | 201.20 | 46.79 | 38.63 |
| 91.42 | 94.23 | 243.12 | 203.10 | 48.51 | 40.83 |
| 93.57 | 96.57 | 247.28 | 204.95 | 50.23 | 43.05 |
| 95.74 | 98.89 | 251.41 | 206.57 | 51.95 | 45.30 |
| 97.96 | 101.2 | 255.50 | 208.12 | 53.76 | 47.68 |
| 100.15 | 103.5 | 259.55 | 209.61 | 55.48 | 49.95 |
| 102.98 | 106.4 | 263.58 | 211.05 | 57.21 | 52.23 |
| Серия 2 | 267.58 | 212.4 | 58.93 | 54.51 | |
| 113.31 | 116.7 | 271.54 | 213.8 | 60.65 | 56.78 |
| 117.50 | 120.7 | 275.46 | 215.1 | 62.36 | 59.04 |
| 120.95 | 123.9 | 279.34 | 216.3 | 64.08 | 61.29 |
| 124.44 | 127.1 | 283.19 | 217.5 | 65.79 | 63.52 |
| 127.89 | 130.2 | 286.98 | 218.6 | 67.50 | 65.73 |
| 131.34 | 133.2 | 290.67 | 219.7 | 69.22 | 67.93 |
| 134.79 | 136.2 | 294.01 | 220.7 | 70.94 | 70.11 |
| 138.29 | 139.2 | 297.85 | 221.7 | 72.85 | 72.51 |
| 141.75 | 142.1 | 301.59 | 222.7 | 74.75 | 74.86 |
| 145.19 | 144.9 | 305.69 | 223.8 | 77.09 | 77.72 |
| 148.64 | 147.7 | 311.81 | 225.4 | 79.35 | 80.43 |
| 152.09 | 150.4 | 318.89 | 227.1 | 81.59 | 83.08 |
| 155.55 | 153.0 | 325.89 | 228.7 | 83.85 | 85.70 |
| 159.00 | 155.6 | 332.80 | 230.2 | 86.11 | 88.30 |
| 162.47 | 158.2 | 339.62 | 231.6 | 88.36 | 90.83 |
| 165.93 | 160.7 | 346.30 | 232.9 | 90.64 | 93.37 |
| 169.50 | 163.2 | Серия 3 | 92.92 | 95.86 | |
| 172.96 | 165.6 | 101.09 | 104.5 | 95.20 | 98.32 |
| 176.42 | 167.9 | 104.51 | 108.0 | 97.50 | 100.8 |
| 179.89 | 170.2 | 108.05 | 111.5 | 99.80 | 103.2 |
| 183.37 | 172.4 | 111.57 | 115.0 | Серия 5 | |
| 186.85 | 174.6 | 115.14 | 118.4 | 14.61 | 2.612 |
| 190.33 | 176.8 | Серия 4 | 15.84 | 3.668 | |
| 193.81 | 178.8 | 26.85 | 15.52 | 17.06 | 4.483 |
| 197.30 | 180.9 | 28.78 | 17.69 | 18.27 | 5.720 |
| 200.78 | 182.85 | 30.67 | 19.79 | 19.54 | 7.107 |
| 204.69 | 185.01 | 32.49 | 21.80 | 20.83 | 8.575 |
| 209.02 | 187.34 | 34.32 | 23.85 | 23.37 | 11.52 |
| 213.34 | 189.59 | 36.16 | 25.91 | ||
| 217.64 | 191.76 | 37.96 | 27.96 | ||
Таблица 2.
Термодинамические функции La2Hf2O7 в области 0–346 K
| T, K | $C_{p}^{ \circ }$, Дж/(моль K) | S°(T), Дж/(моль K) | H°(T)–H°(0), Дж/моль | Ф°(T), Дж/(моль K) |
|---|---|---|---|---|
| 5 | 0.116 | 0.0376 | 0.0141 | 0.00940 |
| 10 | 0.926 | 0.3008 | 2.256 | 0.0752 |
| 15 | 3.045 | 1.015 | 11.42 | 0.2538 |
| 18 | 5.434 | 1.811 | 24.45 | 0.4528 |
| 20 | 7.818 | 2.507 | 37.72 | 0.6213 |
| 25 | 13.42 | 4.858 | 90.94 | 1.221 |
| 30 | 18.88 | 7.786 | 171.7 | 2.064 |
| 35 | 24.50 | 11.12 | 280.0 | 3.114 |
| 40 | 30.38 | 14.77 | 417.1 | 4.339 |
| 45 | 36.52 | 18.70 | 584.3 | 5.714 |
| 50 | 42.88 | 22.87 | 782.7 | 7.219 |
| 60 | 55.90 | 31.84 | 1276 | 10.56 |
| 70 | 68.81 | 41.43 | 1900 | 14.28 |
| 80 | 81.14 | 51.43 | 2651 | 18.30 |
| 90 | 92.69 | 61.66 | 3521 | 22.55 |
| 100 | 103.4 | 71.99 | 4502 | 26.97 |
| 110 | 113.5 | 82.33 | 5587 | 31.54 |
| 120 | 123.0 | 92.61 | 6770 | 36.20 |
| 130 | 132.0 | 102.8 | 8045 | 40.93 |
| 140 | 140.5 | 112.9 | 9408 | 45.71 |
| 150 | 148.7 | 122.9 | 10854 | 50.53 |
| 160 | 156.4 | 132.7 | 12380 | 55.36 |
| 170 | 163.6 | 142.4 | 13981 | 60.19 |
| 180 | 170.4 | 152.0 | 15651 | 65.03 |
| 190 | 176.6 | 161.4 | 17386 | 69.85 |
| 200 | 182.4 | 170.6 | 19181 | 74.67 |
| 210 | 187.7 | 179.6 | 21032 | 79.45 |
| 220 | 192.7 | 188.5 | 22935 | 84.20 |
| 230 | 197.4 | 197.1 | 24886 | 88.92 |
| 240 | 201.8 | 205.6 | 26882 | 93.60 |
| 250 | 205.9 | 213.9 | 28921 | 98.25 |
| 260 | 209.7 | 222.1 | 30999 | 102.9 |
| 270 | 213.3 | 230.1 | 33114 | 107.4 |
| 280 | 216.6 | 237.9 | 35264 | 111.9 |
| 290 | 219.6 | 245.5 | 37445 | 116.4 |
| 298.15 | 221.8 | 251.7 | 39243 | 120.0 |
| 300 | 222.3 | 253.0 | 39654 | 120.9 |
| 310 | 224.8 | 260.4 | 41890 | 125.2 |
| 320 | 227.3 | 267.5 | 44151 | 129.6 |
| 330 | 229.7 | 274.6 | 46435 | 133.9 |
| 340 | 231.8 | 281.5 | 48743 | 138.1 |
| 346 | 232.8 | 285.5 | 50137 | 140.6 |
ЗАКЛЮЧЕНИЕ
Теплоемкость гафната лантана La2Hf2O7 структурного типа Fd3m (пирохлор) измерена методом адиабатической калориметрии. По сглаженным значениям теплоемкости рассчитаны энтропия, приращение энтальпии и приведенная энергия Гиббса в области температур 0–346 K. Стандартные термодинамические функции при 298.15 K составляют: $C_{p}^{^\circ }$ (298.15 K) = 221.8 ± ± 0.5 Дж/(моль K), S° (298.15 K) = 251.7 ± 0.9 Дж/(моль K), H°(298.15 K)–H°(0)= 39243 ± 120 Дж/моль, Ф°(T)= 120.0 ± 1.3 Дж/(моль K). Полученные температурные зависимости термодинамических функций могут быть использованы для моделирования физико-химических процессов с участием гафната лантана и оптимизации процессов его получения.
Список литературы
Arsen’ev P.A., Glushkova V.B., Evdokimov A.A. et al. // Rare earth compounds. Zirconates, hafnates, niobates, tantalates, antimonates. M.: Nauka Publ., 1985. 261 p.
Sevastyanov V.G., Simonenko E.P., Sevastyanov D.V. et al. // Russ. J. Inorg. Chem. 2013. V. 58. P. 1. https://doi.org/10.1134/S0036023613010178
Shlyakhtina A.V., Kolbanev I.V., Knotko A.V. et al. // Inorg. Mater. 2005. V. 41. P. 854.
Shlyakhtina A.V., Boguslavskii M.V., Stefanovich S.Yu. et al. // Inorg. Mater. 2006. V. 42. P. 519. https://doi.org/10.1134/S002016850605013X
Shlyakhtina A.V., Shcherbakova L.G. // Solid State Ionics. 2011. V. 192. P. 200. https://doi.org/10.1016/j.ssi.2010.07013
Brixner L.H. // Mater. Res. Bull. 1984. V. 19. P. 143. https://doi.org/10.1016/0025-5408(84)90084-9
Sickafus K.E., Minervini L., Grimes R.W. et al. // Science. 2000. V. 289 (5480). P. 748. https://doi.org/10.1126/science.289.5480.748
Andrievskaya E.R. // J. Eur. Ceram. Soc. 2008. V. 28. P. 2363. https://doi.org/10.1016/j.jeurceramsoc.2008.01.009
Duran P. // Ceram. Intern. 1975. V. 1. P. 10. https://doi.org/10.1016/0390-5519(75)90032-0
Shevchenko A.V., Lopato L.M., Zaitseva Z.A. // Izv. AN SSSR. Inorg. Mater. 1984. V. 20. P. 1530.
Karyakina E.L., Zoz E.I., Gavrish A.M., Gul’ko N.V. // Izv. AN SSSR. Inorg. Mater. 1978. V. 20. P. 3202.
Govindan Kutti K.V., Rajagopalan S., Mathews C.K. // Mater. Res. Bull. 1994. V. 29. P. 759. https://doi.org/10.1016/0025-5408(94)90201-1
Ushakov S.V., Navrotsky A. // J. Am. Ceram. Soc. 2007. V. 90. P. 1171. https://doi.org/10.1111/j.1551-2916.2007.01592.x
Popov V.V., Menushenkov A.P., Yaroslavtsev. A.A. et al. // J. Alloys Compd. 2016. V. 689. P. 669. https://doi.org/10.1016j.jallcom.2016.08.019
Popov V.V., Petrunin V.F., Korovin C.A. et al. // Russ. J. Inorg. Chem. 2011. V. 56. P. 1617.
Ushakov S.V., Navrotsky A., Tangeman J.A. // MRS Online Proceedings Library Archive. 2008. V. 1122.
Kopan A.R., Gorbachuk M.P., Lakiza S.M., Tichenko Ya.S. // Powder Metallurgy Metal Ceram. 2016. V. 54. P. 696. https://doi.org/10.1007/s11106-016-9764-5
Sommers J.A., Westrum E.F. // J. Chem. Thermodyn. 1977. V. 9. P. 1.
Westrum E.F. // J. Chem. Thermodyn. 1983. V. 15. P. 305.
Gagarin P.G., Tyurin A.V., Guskov V.N. et al. // Russ. J. Inorg. Chem. 2018. V. 63. P. 1478. https://doi.org/10.1134/S0036023618110050
Gagarin P.G., Tyurin A.V., Guskov V.N. et al. // Inorg. Mater. 2017. V. 53. P. 619. https://doi.org/10.1134/S0020168517060048
Wieser M.E., Holden N., Coplen T.B. et al. // Pure Appl. Chem. 2013. V. 85. P. 1047. https://doi.org/10.1351/PAC-REP-13-03-02
Gurevich V.M., Gorbunov V.E., Gavrichev K.S. et al. // Geochem. Int. 1999. V. 37. P. 367.
ICCD PDF 01-078-5592
Kopan A.R., Gorbachuk M.P., Lakiza S.M., Tichenko Ya.S. // Powder Metallurgy Metal Ceram. 2010. V. 49. P. 317. https://doi.org/10.1007/s11106-010-9238-0
Gagarin P.G., Tyurin A.V., Guskov V.N. et al. // Inorg. Mater. 2017. V. 53. P. 619. https://doi.org/10.1134/S0020168517060048
Bolech M., Cordfunke E.H.R., Van Genderen A.C.G. et al. // J. Phys. Chem. Solids. 1977. V. 58. P. 433. https://doi.org/10.1016/s0022-3697(06)00137-5
Gagarin P.G. Avtoref. kand. diss. (Russ.). M., 2018. 19 p.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии