Журнал неорганической химии, 2019, T. 64, № 11, стр. 1166-1170
Синтез, кристаллическая структура и тепловое расширение фосфат-сульфата натрия-бария-циркония
В. И. Петьков 1, *, А. И. Боков 1, Е. А. Асабина 1, М. И. Лелет 1, А. М. Ковальский 2
1 Национальный исследовательский Нижегородский государственный университет им. Н.И. Лобачевского
603950 Нижний Новгород, пр-т Гагарина, 23, Россия
2 Национальный исследовательский технологический университет “МИСиС”
119049 Москва, Ленинский пр-т, 4, Россия
* E-mail: petkov@inbox.ru
Поступила в редакцию 01.04.2019
После доработки 29.04.2019
Принята к публикации 13.05.2019
Аннотация
Протестирован подход к синтезу фосфат-сульфатов на примере NaBa6Zr(PO4)5SO4, позволяющий предотвратить элиминирование серы в процессе его получения. С использованием РФА и ДТА-ТГ изучено фазообразование и термическая стабильность фосфат-сульфата. Методом Ритвельда уточнена структура NaBa6Zr(PO4)5SO4 (пр. гр. I$\overline 4 $3d, a = 10.5449(3) Å, V = 1172.54(5) Å3, Z = 4), родственная минералу эвлитину. Структура образована волнистыми цепями (Na,Ba,Zr)O6-октаэдров, соединенных ребрами, и (P,S)O4-тетраэдров, связанных с октаэдрами через вершины. Методом терморентгенографии установлено, что фосфат-сульфат является сильно расширяющимся материалом (αа = αb = αc = 13.3 × 10–6°С–1).
ВВЕДЕНИЕ
Среди представителей структурного типа эвлитина Bi4(SiO4)3 охарактеризованы двойные висмутсодержащие силикаты, германаты, фосфаты и ванадаты [1–6]. Прототип семейства обладает кубической сингонией (пр. гр. I$\overline 4 $3d, a = 10.300 Å, Z = 4) [7]. Его структура построена сочленением сильно искаженных BiO6-октаэдров, образующих волнистые цепи за счет соединения по ребрам, и SiO4-тетраэдров, соединяющихся с октаэдрами через вершины.
Эвлитин и его структурные аналоги нашли технологическое приложение в качестве материалов со специальными свойствами: диэлектрическими, термолюминесцентными, фотокаталитическими, магнитными и магнитно-оптическими [8–11]. Этот класс веществ может быть расширен за счет получения смешанных фосфатов, в частности фосфат-сульфатов, с улучшенными по сравнению с моноанионными фосфатами свойствами.
Известно, что температуры синтеза фосфатов весьма высоки (>800°C), в то время как многие сульфаты являются термически неустойчивыми (>750°C). Значительная разность в температурах получения фосфатов и термической устойчивости сульфатов приводит к сложностям синтеза фосфат-сульфатов из-за частичного элиминирования серы в виде SO3 в процессе их получения. Поэтому важен кристаллохимический прогноз состава фосфат-сульфатов, исключающий формирование промежуточных нестойких соединений серы в процессе синтеза, и обоснование допустимого температурного интервала, внутри которого синтез идет без потерь серы. Для прогнозирования состава новых фаз эффективно использовать кристаллохимическую формулу структурного типа с учетом возможных изо- и гетеровалентных замещений ионов. Также важен выбор исходных реагентов, способствующих снижению температуры синтеза. Обоснование допустимого температурного интервала основано на литературных данных по температурной устойчивости простых сульфатов, которые могут образоваться в процессе синтеза. Минимальную температуру разложения простого сульфата, который может сформироваться в процессе синтеза, считаем максимальной теоретической температурой получения фосфат-сульфата. В том случае, если в реакционной смеси присутствует компонент, склонный к образованию нестойкого простого сульфата, серу в целевом продукте можно зафиксировать за счет конкурирующего влияния катионов, образующих термостойкие простые сульфаты. Для количественной оценки содержания серы в образце и ее потерь можно использовать метод изотермического поэтапного нагревания с последующим электронно-зондовым микроанализом.
Цель работы – показать эффективность разработанного подхода к получению фосфат-сульфатов на примере направленного синтеза термически устойчивого NaBa6Zr(PO4)5SO4.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Фосфат-сульфат NaBa6Zr(PO4)5SO4 получали золь-гель методом с последующей термообработкой. Исходными реагентами для синтеза служили реактивы марки “х. ч.”: NaCl, Ba(NO3)2, ZrOCl2 · · 8H2O, H3PO4 и H2SO4. Для получения NaBa6Zr(PO4)5SO4 стехиометрические количества водных растворов солей металлов сливали при постоянном перемешивании при комнатной температуре, затем добавляли растворы серной и фосфорной кислот, взятые в соответствии со стехиометрией фосфат-сульфата. Реакционную смесь высушивали при 90−130°C и подвергали термообработке на воздухе при 600−750°C не менее 24 ч на каждой стадии. Стадии нагревания чередовали с диспергированием для обеспечения гомогенизации смеси. Для более полного протекания реакции порошок прессовали в диски. Рентгенофазовый анализ образца проводили после каждой стадии обжига. Максимальная температура синтеза составляла 850°C. Полученный образец представлял собой поликристаллический порошок белого цвета.
Контроль химического состава и однородности образца осуществляли с помощью сканирующего электронного микроскопа JEOL JSM-7600F с термополевой пушкой (катод Шоттки). Микроскоп оснащен системой микроанализа – энергодисперсионным спектрометром OXFORD X-Max 80 (Premium) с полупроводниковым кремний-дрейфовым детектором. Погрешность при определении элементного состава образца составляла не более 2 ат. %.
Рентгенографическую съемку образца выполняли на дифрактометре Shimadzu XRD-6000 (CuKα-излучение, λ = 1.54178 Å, 2θ = 10°–60°), оснащенном температурной приставкой Anton Paar TTK 450. Индицирование дифрактограмм проводили методом структурной аналогии с использованием кристаллографических данных описанных в литературе соединений. Дифрактограмму образца NaBa6Zr(PO4)5SO4 для структурных исследований записывали в интервале углов 2θ 10°–110° с шагом сканирования 0.02° и экспозицией в точке 16 с. Обработку дифрактограммы и уточнение структуры проводили методом Ритвельда [12] с использованием программы RIETAN-97 [13]. Аппроксимирование профилей пиков осуществляли согласно модифицированной функции псевдо-Войта (Mod-TCH pV [14]). В качестве базовой модели для уточнения кристаллической структуры фосфат-сульфата использовали координаты атомов Pb4(PO4)2SO4 [15].
Исследование теплового расширения NaBa6Zr(PO4)5SO4 проводили на том же дифрактометре с использованием температурной приставки с дискретным режимом изменения температуры в интервале от –120 до 200°С с шагом 40−50°С. Образец охлаждали контролируемым потоком жидкого азота. Температуру измеряли термометром сопротивления Pt100 RTD. При каждой выбранной температуре интервал углов дифракции 2θ = 10°−50°, в качестве внешнего стандарта использовали Si. Для построения трехмерной фигуры теплового расширения NaBa6Zr(PO4)5SO4 использовали программное обеспечение Maplesoft [16].
Совмещенный анализ ТГ-ДТА геля со стехиометрией фосфат-сульфата натрия-бария-циркония, подвергнутого предварительной термообработке при 200°С, проводили с помощью синхронного термоанализатора DTG-60H фирмы Shimadzu в интервале температур 20−1000°C со скоростью нагревания 10 град/мин.
Функциональный состав образца подтвержден ИК-спектроскопическим исследованием. ИК-спектр поглощения был записан на ИК-фурье-спектрометре ФСМ-1201 в диапазоне волновых чисел 400−1400 см−1.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Наименее устойчивым промежуточным сульфатом при синтезе NaBa6Zr(PO4)5SO4 является Zr(SO4)2 (tразл < 700°C), что предполагает температуру синтеза соединения ∼700°С. Однако направленный выбор стехиометрии вещества позволяет повысить температуру синтеза за счет образования в процессе его получения термостойкого BaSO4 (tпл = 1580°C) и высокой концентрации катионов бария в фосфат-сульфате, что предотвращает потерю легколетучего компонента. Однофазный NaBa6Zr(PO4)5SO4 получен при 850°C. По данным РФА, образец кристаллизуется в структурном типе эвлитина (пр. гр. I$\overline 4 $3d).
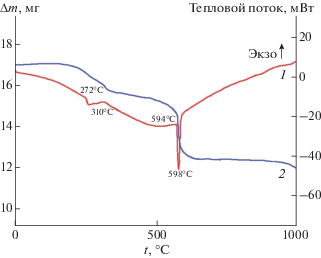
Процессы, предшествующие образованию целевой фазы NaBa6Zr(PO4)5SO4, изучали методом совмещенного анализа ТГ-ДТА (рис. 1). На кривой ТГ можно выделить несколько ступеней потери массы. В интервале температур от 200 до 350°C наблюдается потеря массы, которой соответствует эндотермический эффект на кривой ДТА с минимумом при 310°С. Эта температурная область отвечает разложению исходных реагентов и образованию гидрофосфата циркония. В интервале 550−630°C потеря массы связана с твердофазной реакцией образования целевого продукта, ей соответствует эндотермический эффект с минимумом при 598°C. Целевая реакция
Результаты электронной микроскопии и микрозондового анализа показали, что образец был гомогенным и представлял собой зерна различной формы. Изображение структуры образца позволяет сделать вывод, что размеры зерен колеблются от 1 до 6 мкм (рис. 2). Его состав отвечает формуле Na0.98(2)Ba5.80(6)Zr0.98(2)P5.12(10)S0.98(2)O12 и соответствует теоретическому в пределах погрешности метода.
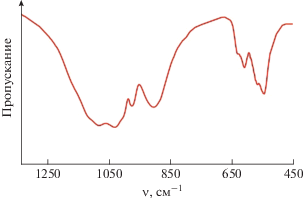
ИК-спектр синтезированного соединения (рис. 3) по положению и форме полос поглощения типичен для ортофосфатов, кристаллизующихся в структурном типе эвлитина с пр. гр. I$\overline 4 $3d. Поскольку разница в степенях окисления и атомных массах фосфора и серы небольшая, а величины межатомных расстояний P–O и S–O при одинаковых КЧ близки, значения частоты колебаний этих связей и положение полос в спектре фосфат-сульфата совпадают. Полосы поглощения в области волновых чисел от 850 до 1200 см−1 отнесены к валентным асимметричным (νas) колебаниям тетраэдрических (фосфатного и сульфатного) ионов. Полосы в области 500−660 см−1 соответствуют деформационным асимметричным (δas) колебаниям иона (P,S)O4.
Кристаллическая структура NaBa6Zr(PO4)5SO4 уточнена методом Ритвельда. На рис. 4 представлены его экспериментальная, вычисленная, штрих- и разностная дифрактограммы. Наблюдается хорошее совпадение экспериментальной и вычисленной дифрактограмм фосфат-сульфата. В качестве исходной модели для уточнения структуры NaBa6Zr(PO4)5SO4 использованы координаты атомов Pb4(PO4)2SO4 [15]. Уточнение кристаллической структуры проводили путем постепенного добавления уточняемых параметров при постоянном графическом моделировании фона. Условия съемки, параметры ячейки и основные данные по уточнению структуры приведены в табл. 1. Результаты уточнения показали, что катионы Na+, Ba2+ и Zr4+ заселяют октаэдрически координированные атомами кислорода позиции 16с. Атомы фосфора и серы заселяют тетраэдрические позиции 12a. Координаты атомов, их тепловые параметры в изотропном приближении и заселенности базисных атомов представлены в табл. 2.
Рис. 4.
Экспериментальная (1), вычисленная (2), разностная (3) и штрих- (4) дифрактограммы сульфат-фосфата NaBa6Zr(PO4)5SO4.
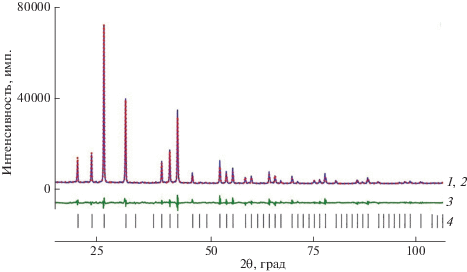
Таблица 1.
Условия съемки и результаты уточнения кристаллической структуры NaBa6Zr(PO4)5SO4
| Характеристика | NaBa6Zr(PO4)5SO4 |
|---|---|
| Пр. гр., Z | I$\overline 4 $3d, 4 |
| a, Å | 10.5449(3) |
| V, Å3 | 1172.54(5) |
| ρрентг, г/см3 | 4.274(4) |
| Интервал углов 2θ, град | 15.00–115.00 |
| Шаг сканирования | 0.02 |
| Число рефлексов (отражение) | 85 |
| Число уточняемых параметров | 25 |
| Факторы достоверности: | |
| Rwp, % | 4.92 |
| Rp, % | 3.21 |
| S | 2.96 |
Таблица 2.
Координаты, параметры атомных смещений и заселенности (q) базисных атомов в структуре сульфат-фосфата NaBa6Zr(PO4)5SO4
| Атом | Позиция | x | y | z | Bизо | q |
|---|---|---|---|---|---|---|
| Na | 16c | 0.0625(1) | 0.0625(1) | 0.0625(1) | 2.23(6) | 0.125 |
| Ba | 16c | 0.0625(1) | 0.0625(1) | 0.0625(1) | 2.23(6) | 0.750 |
| Zr | 16c | 0.0625(1) | 0.0625(1) | 0.0625(1) | 2.23(6) | 0.125 |
| P | 12a | 0.375 | 0 | 0.25 | 2.23(6) | 0.833 |
| S | 12a | 0.375 | 0 | 0.25 | 2.23(6) | 0.167 |
| O | 48e | 0.1399(6) | 0.2894(7) | 0.0113(6) | 2.23(6) | 1.0 |
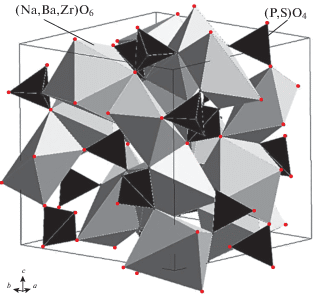
Фрагмент структуры NaBa6Zr(PO4)5SO4 приведен на рис. 5. Его смешанный каркас формируют искаженные (Na,Ba,Zr)O6-октаэдры, образующие волнистые цепи за счет соединения по ребрам между собой, и (P,S)O4-тетраэдры, соединяющиеся с октаэдрами через вершины. Рассчитанные длины связей в координационных многогранниках фосфат-сульфата согласуются с соответствующими значениями, полученными для других соединений аналогичного строения [5, 11, 17]. Межатомные расстояния в октаэдрах (Na,Ba,Zr)O6: три связи (Na,Ba,Zr)−O по 2.585 Å, три другие равноценные связи по 2.699 Å. Расстояния (P,S)−O в тетраэдрах (P,S)O4 составляют 1.475 Å.
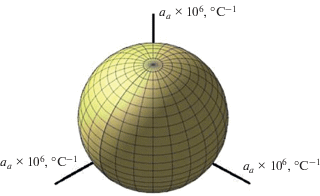
Термическое поведение синтезированного NaBa6Zr(PO4)5SO4 в интервале от −120 до 200°C изучено методом терморентгенографии [18]: определены параметры элементарной ячейки a и V при изменении температуры и коэффициенты теплового расширения соединения. Параметр a кубической ячейки NaBa6Zr(PO4)5SO4 с ростом температуры T линейно увеличивается: a (Å) = = 10.379 + 1 × 10–5T. Увеличение параметра a с ростом температуры является следствием разворота октаэдров и тетраэдров в структуре. Имея кубическую симметрию, материал при повышении температуры равномерно расширяется по всем направлениям (рис. 6) и имеет положительные коэффициенты теплового расширения. Коэффициенты теплового линейного расширения фосфат-сульфата αа = αb = αc = 13.3 × 10–6°С–1 позволяют отнести его к классу сильно расширяющихся соединений. Поскольку сульфат-фосфат расширяется изотропно, коэффициент его объемного теплового расширения (αV) равен утроенному коэффициенту линейного теплового расширения. Исследований теплового расширения соединений со структурой эвлитина мало [19, 20]: все из них расширяются изотропно и имеют коэффициенты теплового линейного расширения αа = (11–18) × 10−6°C−1, т.е. являются сильно расширяющимися материалами.
ЗАКЛЮЧЕНИЕ
Проведен направленный синтез фосфат-сульфата NaBa6Zr(PO4)5SO4, позволивший предотвратить элиминирование серы в виде SO3 в процессе получения за счет конкурирующего влияния катионов, образующих термостойкие простые сульфаты. Результаты РФА, ИК-спектроскопии и микрозондового анализа свидетельствуют об образовании фосфат-сульфата со структурой типа эвлитина. Кристаллическая структура NaBa6Zr(PO4)5SO4 уточнена методом Ритвельда. Изучение термического поведения соединения в интервале от −120 до 200°C показало, что параметры элементарной ячейки линейно увеличиваются с ростом температуры. Фосфат-сульфат расширяется изотропно и является сильно расширяющимся материалом.
Список литературы
Ishii M., Harada K., Senguttuvan N. et al. // J. Cryst. Growth. 1999. V. 205. № 1–2. P. 191. https://doi.org/10.1016/S0022-0248(99)00232-8
Onderka B. // Thermochim. Acta. 2015. V. 601. P. 68. https://doi.org/10.1016/j.tca.2014.12.021
Milenov T.I., Rafailov P.M., Petrova R. et al. // Mater. Sci. Eng. B. 2007. V. 138. № 1. P. 35. https://doi.org/10.1016/j.mseb.2007.01.001
Yu P., Su L., Zhao H., Xu J. // J. Lumin. 2014. V. 154. P. 520. https://doi.org/10.1016/j.jlumin.2014.06.005
Arbib El H., Elouadi B., Chaminade J.P., Darriet J. // Mater. Res. Bull. 2000. V. 35. № 5. P. 761. https://doi.org/10.1016/S0025-5408(00)00270-1
Sahoo P.P., Gaudin E., Darriet J., Guru Row T.N. // Mater. Res. Bull. 2009. V. 44. № 4. P. 812. https://doi.org/10.1016/j.materresbull.2008.09.022
Segal D.J., Santoro R.P., Newham R.E. // Z. Kristallogr. 1966. V. 123. № 1–6. S. 73. https://doi.org/10.1524/zkri.1966.123.16.73
Abhilash P., Sebastian M.T., Surendran K.P. // J. Eur. Ceram. Soc. 2016. V. 36. № 8. P. 1939. https://doi.org/10.1016/j.jeurceramsoc.2016.02.019
Folkerts H.F., Zuidema J., Blasse G. // Chem. Phys. Lett. 1996. V. 249. № 1–2. P. 59. https://doi.org/10.1016/0009-2614(95)01363-6
Zhang Z., Shen P., Wu Ya. et al. // Opt. Mater. 2014. V. 37. P. 866. https://doi.org/10.1016/j.optmat.2014.05.029
Chen X., Gong Z., Wan Q. et al. // Opt. Mater. 2015. V. 44. P. 48. https://doi.org/10.1016/j.optmat.2015.02.029
Rietveld H.M. // Acta Crystallogr. 1967. V. 22. Pt. 1. P. 151.
Kim Y.I., Izumi F. // J. Ceram. Soc. Jpn. 1994. V. 102. P. 401. https://doi.org/10.2109/jcersj.102.401
Izumi F. The Rietveld Method. N.Y.: Oxford Univ. Press, 1993.
Barbier J. // Eur. J. Solid State Inorg. Chem. 1994. V. 31. P. 163.
Knyazev A.V., Komshina M.E., Zhidkov A.V. et al. // Russ. J. Inorg. Chem. 2013. V. 58. № 10. P. 1172. [Князев А.В., Комшина М.Е., Жидков А.В. и др. // Журн. неорган. химии. 2013. Т. 58. № 10. С. 1311.] https://doi.org/10.7868/S0044457X13100140
Arbib El H., Chaminade J.-P., Darriet J., Elouadi B. // Solid State Sci. 2000. V. 2. № 2. P. 243. https://doi.org/10.1016/S1293-2558(00)00132-1
Бубнова Р.С., Кржижановская М.Г., Филатов С.К. Практическое руководство по терморентгенографии поликристаллов. Ч. 1: Осуществление эксперимента и интерпретация полученных данных. СПб.: С.-Петерб. гос. ун-т, 2011.
Pet’kov V.I., Dmitrienko A.S., Bokov A.I. // J. Therm. Anal. Cal. 2018. V. 133. № 1. P. 199. https://doi.org/10.1007/s10973-017-6676-7
Vats B.G., Phatak R., Krishnan K. et al. // J. Alloys Compd. 2017. V. 690. P. 561. https://doi.org/10.1016/j.jallcom.2016.08.122
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии