Журнал неорганической химии, 2019, T. 64, № 11, стр. 1171-1178
Синтез, кристаллическая и молекулярная структура тетрагидрата малеата трис(бензгидразид)кобальта(II) [Co(L1)3](Mal) · 4H2O и гидрата малеата трис(фенилацетгидразид)никеля(II) [Ni(L2)3](Mal) · H2O
В. С. Сергиенко 1, 2, *, Т. В. Кокшарова 3, М. Д. Суражская 1, Т. В. Мандзий 3, А. В. Чураков 1
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
119071 Москва, Ленинский пр-т, 31, Россия
2 Всероссийский институт научной и технической информации РАН
125190 Москва, ул. Усиевича, 20, Россия
3 Одесский национальный университет им. И.И. Мечникова
65082 Одесса, ул. Дворянская, 2, Украина
* E-mail: sergienko@igic.ras.ru
Поступила в редакцию 26.02.2019
После доработки 09.04.2019
Принята к публикации 13.05.2019
Аннотация
Синтезированы координационные соединения состава [Co(L1)3](Mal) · 4H2O (I) и [Ni(L2)3](Mal) · H2O (II) (L1 – бензгидразид, L2 – фенилацетгидразид, H2Mal – малеиновая кислота) и исследованы методами ИК-спектроскопии и спектроскопии диффузного отражения, а также рентгеноструктурного анализа. Структурные единицы кристаллов I и II – комплексные катионы [Co(L1)3]2+ и [Ni(L2)3]2+, малеат-ионы Mal2– и кристаллизационные молекулы воды, объединенные разветвленной системой водородных связей. Атомы металлов в комплексных катионах кристаллов I, II имеют октаэдрическую координацию двумя тройками атомов 3О + 3N трех бидентатно-хелатных лигандов Ln (n = 1, 2).
ВВЕДЕНИЕ
Малеаты 3d-металлов и их смешанолигандные комплексы представляют большой интерес с практической и теоретической точки зрения. Они могут быть перспективны в области нелинейной оптики [1–3]. Термолиз солей ненасыщенных моно- и дикарбоновых кислот, в том числе малеатов, можно использовать для получения наночастиц металла и/или оксида металла малых размеров, стабилизированных в полимерной матрице. Например, термолиз малеатов состава М(ООССН=СНСОО)n · mH2O (M = Fe(III), Co(II)) дает как отдельные частицы оксидов металлов, так и агрегаты от трех до десяти таких частиц, встроенных в полимерную матрицу [4]. Бис(гидромалеат) кобальта проявляет люминесцентные свойства [5].
Теоретический интерес к малеатным комплексам вызван тем, что малеиновая кислота может связываться с ионом металла в моно- или дианионной форме в качестве моно-, би-, три- и тетрадентатного лиганда с формированием разнообразной структуры [6]. Малеат-ион может быть монодентатным, би-, три-, тетрадентатно-мостиковым и хелатным [7]. Авторы [8] получили два изомерных комплекса малеата никеля с фенантролином. При этом в соединении [Ni(H2O)3(Рhen)(C4H2O4)] · H2O малеат действует как монодентатный, а в [Ni(H2O)2(Рhen)(C4H2O4)] ⋅ ⋅ 2H2O – как бис-монодентатный лиганд. В тетрагидрате бис(гидромалеат)кобальта атом металла координируют два монодентатных монодепротонированных аниона [5]. Как правило, кристаллы тетрагидратов малеатов изоморфны для Mn, Fe, Co, Ni, Zn [9]. В комплексе никеля с 2,2'-бипиридином [Ni(C4H2O4)(Bipy)2(H2O)3] · H2O малеат-анион монодентатный [10], а при изменении количества воды – в соединении [Ni(C4H2O4)(C10H8N2)2] · · 7.34H2O – бидентатно-хелатный [11]. В комплексе никеля с 1,2-бис(4-пиридил)этаном малеат-ион действует как хелатирующий лиганд по отношению к одному атому никеля и как монодентатный по отношению к другому [12]. В комплексе малеата марганца с фенантролином {[Mn(Mal)(Рhen)(H2O)2] · · 2H2O}n каждая малеатная единица связывает два атома марганца бис-монодентатно с образованием одномерной цепочки вдоль оси b кристалла [13]. В комплексе кобальта с бензимидазолом мостиковый малеат-ион связывает два атома кобальта через обе концевые карбоксильные группы, одна из которых моно-, а вторая бидентатная. Образуется спиральная цепочечная структура чередующихся малеатных дианионов и атомов Со(II) [14]. Комплекс {[Co(Mal)(H2O)2] · H2O} представляет собой трехмерную сетчатую структуру, в которой каждый ион Co(II) связан с четырьмя ионами Co(II) одним карбоксилатным μ4-мостиковым лигандом [15]. В комплексах меди(II) с хелатирующими ароматическими аминами малеатные лиганды соединяют смежные металлические центры с образованием координационных 1D-цепочек, далее образующих молекулярные двойные 1D-цепочки и (путем нековалентных взаимодействий) трехмерный надмолекулярный 3D-каркас с открытыми каналами [16]. В [17] описан комплекс [Ni(H2O)6][Ni(H2O)2(C4H2O4)] · 4H2O, где бидентатные малеат-анионы образуют с атомами никеля семичленные хелатные циклы. В тиосемикарбазидных комплексах [MII(CH5N3S)2(H2O)2](C4H3O4)2 · · 2H2O, где M = Ni [18], Zn [19], малеат-ион внешнесферный. Авторы [20] получили комплексы малеатов Mn(II), Ni(II) и Cu(II) с диметил-2,2ʹ-бипиридином и показали, что самосборка малеат-аниона с тремя различными переходными металлами первого ряда может давать координационные соединения различной структуры.
В [21] показана возможность изомеризации малеата в фумарат в комплексе цинка с 4,4'-дипиридиламином.
Данные о структурах комплексов карбоксилатов кобальта(II) и никеля(II) с бензгидразидом и фенилацетгидразидом немногочисленны. Мы синтезировали и структурно охарактеризовали фенилацетгидразидные комплексы никеля(II) с бензоат-анионом [22] и 5-сульфосалицилат-анионом [23], а также бензгидразидные комплексы кобальта(II), содержащие малонат-анион [24] и молекулу 5-сульфосалициловой кислоты [25].
В настоящей статье описан синтез, кристаллическая и молекулярная структура, ИК-спектры и спектры диффузного отражения (СДО) комплексов малеата кобальта(II) с бензгидразидом [Co(L1)3](Mal) · 4H2O (I) и малеата никеля(II) с фенилацетгидразидом [Ni(L2)3](Mal) · H2O (II).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез I и II. Навески 4.08 г (для I) и 4.5 г (для II) бензгидразида (0.03 моль) растворяли в 50 мл воды (I) и метанола (II). Небольшими порциями при перемешивании добавляли 2.27 г сухого МII(Mal) · 3H2O (0.01 моль) (M = Co (I), Ni (II)) до полного растворения. Раствор оставляли для самопроизвольного удаления растворителя. После выпадения кристаллического осадка его отделяли, промывали несколько раз водой и сушили в эксикаторе над СаСl2 до постоянной массы.
Исходные малеаты кобальта(II) и никеля(II) получали обменными реакциями нитратов кобальта(II) и никеля(II) с малеатом натрия в водном растворе.
Элементный анализ на металл проводили методом атомно-эмиссионной спектрометрии с индуктивно-связанной плазмой на приборе Perkin–Elmer Optima 8000, на углерод, водород и азот – с помощью CHN-анализатора.
Согласно элементному анализу, кристаллы I соответствуют составу [Co(L1)3](Mal) · 4H2O.
| С | H | Co | N | |
| Найдено, %: | 45.59; | 5.45; | 9.05; | 12.55. |
| Для C25H34CoN6O11 | ||||
| вычислено, %: | 45.94; | 5.21; | 9.04; | 12.86. |
Кристаллы II соответствуют составу [Ni(L2)3](Mal) · H2O.
| С | H | N | Ni | |
| Найдено, %: | 52.24; | 5.25; | 13.08; | 9.04. |
| Для C28H34N6NiO8 | ||||
| вычислено, %: | 52.42; | 5.30; | 13.10; | 9.20. |
ИК-спектры снимали на приборе Perkin–Elmer Spectrum BX II FT-IR System (Perkin–Elmer), образцы готовили в виде таблеток с KBr.
СДО регистрировали на спектрофотометре Lambda-9 (Perkin–Elmer), стандарт – MgO (βMgO = 100%).
РСА. Структура I, II расшифрована прямым методом и уточнена МНК в полноматричном анизотропном приближении для всех неводородных атомов. Позиции всех атомов Н рассчитаны геометричеcки и включены в уточнение по модели “наездника”. Кристаллографические данные и характеристики эксперимента в структурах I, II приведены в табл. 1, основные межатомные расстояния и валентные углы – в табл. 2, геометрические параметры водородных связей – в табл. S1 .
Таблица 1.
Кристаллографические характеристики, результаты эксперимента и уточнения структуры I и II
| Соединение | I | II |
|---|---|---|
| M | 653.51 | 641.32 |
| Температура | 293(2) K | 293(2) K |
| Сингония | Моноклинная | Ромбическая |
| Пр. гр. | Р21/с | Pca21 |
| Параметры ячейки: | ||
| a, Å | 15.300(2) | 11.06(2) |
| b, Å | 17.295(3) | 17.219(4) |
| c, Å | 11.9909(10) | 16.055(3) |
| β, град | 109.792(10) | 90 |
| V, Å3 | 2985.5(7) | 3057(6) |
| Z, ρвыч, г/см3 | 4, 1.454 | 4, 1.393 |
| µ, мм–1 | 5.098 | 1.409 |
| F(000) | 1364 | 1344 |
| Размер кристалла, мм | 0.20 × 0.17 × 0.08 | 0.20 × 0.16 × 0.03 |
| Дифрактометр | CAD4 Enraf–Nonius | CAD4 Enraf–Nonius |
| Тип сканирования | ω | ω |
| Излучение, λ | CuKα, 1.5418 | CuKα, 1.5418 |
| θmin–θmax, град | 4.9–64.9 | 4.8–64.9 |
| Интервалы индексов: | –17 ≤ h ≤ 17, –20 ≤ k ≤ 20, –11 ≤ l ≤ 11 | –13 ≤ h ≤ 13, –20 ≤ k ≤ 20, –18 ≤ l ≤ 18 |
| Число отражений: | ||
| измеренных | 17 799 | 18 741 |
| независимых | 5027 | 5169 |
| ненулевых, I > 2σ(I) | 3510 | 4024 |
| Rint | 0.133 | 0.064 |
| Комплектность по θ, % | 99.0 | 99.7 |
| Учет поглощения | ψ-сканирование | ψ-сканирование |
| Tmax, Tmin | 0.6858, 0.4287 | 0.9589, 0.7658 |
| Метод уточнения | Полноматричный МНК по F 2 | Полноматричный МНК по F 2 |
| N (число уточняемых параметров) | 413 | 389 |
| GOOF (F2) | 1.012 | 1.045 |
| Rhkl [I > 2σ(I)] | R1 = 0.0608, wR2 = 0.1509 | R1 = 0.0341, wR2 = 0.0874 |
| Rhkl (по всем отражениям) | R1 = 0.092, wR2 = 0.171 | R1 = 0.053, wR2 = 0. 096 |
| Остаточная электронная плотность, e/Å3 | 1.125, –0.489 | 0.150, –0.271 |
| Коэффициент экстинкции | 0.0027(3) | 0.0065(10) |
Таблица 2.
Основные длины связей и валентные углы в структуре I и II
| I | II | ||
| Связь | d, Å | Связь | d, Å |
| Co(1)–O(2) Co(1)–O(1) Co(1)–O(3) Co(1)–N(1) Co(1)–N(5) Co(1)–N(3) O(1)–C(1) O(2)–C(2) O(3)–C(3) O(4)–C(22) O(5)–C(22) O(6)–C(25) O(7)–C(25) N(2)–C(1) N(2)–N(1) N(6)–C(3) N(6)–N(5) N(3)–N(4) N(4)–C(2) |
2.074(2) 2.079(3) 2.081(2) 2.139(3) 2.147(3) 2.177(3) 1.252(4) 1.246(4) 1.250(4) 1.254(5) 1.252(5) 1.261(4) 1.244(4) 1.326(4) 1.422(4) 1.326(4) 1.414(4) 1.423(4) 1.320(4) |
Ni(1)–O(3) Ni(1)–O(1) Ni(1)–O(2) Ni(1)–N(3) Ni(1)–N(5) Ni(1)–N(1) O(1)–C(1) N(2)–C(1) N(2)–N(1) N(3)–N(4) O(2)–C(2) N(4)–C(2) N(6)–C(3) N(6)–N(5) O(3)–C(3) O(6)–C(28) C(27)–C(26) O(5)–C(25) C(28)–O(7) C(25)–O(4) |
2.033(4) 2.050(2) 2.056(2) 2.060(4) 2.095(3) 2.103(3) 1.226(4) 1.323(4) 1.421(4) 1.422(4) 1.241(5) 1.322(4) 1.312(4) 1.427(4) 1.240(4) 1.251(4) 1.291(5) 1.252(5) 1.239(4) 1.242(5) |
| Угол | ω, град | Угол | ω, град |
| O(2)Co(1)O(1) O(2)Co(1)O(3) O(1)Co(1)O(3) O(2)Co(1)N(1) O(1)Co(1)N(1) O(3)Co(1)N(1) O(2)Co(1)N(5) O(1)Co(1)N(5) O(3)Co(1)N(5) N(1)Co(1)N(5) O(2)Co(1)N(3) O(1)Co(1)N(3) O(3)Co(1)N(3) N(1)Co(1)N(3) N(5)Co(1)N(3) C(1)O(1)Co(1) C(2)O(2)Co(1) C(3)O(3)Co(1) C(1)N(2)N(1) C(3)N(6)N(5) N(4)N(3)Co(1) C(2)N(4)N(3) N(2)N(1)Co(1) N(6)N(5)Co(1) O(1)C(1)N(2) O(1)C(1)C(4) N(2)C(1)C(4) O(2)C(2)N(4) O(2)C(2)C(10) N(4)C(2)C(10) |
93.48(11) 94.99(10) 87.81(10) 90.00(11) 77.79(10) 165.03(11) 168.19(11) 95.19(11) 77.37(11) 99.66(12) 76.89(10) 169.81(10) 96.24(11) 98.64(11) 94.82(11) 114.4(2) 115.8(2) 115.3(2) 117.9(3) 118.0(3) 107.5(2) 117.8(3) 107.9(2) 108.2(2) 121.3(3) 119.6(3) 119.1(3) 121.6(3) 119.5(3) 118.9(3) |
O(3)Ni(1)O(2) O(1)Ni(1)O(2) O(3)Ni(1)N(3) O(1)Ni(1)N(3) O(2)Ni(1)N(3) O(3)Ni(1)N(5) O(1)Ni(1)N(5) O(2)Ni(1)N(5) N(3)Ni(1)N(5) O(3)Ni(1)N(1) O(1)Ni(1)N(1) O(2)Ni(1)N(1) N(3)Ni(1)N(1) N(5)Ni(1)N(1) O(3)Ni(1)O(1) C(1)O(1)Ni(1) C(1)N(2)N(1) N(4)N(3)Ni(1) C(2)O(2)Ni(1) O(1)C(1)N(2) O(1)C(1)C(4) N(2)C(1)C(4) N(2)N(1)Ni(1) C(2)N(4)N(3) O(2)C(2)N(4) O(2)C(2)C(11) N(4)C(2)C(11) C(3)N(6)N(5) C(3)O(3)Ni(1) N(6)N(5)Ni(1) |
94.38(13) 90.12(9) 172.58(11) 93.99(11) 80.24(13) 79.67(9) 170.65(9) 92.08(10) 95.33(11) 89.27(14) 79.70(10) 169.26(10) 96.94(14) 98.51(10) 91.10(9) 112.8(2) 118.1(3) 107.5(2) 112.3(2) 122.5(3) 121.2(3) 116.3(3) 106.13(17) 117.8(3) 122.1(3) 121.1(3) 116.8(3) 117.9(3) 113.7(2) 106.70(17) |
| I | II | ||
| Угол | ω, град | Угол | ω, град |
| O(3)C(3)N(6) O(3)C(3)C(16) N(6)C(3)C(16) O(4)C(22)O(5) O(4)C(22)C(23) O(5)C(22)C(23) |
121.0(3) 119.6(3) 119.3(3) 123.3(5) 118.4(4) 118.4(4) |
O(3)C(3)N(6) O(3)C(3)C(18) N(6)C(3)C(18) O(7)C(28)O(6) O(7)C(28)C(27) O(6)C(28)C(27) |
122.0(3) 121.0(3) 117.0(3) 125.3(3) 118.1(3) 116.6(3) |
| I | II | ||
| Угол | ω, град | Угол | ω, град |
| C(24)C(23)C(22) C(23)C(24)C(25) O(7)C(25)O(6) O(7)C(25)C(24) O(6)C(25)C(24) |
126.3(4) 124.6(4) 123.5(3) 118.4(3) 118.0(4) |
O(4)C(25)O(5) O(4)C(25)C(26) O(5)C(25)C(26) |
125.7(4) 116.3(4) 118.0(3) |
Результаты РСА соединений I, II депонированы в Кембриджском банке структурных данных (№ 1898465 (I), 18898466 (II)).
РСА проводили в ЦКП ФМИ ИОНХ РАН.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
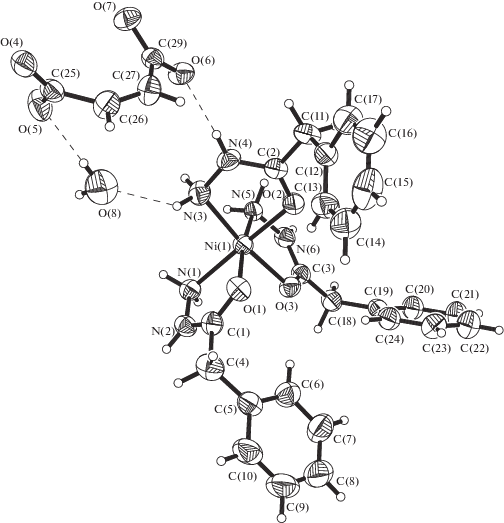
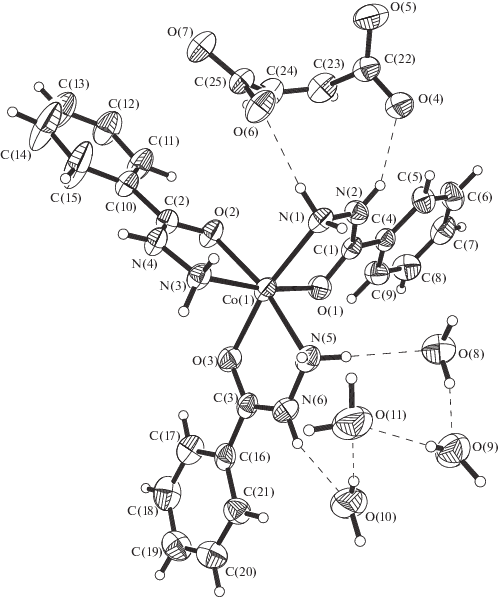
Строение кристаллов I, II определено методом РСА (рис. 1, 2). Структурные единицы кристаллов – комплексные катионы [Co(L1)3]2+ в I и [Ni(L2)3]2+ в II, а также малеат-ионы Mal2– и кристаллизационные молекулы воды mH2O (m = 4 в I, m = 1 в II). Атомы металлов в обоих катионных комплексах имеют октаэдрическую координацию двумя тройками цис-расположенных атомов кислорода и азота трех бидентатно-хелатных, близких по строению лигандов (бензгидразидных L1 в I и фенилацетгидразидных L2 в II). При координации с атомами металлов лигандов Ln (n = 1, 2) в обеих структурах замыкаются три пятичленных металлоцикла MN2CO.
Средние длины связей в структуре I: Co–O 2.078 ± 0.004 Å, Co–N 2.154 ± 0.023 Å; в II: Ni–O 2.046 ± 0.013 Å, Ni–N 2.086 ± 0.026 Å. Связи металл–лиганд в Ni-комплексе II заметно короче, чем в Со-соединении I (в среднем на 0.032 Å для М–О и на 0.068 Å для M–N). В соединении сходного с I cоcтава [Co(L1)3](OH)Cl · H3Ssal (H3Ssal = = 5-сульфосалициловая кислота) [25] связи Cо–О (средн. 2.075 ± 0.010 Å) и Co–N (средн. 2.144 ± ± 0.014 Å) сопоставимы по длине с аналогичными величинами в структуре I. Ранее мы определили кристаллическую структуру двух соединений, содержащих такие же, как в II, комплексные катионы: [Ni(L2)3](HSsal) · 3H2O (III) [23] и [Ni(L2)3](L3)2) · 4H2O (IV) [22] (L3 = однозарядный бензоат-ион). В этих двух соединениях длины связей Ni–O (средн. 2.055 ± 0.010 Å в III и 2.053 ± ± 0.002 Å в IV), как и Ni–N (средн. 2.080 ± 0.007 и 2.083 ± 0.001 Å), сходны с аналогичными расстояниями в структуре II. Малеатные противоионы в обоих соединениях не координируют атомы металла, активно участвуя всеми четырьмя атомами кислорода (О(4)–О(7)) в разветвленной системе акцепторных водородных связей (ВС) (в том числе вилочных) N–H…O, O–H…O с комплексными катионами и кристаллизационными молекулами воды. Последние участвуют также в донорных и акцепторных ВС N–H…O, O–H…N с лигандами L1 в I и L2 в II. Интервал геометрических параметров ВС: H…O 1.82–2.44 и 1.92–2.63, H...N 2.15, 2.22 и 2.10, N…O 2.748–3.034 и 2.708–3.162, O…O 2.729–3.380 и 2.869–3.251 Å, углы NHO 140°–168° и 137°–171°, OHO 135°–172° и 129°–180° соответственно в I и II (табл. S1).
Таблица 3.
Волновые числа (частоты, см–1) максимумов полос поглощения в ИК-спектрах малеата кобальта(II), бензгидразида (L1) и [Co(L1)3](Mal) · 4H2O (I)
| Отнесение | Co(Mal) · 3H2O | L1 | I |
|---|---|---|---|
| ν(NH), ν(NH2) | 3300, 3200, 3049, 3021, 2875 | 3253, 3198, 3074 | |
| ν(C=O) | 1662 | 1655 | |
| δ(NH2) | 1616 | 1611 | |
| νas(COO–) | 1579 | 1567 | |
| ν(С–С)аром. кольца | 1578 пл., 1567 | 1535 | |
| νs(COO–) | 1440 | 1431 | |
| δ(СН)плоск | 1421 | 1405 | |
| ω(NH2) | 1350, 1299 | 1355, 1346, 1322, 1302 | |
| ν(CN) + ν(N–N) + τ(NH2) + δ(CСН) | 1185, 1155, 1121 | 1189, 1163, 1127 | |
| νпульс. кольца + ρ(NH2) + τ(NH2) | 1071, 920, 885, 803 | 1074, 1039, 1023, 937, 902, 807 | |
| δ(СН)внеплоск | 990, 846 | 976, 858 | |
| ρ(CСН) + δ(CСН) | 752 | 708 | |
| δ(СNН) + δ(CСС) | 685, 675, 617 | 650 | |
| δ(СCN) + δ(NСО) | 517 | 536 | |
| Δν(COO–) | 139 | 136 | |
| ΔΔν(COO–) | –3 |
Для отнесения частот основных полос поглощения в ИК-спектрах исходных гидразидов и полученных комплексов (табл. 3, 4) использовали литературные данные для малеатов [1, 4, 13, 16, 26, 27], бензгидразида [28, 29] и фенилацетгидразида [30–33]. Как правило, связывание гидразидов через кислород приводит к понижению ν(C=O) [34–40]. В нашем случае ν(C=O) немного понижается для I и повышается для II. Это обусловлено присутствием ВС и в исходных гидразидах, и в синтезированных нами комплексах. Йенсен еще в 1956 г. доказал существование ВС для фенилацетгидразида не только в кристаллическом состоянии, но и в концентрированных растворах хлороформа [31]. За счет ВС частота ν(C=O) в ИК-спектрах исходных гидразидов понижается сильнее, чем в ИК-спектрах полученных комплексов. Поэтому следует сравнивать величины ν(C=O) в ИК-спектрах комплексов I и II с аналогичными значениями в ИК-спектрах исходных гидразидов в условиях, исключающих образование ВС. В соответствии с литературными данными величины ν(C=O) в ИК-спектрах гидразидов арилкарбоновых кислот без ВС находятся в области 1710–1695 см–1. Так, для газообразного бензгидразида полоса ν(C=O) проявляется при ~1700 см–1 [41]; квантово-химический расчет дал величину 1706 см–1 [42]. Для фенилацетгидразида ожидаемая частота полосы ν(C=О) должна быть ~1710 см–1 [31]. Авторы [43] исследовали ИК-спектры в криогенных условиях и провели квантово-химические расчеты для мономерной формы весьма близкого по строению к бензгидразиду изоникотингидразида. Согласно [43], расчетное значение ν(C=O) составляет 1697.0 см–1 (при 10 K (аргон) 1701.7 см–1, при 20 K (ксенон) 1695.1 см–1). Таким образом, сравнение величины ν(C=О) для исходных бензгидразида и фенилацетгидразида в отсутствие ВС, как и для полученных комплексов, показывает, что эта частота понижается довольно существенно и для I, и для II, что соответствует образованию связи металл–кислород. Присутствие ВС в исходных гидразидах и в изученных нами комплексах I, II сказывается также на изменении других полос поглощения, происходящем при комплексообразовании. Для ν(NH), ν(NH2) в ИК-спектре II происходит понижение частот, а в ИК-спектре I уменьшается их количество. Для ω(NH2) в обоих случаях происходит повышение с изменением числа полос. Значение ν(С–С) не меняется в ИК-спектре II и понижается с уменьшением числа полос в ИК-спектре I. Значения ν(CN) + ν(N–N) + τ(NH2) + δ(CСН) для обоих комплексов повышаются, при этом в спектре II триплет становится дублетом. Понижение частот валентных колебаний ν(NH) и повышение частот полос с вкладом ν(CN) обусловлено участием азота в образовании связи с металлами. В ИК-спектрах фенилацетгидразида присутствуют полосы группы СН2, для валентных колебаний которой при комплексообразовании возрастает разница между частотами νas(C–H) и νs(C–H), а частота деформационных колебаний не изменяется.
Таблица 4.
Волновые числа (частоты, см–1) максимумов полос поглощения в ИК-спектрах малеата никеля(II), фенилацетгидразида (L2) и [Ni(L2)3](Mal) · H2O (II)
| Отнесение | Ni(Mal) · 3H2O | L2 | II |
|---|---|---|---|
| ν(ОH) | 3443 | ||
| ν(NH), ν(NH2) | 3294, 3200 | 3209, 3161 | |
| νas(C–H) (CH2) | 3030 | 3068, 3033 | |
| νs(C–H) (CH2) | 2917 | 2859 | |
| ν(C=O) | 1644 | 1652 | |
| δ(NH2) | 1614 | ||
| νas(COO–) | 1551 | 1557 | |
| ν(С–С)аром. кольца | 1529 | 1530 | |
| δ(СH2) | 1455 | 1455 | |
| νs(COO–) | 1418 | 1430 | |
| δ(СН)плоск | 1440 пл | 1405 | |
| ω(NH2) | 1352, 1265 | 1360 | |
| ν(CN) + ν(N–N) + τ(NH2) + δ(CСН) | 1205, 1156, 1137 | 1217, 1172 | |
| νпульс. кольца + ρ(NH2) + τ(NH2) | 1074, 1007 | 1061, 1033 | |
| δ(СН)внеплоск | 999, 847 | 975, 857 | |
| ρ(CСН) + δ(CСН) | 773 | 769 | |
| δ(СNН) + δ(CСС) | 705, 623 | 697, 653, 632 | |
| δ(СCN) + δ(NСО) | 534 | ||
| Δν(COO–) | 133 | 127 | |
| ΔΔν(COO–) | –6 |
Таблица 5.
Параметры спектров диффузного отражения комплексов I и II
| Соединение | ν, см–1 | Отнесение |
|---|---|---|
| I | 20 200 | 4T1g(F) → 4T1g(P) |
| 6000 | 4T1g(F) → 4T2g | |
| II | 17 200 | 3A2g → 3T1g(P) |
| 10 700 | 3A2g → 3T2g |
Весьма незначительное изменение разностей частот асимметричных и симметричных колебаний группы COO– в обоих случаях, причем в сторону уменьшения, связано с внешнесферным характером малеат-аниона.
ЗАКЛЮЧЕНИЕ
Данные ИК-спектроскопии для комплексов I и II полностью согласуются с результатами РСА. СДО (табл. 5) характерны для октаэдрических комплексов кобальта(II) и никеля(II) [44 ] , что также соответствует результатам РСА.
ФИНАНСИРОВАНИЕ РАБОТЫРабота выполнена в рамках государственного задания ИОНХ РАН в области фундаментальных научных исследований.
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫТаблица S1. Геометрические параметры водородных связей (Å, град) для соединений I и II. Sif-файлы соединений I, II (№ 1898465 (I), 18898466 (II)).
Список литературы
Mahalakshmi V., Lincy A., Thomas J., Saban K.V. // Optik. 2014. V. 125. № 1. P. 191. https://doi.org/10.1016/j.ijleo.2013.06.081
Karuna S., Balu A.R., Muthu S. et al. // Mater. Sci. Poland. 2018. V. 35. № 4. P. 773. https://doi.org/10.1515/msp-2017-0095
Karuna S., Balu A.R., Shyamala D. et al. // Mater. Res. Innovations. 5 May 2017. P. 1. https://doi.org/10.1080/14328917.2017.1324378
Юданова Л.И., Логвиненко В.А., Юданов Н.Ф. и др. // Неорган. материалы. 2013. Т. 49. № 10. С. 1138.
Senthilkumar Ch., Jagan R., Rajesh P. et al. // J. Solid Chem. 2015. V. 230. P. 135. https://doi.org/10.1016/j.jssc.2015.06.035
Barman R.K., Chakrabarty R., Das B.K. // Polyhedron. 2002. V. 21. № 12–13. P. 1189.
Zhang C.-G., Leng Y.-J., Ma Z.-F. et al. // J. Chem. Crystallogr. 1999. V. 29. № 10. P. 1081.
Zheng Y.-Q., Lin J.-L., Kong Z.-P. et al. // J. Chem. Crystallogr. 2002. V. 32. № 10. P. 399.
Ruggiero M.T., Korter T.M. // Phys. Chem. Chem. Phys. 2016. V. 18. P. 5521. https://doi.org/10.1039/c5cp07760e
Li M., Fu X., Wang C. // Acta Crystallogr. 2006. V. 62E. P. m865. https://doi.org/10.1107/S1600536806010269
Pavlová A., Černák J., Harms K. // Acta Crystallogr. 2008. V. 64E. P. m1536. https://doi.org/10.1107/S1600536808036672
Mukherjee P.S., Konar S., Zangrando E. et al. // Inorg. Chem. 2003. V. 42. № 8. P. 2695. https://doi.org/10.1021/ic026150n
Yang J.M., Zhou Z.-H., Zhang H. // Inorg. Chim. Acta. 2005. V. 358. № 6. P. 1841. https://doi.org/10.1016/j.ica.2004.12.011
Xue Y.-H., Xu D.-J., Gu D.-J. // Acta Crystallogr. 2003. V. 59C. P. m387. https://doi.org/10.1107/S0108270103017785
Ghoshal D., Mostafa G., Kumar Maji T. // New J. Chem. 2004. V. 28. № 10. P. 1204. https://doi.org/10.1039/b401928h
Lu P., Wang Y.-Y., Li D.-S. et al. // Inorg. Chim. Acta. 2005. V. 358. № 13. P. 3807. https://doi.org/10.1016/j.ica.2005.05.028
Zheng Y.-Q., Kong Z.-P. // J. Coord. Chem. 2003. V. 56. № 11. P. 967. https://doi.org/10.1080/00958970310001353602
Li S.-L., Usman A., Razak I.A. et al. // Acta Crystallogr. 2003. V. 59C. P. m181. https://doi.org/10.1107/S0108270103006425
Li S.-L., Wu J.-Y., Tian Y.-P. et al. // Acta Crystallogr. 2005. V. 61E. P. m2701. https://doi.org/10.1107/S1600536805038353
Morales-Morales N., Rodríguez-Olivas M., Téllez-López A. et al. // J. Chem. Crystallogr. 11 Sep. 2018. https://doi.org/10.1007/s10870-018-0731-5
Farnum G.A., Martin D.P., Sposato L.K. et al. // Inorg. Chim. Acta. 2010. V. 363. № 1. P. 250. https://doi.org/10.1016/j.ica.2009.08.005
Кокшарова Т.В., Сергиенко В.С., Суражская М.Д. и др. // Журн. неорган. химии. 2017. Т. 62. № 12. С. 1576.
Koksharova T.V., Sergienko V.S., Surazhskaya M.D. et al. // Russ. J. Coord. Chem. 2018. V. 44. № 11. P. 678. https://doi.org/10.1134/S1070328418110040
Анцышкина А.С., Кокшарова Т.В., Садиков Г.Г. и др. // Журн. неорган. химии. 2016. Т. 61. № 4. С. 455.
Анцышкина А.С., Кокшарова Т.В., Сергиенко В.С. и др. // Журн. неорган. химии. 2014. Т. 59. № 12. С. 1665.
Накамото К. ИК спектры и спектры КР неорганических и координационных соединений / Пер. с англ. под ред. Пентина Ю.А. М.: Мир, 1991. Rao S.N., Reddy Y.P., Rao P.S. // Solid State Comm. 1991. V. 76. № 12. P. 1025. https://doi.org/10.1016/0038-1098(91)90122-c
Dodoff N., Grancharov K., Gugova R., Spassovska N. // J. Inorg. Biochem. 1994. V. 54. № 3. P. 221. https://doi.org/10.1016/0162-0134(94)80015-4
Титов Е.В., Греков А.П., Рыбаченко В.И., Шевченко В.В. // Теор. эксп. химия. 1968. Т. 4. № 6. С. 742.
Odunola O.A., Adeoye I.O., Woods J.A.O. // Synth. React. Inorg. Metal-Org. Chem. 2002. V. 32. № 4. P. 801. https://doi.org/org/10.1081/SIM-120004447
Jensen J.B. // Acta Chem. Scand. 1956. V. 10. № 4. P. 667. https://doi.org/org/10.3891/acta.chem.scand.10-0667
Гордон А., Форд Р. Спутник химика / Пер. с англ. Розенберга Е.Л., Коппель С.И. М.: Мир, 1976.
Ul Ain Q., Ashiq U., Ara J.R. et al. // Arab. J. Chem. 2017. V. 1. № 4. P. 488. https://doi.org/org/10.1016/j.arabjc. 2015.02.024
Odunola O.A., Adeoye I.O., Woods J.A.O., Gelebe A.C. // Synth. React. Inorg. Metal-Org. Chem. 2003. V. 33. № 2. P. 205. https://doi.org/10.1081/SIM-120017781
Issa R.M., El-Shazly M.F., Iskander M.F. // Z. Anorg. Allg. Chem. 1967. V. 354. № 1–2. P. 90. https://doi.org/org/10.1002/zaac.19673540118
Zidan A.S.A. // Synth. React. Inorg. Metal-Org. Chem. 2004. V. 34. № 4. P. 743. https://doi.org/org/10.1081/sim-120035954
Гогоришвили П.В., Каркарашвили М.В., Каландаришвили Д.З. // Журн. неорган. химии. 1969. Т. 14. № 6. С. 1516.
Dutta A.A., Chaudhuri N.R. // J. Inorg. Nucl. Chem. 1971. V. 33. № 1. P. 189. https://doi.org/org/10.1016/0022-1902(71)80021-0
Narang K.K., Singh M. // Synth. React. Inorg. Metal-Org. Chem. 1985. V. 15. № 6. P. 821. https://doi.org/org/10.1080/00945718508060598
Narang K.K., Pandey J.P., Singh K.P., Rai P.K. // Synth. React. Inorg. Metal-Org. Chem. 1990. V. 20. № 10. P. 1301. https://doi.org/org/10.1080/00945719008048635
NIST (National Institute of Standards and Technology) Standard Reference Data Program Collection (C), 2009.
Arjunan V., Rani T., Mythili C.V., Mohan S. // Spectrochim. Acta. 2011. V. 79A. № 3. P. 486. https://doi.org/10.1016/j.saa.2011.03.018
Borba A., Gómez-Zavaglia A., Fausto R. // J. Phys. Chem. A. 2009. V. 113. № 32. P. 9220. https://doi.org/10.1021/jp9037914
Ливер Э. Электронная спектроскопия неорганических соединений. Т. 2 / Пер. с англ. под ред. Цивадзе А.Ю. М.: Мир, 1987.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии