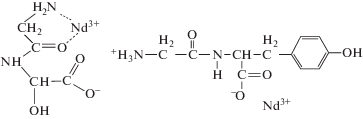Журнал неорганической химии, 2019, T. 64, № 11, стр. 1224-1228
Термодинамика реакций комплексообразования ионов Nd3+ и Eu3+ с глицил-DL-аланином, глицил-DL-лейцином и глицил-DL-тирозином в водном растворе в интервале рН 1.6–7.5
А. И. Лыткин 1, В. В. Черников 1, О. Н. Крутова 1, *, П. Д. Крутов 1
1 Ивановский государственный химико-технологический университет
153000 Иваново, Шереметевский пр-т, Россия
* E-mail: kdvkonkpd@yandex.ru
Поступила в редакцию 01.03.2019
После доработки 25.04.2019
Принята к публикации 13.05.2019
Аннотация
Калориметрическим методом определены энтальпии комплексообразования ряда дипептидов: глицил-DL-аланина, глицил-DL-лейцина и глицил-DL-тирозина (HL±) c ионами Nd3+ и Eu3+ при 298.15 K и значениях ионной силы 0.1 (фоновый электролит KNO3). Рассчитаны термодинамические характеристики реакций образования комплексов указанных дипептидов с ионами Nd3+ и Eu3+ состава LnL2+ и LnHL3+ при различных мольных соотношениях [металл] : [лиганд] в интервале рН 1.6–7.5. На основании анализа полученных термодинамических параметров сделано заключение о структуре изучаемых комплексов.
ВВЕДЕНИЕ
В последнее время наметился значительный прогресс в координационной химии лантаноидов [1]. Возрождение интереса связано с возможностью использования реагентов на основе лантаноидов в ряде областей медицины, а также при исследовании новых материалов [2, 3]. В качестве объектов исследования выбраны три дипептида глицинового ряда, так как наша работа продолжает изучение процессов комплексообразования различных биолигандов с лантаноидами [4, 5].
В литературе имеются данные по константам образования комплексов ионов Nd3+ и Eu3+ с глицил-DL-аланином, глицил-DL-лейцином и глицил-DL-тирозином [6], константы устойчивости комплексов Nd, Eu, Gd, Ho и Yb с некоторыми ди- и трипептидами были определены методом потенциометрического титрования. Исследования проводили в термостатируемой стеклянной ячейке со стеклянным электродом типа GA-50 при 25 ± 0.1°С, I = 0.1 (хлорид калия) и соотношениях [металл] : [лиганд] = 2 : 1 и 4 : 1. Авторами получены значения констант для комплексов МeL с участием глицил-DL-аланина, глицил-DL-лейцина и комплексов МeНL с глицил-DL-тирозином в качестве лиганда.
В литературе отсутствуют данные по определению энтальпий образования комплексов ионов Nd3+ и Eu3+ с глицил-DL-аланином, глицил-DL-лейцином и глицил-DL-тирозином в водном растворе.
Цель настоящей работы – прямое калориметрическое определение энтальпий процессов комплексообразования Nd3+ и Eu3+ с глицил-DL-аланином, глицил-DL-лейцином и глицил-DL-тирозином при 298.15 K, I = 0.1 (на фоне нитрата калия) и различных мольных соотношениях [металл] : [лиганд], а также расчет термодинамических характеристик изучаемых процессов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали кристаллические препараты глицил-DL-аланина, глицил-DL-лейцина и глицил-DL-тирозина (все ≥99%) фирмы “Sigma” (США) без дополнительной очистки. Бескарбонатные растворы KОН и раствор HNO3 готовили по обычной методике [7] из реактивов марки “х. ч.”; концентрацию растворов устанавливали обычными титриметрическими методами. Растворы нитратов Nd3+ и Eu3+ готовили из перекристаллизованных препаратов марки “х. ч.”. Концентрацию Nd3+ и Eu3+ в растворе определяли комплексонометрическим методом [8]. Для поддержания заданного значения ионной силы использовали перекристаллизованный нитрат калия марки “х. ч.”.
Измерения проводили в калориметре с изотермической оболочкой, оснащенном реакционным сосудом объемом 60 см3, с электрической калибровкой при t = (293.15–308.15) ± 0.01 K и P = 100.5 ± ± 0.7 кПа и автоматической записью кривой температура–время [9]. В качестве датчика температуры использовали термистор КМТ-14. Термостатирование калориметрической ячейки осуществляли в термостате, снабженном ПИД-регулятором, с точностью 0.002 K. Датчиком температуры термостата служил платиновый термометр сопротивления. Калориметр калибровали по току. Объем калориметрической жидкости – 42.83 мл, рабочий объем ампулы – 1–1.6 см3, максимальная термометрическая чувствительность калориметрической установки – (0.5–2) × 10–2 Дж/мм шкалы самописца. Относительная погрешность определения теплоты растворения стандартного вещества составляла 0.1–0.3%. Навески взвешивали на весах ВЛР-200 с точностью 2 × 10–4 г. Работу установки проверяли по интегральным энтальпиям растворения в воде кристаллического хлорида калия и считали ее пригодной для измерения, если определенная в ней величина ΔsolН298.15(КСl ∞ ∞ Н2О) отличалась от стандартной не более чем на 0.3%. В качестве стандартной использовали наиболее надежную в настоящее время величину ΔsolН298.15(КСl ∞ Н2О) = –17.234 ± 0.018 кДж/моль, соответствующую стандарту SRM 1655NBS [10]. Тепловое значение калориметра для воды составляло 87 ± 12 Дж/K [11].
Экспериментально измеряли энтальпии процессов образования комплексных частиц в системе Nd3+ и Eu3+ с глицил-DL-аланином, глицил-DL-лейцином и глицил-DL-тирозином при температуре 298.15 K и значениях ионной силы 0.1 (KNO3). Величину рН контролировали с помощью прибора “Мультитест” ИПЛ-311. Совпадение расчетных и экспериментальных значений рН свидетельствовало о правильности выбора концентрационных условий проведения калориметрического эксперимента.
Расчет энтальпий образования комплексов Nd3+ или Eu3+ с дипептидами выполняли по программе “HEAT”, алгоритм которой описан в работах [12, 13].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В изучаемой системе возможно протекание следующих реакций:
(1а)
${\text{N}}{{{\text{d}}}^{{3 + }}} + {\text{ Н}}{{{\text{L}}}^{ \pm }} = {\text{ }}{{[{\text{NdНL}}]}^{{3 + }}},$(2)
${\text{N}}{{{\text{d}}}^{{3 + }}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} = {\text{NdO}}{{{\text{H}}}^{{2 + }}} + {{{\text{H}}}^{ + }},$Аналогичные реакции протекают в системе ион Eu3+–дипептид. Процесс (1а) относится к взаимодействию Nd3+ или Eu3+ с глицил-DL-тирозином.
Чтобы подобрать необходимые условия для проведения калориметрического опыта, был выполнен предварительный расчет по программе “KEV” [13] с учетом всех протекающих процессов в системе (1)–(5). На основании результатов расчета построены зависимости равновесной концентрации частиц в растворе от рН при различных соотношениях [металл] : [лиганд]. Измерен суммарный тепловой эффект. Вклад процесса (2) в суммарный тепловой эффект не превышал 8%.
В калориметрический стакан помещали раствор нитрата неодима(III) или нитрата европия(III) концентрации 0.004736 моль/л объемом 40.02 мл с заданным значением ионной силы. В ампуле находился раствор KPep исходной концентрации 0.41152 моль/кг раствора. Были также измерены теплоты разведения KPep в растворах фонового электролита. Экспериментальные данные по суммарным тепловым эффектам для систем глицил–DL-аланин–неодим(III) (европий(III)) представлены в табл. 1 и 2 соответственно.
Таблица 1.
Тепловые эффекты взаимодействия Nd(NО3)3 (концентрация 0.004763 моль/л раствора) с растворами KРер (исходная концентрация 0.4325 моль/кг раствора глицил-DL-аланина) при 298 K и ионной силе I = 0.1
| m(KРер), г | с0(H) × 10–5, моль/л | с0(Рер) × 10–3, моль/л | с0(Nd) × 10–3, моль/л | –ΔmixH, кДж/моль |
|---|---|---|---|---|
| 0.1017 | 1.4770 | 1.1322 | 32.00 ± 0.20 | |
| 0.1037 | 1.4137 | 1.0798 | 4.7630 | 32.41 ± 0.27 |
| 0.1062 | 1.4327 | 1.0954 | 32.62 ± 0.25 | |
| 0.2025 | 2.6337 | 2.0826 | 33.01 ± 0.18 | |
| 0.2035 | 2.6780 | 2.1191 | 4.7680 | 33.22 ± 0.28 |
| 0.2067 | 2.7192 | 2.15294 | 33.26 ± 0.22 | |
| 0.3002 | 3.7037 | 3.1265 | 33.45 ± 0.25 | |
| 0.3101 | 3.8291 | 3.2296 | 4.7860 | 34.12 ± 0.21 |
| 0.3697 | 3.9281 | 3.2255 | 34.51 ± 0.23 | |
| 0.4172 | 6.7593 | 4.2408 | 35.12 ± 0.20 | |
| 0.4252 | 6.8339 | 4.2199 | 4.7892 | 35.44 ± 0.25 |
| 0.4361 | 6.9317 | 4.3345 | 36.16 ± 0.22 |
Таблица 2.
Тепловые эффекты взаимодействия Eu(NО3)3 (концентрация 0.004698 моль/л раствора) с растворами KРер (исходная концентрация 0.4352 моль/кг раствора глицил-DL-аланина) при 298 K и ионной силе I = 0.1
| m(KРер), г | с0(H) × 10–5, моль/л | с0(Рер) × 10–3, моль/л | с0(Eu) × 10–3, моль/л | –ΔmixH, кДж/моль |
|---|---|---|---|---|
| 0.1027 | 1.2017 | 1.0699 | 36.0 ± 0.25 | |
| 0.1061 | 1.2445 | 1.1050 | 4.6920 | 36.62 ± 0.27 |
| 0.1052 | 1.3595 | 1.1997 | 37.01 ± 0.22 | |
| 0.2254 | 2.8288 | 2.2430 | 37.52 ± 0.15 | |
| 0.2264 | 2.8681 | 2.3575 | 4.6960 | 38.31 ± 0.28 |
| 0.2237 | 2.9079 | 2.2258 | 39.15 ± 0.20 | |
| 0.3552 | 4.5465 | 3.4905 | 39.81 ± 0.25 | |
| 0.3522 | 4.5818 | 3.3551 | 4.6950 | 40.48 ± 0.22 |
| 0.3541 | 4.3326 | 3.4790 | 40.53 ± 0.21 | |
| 0.4120 | 6.8194 | 4.2902 | 41.42 ± 0.25 | |
| 0.4125 | 6.8738 | 4.1705 | 4.6982 | 41.35 ± 0.29 |
| 0.4122 | 6.9206 | 4.1679 | 41.80 ± 0.28 |
На основании полученного массива данных рассчитывали теплоты реакций комплексообразования, удовлетворяющие минимуму функции:
(6)
$F = \sum\limits_{i = 1}^n {\left( {{{\Delta }_{r}}H_{i}^{{{\text{эксп}}}} - {{\Delta }_{r}}H_{i}^{{{\text{расч}}}}} \right)\omega _{i}^{2}} \to \min ,$(7)
$\begin{gathered} {{\Delta }_{r}}H_{i}^{{{\text{расч}}}} = {\text{ }}(\Delta [{\text{H}}{{{\text{L}}}^{ \pm }}]{{\Delta }_{r}}{{H}_{3}} + \Delta [{\text{Nd}}{{{\text{L}}}^{{2 + }}}]{{\Delta }_{r}}{{H}_{1}} + \\ + \,\,\Delta [{\text{NdО}}{{{\text{Н}}}^{{2 + }}}]{{\Delta }_{r}}{{H}_{2}} + \Delta [{\text{O}}{{{\text{H}}}^{--}}]{{\Delta }_{r}}{{H}_{{\text{w}}}}), \\ \end{gathered} $(8)
${{\omega }_{i}} = {A \mathord{\left/ {\vphantom {A {\sigma _{i}^{2}}}} \right. \kern-0em} {\sigma _{i}^{2}}},$Расчет энтальпий реакций образования выполняли по программе “HEAT” [13]. На основании экспериментальных данных были рассчитаны среднеарифметические значения тепловых эффектов по результатам трех–четырех опытов. Для расчета доверительного интервала среднего значения ΔН критерий Стьюдента tα = 3.18 был взят при доверительной вероятности 0.95.
Наиболее вероятные значения констант ступенчатой диссоциации глицил-DL-аланина, глицил-DL-лейцина и глицил-DL-тирозина представлены в работах [14–20], измерения были выполнены при Т = 298.15 K, I = 0.1 (KNO3). Гидролиз ионов Nd3+ и Eu3+ и энтальпии процесса (2) учитывали по данным [21], энтальпии процессов кислотно-основного взаимодействия в растворах глицил-DL-аланина, глицил-DL-лейцина и глицил-DL-тирозина – по данным [22, 23], термодинамические параметры диссоциации воды взяты из работы [24].
Термодинамические характеристики процессов комплексообразования Nd3+ и Eu3+ с глицил-DL-аланином, глицил-DL-лейцином и глицил-DL-тирозином в водном растворе найдены при совместном использовании результатов термохимических измерений и данных по константам комплексообразования (табл. 3).
Таблица 3.
Термодинамические характеристики образования комплексов Nd3+ и Eu3+ с глицил-DL-аланином (L), глицил-DL-лейцином (L*) и глицил-DL-тирозином (L**) при I = 0.1 (нитрат калия) и Т = 298.15 K
| Процесс | lg β | –ΔrH, кДж/моль | ΔrS, Дж/(моль K) |
|---|---|---|---|
| Nd3+ + L– = NdL2+ | 2.30 ± 0.05 | 3.51 ± 0.33 | 32.3 ± 2.3 |
| Nd3+ + L–* = NdL2+* | 2.40 ± 0.05 | 4.21 ± 0.33 | 31.8 ± 2.3 |
| Nd3+ + L–** = NdНL2+** | 2.70 ± 0.05 | 2.01 ± 0.33 | 44.9 ± 2.3 |
| Eu3+ + L– = EuL2+ | 2.60 ± 0.05 | 3.91 ± 0.33 | 36.6 ± 2.3 |
| Eu3+ + L–* = EuL2+* | 2.45 ± 0.05 | 4.52 ± 0.33 | 31.7 ± 2.3 |
| Eu3+ + L–** = EuНL2+** | 2.85 ± 0.05 | 2.41 ± 0.33 | 46.5 ± 2.3 |
Строение дипептидов обусловливает возможность образования самых различных форм комплексных соединений с ионами металлов [25–30]. Так, по данным рентгеноструктурного анализа, только карбоксильная группа может давать девять форм связывания молекулы с ионом металла. Присутствие аминогруппы позволяет образовывать хелатные комплексы, а при наличии дополнительных донорных групп в боковой цепи количество возможных форм возрастает.
Для комплексов Nd3+ и Eu3+ с глицил-DL-аланином и глицил-DL-лейцином наиболее вероятный тип координации – через атом азота аминогруппы глицинового остатка дипептида и атом кислорода пептидной связи; образуется пятичленный хелатный узел (рис. 1). Для f-элементов поведение при комплексообразовании аналогично d-элементам, и данный тип координации, когда ион металла способен вытеснить протон аминогруппы, был отмечен в работах [31, 32]. Для комплексов Nd3+ и Eu3+ с глицил-DL-тирозином образование комплекса состава [LnНL]3+ обусловлено наличием фенольного кольца в молекуле дипептида. Небольшие энтальпии процессов (1a) (табл. 3) свидетельствуют о монодентатной координации пептида при образовании комплексов [LnНL]3+ с участием карбоксильных групп пептида. При протонировании комплекса связи по азоту аминогруппы блокируются, и координация идет только по кислороду карбоксильной группы, что вызывает изменение энтальпийных характеристик по сравнению с комплексами состава LnL2+. Предположение о возможной координации лиганда в комплексе [LnНL]3+ посредством карбоксильной группы и двух атомов кислорода пептидных групп не подтверждается полученными нами термодинамическими данными. Изученные ранее [33 ] процессы комплексообразования с дикарбоновыми кислотами с формированием 6- и 7-членных циклов при участии ацидогрупп более эндотермичны по сравнению с процессом (1a) и сопровождаются положительными величинами ΔrS° ∼ 150 Дж/(моль K).
Список литературы
Kremera C., Torresa J., Dom’ınguezb S. et al. // Coord. Chem. Rev. 2005. V. 249. P. 567. https://doi.org/10.1016/j.ccr.2004.07.004
Woods M., Kovacs Z., Sherr A.D. // J. Supramolecular Chem. 2002. V. 2. P. 1. https://doi.org/10.1016/S1472-7862(02)00072-2
Bianchi A., Calabi L., Corana F. et al. // Coord. Chem. Rev. 2000. V. 204. P. 309. https://doi.org/10.1016/S0010-8545(99)00237-4
Лыткин А.И., Черников В.В., Крутова О.Н. и др. // Журн. общ. химии. 2018. Т. 88. № 5. С. 811.
Лыткин А.И., Черников В.В., Крутова О.Н. и др. // Журн. физ. химии. 2017. Т. 91. № 6. С. 986.
Feige P., Mocker D., Dreyer R. et al. // J. Inorg. Nucl. Chem. 1973. V. 35. № 9. P. 3269. https://doi.org/10.1016/0022-1902(73)80029-6
Коростелев П.П. Приготовление растворов для химико-аналитических работ. М.: Изд-во АН СССР, 1962. С. 398.
Васильев В.П., Морозова Р.П., Кочергина Л.А. Аналитическая химия. Лабораторный практикум. М.: Дрофа, 2004. 328 с.
Lytkin A.I., Chernikov V.V., Krutova O.N. et al. // J. Therm. Anal. Calorim. 2017. V. 130. P. 457.
Kilday M.V. // J. Research. N. B. S. 1980. V. 85. № 6. P. 467.
Скуратов С.М., Колесов В.П., Воробьев А.Ф. // Термохимия. Ч. 1. М.: Изд-во МГУ, 1964. С. 300.
Васильев В.П., Бородин В.А., Козловский Е.В. Применение ЭВМ в химико-аналитических расчетах. М.: Высш. школа, 1993. С. 81.
Meshkov A.N., Gamov G.A. // Talanta. 2019. V. 198. P. 200. https://doi.org/10.1016/j.talanta.2019.01.107
Nair M., Subbalakshmi G. // J. Indian Chem. Soc. 2000. V. 122. № 33. P. 8091. https://doi.org/10.1021/ja000502c
Shoukry M., Khairy E., El-Sherif A. // Trans. Met. Chem. 2002. V. 27. № 6. P. 656. https://doi.org/10.1023/A:1019831618658
Conato C., Ferrari S., Remell M. // Polyhedron. 2001. V. 20. № 7–8. P. 615. https://doi.org/10.1016/S0277-5387(01)00713-6
Pallade D., Gannova Y. // Coord. Chem. 2003. V. 29. № 2. P. 110. https://doi.org/10.1023/A:1022338101679
Mohamed M. // J. Coord. Chem. 2003. V. 56. № 9. P. 745. https://doi.org/10.1080/0095897031000110619
El-Sherif A., Shoukry M., Edlik R. // J. Chem. Soc., Dalton Trans. 2003. № 7. P. 1425. https://doi.org/10.1039/B212104B
Nair M., Subbalakshmi G. // Indian J. Chem. 2000. V. 39A. P. 468.
Назаренко В.А., Антонович В.П., Невская Е.М. Гидролиз ионов металлов в разбавленных растворах. М.: Атомиздат, 1978. С. 46.
Лыткин А.И., Черников В.В., Крутова О.Н. и др. // Журн. физ. химии. 2016. Т. 90. № 4. С. 513.
Gridchin S.N. // Russ. J. Phys. Chem. A. 2016. Т. 90. № 11. С. 2170.
Васильев В.П., Шеханова Л.Д. Калориметрическое определение теплоты ионизации воды в присутствии различных электролитов // Журн. неорган. химии. 1974. Т. 19. № 11. С. 2969.
Горболетова Г.Г., Метлин А.А., Бычкова С.А. // Журн. физ. химии. 2018. Т. 92. № 5. С. 684.
Горболетова Г.Г., Метлин А.А. // Журн. физ. химии. 2018. Т. 92. № 11. С. 1720.
Cisnetti F., Lebrun C., Delangle P. // Dalton Trans. 2010. V. 39. P. 3560. https://doi.org/10.1039/c003060k
Prell J.S., Flick T.G., Oomen J. et al. // J. Phys. Chem. A. 2010. V. 114. P. 854.
Илакин В.С., Штырлин В.Г., Захаров А.В., Конькин А.Л. // Журн. общ. химии. 2002. Т. 72. № 3. С. 377.
Nagy N.V., Szabo-Planka T., Rockenbauer A. // J. Am. Chem. Soc. 2003. V. 125. P. 5227.
Ciunik Z. Clowaiak T. // Inorg. Chim. Acta. V. 44. № 1. P. 249. https://doi.org/10.1016/S0020-1693(00)91023-5
Davies H.O., Cillard R.D., Hursthouse M.B., Lehman A. // Chem. Soc. Chem. Commun. 1993. № 9. P. 1137. https://doi.org/10.1039/c39930001137
Орлова Т.Д., Катровцева А.В., Бычкова С.А., Фам Тхи Лан // Журн. физ. химии. 2011. Т. 85. № 2. С. 275.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии