Химическая физика, 2023, T. 42, № 4, стр. 81-88
Твердые продукты захвата NO2 и O3 на покрытии из метановой сажи
А. А. Еганов 1, Д. А. Кардонский 1, И. В. Сулименков 2, В. И. Козловский 2, Е. В. Апарина 2, В. В. Зеленов 2, *
1 Первый московский государственный медицинский университет им. И.М. Сеченова
Москва, Россия
2 Федеральный исследовательский центр химической физики им. Н.Н. Семёнова Российской академии наук
Москва, Россия
* E-mail: v.zelenov48@gmail.com
Поступила в редакцию 15.04.2022
После доработки 17.06.2022
Принята к публикации 20.06.2022
- EDN: MWMISN
- DOI: 10.31857/S0207401X23040064
Аннотация
С использованием проточного реактора с подвижной вставкой и масс-спектрометрическим контролем газового состава была проведена обработка образцов метановой сажи реагентами O3 и NO2 до момента полного прекращения их захвата поверхностью. Анализ растворов исходной метановой сажи и твердых продуктов ее реакции с окисляющими реагентами O3 и NO2 в ацетонитриле проводился с использованием масс-спектрометрии высокого разрешения с электроспрейным ионным источником и газовой хроматографии–масс-спектрометрии с электронной ионизацией. Установлено, что исходная сажа содержит ряд ароматических соединений, включая и полициклические, которые полностью расходуются в реакции с этими окислителями. Соединения из класса парафинов остаются инертными по отношению к NO2 и О3. В качественном отношении продукты нитрования и озонирования одинаковы как по своему составу, так и по содержанию основных функциональных групп. Количество продуктов озонирования значительно больше аналогичных продуктов нитрования. Это является причиной высокой реакционной способности нитрованной сажи по отношению к захвату озона.
ВВЕДЕНИЕ
Окислы азота NOx и озон как следовые газы с относительными концентрациями ∼40–70 ppb [1, 2] являются эффективными окислителями земной атмосферы. Источниками окислов азота в тропосфере служат грозовые разряды, потоки закиси азота от поверхности Земли, газофазные фотохимические реакции с участием озона, процессы горения биомасс и природных топлив [3]. Озон в тропосфере образуется в циклах фотохимических реакций с участием OH, NOx и различных органических компаундов; дополнительный вклад вносят грозовые разряды и интрузия O3 из стратосферы [4–8].
Твердые аэрозоли смешанного состава с частицами микронного и субмикронного размеров: PM2.5–PM10, широко распространены в атмосфере. Средняя масса аэрозоля в тропосфере составляет около 15 мкг · м–3, а в особо загрязненных густонаселенных регионах она достигает 200 мкг · м–3 и более [9, 10]. Бóльшую часть твердого органического аэрозоля составляет сажа, происхождение которой связано с горением биомасс и топлив различных технических устройств [11, 12]. На основе полевых измерений и моделирования средняя глобальная эмиссия сажевого аэрозоля оценивается в 6.6–11.6 Тг · год–1, а концентрация субмикронных частиц углерода в воздухе – ∼0.6 мкг · м–3 [13–15].
В лабораторных исследованиях процессов горения различных топлив установлено, что сажа представляет собой некий углеродный остов, в составе которого и на поверхности находятся функциональные группы, содержащие атомы C, H и O. Это алканы, алкены, алкины, ароматические, карбонильные и эфирные группы в различных соотношениях, в зависимости от вида топлива и состава топливовоздушной смеси [16–18]. Кроме того, сажа содержит также полициклические ароматические углеводороды (ПАУ), или арены, которые состоят из нескольких сопряженных бензольных колец, содержащих только атомы С и Н в различных конфигурациях [19–21]. В условиях неполного сгорания вначале происходит формирование частиц размером 5–10 нм вследствие реактивной коагуляции молекул ПАУ [22–25]. Системы горения топлив производят значительные количества ПАУ, которые оказывают вредное воздействие на здоровье человека [26]. В атмосфере при взаимодействии ПАУ с активными газовыми компонентами, а также при высокотемпературном горении возможно образование еще более токсичных продуктов – нитро-ПАУ и окси-ПАУ, которые вызывают рост опухолей и повреждение биомолекул в живых организмах [27, 28].
К настоящему времени имеется много лабораторных исследований по захвату NO2 и O3 на различных типах покрытий из сажевых субстратов, включая электроискровую сажу (черный углерод), свечную сажу, сажу горения этилена, толуола, гексана, керосина и т.п. В большинстве случаев используемые методики позволяли определять коэффициенты захвата и регистрировать газофазные продукты. Гораздо меньше работ связано с исследованием поверхности сажи и определением состава твердых продуктов таких процессов захвата [29, 30]. Для идентификации поверхностных групп использовали ИК- и УФ-спектроскопию, ЭПР, газовую хроматографию с масс-спектрометрией электронного удара или фотоионизацией. В частности, было установлено, что при горении этилен-кислородного пламени кроме алифатических групп образуется значительное количество аренов, содержащих от 16 до 30 атомов углерода [23]. Данные, получаемые с применением различных методик, позволяют составить цельную картину гетерогенного взаимодействия газ – твердое тело и моделировать в дальнейшем конкретные процессы захвата активных атмосферных газов на твердом тропосферном аэрозоле. В лабораторных исследованиях по изучению захвата газовых реагентов NO2, HNO3, O3 на покрытиях из сажи горения различных топлив установлено, что в таких процессах расходуются активные поверхностные центры сажи. Это приводит к изменению состава и структуры поверхности и образованию функциональных групп R–NO2, R–ONO, R–ONO2, C–N–NO2, C–O, C=O [31–34].
При исследовании захвата NO2 и O3 на покрытии из метановой сажи нами ранее был получен ряд элементарных параметров, описывающих процесс захвата, и на базе лэнгмюровской концепции конкурентной адсорбции предложен механизм захвата с учетом многостадийности этого процесса. Было показано, что сажа после ее нитрования реагентом NO2 до полного прекращения захвата последнего остается реакционноспособной по отношению к озону [35]. Таким образом, вследствие конкурентной адсорбции в условиях тропосферы должен существовать дополнительный канал стока озона на продуктах захвата конкурирующего реагента. При типичном соотношении концентраций NO2/O3 для промышленно развитого региона в зимнее время [1] этот дополнительный интегральный вклад в захват озона должен составлять до 70% от основного канала стока.
С целью выяснения различия в реакционной способности сажи к этим реагентам в настоящей работе проведен сравнительный анализ твердых продуктов захвата NO2 и O3 на покрытии из метановой сажи. С этой же целью был проанализирован состав твердых продуктов озонирования сажи после ее предварительного нитрования реагентом NO2.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Анализ исходной необработанной сажи и твердых продуктов ее реакций с NO2 и O3 проводили с использованием масс-спектрометра высокого разрешения Exactive Orbitrap производства компании ThermoFisher Scientific (Germany) c электроспрейным ионным источником, а также тандемного прибора газовой хроматографии–масс-спектрометрии (ГХ–МС) GCMS-QP2010Ultra производства компании Shimadzu (Japan) c ионизацией электронным ударом. Наработку твердых продуктов захвата этих реагентов на пленочном покрытии из метановой сажи проводили в процессе исследования кинетики их захвата в проточном реакторе с подвижной вставкой и нанесенным на нее исходным сажевым покрытием. Реактор сопряжен с секторным магнитным масс-спектрометром высокого разрешения. Подробное описание установки дано в работе [35]. Время окончания обработки определяли по прекращению дальнейшего захвата реагентов NO2 или О3 и контролировали по интенсивности масс-спектральных линий с m/z = 46 и 48 соответственно.
В качестве источника сажи использовали лабораторную горелку, присоединенную к газовой магистрали, без дополнительной подачи окисляющего агента. Сажу наносили на стержень из нержавеющей стали, который располагали на расстоянии 15–17 см от основания пламени и вращали его вручную в процессе осаждения сажи. Стержень с нанесенной сажей сразу вставляли в реактор и до проведения эксперимента оставляли под вакуумом при ∼10–4 Торр. После проведения эксперимента прореагировавшую сажу смывали ацетонитрилом марки “ЧДА” объемом ∼20 мл и центрифугировали.
Условия регистрации хроматограмм: газовый хромато-масс-спектрометр GCMS-QP2010Ultra с капиллярной колонкой GsBP-5MS (длина – 30 м, диаметр – 0.25 мм, толщина фазы – 0.25 мкм). Начальная температура колонки – 70 °С, выдержка – 2 мин с последующим нагревом со скоростью 20 °С мин–1 до 280 °С и конечной выдержкой в течение 15 мин. Газ-носитель − гелий. Скорость потока газа-носителя – 1 мл · мин–1. Температура квадрупольного анализатора – 150 °С. Температура ионного источника – 230 °С. Время включения катодов и анализатора (“задержка на растворитель”) – через 3.51 мин после ввода пробы. Диапазон сканируемых величин отношения массы m иона к его заряду z равен 50−750.
Условия регистрации масс-спектров высокого разрешения: масс-спектрометр Exactive Orbitrap с интерфейсом типа ионная воронка, температура входного капилляра масс-спектрометра – 150 °С. Для анализа ионов из приготовленных растворов (концентрация образца в ацетонитриле – 25 мг · л–1) использовался атмосферный электроспрейный ионный источник [36] со шприцевой подачей раствора (скорость выхода раствора – 1 мкл · мин–1, внутренний диаметр кварцевого капилляра – 100 мкм, величина напряжения между кварцевым капилляром и входным капилляром масс-спектрометра – около 3 кВ). Величина рабочего разрешения масс-спектрометра составляла около 10 000 (отношение значения m/z ионного пика к его ширине на половине высоты). Относительная погрешность определения величины m/z составляла 2 · 10–6.
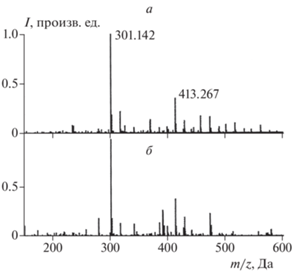
На рис. 1 приведены масс-спектры высокого разрешения положительно заряженных ионов, полученные методом электроспрея при атмосферном давлении. В этом методе ионизации образуются квазимолекулярные ионы, которые получаются при присоединении к молекуле либо протона, либо иона щелочного металла (калия или натрия). Источником щелочных металлов служит используемый растворитель, в который ионы щелочных металлов попадают при его производстве или хранении в стеклянной лабораторной посуде. Основными побочными компонентами анализируемого раствора образца являются также фталаты: дибутилфталат (DBPh), диоктилфталат (DOPh) и их производные. Эти вещества содержатся в качестве пластификаторов в материале лабораторного пластикового оборудования – ампулах для хранения образцов и капиллярах подачи образцов в электроспрейный ионный источник. Так, на рис. 1, как и во всех других масс-спектрах, наиболее интенсивными являются линии ионов [DBPh+Na]+ (m/z = 301.142) и [DOPh+Na]+ (m/z = 413.267). Эти компоненты масс-спектра, общие для всех образцов, были исключены при дальнейшем анализе состава продуктов.
Рис. 1.
Масс-спектры высокого разрешения в положительных ионах: а – сажа после экспозиции к NO2; б – сажа после экспозиции к O3.
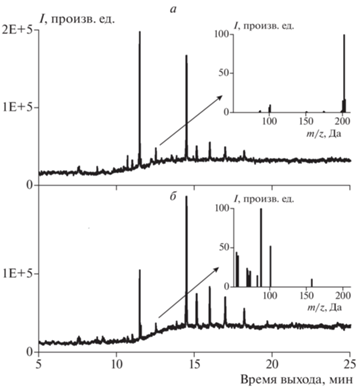
При анализе состава продуктов методом ГХ–МС (рис. 2) во всех хроматограммах наиболее интенсивные пики с временами выхода 14.495, 15.14, 15.975, 16.975, 18.195 мин относят также к фталатам. Эти побочные компоненты легко выявляются по их характерным масс-спектрам электронного удара с доминирующим пиком m/z = 149 и исключаются из рассмотрения при анализе состава продуктов.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Результаты хроматографического анализа состава продуктов приведены в табл. 1. Идентификацию веществ проводили по восьми наиболее интенсивным пикам, учитывая соотношение их интенсивностей. Это позволяет практически однозначно определять искомое соединение. Так, в качестве иллюстрации на вставках рис. 2 приведены масс-спектры пирена и эфира карбоновой кислоты с одним и тем же временем выхода хроматографического пика продуктов исходной сажи и продуктов ее нитрования. Исключение составляет ряд классов веществ, таких как парафины и фталаты. Масс-спектры электронного удара этих соединений внутри своих классов очень похожи по составу и соотношению интенсивностей осколочных ионов. В последнем столбце табл. 1 приведены идентификационные номера соответствующих веществ из базы данных NIST [37]. Из данных этой таблицы следует, что исходная сажа содержит ряд ароматических соединений, включая и полициклические, которые полностью расходуются в реакции с NO2 и O3. В целом количество продуктов озонирования больше по сравнению с продуктами нитрования. Продукты процесса нитрования с последующим озонированием те же, что и продукты нитрования. Парафины, содержащиеся в исходной саже, не расходуются как при нитровании, так и при озонировании.
Таблица 1.
Состав продуктов в исходной саже и после ее нитрования, озонирования, а также после нитрования с последующим озонированием, установленный методом ГХ–МС
| Время выхода, мин | Номер образца* | Формула | ID NIST |
|---|---|---|---|
| 7.32–8.24 | 1–4 | CnH2n+2 | парафины |
| 8.27 | 3 | C19H24 | 73 567 |
| 8.33 | 3 | C16H15NO2 | 84297-09-6** |
| 8.6 | 1 | C15H32 | 17 052 |
| 8.6 | 2, 3, 4 | C10H10O4 | 71 717 |
| 8.66–9.44 | 1–4 | CnH2n+2 | парафины |
| 9.72 | 1 | C13H18O3 | 61 591 |
| 9.88 | 2, 3, 4 | C18H30O4 | 34 366 |
| 10.07 | 1 | C20H40O | 31 855 |
| 10.285 | 2, 3, 4 | C28H44N2 | 104 607 |
| 10.35–10.64 | 1–4 | CnH2n+2 | парафины |
| 10.81 | 1 | C14H10 | 76 767 |
| 10.84–11.3 | 1–4 | CnH2n+2 | парафины |
| 12.515 | 1 | C16H10 | 83 585 |
| 12.515 | 2, 3, 4 | C21H42O2 | 35 652 |
| 13.545 | 3, 4 | C22H42O4 | 58 241 |
| 24.86 | 1 | C22H12 | 96 826 |
Результаты анализа продуктов по масс-спектрам высокого разрешения приведены в табл. 2–6. Абсолютная чувствительность данного метода анализа и точность определения массы ионов оказываются существенно выше по сравнению с ГХ–МС, но есть и своя специфика: идентификация ионов в масс-спектре проводится методом генерирования возможных структур ионов с точными массами, отличными от измеренных не более чем на 1 мДa. В результате определяется брутто-формула, которой может соответствовать несколько индивидуальных соединений. Выбор из них конкретного соединения требует дополнительного анализа. Так, из анализа брутто-формул соединений, приведенных в этих таблицах, можно выявить различные классы соединений. Группа продуктов из табл. 2, содержащихся в исходной саже, представляет собой полициклические ароматические соединения (C9H9ON5, C10H11ON5, C12H14ON4, C13H8O4N2, C15H10N4, C16H12O4, C18H10O3, C26H33O7N, C27H32O4N2, C30H31O4N), ароматические кислоты (C11H9O4N, C12H15O4N) и их нитропроизводные (C10H9O7N, C12H8O6N4). Твердые продукты озонирования (табл. 4 ) включают в себя сложные эфиры органических кислот (C8H14O5, C10H14O5, C12H24O4, C14H18O3, C14H24O5, C15H24O5, C22H42O4, C25H40O4), полициклические соединения с аминогруппой (C11H16O5N5, C20H30N4, C20H38O5N2, C21H37N), амидогруппой (C12H25ON, C13H15ON, C13H27ON, C14H29ON, C16H33ON, C17H35ON), ацетильной группой (C16H26O9, C18H22O8, C20H26O9) и кетогруппой (C17H12ON6, C21H14O2). Состав продуктов нитрования (табл. 3 и 5) близок к продуктам озонирования из табл. 4 – это преобладающе сложные эфиры органических кислот в табл. 5, а в табл. 3, кроме этого, − ароматические полициклические соединения. Аналогично анализу данных ГХ–МС из сравнения состава продуктов нитрования и озонирования можно сделать вывод о более высокой реакционной способности сажи к озонированию.
Таблица 2.
Твердые продукты в исходной саже, которые полностью расходуются как при нитровании, так и при озонировании
| Брутто-формула | М, а.е.м | Идентификация по иону | NIST* |
|---|---|---|---|
| C8H13O5N | 203.079 | MK+ | 8 |
| C9H9ON5 | 203.081 | MK+ | 3 |
| C10H11ON5 | 217.096 | MK+ | 3 |
| C11H9O4N | 219.053 | MNa+ | 12 |
| C12H8O6N4 | 304.044 | MH+ | 1 |
| C12H14ON4 | 230.117 | MK+ | 2 |
| C12H15O4N | 237.100 | MK+ | 33 |
| C13H8O4N2 | 256.048 | M+ | 3 |
| C15H10N4 | 246.091 | MNa+ | 8 |
| C16H10 | 202.078 | M+ | 3 |
| C16H12O4 | 268.074 | MH+ | 28 |
| C18H10O3 | 274.063 | MH+ | 1 |
| C24H44O6 | 428.314 | MH+ | 1 |
| C26H33O7N | 471.226 | MH+ | 1 |
| C27H32O4N2 | 448.236 | MH+ | 1 |
| C27H38O5 | 442.272 | MK+ | 1 |
| C28H32O3N2 | 444.241 | MNa+ | 2 |
| C30H31O4N | 469.225 | MH+ | 1 |
Таблица 3.
Твердые продукты нитрования сажи, которые отсутствуют в продуктах озонирования
| Брутто-формула | М, а.е.м | Идентификация по иону | NIST* |
|---|---|---|---|
| C6H6O2N2 | 138.043 | MH+ | 15 |
| C8H19O2N | 161.142 | MK+ | 4 |
| C11H12N4 | 200.106 | M+ | 3 |
| C15H15N | 209.120 | MH+ | 22 |
| C17H34O6 | 334.236 | MNa+ | 4 |
| C19H41N | 283.324 | MH+ | 6 |
| C26H48O8N2 | 516.341 | MH+ | 1 |
Таблица 4.
Твердые продукты озонирования сажи, которые отсутствуют в продуктах нитрования
| Брутто-формула | М, а.е.м | Идентификация по иону | NIST* |
|---|---|---|---|
| C8H13O2N3 | 183.101 | MNa+ | 1 |
| C8H14O5 | 190.084 | MNa+ | 18 |
| C10H14O5 | 214.084 | MH+ | 6 |
| C11H16O5N5 | 298.115 | MNa+ | 1 |
| C15H27O3N | 269.199 | M+ | 2 |
| C12H24O4 | 232.167 | MNa+ | 2 |
| C12H25ON | 199.194 | MH+ | 12 |
| C13H15ON | 201.115 | M+ | 15 |
| C13H27ON | 213.209 | MH+ | 7 |
| C14H18O3 | 234.126 | MH+ | 28 |
| C14H20O6N6 | 368.144 | MH+ | 1 |
| C14H24O5 | 272.162 | MNa+ | 6 |
| C14H29ON | 227.225 | MH+ | 9 |
| C15H24O5 | 284.162 | MNa+ | 10 |
| C16H13N | 219.105 | MH+ | 15 |
| C16H26O9 | 362.158 | MNa+ | 1 |
| C16H33ON | 255.256 | MH+ | 5 |
| C17H12ON6 | 316.107 | MK+ | 1 |
| C17H22O3 | 274.157 | MH+ | 6 |
| C17H35ON | 269.272 | MH+ | 3 |
| C18H22O8 | 366.131 | MH+ | 7 |
| C20H26O9 | 410.158 | MNa+ | 1 |
| C20H30N4 | 326.247 | MNa+ | 1 |
| C20H38O5N2 | 386.278 | MNa+ | 1 |
| C21H14O2 | 298.099 | MH+ | 2 |
| C21H37N | 303.293 | MH+ | 5 |
| C22H20O8 | 412.116 | MNa+ | 2 |
| C22H42O4 | 370.308 | MNa+ | 11 |
| C25H40O4 | 404.293 | MH+ | 7 |
| C25H46O4 | 410.340 | MNa+ | 1 |
| C26H48O4 | 424.355 | MNa+ | 1 |
| C27H22O3N2 | 422.163 | MNa+ | 2 |
| C30H44O3 | 452.329 | MNa+ | 4 |
| C30H44O4 | 468.324 | MH+ | 3 |
Таблица 5.
Твердые продукты, одинаковые как при нитровании сажи, так и при ее озонировании
| Брутто-формула | М, а.е.м | Идентификация по иону | NIST* |
|---|---|---|---|
| C9H16O4 | 188.105 | MNa+ | 42 |
| C10H15O2N3 | 209.116 | M+ | 1 |
| C10H16O4 | 200.105 | MNa+ | 51 |
| C10H16O5 | 216.100 | MNa+ | 12 |
| C10H18O4 | 202.121 | MNa+ | 53 |
| C10H22O4 | 206.152 | MNa+ | 4 |
| C22H28O | 320.214 | MH+ | 2 |
| C23H40O6N2 | 440.289 | MH+ | 1 |
Таблица 6.
Твердые продукты после нитрования сажи с последующим озонированием
| Брутто-формула | М, а.е.м | Идентификация по иону | NIST* |
|---|---|---|---|
| C16H27N | 233.214 | MH+ | 8 |
| C16H30O3 | 270.219 | MNa+ | 5 |
| C16H38N4 | 286.310 | M+ | 1 |
| C17H20O4N2 | 316.142 | MK+ | 4 |
| C18H20O6N2 | 360.132 | MNa+ | 3 |
| C18H26N2 | 270.210 | MH+ | 3 |
| C18H29N | 259.230 | MH+ | 1 |
| C18H29O4N | 323.210 | MH+ | 2 |
| C18H31N | 261.246 | MH+ | 6 |
| C19H29N | 271.230 | MH+ | 6 |
| C20H26O4N2 | 358.189 | MK+ | 6 |
| C20H35N | 289.277 | MH+ | 4 |
| C22H43ON | 337.334 | MH+ | 6 |
| C27H50O6 | 470.361 | MK+ | 3 |
| C30H46O5 | 426.335 | MNa+ | 1 |
Состав продуктов озонирования сажи после ее предварительного нитрования тот же, что и после простого озонирования. Дополнительно образуются продукты (табл. 6), характерные только для этого процесса последовательного окисления: внедрение атома азота в углеродные цепочки (C16H38N4), в полициклические ароматические структуры (C16H27N, C18H31N, C18H20O6N4, C22H43ON), образование мостиковых структур через атом азота (C17H20O4N2, C19H29N, C20H35N).
ЗАКЛЮЧЕНИЕ
Из анализа хромато-масс-спектрометрических данных по составу свежей метановой сажи и сажи, обработанной NO2 и О3, можно сделать следующие выводы. Исходная сажа содержит ряд ароматических соединений, включая и полициклические, которые полностью расходуются в реакции с этими окислителями. Есть класс соединений, инертных по отношению к NO2 и О3. К ним относится группа парафинов. Продукты нитрования и озонирования одинаковы, но количество последних больше. В результате процесса нитрования с последующим озонированием образуются те же продукты, что и после простого озонирования. Такие же выводы следуют и из анализа данных масс-спектрометрии высокого разрешения. Из этих данных можно также сделать дополнительный вывод о наличии специфических продуктов, присутствующих либо только в продуктах нитрования (табл. 3), либо озонирования (табл. 4 ), либо в продуктах последовательного процесса окисления (табл. 6). Тем не менее основной вывод остается прежним – в качественном отношении продукты нитрования и озонирования одинаковы как по своему составу, так и по содержанию основных функциональных групп. Различие состоит в количественном составе продуктов окисления – окислительная способность озонирования гораздо выше, поэтому после нитрования сажа остается реакционноспособной по отношению к захвату озона.
Работа выполнена в рамках госзадания FFZE-2022-0008 (регистрационный номер 122040500059-8).
Список литературы
Roberts-Semple D., Song F., Gao Yu. // Atmos. Pollut. Res. 2012. V. 3. P. 247; www.atmospolres.com
Liu Yu., Tang G., Liu B. et al. // Atmos. Environ. 2022. V. 275. P. 119018; https://doi.org/10.1016/jatmosenv.2022.119018
Schumann U., Huntrieser H. // Atmos. Chem. Phys. 2007. V. 7. P. 3823; www.atmos-chem-phys.net/7/3823/2007/
Washenfelder R.A., Wagner N.L., Dubé W.P., Brown S.S. // Environ. Sci. Technol. 2011. V. 45. P. 2938; https://doi.org/10.1021/es103340u
Ларин И.К. // Хим. физика. 2019. Т. 38. №5. С. 81; https://doi.org/10.1134/S0207401X1905008X
Ларин И.К., Алоян А.Е., Ермаков А.Н. // Хим. физика. 2021. Т. 40. № 5. С. 86; https://doi.org/10.31857/S0207401X21050095
Ларин И.К. // Хим. физика. 2022. Т. 41. № 5. С. 371; https://doi.org/10/31857/S0207401X22050089
Xiong X., Liu X., Wu W. et al. // Atmos. Environ. 2022. V. 273. P. 118956; https://doi.org/10.1016/j.atmosenv.2022.118956
Aas W., Tsyro S., Bieber E. et al. // Atmos. Chem. Phys. 2012. V. 12. P. 8073; https://doi.org/10.5194/acp-12-8073-2012
Sharma S.K., Karapurkar S.G., Shenoy D.M., Mandal T.K. // J. Atmos. Chem. 2022. V. 79. P. 67; https://doi.org/10.1007/s10874-022-09429-0
Berner A., Sidla S., Galambos Z. et al. // J. Geophys. Res. Atmospheres. 1996. V. 101. P. 19559; https://doi.org/10.1029/95JD03425
Pohl K., Cantwell M., Herckes P., Lohmann R. // Atmos. Chem. Phys. 2014. V. 14. P. 7431; https://doi.org/10.5194/acp-14-7431-2014,2014
Bond T.C., Streets D.G., Yarber K.F. et al. // J. Geophys. Res. 2004. V. 109. D14203; https://doi.org/10.1029/2003JD003697
Wang R., Tao S., Shen H. et al. // Environ. Sci. Technol. 2014. V. 48. P. 6780; https://doi.org/10.1021/es5021422
Klimont Z., Kupiainen K., Heyes C. et al. // Atmos. Chem. Phys. 2017. V. 17. P. 8681; https://doi.org/10.5194/acp-8681-2017
Akhter M.S., Chughtai A.R., Smith D.M. // Applied Spec. 1985. V. 39. P. 143; https://doi.org/10.1366/0003702854249114
Stadler D., Rossi M.J. // Phys. Chem. Chem. Phys. 2000. V. 2. P. 5420; https://doi.org/10.1039/b005680o
Cain J.P., Gassman P.L., Wang H., Laskin A. // Phys. Chem. Chem. Phys. 2010. V. 12. P. 5206; https://doi.org/10.1039/b924344e
Smedley J.M., Williams A., Bartle K.D. // Combust.and Flame 1992. V. 91. P. 71; https://doi.org/10.1016/0010-2180(92)90128-C
Siegmann K., Hepp H., Sattler K. // Combust. Sci. Technol. 1995. V. 109. P. 165; https://doi.org/10.1080/00102209508951900
Onischuk A.A., di Stasio S., Karasev V.V. et al. // Aerosol Sci. 2003. V. 34. P. 383; https://doi.org/10.1016/S0021-8502(02)00215-X
Dobbings R.A., Fletcher R.A., Chang H.-C. // Combust. and Flame. 1998. V. 115. P. 285; https://doi.org/10.1016/S0010-2180(98)00010-8
Oktem B., Tolocka M.P., Zhao B. et al. // Combust. and Flame. 2005. V. 142. P. 364; https://doi.org/10.1016/j.combustflame.2005.03.016
Hafner W.D., Carlson D.L., Hites R.A. // Environ. Sci. Technol. 2005. V. 39. P. 7374; https://doi.org/10.1021/es0508673
Lang C., Tao S., Liu W. et al. // Environ. Sci. Technol. 2008. V. 42. P. 5156; https://doi.org/10.1021/es800453n
Li W., Park R., Alexandrou N. et al. // Environ. Sci. Technol. 2021. V. 55. P. 2254; https://doi.org/10.1021/acs.est.0c07079
Ringuet J., Albinet A., Leoz-Garziandia E. et al. // Atmos. Environ. 2012. V. 61. P. 15; https://doi.org/10.1016/j.atmosenv.2012.07.025
Roy R., Jan R., Gunjal G. et al. // Atmos. Environ. 2019. V. 210. P. 47; https://doi.org/10.1016/j.atmosenv.2019.04.034
Liu Y., Liu C., Ma J. et al. // Phys. Chem. Chem. Phys. 2010. V. 12. P. 10896; https://doi.org/10.1039/c0cp00402b
Burkholder J.B., Sander S.P., Abbatt J.P.D. et al. “Chemical Kinetics and Photochemical Data for Use in Atmospheric Studies. Evaluation № 19”. Pasadena: NASA JPL Publication 19-5, 2019; http://jpldataeval.jpl.nasa.gov
Akhter M.S., Chughtai A.R., Smith D.M. // J. Phys. Chem. 1984. V. 88. P. 5334; https://doi.org/10.1021/j.150666a046
Smith D.M., Chughtai A.R. // J. Geophys. Res. 1996. V. 101D. P. 19607; https://doi.org/10.1029/95JD03032
Kirchner U., Scheer V., Vogt R. // J. Phys. Chem. A. 2000. V. 104. P. 8908; https://doi.org/10.1021/jp0005322
Han C., Liu Y., He H. // Atmos. Environ. 2013. V. 64. P. 270; https://doi.org/10.1016/j.atmosenv.2012.10.008
Зеленов В.В., Апарина Е.В. // Хим. физика. 2023. Т. 42. № 1. С. 73; https://doi.org/10.31857/S0207401X23010144
Kozlovski V., Brusov V., Sulimenkov I. et al. // Rapid Commun. Mass Spectrom. 2004. V. 18. P. 780; https://doi.org/10.1002/rcm.1405
www.sisweb.com/software/ms/nist.htm
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика