Химическая физика, 2023, T. 42, № 4, стр. 89-94
Реакция сероводорода c атомарным хлором в области температур 273–366 K
И. К. Ларин 1, Т. И. Белякова 1, Н. А. Мессинева 1, *, Е. М. Трофимова 1, **
1 Федеральный исследовательский центр химической физики им. Н.Н. Семенова Российской академии наук
Москва, Россия
* E-mail: nat-messineva@yandex.ru
** E-mail: eltrofimova@yandex.ru
Поступила в редакцию 21.05.2022
После доработки 15.06.2022
Принята к публикации 20.06.2022
- EDN: MXGZMS
- DOI: 10.31857/S0207401X23040118
Аннотация
Методом резонансной флуоресценции атомов хлора в проточном реакторе в диапазоне температур 273–366 K была измерена константа скорости реакций атома хлора с сероводородом, значение которой уменьшалось при увеличении температуры в реакторе. Такое поведение константы скорости можно было бы объяснить тем, что данная реакция протекает на поверхности реактора. Однако опыты, проведенные при разных условиях диффузии реагентов к поверхности реактора, показали, что реакция атома хлора с сероводородом протекает в объеме.
ВВЕДЕНИЕ
В природных условиях сероводород и атомы хлора могут взаимодействовать в самых разных условиях. В прибрежной зоне морей и океанов сероводород образуется за счет анаэробного разложения биомассы водорослей и различных органических остатков, а также при восстановлении донных сульфатных отложений анаэробными бактериями [1–3]. Наличие сероводорода и других соединений серы способствует образованию сульфатных аэрозолей, что оказывает существенное влияние на климат и концентрацию озона в тропосфере [4–6]. В этой же зоне образуются атомы хлора при фотолизе молекулярного хлора, поступающего в атмосферу за счет реакции тропосферного озона и ClNO3 с аэрозолями морской соли [7]. Имеются и антропогенные источники, общие для сероводорода и атомов хлора: гниение и горение свалок бытовых и промышленных отходов, взрывы на промышленных предприятиях [8]. В этих условиях концентрации атомов хлора и сероводорода в атмосфере могут достигать значительных величин, и их взаимодействие может иметь практическое значение.
МЕТОДИКА ЭКСПЕРИМЕНТА
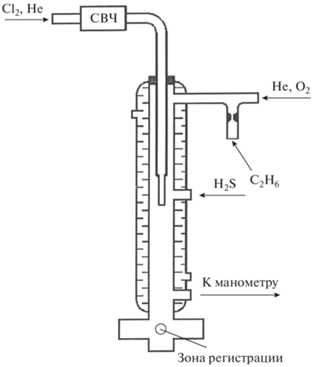
Опыты проводили в проточном реакторе, внутренняя поверхность которого была покрыта фторопластом фторопластом-32Л (Ф-32Л) для того, чтобы уменьшить скорость гетерогенной гибели атомов и радикалов. Экспериментальная установка включала в себя источник атомов хлора, систему регистрации атомов хлора, реактор и систему подачи реагентов. Опыты проводили в условиях струи в реакторе, изображенном на рис. 1. Он представлял собой кварцевый цилиндр внутренним диаметром 2.5 см. Реактор имел водяную рубашку, присоединенную к термостату, что позволяло изменять его температуру в диапазоне 273–366 K и поддерживать ее с точностью 1 K. Температура в термостате контролировалась при помощи ртутного термометра. Давление в реакторе измеряли с помощью вакуумметра ВДГ-1 в диапазоне 1–10 Торр с точностью ~0.05 Торр. Вакуумметр калибровали по соответствию его показаний значению упругости паров воды при 0 °С (температура тающего льда). Газы-разбавители (азот и гелий), а также сероводород поступали в реакционный сосуд через боковые отверстия. Сероводород получали в реакции Na2S c серной кислотой и очищали многократной низкотемпературной перегонкой.
Атомы хлора генерировали разрядом частотой 254 Мгц и мощностью 2.5 Вт в разбавленном потоке Cl2 в гелии. Поверхность зоны разряда была обработана ортофосфорной кислотой. Та часть сопла, которая находилась ниже по течению струи реагентов, была покрыта углеводородной смазкой. В зоне, находящейся между разрядом и реактором, сопло было дважды изогнуто под прямым углом, чтобы предотвратить проникновение ультрафиолета в реактор и счетчик фотонов.
Для регистрации атомов хлора был использован метод атомной резонансной флуоресценции (РФ), работающий в режиме счета фотонов. Источником резонансного излучения служила проточная лампа, работающая на смеси Cl2 с гелием (1 ⋅ 1013 и 1 ⋅ 1017 молекул/см3, соответственно) и излучающая резонансную линию с длиной волны 118.9 нм. Поглощенные, а затем излученные атомами хлора фотоны регистрировались фотоионизационным счетчиком нашего собственного производства, работающим в диапазоне 117–134 нм.
Для калибровки абсолютной чувствительности к атомам хлора использовалось титрование с помощью C2H6 (марки “ХЧ”). Отношение сигнал/шум, равное двум, получено при [Cl] = = 0.8 · 1010 молекул/см3.
Эксперименты проводили следующим образом. Вначале через подвижную трубку, соединенную с реактором герметичным устройством, изготовленным из тефлона, в реактор вводили атомы хлора в смеси с гелием или азотом. Во всех опытах использовали гелий и азот марки “ВЧ”. Сигнал РФ атомов хлора до начала реакции (J0) измеряли вдоль оси реактора на различных расстояниях от зоны регистрации. Затем из градуированного объема через вентиль тонкой регулировки в реактор поступал H2S, который вступал в реакцию с атомами хлора:
За расходованием атомов хлора в реакции (1) следили, измеряя сигнал РФ атомов хлора (J).Выражение для скорости расходования атомов хлора в ходе изучаемой реакции (1) можно записать следующим образом:
Аналогично для [H2S] = 0 можно записать
После интегрирования получаем следующее выражение:
Так как концентрация атома хлора пропорциональна сигналу РФ, то вместо последнего выражения имеем ln(J0/J) = k1[H2S]t. Построение зависимости ln(J0/J) от концентрации сероводорода при фиксированном времени реакции или от времени реакции при неизменной концентрации сероводорода позволяет получить значение k1.
РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТА
Были проведены опыты, в которых измерялась зависимость ln(J0/J) от времени контакта реагентов t при температуре 273 К, давлении в реакторе 0.8 Торр, [Cl] = 0.7 · 1012 молекул/см3 и [H2S] = = 2.8 · 1012 молекул/см3. Для того чтобы работать с такими низкими концентрациями сероводорода, последний был в тридцать раз разбавлен азотом. Результаты опытов представлены на рис. 2.
Рис. 2.
График зависимости ln(J0/J) от времени контакта реагентов. Условия реакции: давление в реакторе – 0.8 Торр, температура – 273 К, [Cl]0 = 0.8 · 1012 молекул/см3, [H2S] = 3.5 · 1012 молекул/см3. Разбавитель-гелий.
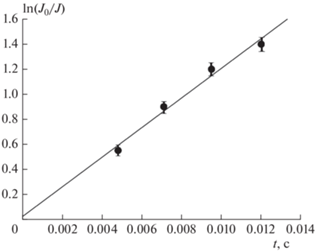
Используя значение тангенса угла наклона прямой на рис. 2, мы рассчитали константу скорости реакции (1), которая оказалась равной (7.9 ± 0.8) · 10–11 молекула–1 · см3 · c–1. Константу скорости реакции (1) мы измерили также при температурах 323, 343 и 366 К. Полученные нами данные представлены в табл. 1.
Таблица 1.
Температурная зависимость константы скорости реакции атома хлора с сероводородом
| T, K | 1/T, K–1 | k1 ∙ 1011, молекула–1 · см3 · с–1 | ln (k1 ∙ 1011) |
|---|---|---|---|
| 273 | 3.66 | 7.9 | 2.07 |
| 323 | 3.09 | 6.7 | 1.90 |
| 343 | 2.9 | 6.5 | 1.87 |
| 366 | 5.9 | 5.9 | 1.78 |
На рис. 3 представлена зависимость логарифма константы скорости реакции (1) от обратной температуры. Из значения тангенса угла наклона прямой на этом рисунке и величины сечения на оси y было получено следующее выражение для константы скорости реакции (1):
Рис. 3.
Зависимость скорости реакции атомов хлора с сероводородом от температуры в диапазоне температур 273–366 К.
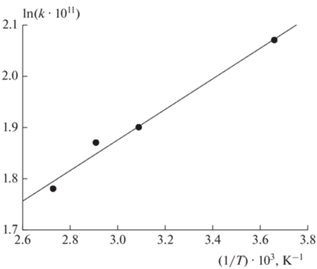
k1 = (2.48 ± 0. 43) · 10–11 ×
× exp{(2.6 ± 0.7)/RT} молекула–1 · см3 · с–1.
Из этого выражения следует, что константа скорости реакции (1) уменьшается при увеличении температуры в реакторе. Подобную зависимость константы скорости реакции от температуры мы неоднократно наблюдали в наших исследованиях.
Как было показано в работе [9], константы скорости одной и той же реакции при протекании ее в объеме или на различных поверхностях могут различаться в десятки и даже в тысячи раз. Включение быстрых гетерогенных реакций в моделирование химических процессов в атмосфере может объяснить те явления, которые невозможно было объяснить с точки зрения гомогенных процессов. Поэтому в наших исследованиях реакций, важных для химии атмосферы, мы особое внимание уделяли решению вопроса о том, является ли изучаемая нами реакция гомогенной или протекает на поверхности реактора.
Для цепных процессов мы применяли методику, разработанную в [10], с помощью которой было доказано, что реакция радикала IO с NO протекает в объеме, а реакции радикала IO с CO, диметилсульфидом и сероводородом являются в условиях нашего эксперимента гетерогенными [11–13]. При этом константы скорости и гомогенной, и гетерогенных реакций уменьшались с ростом температуры.
При исследовании бимолекулярных процессов для того, чтобы выяснить, является ли изучаемая реакция полностью гомогенной или протекает на поверхности, мы использовали методику, предложенную в работе [14]. С ее помощью мы показали, что реакции атомов йода с озоном, реакции атомов хлора с CF3I, C3F7I и CH3Br являются гомогенными [15, 16], а реакции атомов хлора с CH3I и CF3Br – гетерогенными [17, 18].
Диффузионные процессы переноса (радиальная и аксиальная диффузия) в тех условиях эксперимента, когда времена диффузии реагентов велики по сравнению с временами реакции, приводят к тому, что константа скорости реакции, определяемая в таких условиях (kнабл), оказывается заниженной по сравнению с истинной константой скорости (k). Особенно сильно этот эффект проявляется, если измеряемая константа скорости оказывается константой скорости гетерогенного процесса.
В работе [19] распределение концентрации активного реагента (R) в реакции, протекающей в струевых условиях, представлено в виде суммы сходящегося ряда. Показано, что за зоной установления профиля концентрации спад концентрации реагента вдоль реактора описывается одним экспоненциально затухающим множителем:
Величина λ2 связана с характерным временем жизни атомов хлора в реакторе следующим соотношением:
где $\tau _{{{\text{эф}}}}^{{ - 1}}$ = (–v0d ln[R(z)]/dz) и определяется непосредственно в эксперименте. В нашем случае [R(z)] = [Cl0](z)/[Cl](z). Отношение [Cl0](z)/[Cl](z) пропорционально отношению сигналов резонансной флуоресценции атомов хлора, а dz/v0 равно времени t [с] контакта реагентов.Более подробно математические выкладки изложены в работе [14]. С помощью программы, представленной в этой работе, мы рассчитали зависимость k/kэф от λ2 для случая, когда параллельно протекают и гомогенная, и гетерогенная реакции. На рис. 4 приведена теоретическая зависимость k/kэф от λ2 для случая чисто гомогенной реакции (нижняя кривая), чисто гетерогенной реакции (верхняя кривая) и для случаев, когда отношение kгет/(kгет+ kгом) = 0.1 и 0.5.
Рис. 4.
График теоретической зависимости k/kнабл от λ2 для случая чисто гомогенной реакции (нижняя кривая), чисто гетерогенной реакции (верхняя кривая) и для случаев, когда отношение kгет/(kгет+ kгом) = 0.1 и 0.5. Черные кружки – экспериментальные данные.

В качестве значения коэффициента диффузии атома хлора в гелии использовано среднее между приведенными в работах [20] (0.75) и [21] (0.526) значениями.
Опыт, результат которого представлен на рис. 2, проведен в условиях быстрой диффузии к стенке реактора и как можно меньшей скорости реакции. Мы также провели опыты, используя в качестве разбавителя азот, а также повысив давление в реакторе и концентрацию H2S, т.е. ухудшая условия диффузии атомов хлора к стенке реактора и увеличивая скорость реакции.
Условия экспериментов, проведенных в диапазоне температур в реакторе 273–366 К, а также значения $\tau _{{{\text{эф}}}}^{{ - 1}},$ λ2 и отношения k/kнабл приведены в табл. 2. Значение коэффициента диффузии атома хлора в азоте взято из работы [21].
Таблица 2.
Зависимость отношения k1/k1 набл от параметра λ2
| T, K | P, Торр | Газ-разбавитель | k1 ∙ 1011, молекула–1 · см3 · с–1 | λ2 | k1/k1 набл |
|---|---|---|---|---|---|
| 273 | 0.8 | He | 7.91 | 0.6 | 1 |
| 2.2 | He | 7.70 | 5.0 | 1.03 | |
| 1.9 | N2 | 7.32 | 9.0 | 1.08 | |
| 1.2 | He | 7.67 | 1.3 | 1.03 | |
| 1.6 | He | 7.63 | 2.8 | 1.03 | |
| 1.5 | N2 | 7.48 | 6.2 | 1.06 | |
| 1.9 | He | 7.60 | 4.2 | 1.04 | |
| 323 | 0.9 | He | 6.72 | 0.7 | 1.0 |
| 2.0 | He | 6.55 | 4.1 | 1.02 | |
| 343 | 0.8 | He | 6.51 | 0.67 | 1.0 |
| 2.0 | He | 6.30 | 3.8 | 1.03 | |
| 366 | 1.1 | He | 5.90 | 0.8 | 1.0 |
| 2.0 | He | 5.30 | 4.7 | 1.1 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Константа скорости реакции атома хлора с сероводородом измерялась, начиная с 1978 года, в целом ряде работ, некоторые из которых были проведены в широком интервале температур. Хотя отмечалось, что взаимодействие этих веществ может происходить в основном только в атмосфере Венеры или в вулканических извержениях, но тем не менее эта реакция продолжала привлекать внимание исследователей. Дело в том, что при ее изучении наблюдалось образование колебательно-возбужденных молекул хлористого водорода с инверсией между вторым и первым энергетическими уровнями молекулы HCl, что было детектировано с помощью инфракрасной хемилюминесценции [22, 23]. Возникала возможность применения этой реакции для создания химического лазера.
Значения констант скорости реакции (1) при температуре 298 К, измеренные разными авторами, различаются приблизительно в три раза. Имеются и разногласия по поводу механизма реакции. Одни авторы предполагают, что происходят отрыв атома водорода от молекулы сероводорода и присоединение его к атому хлора, другие склоняются к протеканию реакции через промежуточный комплекс. Существование такого комплекса было предсказано теоретически в работе [24]. Однако в [21] было показано, что варьирование давления в реакторе в широком диапазоне не приводило к изменению измеренной константы скорости реакции (1).
Теоретические исследования данной реакции не привели к согласию с экспериментом. Расчеты по теории переходного состояния, проведенные в работе [25] в предположении прямого отрыва атома водорода от молекулы сероводорода, дали при комнатной температуре величину константы скорости реакции (1) на порядок ниже, чем экспериментально наблюдаемая. В работе [26], напротив, получили в 15 раз завышенную константу скорости данной реакции, предполагая, что она протекает через промежуточный комплекс.
Учитывая, что константа скорости реакции (1), уменьшается при увеличении температуры, мы могли предположить, что, как и в случае исследованных нами ранее реакций с серосодержащими соединениями, данная реакция протекает на поверхности реактора. Однако опыты, проведенные нами в условиях увеличенного времени диффузии активных центров к поверхности реактора по сравнению с временем реакции, дали практически такое же значение константы скорости реакции (1), как и в условиях более быстрой диффузии и более медленной реакции. Это говорит о том, что гетерогенная реакция на стенке не играет существенной роли.
ВЫВОДЫ
1. В работе обсуждены возможные области, в которых реакция сероводорода с атомами хлора может играть заметную роль.
2. Константа скорости реакции (1) измерена в интервале температур 273–366 К.
3. Нами подтверждено наблюдаемое некоторыми авторами уменьшение значения константы скорости реакции сероводорода с атомом хлора при увеличении температуры.
4. Было показано, что такая зависимость константы скорости реакции от температуры не связана с протеканием ее на поверхности реактора.
5. Полученные нами значения константы скорости реакции (1) близки к значениям, полученным в 2015 году авторами работы [27].
Список литературы
Hansen M.H., Ingvorsen K., Jorgensen B.B. // Limn. Oceanog. 1978. V. 5. P. 68.
Jorgensen B.B. // Limn. Oceanogr. 1977. V. 22. P. 814.
Kump L.R., Pavlov A., Arthur M.A. // Geology. 2005. V. 33. P. 397.
Лозбень Е.М., Лебедев А.В., Деминский М.А., Грановский А.А., Потапкин Б.В. // Хим. физика. 2022. Т. 41. № 5. С. 3.
Ларин И.К., Алоян А.Е., Ермаков А.Н. // Хим. физика. 2021. Т. 40. № 3. С. 80.
Ларин И.К. // Хим. физика. 2020. Т. 39. № 3. С. 85.
Finglasson-Pitts B.J., Ezell M.J., Pitts Jr J.N. // Nature. 1989. V. 337. P. 241.
Buekens A., Huang H. // J. Hazard. Mater. 1998. V. 62. P. 1.
Behnke W., Zetsch C. // J. Aerosol Sci. 1989. V. 20. № 8. P. 1167.
Бубен С.Н., Ларин И.К., Мессинева Н.А., Трофимова Е.М. // Хим. физика. 1989. Т. 8. С. 1234.
Ларин И.К., Спасский А.И., Трофимова Е.М., Туркин Л.Е. // Кинетика и катализ. 2000. Т. 4. С. 437.
Ларин И.К., Спасский А.И., Трофимова Е.М., Прончева Н.Г. // Кинетика и катализ. 2014. Т. 55. № 3. С. 301.
Ларин И.К., Спасский А.И., Трофимова Е.М. // Хим. физика. 2020. Т. 39. № 10. С. 29; https://doi.org/10.31857/S0207401X2010009XI
Orkin V.L., Khamaganov V.G., Larin I.K. // Intern. J. Chem. Kinet. 1993. V. 25. P. 67.
Ларин И.К., Спасский А.И., Трофимова Е.М. // Изв. РАН. Энергетика. 2012. № 3. С. 44.
Ларин И.К., Спасский А.И., Трофимова Е.М. Прончева Н.Г. // Кинетика и катализ. 2018. Т. 59. № 1. С. 11.
Ларин И.К. Спасский А.И., Туркин Л.Е. Трофимова Е.М. // Кинетика и катализ. 2010. Т. 51. № 3. С. 369.
Ларин И.К., Спасский А.И., Трофимова Е.М. // Хим. физика. 2019. Т. 38. № 4. С. 16; https://doi.org/10.1134/S0207401X19040071I
Гершензон Ю.М., Розенштейн В.Б., Спасский А., Коган А.М. // Докл. АН СССР. 1972. Т. 205. С. 624.
Hwang C.J., Jiang R.C., Su T.M. // J. Chem. Phys. 1986. V. 84. P. 5095.
Cotter E.S.N., Booth N.J., Canosa-Mas C.E. et al. // Phys. Chem. Chem. Phys. 2001. V. 3. P. 402; https://doi.org/10.1039/B101434J
Hwang C.J., Su T.M. // J. Chem. Phys. 1987. V. 91. P. 2351.
Coombe A.T., Pritt Jr., D. Philipovich // Chem. Phys. Lett. 1975. V. 35. P. 345.
Dill B. Heydtmann H. // Chem. Phys. 1978. V. 35. P. 161.
Wilson C., Hirst D.M. // J. Chem. Soc., Faraday Trans. 1997. V. 93. P. 2831; https://doi.org/10.1039/A701664F
Resende S.M., Piego J.R.Ir. // Mol. Phys. 2008. V. 106. P. 841.
Gao Y., Alecu I.M., Goumri A., Marshall P. // Chem. Phys. Lett. 2015. V. 624. P. 83; https://doi.org/10.1016/j.cplett.2015.02.011
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика