Химическая физика, 2023, T. 42, № 3, стр. 49-57
Чувствительность взрывчатых веществ к удару и скорость реакции термического разложения
Г. М. Назин 1, Б. Л. Корсунский 1, 2, А. И. Казаков 1, *, А. В. Набатова 1, Н. Г. Самойленко 1
1 Институт проблем химической физики Российской академии наук
Черноголовка, Россия
2 Федеральный исследовательский центр им. Н.Н. Семёнова Российской академии наук
Москва, Россия
* E-mail: akazakov@icp.ac.ru
Поступила в редакцию 01.04.2022
После доработки 29.04.2022
Принята к публикации 20.05.2022
- EDN: NBVFBA
- DOI: 10.31857/S0207401X23030123
Аннотация
Выделена группа из 14 взрывчатых соединений, для которых имеются корректные данные как по чувствительности к механическим воздействиям, так и по кинетике реакции термического разложения. Оценены кинетические параметры начальной стадии разложения в твердой фазе. С использованием этих параметров по формулам, описывающим очаговый взрыв, рассчитана критическая температура самовоспламенения Ткр, критический радиус очага и объемная мощность теплового потока, вызывающего самовоспламенение. Выявлена корреляционная связь Ткр с критическим давлением Ркр, при котором происходит взрыв образца. Проведено сравнение эффективности действия на чувствительность таких факторов, как скорость реакции термического разложения и теплота взрыва.
ВВЕДЕНИЕ
Установление связи чувствительности со строением взрывчатых веществ (ВВ) является актуальной, но до сих пор все еще не решенной проблемой. В литературе приводятся корреляционные зависимости чувствительности от теплоты взрыва [1], кислородного баланса (КБ) [2, 3], электроотрицательности соединений [4], химического сдвига протонов в спектрах ЯМР [5] и ряда других показателей [6], которые могут указывать на связь чувствительности как с энергетическими свойствами соединений, так и с их реакционной способностью. Однако все эти разнородные зависимости имеют частный характер, охватывают лишь небольшие группы веществ и, скорее всего, являются отражением зависимости чувствительности от такой более универсальной и важной характеристики ВВ, как скорость реакции термического разложения.
Гипотеза о тесной связи чувствительности с реакцией термического разложения была высказана еще в первой половине прошлого века (см. [7]). Однако до сих пор эта гипотеза не получила развития главным образом из-за отсутствия надежных данных по кинетике разложения. В теоретической работе [8] установлено наличие фундаментальной связи чувствительности с реакционной способностью и стабильностью ВВ. Отмечается также, что значение константы скорости термораспада k1 (правда, не экспериментальное, а расчетное) при критических температурах изменяется в пределах одного порядка, и прогнозируется гиперболическая зависимость критического давления Ркр от k1. В то же время в этой статье не приведено соотношений между Ркр и k1, удобных для практического использования. В предлагаемой работе проведен более детальный анализ этой темы, выполненный на основе корректных экспериментальных значений кинетических параметров реакции разложения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исследование кинетики термического превращения ВВ в изотермических условиях проводили на автоматическом дифференциальном автоматическом микрокалориметре ДАК-1-2, разработанном и изготовленном в ИПХФ РАН (Россия) [9], в стеклянных запаянных ампулах с внутренним объемом около 2 см3, не имеющих холодных частей, что позволяет сохранять все продукты превращения в зоне реакции. Навеска исследуемых веществ составляла примерно 10 мг, а величина отношения массы навески к свободному объему ампулы – примерно 5 · 10–3 г/см3 при всех указанных температурах испытания. Термические превращения ВВ в неизотермическом режиме изучали методами термогравиметрии (ТГ) и дифференциальной сканирующей калориметрии (ДСК) с использованием синхронного термического анализатора STA 449 F3 Jupiter производства компании Netzsch (Germany) в диапазоне температур 30–430 °C в потоке газообразного аргона (40 мл/мин) и скоростях нагрева 5 и 10 град/мин. Для измерений использовали стандартные корундовые тигли (V = 85 мкл, d = 6.8 мм), завальцованные крышкой с отверстием. В качестве эталона использовали пустой тигель. Взвешивание осуществляли на внутренних весах с точностью ±10–4 мг. Масса навески составляла около 2 мг. Перед измерением определяли базовую линию путем построения графика коррекции с пустыми тиглями. Анализ газов, образующихся в результате разложения образца, проводили с помощью подключенного к прибору квадрупольного масс-спектрометра.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Согласно тепловой теории чувствительности [10], возбуждение взрыва при механическом воздействии протекает в две последовательные стадии. Сначала в результате трения частиц при неупругой деформации образца в нем возникают горячие точки – микроскопические очаги, разогретые до температур порядка 1000 К. Разогрев зависит от таких свойств, как предел прочности на сдвиг (т.е. удельный коэффициент трения) и теплоемкость вещества. С реакцией разложения этот этап связан слабо. Однако из самого существования первого этапа вытекает требование, чтобы вещество в очаге, нагретом до критической температуры самовоспламенения Ткр, находилось в твердом состоянии. Вторая стадия инициирования заключается в самовоспламенении очага, нагретого на первом этапе до температуры Ткр. Единственной причиной самовоспламенения является реакция термического разложения, поэтому именно на этой стадии можно ожидать проявления связи реакции с чувствительностью.
Чтобы установить взаимозависимость между чувствительностью и реакцией разложения, необходимо прежде всего представить набор веществ, для которых имеются корректные (полученные на одном копре) сведения по чувствительности и достаточно точные (c ошибкой определения энергии активации, не превышающей 8 кДж/моль) данные по кинетике разложения. Анализ работ [1–6, 10–15] показал, что этому требованию соответствуют только 14 соединений, представленных в табл. 1. Все они принадлежат к группе известных вторичных ВВ и в основном относятся к соединениям состава HCNO.
Таблица 1.
Кинетические параметры реакции термического разложения соединений
| Соединение | Тпл, К | Среда | ∆Т, К | Е, кДж/моль | lg (Z, с–1) | Ссылка |
|---|---|---|---|---|---|---|
| 1,3,5-Триамино-2,4,6-тринитробензол – ТАТБ, (1) | 623 | Твердая фаза | 557–593 | 172.5 | 11.6 | [11] |
| Тротил (2) | 355 | Расплав | 488–523 | 194.6 | 12.9 | [11] |
| 5-Амино-4,6-динитро-бензофуроксан (3) | 573 | Газ | 488–583 | 154.0 | 11.7 | [17] |
| Пикриновая кислота (4) | 395 | Расплав | 523–573 | 161.1 | 11.5 | [18] |
| Гексоген (5) | 477 | Раствор в ДНБ | 453–483 | 166.1 | 14.3 | [11] |
| Тетрил (6) | 402. | Раствор в ДНБ | 468–503 | 150.7 | 13.8 | [11] |
| Октоген (7) | 553 | Раствор в ТНБ | 463–503 | 171.6 | 14.8. | [11] |
| ТЭН (8) | 414 | Расплав | 304–428 | 163.2 | 13.8 | [11] |
| Бензотрифуроксан (9) | 471 | Раствор в ТНБ | 463–477 | 173.7 | 13.8 | [11] |
| Бис-(тринитроэтил)-нитрамин (10) | 369 | Расплав | 313–289 | 153.6 | 15.5 | [11] |
| 1,1,1,3,6,8,8,8-Октанитро-3,6-диазаоктан (11) | 445 | Раствор в ДНБ | 433–453 | 174.5 | 16.9 | [11] |
| Гексанитрогексаазаизовюрцитан (12) | 481 | Твердая фаза | 463–477 | 151.9 | 13.6 | [19] |
| Фуразанотетразиндиоксид (13) | 386 | Расплав | 383–413 | 168.7 | 18.2 | [20] |
| Бис(дифтораминодинитроэтил)нитрамин (14) | 375 | Расплав | 313–423 | 153.6 | 15.5 | [11] |
Далее надо выбрать параметры, однозначно характеризующие реакцию и чувствительность, и проверить наличие связи между этими параметрами. В качестве меры чувствительности использовано давление сжатия образца Ркр [16], которое соответствует верхнему пределу чувствительности вещества. Значения Ркр для выбранных соединений взяты из работы [1]. Равноценными характеристиками, которые используются для сравнения реакционной способности соединений, могут быть константа скорости, определенная при постоянной температуре, или температура, соответствующая заданному значению константы скорости. Выбор между этими характеристиками был сделан по результатам приведенных ниже расчетов.
Формулы для расчета Ткр
Критические условия очагового самовоспламенения определяются следующим образом [10, 21, 22]:
(1)
$\begin{gathered} {{r}^{2}}Е\rho {{Q}_{{{\text{разл}}}}}Z\exp \left( { - Е{\text{/}}R{{T}_{{{\text{кр}}}}}} \right){\text{/}}\lambda RT_{{{\text{кр}}}}^{2} = \\ = 12.1{{\left[ {\ln E\left( {{{T}_{{{\text{кр}}}}} - {{Т}_{0}}} \right){\text{/}}RT_{{{\text{кр}}}}^{2}} \right]}^{{0.6}}}, \\ \end{gathered} $(2)
${{\tau }_{{{\text{инд}}}}} = {{с}_{р}}RT_{{{\text{кр}}}}^{2}\exp \left( {E{\text{/}}R{{T}_{{{\text{кр}}}}}} \right){\text{/}}{{Q}_{{{\text{разл}}}}}EZ.$В этих формулах r – радиус очага, ρ – плотность вещества, Qразл – тепловой эффект реакции разложения на единицу массы, Е – энергия активации, Z – предэкспоненциальный множитель, λ – теплопроводность, ср – теплоемкость, R – газовая постоянная, Ткр – критическая температура самовоспламенения, Т0 – начальная температура очага.
Уравнение (1) содержит ряд параметров и их сочетаний, которые мало зависят от строения соединений и которые в первом приближении, часто рассматриваются как постоянные величины. В работах [10, 22] показано, что численное значение всей правой части уравнения (1) при любых значениях Е и Ткр, встречающихся в ряду ВВ, изменяется в пределах 20–25. Поэтому без существенной ошибки можно записать
(3)
${{r}^{2}}Е\rho {{Q}_{{{\text{разл}}}}}Z\exp \left( { - Е{\text{/}}R{{T}_{{{\text{кр}}}}}} \right){\text{/}}\lambda RT_{{{\text{кр}}}}^{2} = 22.5.$Отметим, что в формулу (1) входят две важные величины, связанные с реакцией разложения: константа скорости k1 = Z exp(–E/RTкр), которая, как показано в [10], описывает самую раннюю стадию распада (на 1%), и отнесенная к единице объема мощность теплового потока W = ρQразлk1, от которой зависят рост температуры очага и его самовоспламенение.
Для проведения расчетов по формулам (2) и (3) необходимо знать тепловой эффект реакции разложения, Qразл, и кинетические параметры разложения в твердом состоянии, k1 тв. Экспериментальные данные по Qразл и k1 тв практически отсутствуют.
Экспериментально-расчетное определение Qразл, Qпл и Етв
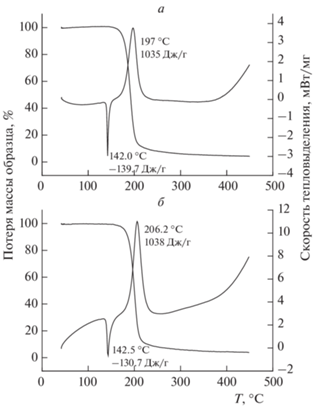
Значения Qразл для ключевых соединений были определены экспериментально с использованием микрокалориметра. Чтобы зафиксировать тепловыделение на ранней стадии распада, сначала опыты проводили при температуре, соответствующей k1 = 10–6 с–1. При таком значении константы скорости время разложения на 1% составляет более 150 мин, что в 10 раз больше периода прогрева ампулы в калориметре. Затем температуру повышали на 150 градусов и замеряли тепловыделение на конечном этапе реакции. Как правило, дополнительное тепловыделение было незначительным. Типичные кинетические кривые тепловыделения представлены на рис. 1.
Рис. 1.
Зависимость скорости тепловыделения от текущей теплоты процесса для ТЭНа: 1 – 140 °С, m/V = = 2.3 · 10–3 г/см3; 2 – 140 °С, m/V = 1.8 · 10–3 г/см3; 3 – 293 °С, остаток после разложения навески с m/V = = 1.8 · 10–3 г/см3 при 140 °С.
Измерения Qразл проведены также методом ДСК с использованием проточного калориметра STA 449 F5 (Netzsch, Germany). Вследствие удаления NO2 из зоны реакции значения Qразл, полученные этим методом, всегда существенно меньше, чем при измерениях в запаянной ампуле. Зато эта методика позволяет следить за выделением тепла и изменением веса после прохождения пика тепловыделения вплоть до 670 К. Ни для одного из изученных соединений такого изменения (отклонения от нулевой линии) не наблюдалось. Качественный масс-спектрометрический анализ конечных продуктов распада, выполненный в рамках этой же методики, показал, что во всех случаях продуктами являются N2, NO, N2O, CO, CO2, HCN, HCNO и (CN)2. Кроме того, после разложения всегда остается нелетучий остаток в количестве 5–10% по весу.
Полученные данные (см. табл. 2) показывают, что для ароматических нитросоединений, нитраминов и соединения 13 Qразл в 2–3 раза ниже, чем Qмакс. Для остальных типов веществ без большой погрешности можно принять Qразл = 0.8Qмакс, где Qмакс – максимальная теплота взрыва, соответствующая превращению вещества в продукты, соответствующие термодинамическому равновесию, а именно в Н2О, N2, СО2 и С. Во всех случаях Qразл меньше Qмакс, что связано с кинетическим контролем состава продуктов. В первом, эндотермическом акте реакции обычно образуются свободные радикалы и NO2. Вторичные процессы, представляющие собой рекомбинацию или диспропорционирование свободных радикалов и их реакции с NO и NO2, идут с большей скоростью, чем первый акт. В этих реакциях выделяется тепло, вместо NO2 образуются NO и N2O. Как только свободные радикалы и NO2 исчезают, первый этап реакции заканчивается. Обычный состав продуктов после первого этапа приведен выше. Чтобы из всех этих соединений быстро получились продукты взрыва, необходимо поднять температуру до 2000 К.
Таблица 2.
Теплофизические свойства веществ и значения энергия активации реакции в твердой фазе
| Соединение | ρ, г/cм3 | ср, Дж/г · град | Qмакс, кДж/г | ρQмакс, кДж/см3 | Qразл, кДж/г | ρQразл, кДж/см3 | Qпл, кДж/моль | ∆Е, кДж/моль | Етв, кДж/моль |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 1.987 | 1.25 | 4.97 | 9.88 | 3.98* | 7.90 | – | – | 172.5 |
| 2 | 1.65 | 1.465 | 5.86 | 9.67 | 2.09* | 3.45 | 17.5* | 11.6 | 206.2 |
| 3 | 1.91 | 1.25 | 6.01 | 11.48 | 4.81** | 9.19 | 32.1** | 21.4 | 175.4 |
| 4 | 1.767 | 1.09 | 5.64 | 9.98 | 4.19* | 7.40 | 12.5* | 8.4 | 169.5 |
| 5 | 1.816 | 1.26 | 6.80 | 12.35 | 4.19* | 7.60 | 34.5** | 23.0 | 187.5 |
| 6 | 1.73 | 0.94 | 6.35 | 10.99 | 2.09* | 3.62 | 17.0* | 11.3 | 162.0 |
| 7 | 1.90 | 1.05 | 6.78 | 12.88 | 1.17* | 2.23 | 31.4** | 20.4 | 192.0 |
| 8 | 1.78 | 1.14 | 6.94 | 12.35 | 5.90* | 10.50 | 43.9* | 29.3 | 192.5 |
| 9 | 1.90 | 1.25 | 6.99 | 3.28 | 5.59** | 10.62 | 26.4** | 17.6 | 191.3 |
| 10 | 1.96 | 1.25 | 5.46 | 10.71 | 4.37** | 8.56 | 37.7* | 25.1 | 178.7 |
| 11 | 1.88 | 1.25 | 7.29 | 13.56 | 5.83** | 10.96 | 25.1** | 16.7 | 191.2 |
| 12 | 2.04 | 1.25. | 6.94 | 1.416 | 4.60* | 9.38 | 26.8** | 17.9 | 169.8 |
| 13 | 1.84 | 1.25 | 8.10 | 1.49 | 1.82* | 3.35 | 21.8** | 14.5 | 183.2 |
| 14 | 2.04 | 1.25 | 6.55 | 13.36 | 4.72* | 9.63 | 40.4* | 26.8 | 180.4 |
Экспериментальное изучение реакции термического разложения в твердом состоянии весьма затруднено (см. обзор [24]). Большинство исследований твердофазных реакций проведено при температурах ниже 550 К, когда преобладающее значение имеет реакция, идущая на дефектах кристалла. В молекулярных кристаллах этими дефектами являются дислокации, образующие границы микроблоков. Считается, что для реакций, идущих на дефектах, т.е. на поверхности микроблоков, энергия активации остается такой же как, в жидкой фазе: Едеф = Еж, а предэкспонент уменьшается примерно в сто раз, Zдеф = 0.01Zж. Это соотношение может быть во многих случаях использовано для оценки Zж по известному значению Едеф. Однако при более высоких температурах доминирующей становится реакция, идущая в ненарушенной кристаллической решетке, т.е. во всем объеме кристалла. Определить эту константу скорости экспериментально удается в редких случаях. Для низкоплавких соединений измерить скорость разложения в твердом состоянии вообще невозможно. Однако, используя полуэмпирическую модель “расплавленной клетки”, развитую для мономолекулярных реакций в твердой фазе (см. [24]), кинетические параметры твердофазного распада с удовлетворительной точностью можно рассчитать, исходя из данных по распаду в жидкой фазе (расплав), которые в случае независимости скорости от полярности среды могут быть заменены на данные, полученные в инертных растворителях или газовой фазе. Согласно этой модели элементарному акту распада предшествует расширение молекулярной клетки до такого объема, в котором действие сил кристаллической решетки исчезает и молекула реагирует с такой же скоростью, как в жидкой фазе.
Расширение молекулярной клетки происходит в результате флуктуации свободного объема, величина которого зависит от температуры. Поэтому образование расплавленной клетки сопровождается появлением добавочной энергии активации (∆Е), связанной с теплотой плавления Qпл простым соотношением: ∆E = RT ln(kж/kтв) = 2Qпл/3. Поступательное движение молекулы как целой частицы в реакции разложения не участвует, и поэтому при расчете ∆Е учитывается только колебательно-вращательная составляющая Qпл. Для реакции, идущей в объеме кристалла, предэкспоненциальный множитель Z при фазовом переходе “жидкость – твердое” не изменяется.
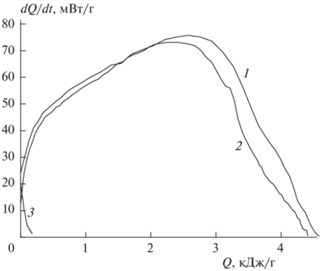
Для нахождения ∆Е необходимо знать Qпл. Для низкоплавких соединений эта величина была определена экспериментально с помощью проточного калориметра STA 449 F5 (Netzsch, Germany), отличающегося высокой чувствительностью и точностью измерения веса и температуры. Пример определения Qпл показан на рис. 2. Для остальных соединений значение Qпл рассчитывалось по известному из справочной литературы правилу: Qпл = 56Тпл [Дж/моль]. Значения Qпл, ∆Е и Етв = Еж + ∆Е приведены в табл.2.
Расчет Ткр, Wкр и r
Из всех переменных, входящих в уравнения (2) и (3), экспериментальному определению не поддаются только температура Ткр и радиус очага rкр. Последние обычно рассчитывают, используя последовательно соотношения (2) и (3) [10]. При этом, как показано в [10], при отсутствии справочных данных по параметрам cр и λ можно использовать их средние значения: ср = 1.25 Дж/г · град и λ = = 10‒3 Вт/см · град, отклонение от которых редко превышает 20%. Результаты расчетов значений Ткр, выполненные с использованием Qразл и Етв при τинд = 10–5 с–1, приведены в табл. 3. Кроме того, отдельно была подсчитана объемная мощность теплового потока в критических условиях: Wкр = ρQразлZ exp(–Етв/RTкр).
Таблица 3.
Значения Ткр и других параметров в критических условиях
| Соединение | Т1 кра, К | Т2 крб, К | Т3 крв, К | Т4 крг, К | k1 · 10–3 c–1 при Т1 кр | Wкр · 10–6, Вт/см3 | rкр · 104, см | Ркр, кбар |
|---|---|---|---|---|---|---|---|---|
| 1 | 1122 | 1076 | 1076 | – | 3.71 | 29.35 | 3.02 | 12.5 |
| 2 | 1156 | 1200 | 1085 | 1031 | 1.34 | 4.63 | 3.06 | 10.6 |
| 3 | 1123 | 1171 | 957 | 945 | 0.63 | 5.89 | 3.08 | 10.1 |
| 4 | 1053 | 1096 | 978 | 962 | 1.99 | 15.7 | 3.43 | 9.5 |
| 5 | 865 | 891 | 755 | 740 | 0.95 | 7.2 | 3.15 | 8.2 |
| 6 | 798 | 823 | 736 | 701 | 0.63 | 2.28 | 3.74 | 8.0 |
| 7 | 887 | 913 | 787 | 734 | 3.16 | 7.04 | 3.37 | 7.1 |
| 8 | 774 | 794 | 652 | 652 | 0.45 | 4.7 | 3.34 | 6.6 |
| 9 | 870 | 896 | 785 | 782 | 0.66 | 7.01 | 3.08 | 5.6 |
| 10 | 737 | 757 | 630 | 625 | 0.69 | 6.40 | 3.06 | 5.2 |
| 11 | 702 | 718 | 639 | 633 | 0.38 | 4.08 | 3.11 | 5.1 |
| 12 | 701 | 720 | 617 | 608 | 0.89 | 8.37 | 3.00 | 3.7 |
| 13 | 633 | 647 | 581 | 556 | 1.26 | 4.2 | 3.00 | 3.4 |
| 14 | 742 | 762 | 628 | 621 | 0.63 | 6.08 | 3.01 | 3.1 |
а Рассчитана по уравнению (2) при τинд = 10–5 с и значениях Етв, Qразл.
б Рассчитана по уравнению (2) при τинд = 5 · 10–6 с и значениях Етв, Qразл.
в Рассчитана по уравнению (2) при τинд = 10–5 с и значениях Еж, Qразл.
г Рассчитана по уравнению (2) при τинд = 10–5 с и значениях Еж, Qмакс.
Из табл. 3 видно, что критический размер очага rкр у всех веществ изменяется в очень узком интервале. Среднее значение rкр = 3 · 10–4 см. Видно также, что тепловой поток Wкр и константа скорости k1 при соответствующей величине Ткр изменяются в ограниченных пределах. В случае k1 наблюдаемый разброс может быть связан с ошибкой, допущенной при экспериментальном определении энергии активации. Поэтому целесообразно охарактеризовать k1 средним значением, k1 ср, и средней погрешностью измерения, ε. Подсчет по данным, приведенным для всех 14 соединений в табл. 3, дает k1 cр = 1.24 ⋅ 103 с–1 и ε = 64%. Отклонение k1 от среднего значения не превышает 2 раз, что лежит в пределах ошибки измерения энергии активации (8 кДж/моль). Можно ожидать, что реальные значения k1 при соответствующей величине Ткр у всех веществ близки к k1 cр и вещества различаются между собой только величиной Ткр, при которой достигается это значение константы скорости. Таким образом, параметр Ткр следует признать характеристикой реакции, наиболее пригодной для обнаружения взаимосвязи реакции с чувствительностью.
Связь Ркр с Ткр
На рис. 3 показана корреляционная связь Ркр с Ткр. Видно, что между этими величинами существует связь с достаточно высоким коэффициентом корреляции R = 0.91 (№ 1 в табл. 4).
Рис. 3.
Корреляционные зависимости Ркр от Т1 кр. Цифры возле точек соответствуют номерам соединений в табл. 1.
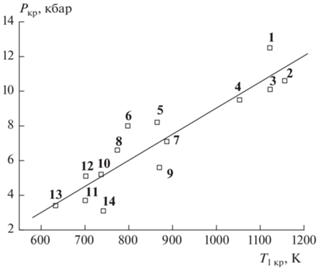
Таблица 4.
Значения коэффициентов корреляционных зависимостей Y = a + bX
| № п/п | X | Y | a | b | R |
|---|---|---|---|---|---|
| 1 | Т1 кр, К | Ркр, кбар | –6.0 ± 1.7 | 0.015 ± 0.002 | 0.91 |
| 2 | Т2 кр, К | Ркр, кбар | –5.7 ± 2.0 | 0.014 ± 0.002 | 0.89 |
| 3 | Т3 кр, К | Ркр, кбар | –4.8 ± 1.5 | 0.015 ± 0.002 | 0.92 |
| 4 | Т4 кр, К | Ркр, кбар | –4.4 ± 1.7 | 0.015 ± 0.002 | 0.89 |
| 5* | ρQмакс, Дж/см3 | Ркр, кбар | 24.4 ± 3.4 | –1.4 ± 0.3 | 0.83 |
| 6* | ρQмакс, Дж/см3 | Т1 кр, К | 1850 ± 240 | 80 ± 20 | 0.77 |
| 7** | ρQмакс, Дж/см3 | Ркр, кбар | 27.9 ± 2.3 | –1.7 ± 0.2 | 0.97 |
| 8** | ρQмакс, Дж/см3 | Т1 кр, К | 2120 ± 90 | 100 ± 7 | 0.99 |
Представляет интерес определить, как влияет на величину Ткр уменьшение τинд, определяемого формулой (2). Принципиально важно также сделать оценку тех изменений Ткр, которые происходят при замене Етв на Еж и Qразл на Qмакс. Результаты соответствующих расчетов представлены в табл. 3. Во избежание путаницы, каждому варианту расчета в табл. 3 присвоен свой номер. Корреляционные соотношения между Ркр и Ткр, рассчитанные для разных сочетаний параметров, представлены в табл. 4.
По результатам проведенных расчетов можно сделать несколько выводов. Если провести расчет Ткр по уравнению (2), уменьшив при этом период индукции в 2 раза, т.е. при τинд = 5 · 10–6 с, то для соединений 1–3 значения Ткр уменьшаются на 50 градусов, т.е. на 5%, а для остальных соединений эти изменения еще менее значительны. При этом корреляционная связь Ткр с Ркр сохраняется на высоком уровне (№ 2 в табл. 4). Хорошая корреляция между Ткр и Ркр наблюдаются и в том случае, если вместо Етв использовать Еж в сочетании как с Qразл, так и с Qмакс (№ 3 и № 4 в табл. 4). Сами значения Ткр при этом уменьшаются на 50–100 градусов.
Устойчивость связи Ркр с Ткр свидетельствует о сильной зависимости чувствительности от скорости разложения и сравнительно малом влиянии на нее других факторов. Признавая универсальный характер зависимости Ркр от Ткр, корреляционное соотношение № 4 (табл. 4), для построения которого вместо Qразл и Етв используются точнее и легче определяемые величины Еж и Qмакс, можно рекомендовать для оценки относительной чувствительности новых соединений. Точность прогноза зависит от точности определения кинетических параметров реакции, но даже при приближенной оценке этих параметров и Ткр возможно разделение соединений на три категории: ВВ малочувствительные, имеющие Pкр > 10 кбар, высокочувствительные (Ркр < 5 кбар) и обладающие средней чувствительностью (Ркр = 6–10 кбар).
Учитывая доминирующую роль реакции разложения, можно предположить, что упомянутая выше взаимосвязь Ркр и энергетических (ρQмакс и КБ) или других показателей соединений существует только в тех случаях, когда сами эти показатели коррелируют с Ткр. Например, зависимость Ркр от ρQмакс (№ 5 в табл. 4), построенная для соединений 1–14, имеет коэффициент корреляции R = 0.87. Такую же пониженную величину R = 0.77 имеет зависимость Ткр от ρQмакс (№ 6 в табл. 4). Однако если на кривой зависимости № 5 убрать сильно выпадающие точки и провести сопоставление Ркр с ρQмакс по соединениям 1, 2, 5, 7, 11–13, то корреляция (№ 7 в табл. 4) сильно улучшается (R = 0.97). Одновременно до R = 0.99 повышается коэффициент корреляции для зависимости Ткр от ρQмакс (№ 8 в табл. 4).
Связь Ткр с ρQмакс или КБ является не совсем случайной. Наиболее вероятным представляется проявление этой связи в группе мощных ВВ. Повышение мощности ВВ достигается путем компактного насыщения молекул группами NO2 или другими эксплозофорными группами. При этом повышаются энтальпия образования соединения, Qмакс и КБ. Находясь в α- или β-положениях относительно реакционного центра, NO2-группы как электроотрицательные заместители влияют на скорость реакции. Отсюда и возникает связь ρQмакс или КБ с Ткр. Очевидно, однако, что эта связь является возможной, но не обязательной. Если нитрогруппа вводится вдали от реакционного центра, то Qмакс и КБ будут расти, а скорость реакции не изменится; при этом не будет изменяться и Ркр. Примеры постоянства чувствительности в широком диапазоне изменения КБ можно найти в работе [3]. В соединениях с положительным КБ тепловой эффект Qмакс из-за избытка окислителя уменьшается, а константа скорости k1 может увеличиться. В литературе отмечаются также случаи увеличения чувствительности при снижении энергетики соединений [25]. Это происходит из-за полной потери связи между Qмакс и скоростью реакции. Так, например, в ряду пикриновая кислота – тринитрорезорцин – тринитрофлороглюцин Qмакс уменьшается, а частость взрыва, определенная на стандартном копре по ГОСТ 4545-88, возрастает с 25 до 100%.
Разложение пикриновой кислоты заключается в переносе атома Н от группы OH к нитрогруппе, т.е. в изомеризации в ациформу. Реакция имеет один реакционный центр, включающий группу OH и одну из нитрогрупп, находящихся в орто-положении. Нитрогруппы в мета- и пара-положениях в реакции не участвуют. При введении второй и третьей группы OH возникают новые центры реакции, идентичные первому. При этом тепловой эффект Qразл увеличивается соответственно в 2 и 3 раза, а главное, как показано в работах [11, 26], возрастает скорость реакции. Поэтому чувствительность с уменьшением Qмакс не падает, а растет.
Необходимо отметить, что хорошая корреляция между Ркр и Ткр может наблюдаться только в том случае, если первая стадия инициирования у всех веществ будет протекать в одинаковых условиях, т.е. прочность на сдвиг, σпр, у всех веществ будет примерно одинаковой. По-видимому, такое постоянство σпр имеет место для большинства НСNO-соединений. Во всяком случае, изменение σпр в этом ряду не приводит к заметному искажению корреляционных соотношений между Ркр и Ткр. Тем не менее вопрос о влиянии σпр на Ркр HCNO-соединений заслуживает более детального рассмотрения. По данным, полученным в [10], в ряду тротил – пикриновая кислота – тетрил – ТЭН – гексоген – октоген значения σпр равны соответственно 40, 52, 53, 60, 82, 125 МПа. Отклонение октогена от других соединений по величине σпр следует признать значительным. Возможно, что именно из-за повышенного значения σпр октоген имеет более высокую чувствительность, чем гексоген, хотя по величине Ткр эти соединения отличаются мало. В монографии [10] отмечается также, что σпр увеличивается с ростом температуры плавления и может зависеть от строения соединений. Самым важным свойством, влияющим на величину σпр, является пластичность материала. Аномально высокое значение Ркр у ТАТБ может быть связано с тем, что это вещество, имея слоистое строение кристаллов [27], обладает определенной пластичностью и, следовательно, пониженным σпр.
В свете полученных результатов можно признать, что чувствительность HCNO-соединений, т.е. практически всех реальных ВВ, определяется в основном скоростью тепловыделения в реакции разложения. Полезным свойством соединений, снижающим чувствительность, является также пластичность кристаллов.
ЗАКЛЮЧЕНИЕ
Для 14-ти взрывчатых веществ, которые представляют все основные классы ВВ состава НCNO, по формулам, описывающим очаговое самовоспламенение, проведен расчет критической температуры Ткр с использованием (в соответствии с рекомендацией тепловой теории чувствительности) кинетических параметров (Е и z), а также теплового эффекта (Qразл) реакции термического разложения в твердой фазе. Показано, что Ткр является наиболее точной характеристикой реакции разложения. Значения Ткр лежат в интервале 700–1150 К. Между Ркр и Ткр существует корреляционная cвязь: Ркр [кбар] = –6.0 + 0.002Ткр (R = 0.91). При замене Qразл и Етв на легче и точнее определяемые параметры, Qмакс и Еж, значения Ткр уменьшаются, но корреляционная связь Ткр с Ркр сохраняется на прежнем уровне: Ркр [кбар] = –4.4 + + 0.015Ткр (R = = 0.89). Эту корреляцию целесообразно использовать для приближенного прогноза относительной чувствительности новых соединений. Показано также, что описанные в литературе корреляционные зависимости чувствительности от энергетических показателей соединений (теплоты взрыва и кислородного баланса) существуют только в тех случаях, когда сами эти показатели коррелируют с Ткр.
Работа выполнена по темам госзаданий (регистрационные номера АААА-А19-119101690058-9, АААА-А19-119120690042-9 и АААА-А21-121011990037-8).
Список литературы
Пепекин В.И., Корсунский Б.Л., Денисаев А.А. // Физика горения и взрыва. 2008. Т. 44. № 5. С. 101.
Kamlet M.J., Adolph H.G. // Proc. 7th Sympos. (Intern.) on Detonation. V. 1. Annapolis, MD: NSWC, 1981. P. 60.
Kamlet M.J., Adolph H.G. // Prop., Expl., Pyrotech. 1979. V. 4. № 2. P. 30; https://doi.org/10.1002/prep.19790040204
Mullay J. // Ibid. 1987. V. 12. № 1. P. 60; https://doi.org/10.1002/prep.19870120403
Литвинов Б.В. Избр. тр. Снежинск: Изд-во РФЯЦ-ВНИИТФ, 2014. С. 353.
Zeman S. // Prop., Expl., Pyrotech. 2000. V. 25. № 2. P. 66; https://doi.org/10.1002/(SICI)1521-4087(200004)25:2<66: :AID-PREP66>3.0.CO;2-Q
Холево Н.А. Чувствительность взрывчатых веществ к удару. М.: Машиностроение, 1974.
Дубовик А.В. // Взрывное дело. 2020. № 126/83. С. 38
Гальперин Л.Н., Колесов Ю.Р., Машкинов Л.Б. и др. // Тр. 4-й Всесоюз. конф. по калориметрии. Тбилиси: Мецниереба, 1973. С. 539.
Афанасьев Г.Т., Боболев В.К. Инициирование твердых взрывчатых веществ ударом. М.: Наука, 1968.
Манелис Г.Б., Назин Г.М., Рубцов Ю.И., Струнин В.А. Термическое разложение и горение взрывчатых веществ. М.: Наука, 1996.
Назин Г.М., Дубихин В.В., Далингер И.Л., Казаков А.И., Набатова А.В. // Хим. физика. 2021. Т. 40. № 1. С. 30; https://doi.org/10.31857/S0207401X21010118
Назин Г.М., Корсунский Б.Л. // Хим. физика. 2021. Т. 40. № 3. С. 53; https://doi.org/10.31857/S0207401X21030092
Назин Г.М., Дубихин В.В., Гончаров Т.К. и др. // Хим. физика. 2021. Т. 40. № 6. С. 54; https://doi.org/10.31857/S0207401X21060121
Дубовик А.В. // Хим. физика. 2022. Т. 41. № 3. С. 49; https://doi.org/10.31857/S0207401X22030050
Афанасьев Г.Т., Пепекин В.И. // Хим. физика. 2005. Т. 24. № 6. С. 70.
Фаляхов И.Ф., Шарнин Г.П., Сафин Н.М. и др. // Матер. 21 Междунар. пиротех. сем. М.: ИХФ РАН, 1995. С. 184.
Андреев К.К., Лю Бао-фен // Теория взрывчатых веществ. М.: Оборонгиз, 1963. С. 349.
Patil D.G., Brill T.B. // Combust. and Flame. 1991.V. 87. P. 143.
Неделько В.В., Захаров В.В., Корсунский Б.Л. и др. // Хим. физика. 2013. Т. 32. № 3. С. 25; https://doi.org/10.7868/S0207401X13030060
Дубовик А.В. Чувствительность твердых взрывчатых систем к удару. М.: РХТУ им. Д.И. Менделеева, 2011.
Мержанов А.Г., Барзыкин В.В., Гонтковская В.Т. // ДАН. 1968. Т. 148. № 2. С. 380.
Дубовик А.В. // Там же. 1986. Т. 286. № 2. С. 333.
Манелис Г.Б., Назин Г.М., Прокудин В.Г. // Изв. АН. Сер. хим. 2011. № 11. С. 1417.
Нестеренко Д.А., Гаранин В.А., Казаков А.И. и др. // Хим. физика. 2014. Т. 33. № 10. С. 46; https://doi.org/10.7868/S0207401X14100094
Fan J., Gu Z., Xiao H., Dong H. // J. Phys. Org. Chem. 1998. V. 11. № 3. P. 177; https://doi.org/10.1002/(SICI)1099-1395(199803)11: 3<177::AIDC990>3.0.CO;2-9
Cady H.H., Larson A.C. // Acta Cryst. 1965. V. 18. № 3. P. 485; https://doi.org/10.1107/s0365110x6500107x
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика