Химическая физика, 2023, T. 42, № 3, стр. 58-62
Кинетические характеристики газификации уротропина в потоках азота и углекислого газа
Е. А. Салганский 1, *, Д. О. Глушков 2, М. В. Салганская 1
1 Институт проблем химической физики Российской академии наук
Черноголовка, Россия
2 Национальный исследовательский Томский политехнический университет
Томск, Россия
* E-mail: sea@icp.ac.ru
Поступила в редакцию 26.08.2022
После доработки 15.09.2022
Принята к публикации 20.09.2022
- EDN: NCSTBG
- DOI: 10.31857/S0207401X23030147
Аннотация
На основе данных термогравиметрического анализа и дифференциальной сканирующей калориметрии определены кинетические характеристики термического разложения уротропина в потоках N2 и CO2. Скорости нагрева образцов составляли 20, 60 и 90 К/мин. Значения кинетических констант скорости разложения уротропина определены по методу Киссинджера. При газификации в азоте энергия активации термораспада уротропина увеличивается со 106 до 139 кДж/моль в условиях роста степени превращения вещества. Значение предэкспонента также увеличивается с 0.35 · 109 до 145 · 109 с–1. Разложение уротропина протекает по экзотермической реакции с теплотой 368, 339 и 275 кДж/кг для скоростей нагрева 20, 60 и 90 К/мин соответственно. При газификации в углекислом газе энергия активации термораспада уротропина сначала увеличивается со 110 до 132 кДж/моль по мере увеличения степени превращения, а затем снижается до 120 кДж/моль. Теплота разложения уротропина в потоке СО2 составляет 382, 327 и 303 кДж/кг для скоростей нагрева 20, 60 и 90 К/мин соответственно.
ВВЕДЕНИЕ
Уротропин (гексаметилентетрамин, гексамин) – это полициклический амин, широко применяемый в медицине [1, 2], в производстве фенолформальдегидных смол [3], при получении белковых и других пластмасс [4, 5], в качестве пищевой добавки [6], а также в производстве энергетических веществ [7, 8]. Одной из особенностей уротропина является то, что при нагревании он разлагается без плавления. Поэтому уротропин применим в качестве модельного горючего для исследования режимов и характеристик работы низкотемпературных газогенераторов [9]. Продукты разложения горючего являются источниками калорийных газов, сжигаемых в энергетических установках [10–12]. Для различных аппаратов разрабатываются свои силовые установки [13–15].
Математическое моделирование процесса газификации горючих веществ основано на исходных данных о скоростях химических реакций разложения. Известно [16–18], что режим и скорость термодеструкции веществ определяются температурными условиями процесса. Для измерения скорости реакции процесса широко применяется метод термогравиметрического анализа (ТГА) [19–21]. Для определения теплоты химической реакции используют метод дифференциальной сканирующей калориметрии (ДСК) [22–24].
Газификация горючего в низкотемпературном газогенераторе протекает в условиях фильтрации высокотемпературных газов. Закономерности фильтрации через пористое горючее аналогичны фильтрационному горению твердых топлив [25, 26]. Основные компоненты продуктов горения таких топлив – азот, углекислый газ и пары воды. То есть газификация горючего в газогенераторе протекает в инертной или восстановительной среде. Поэтому целью работы является определение кинетических характеристик термического разложения уротропина в инертной и восстановительной средах.
МЕТОДИКА ЭКСПЕРИМЕНТА
При проведении серий ТГА- и ДСК-исследований использовался технический уротропин (ТУ 2478-014-74999404-2006) плотностью 1157 кг/м3. Масса навесок уротропина для термоанализатора TGA/DSC 3+ производства компании Mettler Toledo (Switzerland) составляла около 40 мг. В качестве фильтрующегося газа в разных сериях анализов использовали азот и углекислый газ. Расход газа составлял около 60 мл/мин. Навески уротропина в корундовых тиглях нагревали от 300 до 650 К (от комнатных значений температуры до значений, при которых заканчивалось протекание физико-химических процессов) со скоростями 20, 60 и 90 К/мин. Систематические погрешности измерения температуры и массы составляли ±0.5 К и 5 мкг соответственно. Обработка ТГА-данных осуществлялась с помощью ПО STARe (Mettler Toledo, Switzerland). Основными регистрируемыми характеристиками в условиях термической конверсии навески были потеря массы и величина теплового потока.
Значения кинетических характеристик термического разложения уротропина определялись в рамках метода Киссинджера [27–29]:
Таким образом, согласно приведенному выше выражению реализуется линейная зависимость его левой части от обратной температуры. По величине углового коэффициента такой линейной функции можно рассчитать энергию активации, а с использованием значения свободного коэффициента – предэкспонент [30].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На рис. 1 и 2 приведены кривые ТГ, ТГА процесса газификации уротропина в инертной (N2) и восстановительной (CO2) средах. В зависимости от скорости нагрева использованы следующие обозначения кривых: 1 – 20 К/мин, 2 – 60 К/мин, 3 – 90 К/мин.
Рис. 1.
Кривые ТГ (изменения массы) процесса газификации уротропина в потоке азота (сплошные линии) и углекислого газа (штриховые). Скорость нагрева: 1 – 20 К/мин, 2 – 60 К/мин, 3 – 90 К/мин.
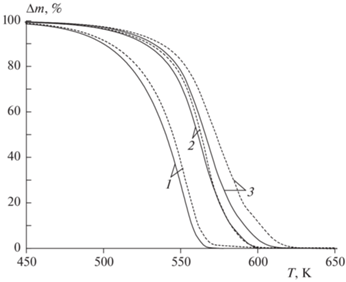
Рис. 2.
Кривые ТГА (скорости изменения массы) процесса газификации уротропина в потоке азота (сплошные линии) и углекислого газа (штриховые). Скорость нагрева: 1 – 20 К/мин, 2 – 60 К/мин, 3 – 90 К/мин.
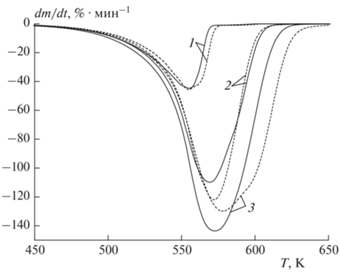
На рис. 1 представлены зависимости (кривые ТГ) изменения массы уротропина от температуры в потоках азота и углекислого газа. Газификация уротропина интенсифицируется после его прогрева до температуры 450 К. В инертной среде образец полностью газифицируется при достижении температур 566, 597 и 612 К для скоростей нагрева 20, 60 и 90 К/мин соответственно. Стоит отметить, что соответствующие начальные массы навесок составляли 38.63, 40.06 и 40.87 мг.
В потоке углекислого газа уротропин полностью газифицируется при достижении температур 589, 598 и 623 К соответственно для скоростей нагрева 20, 60 и 90 К/мин. Соответствующие начальные массы навесок составляли 40.49, 39.94 и 39.90 мг. На основании результатов анализа можно сделать обоснованный вывод, что в восстановительной среде газификация уротропина протекает дольше, чем в инертной, при идентичных условиях нагрева.
На рис. 2 представлены зависимости (кривые ТГА) скорости изменения массы уротропина от температуры в потоках азота и углекислого газа. Для скорости нагрева 20 К/мин максимальная скорость уменьшения массы уротропина составляет 45% · мин–1 при температуре 555 К как в потоке азота, так и в потоке углекислого газа. При скорости нагрева 60 К/мин максимальная скорость потери массы уротропина составляет 110% · мин–1 при температуре 569 К в потоке азота и 122% · мин–1 при температуре 572 К в потоке углекислого газа. При скорости нагрева 90 К/мин максимальная скорость уменьшения массы уротропина составляет 144% · мин–1 при температуре 573 К в потоке азота и 130% · мин–1 при температуре 578 К в потоке углекислого газа. В условиях наиболее высокой скорости нагрева в восстановительной среде газификация уротропина протекает медленнее, чем в азоте, и максимальная скорость изменения массы характерна для области относительно больших значений температуры. Также стоит отметить, что чем выше скорость нагрева уротропина, тем в более широком температурном диапазоне протекает газификация.
На рис. 3 представлены графики зависимости ln(β/T 2) = f(1/T) при разных значениях степени превращения (25, 50 и 75%) уротропина для определения энергии активации его газификации в потоках азота и углекислого газа. Результаты расчета кинетических констант газификации уротропина представлены в табл. 1. В случае газификации в азоте энергия активации термораспада уротропина увеличивается со 106 до 139 кДж/моль с ростом степени превращения. Значение предэкспонента также возрастает. При газификации в углекислом газе энергия активации термораспада уротропина сначала увеличивается со 110 до 132 кДж/моль по мере увеличения степени превращения, а затем снижается до 120 кДж/моль. Аналогичная тенденция характерна для изменения значений предэкспонента.
Рис. 3.
Графики зависимости ln(β/T 2) = f(1/T) при разных значениях степени превращения уротропина: 1 – 25%, 2 – 50%, 3 – 75%, для определения энергии активации его газификации в потоке азота (сплошные линии и темные точки) и углекислого газа (штриховые линии и светлые точки).
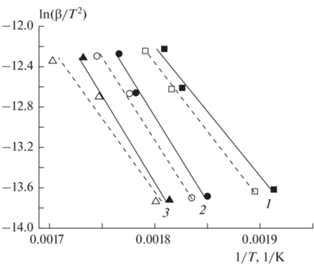
Таблица 1.
Значения кинетических констант газификации уротропина в потоке N2 или CO2 при разных значениях степени превращения
| Степень превращения, % | Е, Дж/моль | k0, с–1 | ||
|---|---|---|---|---|
| N2 | CO2 | N2 | CO2 | |
| 25 | 106 290 | 110 125 | 0.35 · 109 | 0.69 · 109 |
| 50 | 135 377 | 131 725 | 123 · 109 | 42.6 · 109 |
| 75 | 138 899 | 119 588 | 145 · 109 | 1.66 · 109 |
Полученные результаты хорошо соответствуют результатам ранее выполненных исследований [31, 32]. В работе [31] изучена газификация уротропина в потоке азота при скоростях нагрева менее 10 К/мин, а также в изотермических условиях. Установленное значение энергии активации разложения уротропина составляет около 120 кДж/моль, а предэкспонента – 7.98 · 109 с–1. В работе [32] проведены эксперименты по разложению уротропина в аналогичных условиях. Установленное значение энергии активации его разложения составляет около 150 кДж/моль.
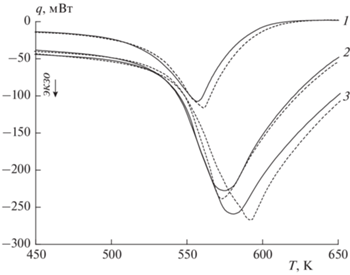
На рис. 4 представлены зависимости (кривые ДСК) теплового потока от температуры при газификации уротропина в потоке азота и в потоке углекислого газа. Видно, что разложение уротропина – это экзотермический процесс. Чем выше скорость нагрева, тем больше значение модуля теплового потока [33]. При этом минимальные значения теплового потока соответствуют области относительно больших значений температуры. Результаты ДСК позволяют оценить теплоту газификации уротропина, которая в данной работе определялась для степени превращения образца в диапазоне от 2 до 98%. В инертной среде теплота газификации уротропина составила 368, 339 и 275 кДж/кг для скоростей нагрева 20, 60 и 90 К/мин соответственно. Для аналогичных условий в восстановительной среде теплота газификации уротропина составила 382, 327 и 303 кДж/кг соответственно. Для сравнения авторами работы [31] в рамках исследования газификации уротропина в потоке азота установлено, что значение теплоты его разложения составляет около 319 кДж/кг, но для моделирования этого процесса предложено использовать значение, равное 286 кДж/кг.
ЗАКЛЮЧЕНИЕ
В рамках методов термогравиметрического анализа и дифференциальной сканирующей калориметрии определены кинетические характеристики термического разложения уротропина в инертной и восстановительной средах. В качестве фильтрующегося газа использованы азот и углекислый газ. Скорость нагрева навесок составляла 20, 60 и 90 К/мин. Значения кинетических констант процесса сублимации уротропина определены по методу Киссинджера.
Для процесса газификации в инертной среде получены следующие характеристики. Для степени превращения вещества в 25, 50 и 75% значения энергии активации термораспада уротропина составляют 106, 135 и 139 кДж/моль, соответственно, а значения предэкспоненциального коэффициента для аналогичных условий – 0.35 · 109, 123 · 109 и 145 · 109 с–1. Процесс разложения уротропина является экзотермическим с выделением 368, 339 и 275 кДж/кг теплоты для скоростей нагрева 20, 60 и 90 К/мин соответственно.
При газификации уротропина в восстановительной среде значения энергии активации термораспада составляют 110, 132 и 120 кДж/моль соответственно для степени превращения вещества 25, 50 и 75%. Соответствующие значения предэкспоненциального коэффициента равны 0.69 · 109, 42.6 · 109 и 1.66 · 109 с–1. Процесс разложения уротропина идет по экзотермической реакции с выделением 382, 327 и 303 кДж/кг теплоты для скоростей нагрева 20, 60 и 90 К/мин соответственно.
Исследование выполнено по теме госзадания (регистрационный номер АААА-А19-119100800130-0).
Список литературы
Stepankova H., Swiatkowski M., Kruszynski R. et al. // Intern. J. Nanomed. 2021. V. 16. P. 4431; https://doi.org/10.2147/IJN.S304902
Tseng K.W., Hsiao Y.P., Jen C.P. et al. // Sensors. 2020. V. 20. 2455; https://doi.org/10.3390/s20092455
Виткалова И.А., Торлова А.С., Пикалов Е.С. // Науч. обозрение. Техн. науки. 2017. № 2. С. 15.
Третьяков А.О. // Хим. пром-сть. 2005. Т. 82. № 11. С. 551.
Сапченко С.А., Барсукова М.О., Нохрина Т.В. и др. // Изв. АН. Сер. хим. 2020. № 3. С. 461.
Воробьёв В.В. // Аграрная Россия. 2010. № 2. С. 2.
Xie Q., Zhang L., Yu X. et al. // Propell. Explos. Pyrotech. 2020. V. 45. № 12. P. 1859; https://doi.org/10.1002/prep.202000087
Turhan H., Atalar T., Erdem N. et al. // Ibid. 2013. V. 38. № 5. P. 651; https://doi.org/10.1002/prep.201200162
Salganskaya M.V., Zaichenko A.Yu., Podlesniy D.N. et al. // Acta Astronaut. 2022; https://doi.org/10.1016/j.actaastro.2022.08.039
Аврашков В.Н., Метёлкина Е.С., Мещеряков Д.В. // Физика горения и взрыва. 2010. Т. 46. № 4. С. 36.
Селезнев Р.К. // Физ.-хим. кинетика в газ. динамике. 2014. Т. 15. № 3. С. 4.
Салганский Е.А., Луценко Н.А. // Хим. физика. 2022. Т. 41. № 3. С. 68; https://doi.org/10.31857/S0207401X22030116
Белобровина М.В., Сенюшкин Н.С. // Актуальные пробл. авиации и космонавтики. 2013. Т. 1. № 9. С. 47.
Salgansky E.A., Lutsenko N.A. // Aerosp. Sci. Technol. 2021. V. 109. 106420; https://doi.org/10.1016/j.ast.2020.106420
Фролов С.М., Иванов В.С. // Хим. физика. 2021. Т. 40. № 4. С. 68.
Михалкин В.Н., Сумской С.И., Тереза А.М. и др. // Хим. физика. 2022. Т. 41. № 8. С. 3; https://doi.org/10.31857/S0207401X2208009X
Юрьев Б.П., Дудко В.А. // Хим. физика. 2022. Т. 41. № 1. С. 17; https://doi.org/10.31857/S0207401X22010174
Tereza A.M., Medvedev S.P., Smirnov V.N. // Acta Astronaut. 2021. V. 181. P. 612; https://doi.org/10.1016/j.actaastro.2020.09.048
Гольдберг В.М., Ломакин С.М., Тодинова А.В. и др. // Изв. АН. Сер. хим. 2010. № 4. С. 790.
Sieradzka M., Mlonka-Mędrala A., Magdziarz A. // Fuel. 2022. V. 330. 125566; https://doi.org/10.1016/j.fuel.2022.125566
Жуйков А.В., Глушков Д.О. // ХТТ. 2022. № 5. С. 45.
Назин Г.М., Дубихин В.В., Казаков А.И. и др. // Хим. физика. 2022. Т. 41. № 1. С. 48; https://doi.org/10.31857/S0207401X22010125
Shen H., Qiao H., Zhang H. // Chem. Eng. J. 2022. V. 450. 137905; https://doi.org/10.1016/j.cej.2022.137905
Ramirez-Gutierrez C.F., Lujan-Cabrera I.A., Valencia-Molina L.D. et al. // Mater. Today Commun. 2022. V. 33. 104188; https://doi.org/10.1016/j.mtcomm.2022.104188
Салганская М.В., Глазов С.В., Салганский Е.А. и др. // Хим. физика. 2008. Т. 27. № 1. С. 27.
Rabinovich O.S., Malinouski A.I., Kislov V.M. et al. // Combust. Theor. Model. 2016. V. 20. № 5. P. 877; https://doi.org/10.1080/13647830.2016.1190034
Miura K., Maki T. // Energy Fuels. 1998. V. 12. № 5. P. 864; https://doi.org/10.1021/ef970212q
Zhang J., Wang Z., Zhao R. et al. // Energies. 2020. V. 13. 3313; https://doi.org/10.3390/en13133313
Zhang J., Chen T., Wu J. et al. // Roy. Soc. Chem. Adv. 2014. V. 4. 17513; https://doi.org/10.1039/c4ra01445f
Vyazovkin S. // Molecules. 2020. V. 25. 2813; https://doi.org/10.3390/molecules25122813
Rao G., Feng W., Zhang J. et al. // J. Therm. Anal. Calorim. 2019. V. 135. № 4. P. 2447; https://doi.org/10.1007/s10973-018-7359-8
Peng H.L., Chen L.P., Lu G.B. et al. // Hanneng Cailiao/Chinese J. Energetic Mater. 2016. V. 24. № 5. P. 497; https://doi.org/10.11943/j.issn.1006-9941.2016.05.012
Салганский Е.А., Фурсов В.П., Глазов С.В. и др. // Физика горения и взрыва. 2003. Т. 39. № 1. С. 44.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика