Химическая физика, 2022, T. 41, № 7, стр. 23-31
Селективность комплексных катализаторов этилалюминийдихлорид–протонодонор из фракции C4 при инициировании реакции олигомеризации изобутилена
Г. Е. Заиков 1, *, М. И. Арцис 1, Д. С. Андреев 2, А. В. Игнатов 2
1 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
2 Себряковский филиал Волгоградского государственного
технического университета
Михайловка, Волгоградской обл., Россия
* E-mail: chembio@sky.chph.ras.ru
Поступила в редакцию 08.12.2021
После доработки 26.01.2022
Принята к публикации 21.02.2022
- EDN: AGFVHD
- DOI: 10.31857/S0207401X22070160
Аннотация
Методом ab initio HF/3-21G изучен механизм инициирования изобутилена в присутствии комплексных катализаторов этилалюминийдихлорид–протонодонор (вода, фенол, соляная кислота). Оценена энергетика этих реакций, получены значения их энергии активации и тепловых эффектов. Установлено, что в ряду изучаемых катализаторов увеличение энергии активации реакции инициирования олигомеризации изобутилена из фракции C4 симбатно с селективностью этого процесса.
ВВЕДЕНИЕ
Селективность химических реакций является важнейшей характеристикой многих технологических процессов, в частности процессов олигомеризации (теломеризации, полимеризации, изомеризации и т.д.) изобутилена из фракции C4 в присутствии комплексных катализаторов типа этилалюминийдихлорид–протонодонор (вода, фенол, соляная кислота) [1–4]. Эта реакция относится к очень быстрым процессам, изучению которых уделяется достаточно большое внимание последнее время. Это касается как особенностей кинетики, так и квантовохимического моделирования в растворе и газовой фазе [5–8]. В работе [1] показано, что дальнейшему пониманию вопроса о селективности вышеперечисленных инициаторов может способствовать квантовохимическое изучение механизмов инициирования изобутилена в присутствии этих катализаторов. Однако представленные расчеты в этой работе выполнены полуэмпирическим методом CNDO/2, ошибка которого по энергетическим параметрам составляет 40 кДж/моль и как минимум на сегодняшний день эти расчеты требуют уточнения.
В связи с этим целями настоящей работы были изучение механизма инициирования реакции олигомеризации изобутилена из фракции C4 в присутствии комплексных катализаторов этилалюминийдихлорид (C2H5AlCl2) – протонодонор (H2O, HOC6H5, HCl) квантовохимическим методом ab initio HF/3-21G, точность которого равна 5 кДж/моль, и в связи с новыми полученными данными – более глубокая интерпретация вопроса о селективности этого процесса.
МЕТОДИЧЕСКАЯ ЧАСТЬ
Квантовохимический расчет изучаемых механизмов реакций выполнялся методом ab initio HF/3-21G [9] по методике, примененной, например, в работах [10–13], с использованием программного обеспечения, представленного в работах [14–16]. Расчет выполнен для изолированной молекулы в газовой фазе и, для сравнения, в гептане. Общий заряд изучаемых систем равен нулю, а мультиплетность равна единице. Оптимизация положения изучаемых изоолефинов относительно катализатора на каждом этапе взаимодействия выполнялась по всем параметрам. В качестве координат реакции для изобутилена были выбраны два направления: H+–Cα (атака протоном на α-углеродный атом) и H+–Cβ (атака протоном на β-углеродный атом).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Структуры исходных и конечных моделей взаимодействия активных центров (АЦ) комплексных катализаторов с изобутиленом показаны ниже на рис. 1–9, изменение зарядов на атомах – в табл. 1–3.
Рис. 1.
Структура исходной модели комплексного катализатора AlCl2C2H5–вода (Cα) с изобутиленом. Расстояние между атомами C1 и H14 равно 3.1 Å.
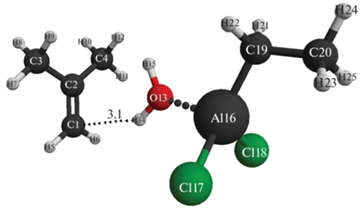
Рис. 2.
Конечная атомно-молекулярная структура взаимодействия комплексного катализатора AlCl2C2H5–вода (Cα) с изобутиленом.
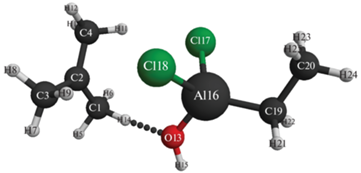
Рис. 3.
Изменение общей энергии (ΔE) вдоль координаты реакции взаимодействия комплексного катализатора AlCl2C2H5–вода (Cα) с изобутиленом.

Рис. 4.
Структура исходной модели комплексного катализатора AlCl2C2H5–фенол (Cα) с изобутиленом. Расстояние между атомами C1 и H13 здесь и ниже на рис. 7 равно 3.1 Å.
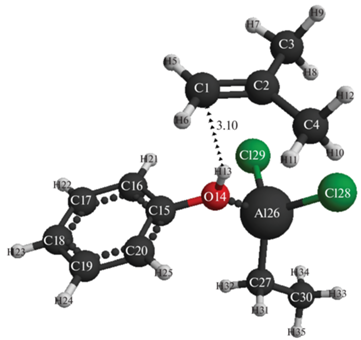
Рис. 5.
Конечная атомно-молекулярная структура взаимодействия комплексного катализатора AlCl2C2H5–фенол (Cα) с изобутиленом.
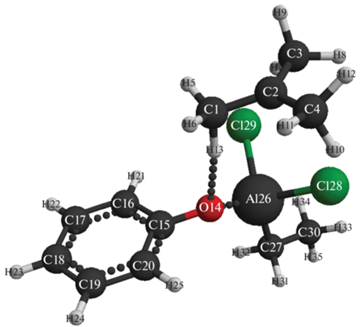
Рис. 6.
Изменение общей энергии (ΔE) вдоль координаты реакции взаимодействия комплексного катализатора AlCl2C2H5–фенол (Cα) с изобутиленом.
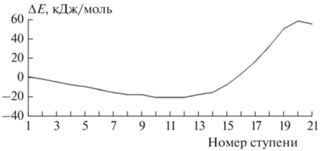
Рис. 7.
Структура исходной модели комплексного катализатора AlCl2C2H5 – соляная кислота (Cα) с изобутиленом.
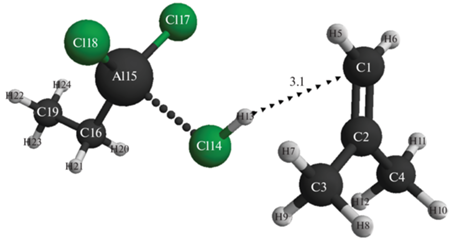
Рис. 8.
Конечная атомно-молекулярная структура взаимодействия комплексного катализатора AlCl2C2H5 – соляная кислота (Cα) с изобутиленом.

Рис. 9.
Изменение общей энергии (ΔE) вдоль координаты реакции взаимодействия комплексного катализатора AlCl2C2H5 – соляная кислота (Cα) с изобутиленом.

Таблица 1.
Заряды на всех атомах изучаемой молекулярной системы вдоль координаты реакции взаимодействия комплексного катализатора AlCl2C2H5–вода (Cα) с изобутиленом
| Атом | Номер ступени взаимодействия | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | |
| C(1) | –0.436 | –0.424 | –0.432 | –0.434 | –0.438 | –0.443 | –0.453 | –0.461 | –0.475 | –0.495 | –0.517 | –0.545 | –0.579 | –0.621 | –0.659 | –0.713 | –0.761 | –0.812 | –0.854 | –0.855 | –0.633 |
| C(2) | –0.095 | –0.115 | –0.114 | –0.118 | –0.119 | –0.119 | –0.114 | –0.113 | –0.106 | –0.093 | –0.080 | –0.063 | –0.044 | –0.021 | –0.006 | 0.021 | 0.043 | 0.069 | 0.104 | 0.157 | –0.047 |
| C(3) | –0.599 | –0.606 | –0.608 | –0.608 | –0.609 | –0.609 | –0.608 | –0.608 | –0.608 | –0.608 | –0.608 | –0.609 | –0.610 | –0.611 | –0.613 | –0.615 | –0.618 | –0.622 | –0.630 | –0.651 | –0.549 |
| C(4) | –0.599 | –0.607 | –0.617 | –0.618 | –0.618 | –0.617 | –0.617 | –0.617 | –0.617 | –0.617 | –0.618 | –0.619 | –0.621 | –0.624 | –0.626 | –0.634 | –0.636 | –0.642 | –0.654 | –0.684 | –0.628 |
| H(5) | 0.220 | 0.216 | 0.214 | 0.215 | 0.216 | 0.217 | 0.218 | 0.219 | 0.221 | 0.222 | 0.224 | 0.226 | 0.229 | 0.232 | 0.237 | 0.242 | 0.249 | 0.256 | 0.263 | 0.265 | 0.235 |
| H(6) | 0.223 | 0.227 | 0.227 | 0.228 | 0.230 | 0.232 | 0.234 | 0.236 | 0.239 | 0.242 | 0.246 | 0.250 | 0.256 | 0.264 | 0.272 | 0.286 | 0.295 | 0.305 | 0.312 | 0.308 | 0.235 |
| H(7) | 0.225 | 0.218 | 0.217 | 0.217 | 0.217 | 0.218 | 0.218 | 0.219 | 0.219 | 0.220 | 0.221 | 0.222 | 0.223 | 0.224 | 0.226 | 0.227 | 0.230 | 0.235 | 0.243 | 0.258 | 0.235 |
| H(8) | 0.233 | 0.236 | 0.235 | 0.235 | 0.236 | 0.237 | 0.237 | 0.237 | 0.238 | 0.238 | 0.239 | 0.239 | 0.240 | 0.241 | 0.242 | 0.244 | 0.247 | 0.250 | 0.257 | 0.267 | 0.217 |
| H(9) | 0.190 | 0.200 | 0.211 | 0.214 | 0.216 | 0.219 | 0.221 | 0.223 | 0.225 | 0.227 | 0.229 | 0.230 | 0.232 | 0.234 | 0.237 | 0.238 | 0.243 | 0.249 | 0.261 | 0.291 | 0.522 |
| H(10) | 0.233 | 0.234 | 0.231 | 0.232 | 0.233 | 0.233 | 0.233 | 0.234 | 0.235 | 0.235 | 0.236 | 0.236 | 0.237 | 0.238 | 0.239 | 0.241 | 0.243 | 0.247 | 0.255 | 0.275 | 0.233 |
| H(11) | 0.229 | 0.232 | 0.238 | 0.239 | 0.240 | 0.241 | 0.242 | 0.244 | 0.246 | 0.248 | 0.251 | 0.254 | 0.258 | 0.264 | 0.265 | 0.273 | 0.277 | 0.286 | 0.303 | 0.343 | 0.274 |
| H(12) | 0.189 | 0.206 | 0.226 | 0.228 | 0.230 | 0.231 | 0.233 | 0.234 | 0.235 | 0.235 | 0.235 | 0.236 | 0.236 | 0.235 | 0.238 | 0.239 | 0.242 | 0.246 | 0.253 | 0.257 | 0.209 |
| O(13) | –0.802 | –0.807 | –0.811 | –0.813 | –0.816 | –0.819 | –0.822 | –0.825 | –0.829 | –0.833 | –0.837 | –0.842 | –0.847 | –0.853 | –0.859 | –0.864 | –0.870 | –0.874 | –0.876 | –0.878 | –0.840 |
| H(14) | 0.498 | 0.500 | 0.494 | 0.495 | 0.495 | 0.496 | 0.496 | 0.499 | 0.503 | 0.507 | 0.514 | 0.523 | 0.535 | 0.549 | 0.564 | 0.580 | 0.595 | 0.604 | 0.594 | 0.541 | 0.274 |
| H(15) | 0.488 | 0.493 | 0.495 | 0.494 | 0.494 | 0.493 | 0.492 | 0.491 | 0.490 | 0.489 | 0.487 | 0.485 | 0.483 | 0.480 | 0.476 | 0.473 | 0.467 | 0.460 | 0.448 | 0.426 | 0.477 |
| Al(16) | 1.457 | 1.462 | 1.478 | 1.480 | 1.481 | 1.481 | 1.480 | 1.481 | 1.481 | 1.480 | 1.479 | 1.479 | 1.478 | 1.478 | 1.480 | 1.483 | 1.486 | 1.490 | 1.496 | 1.499 | 1.475 |
| Cl(17) | –0.605 | –0.624 | –0.631 | –0.632 | –0.631 | –0.632 | –0.633 | –0.634 | –0.634 | –0.635 | –0.635 | –0.635 | –0.636 | –0.637 | –0.637 | –0.636 | –0.638 | –0.639 | –0.643 | –0.649 | –0.620 |
| Cl(18) | –0.606 | –0.617 | –0.615 | –0.616 | –0.616 | –0.616 | –0.616 | –0.617 | –0.618 | –0.619 | –0.620 | –0.622 | –0.624 | –0.627 | –0.630 | –0.636 | –0.640 | –0.648 | –0.661 | –0.685 | –0.625 |
| C(19) | –0.918 | –0.902 | –0.912 | –0.913 | –0.913 | –0.913 | –0.912 | –0.912 | –0.911 | –0.909 | –0.908 | –0.906 | –0.905 | –0.903 | –0.903 | –0.903 | –0.901 | –0.899 | –0.895 | –0.888 | –0.917 |
| C(20) | –0.586 | –0.590 | –0.591 | –0.592 | –0.591 | –0.591 | –0.591 | –0.591 | –0.590 | –0.591 | –0.591 | –0.591 | –0.590 | –0.590 | –0.590 | –0.590 | –0.590 | –0.589 | –0.589 | –0.587 | –0.586 |
| H(21) | 0.217 | 0.221 | 0.213 | 0.213 | 0.212 | 0.211 | 0.210 | 0.209 | 0.209 | 0.208 | 0.207 | 0.206 | 0.206 | 0.205 | 0.203 | 0.202 | 0.199 | 0.194 | 0.187 | 0.177 | 0.215 |
| H(22) | 0.214 | 0.220 | 0.222 | 0.222 | 0.222 | 0.221 | 0.221 | 0.221 | 0.220 | 0.220 | 0.220 | 0.219 | 0.218 | 0.218 | 0.217 | 0.218 | 0.216 | 0.214 | 0.212 | 0.206 | 0.213 |
| H(23) | 0.213 | 0.213 | 0.212 | 0.212 | 0.212 | 0.212 | 0.212 | 0.212 | 0.212 | 0.213 | 0.213 | 0.213 | 0.213 | 0.214 | 0.213 | 0.213 | 0.213 | 0.213 | 0.213 | 0.213 | 0.212 |
| H(24) | 0.207 | 0.207 | 0.207 | 0.207 | 0.206 | 0.206 | 0.206 | 0.205 | 0.205 | 0.205 | 0.204 | 0.204 | 0.203 | 0.203 | 0.202 | 0.201 | 0.200 | 0.198 | 0.195 | 0.189 | 0.205 |
| H(25) | 0.212 | 0.210 | 0.212 | 0.212 | 0.212 | 0.212 | 0.212 | 0.211 | 0.211 | 0.211 | 0.211 | 0.210 | 0.210 | 0.209 | 0.209 | 0.210 | 0.209 | 0.208 | 0.207 | 0.206 | 0.211 |
Таблица 2.
Заряды на всех атомах изучаемой молекулярной системы вдоль координаты реакции взаимодействия комплексного катализатора AlCl2C2H5–фенол (Cα) с изобутиленом
| Атом | Номер ступени взаимодействия | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | |
| C(1) | –0.449 | –0.452 | –0.454 | –0.460 | –0.450 | –0.457 | –0.466 | –0.477 | –0.491 | –0.508 | –0.530 | –0.556 | –0.594 | –0.630 | –0.672 | –0.719 | –0.769 | –0.822 | –0.848 | –0.824 | –0.779 |
| C(2) | –0.073 | –0.075 | –0.077 | –0.074 | –0.099 | –0.095 | –0.091 | –0.085 | –0.078 | –0.068 | –0.056 | –0.041 | –0.017 | 0.000 | 0.020 | 0.043 | 0.068 | 0.100 | 0.137 | 0.202 | 0.226 |
| C(3) | –0.619 | –0.619 | –0.620 | –0.620 | –0.619 | –0.620 | –0.619 | –0.619 | –0.619 | –0.619 | –0.619 | –0.620 | –0.625 | –0.624 | –0.626 | –0.629 | –0.634 | –0.643 | –0.656 | –0.684 | –0.692 |
| C(4) | –0.618 | –0.619 | –0.621 | –0.619 | –0.620 | –0.619 | –0.620 | –0.620 | –0.620 | –0.620 | –0.620 | –0.621 | –0.622 | –0.624 | –0.625 | –0.628 | –0.631 | –0.637 | –0.652 | –0.683 | –0.697 |
| H(5) | 0.206 | 0.207 | 0.208 | 0.209 | 0.213 | 0.214 | 0.216 | 0.218 | 0.220 | 0.223 | 0.226 | 0.231 | 0.237 | 0.242 | 0.250 | 0.258 | 0.267 | 0.277 | 0.284 | 0.286 | 0.287 |
| H(6) | 0.204 | 0.205 | 0.207 | 0.208 | 0.212 | 0.213 | 0.215 | 0.216 | 0.218 | 0.220 | 0.222 | 0.225 | 0.228 | 0.233 | 0.239 | 0.247 | 0.255 | 0.264 | 0.270 | 0.268 | 0.266 |
| H(7) | 0.210 | 0.211 | 0.211 | 0.212 | 0.216 | 0.216 | 0.217 | 0.219 | 0.220 | 0.222 | 0.224 | 0.226 | 0.233 | 0.235 | 0.239 | 0.243 | 0.250 | 0.262 | 0.279 | 0.337 | 0.364 |
| H(8) | 0.249 | 0.249 | 0.252 | 0.253 | 0.253 | 0.256 | 0.257 | 0.259 | 0.261 | 0.262 | 0.263 | 0.264 | 0.269 | 0.270 | 0.272 | 0.274 | 0.278 | 0.286 | 0.297 | 0.289 | 0.286 |
| H(9) | 0.223 | 0.224 | 0.225 | 0.225 | 0.229 | 0.229 | 0.229 | 0.229 | 0.229 | 0.229 | 0.229 | 0.229 | 0.228 | 0.229 | 0.230 | 0.232 | 0.234 | 0.238 | 0.249 | 0.268 | 0.274 |
| H(10) | 0.254 | 0.259 | 0.263 | 0.263 | 0.262 | 0.264 | 0.266 | 0.269 | 0.271 | 0.273 | 0.274 | 0.276 | 0.275 | 0.279 | 0.282 | 0.286 | 0.290 | 0.296 | 0.319 | 0.357 | 0.375 |
| H(11) | 0.205 | 0.205 | 0.205 | 0.206 | 0.209 | 0.209 | 0.210 | 0.210 | 0.211 | 0.212 | 0.213 | 0.214 | 0.213 | 0.215 | 0.217 | 0.219 | 0.223 | 0.228 | 0.238 | 0.255 | 0.265 |
| H(12) | 0.221 | 0.221 | 0.221 | 0.221 | 0.224 | 0.224 | 0.224 | 0.224 | 0.224 | 0.224 | 0.225 | 0.225 | 0.228 | 0.228 | 0.230 | 0.232 | 0.235 | 0.240 | 0.249 | 0.265 | 0.272 |
| H(13) | 0.494 | 0.493 | 0.492 | 0.492 | 0.495 | 0.496 | 0.497 | 0.500 | 0.504 | 0.509 | 0.516 | 0.525 | 0.537 | 0.550 | 0.564 | 0.578 | 0.588 | 0.591 | 0.562 | 0.493 | 0.448 |
| O(14) | –0.860 | –0.860 | –0.861 | –0.863 | –0.866 | –0.868 | –0.870 | –0.873 | –0.876 | –0.879 | –0.883 | –0.888 | –0.893 | –0.897 | –0.902 | –0.907 | –0.912 | –0.917 | –0.921 | –0.934 | –0.962 |
| C(15) | 0.323 | 0.319 | 0.318 | 0.321 | 0.323 | 0.323 | 0.323 | 0.323 | 0.324 | 0.324 | 0.324 | 0.325 | 0.327 | 0.328 | 0.329 | 0.332 | 0.336 | 0.348 | 0.366 | 0.408 | 0.450 |
| C(16) | –0.256 | –0.253 | –0.254 | –0.255 | –0.255 | –0.255 | –0.256 | –0.257 | –0.258 | –0.259 | –0.260 | –0.261 | –0.262 | –0.262 | –0.264 | –0.265 | –0.267 | –0.269 | –0.274 | –0.290 | –0.300 |
| C(17) | –0.233 | –0.233 | –0.233 | –0.233 | –0.233 | –0.233 | –0.233 | –0.233 | –0.233 | –0.233 | –0.233 | –0.233 | –0.232 | –0.232 | –0.232 | –0.232 | –0.232 | –0.231 | –0.230 | –0.230 | –0.229 |
| C(18) | –0.230 | –0.230 | –0.230 | –0.230 | –0.230 | –0.230 | –0.230 | –0.231 | –0.231 | –0.231 | –0.231 | –0.232 | –0.232 | –0.233 | –0.233 | –0.234 | –0.236 | –0.238 | –0.243 | –0.253 | –0.261 |
| C(19) | –0.232 | –0.232 | –0.232 | –0.232 | –0.233 | –0.232 | –0.233 | –0.232 | –0.232 | –0.232 | –0.232 | –0.232 | –0.232 | –0.232 | –0.231 | –0.231 | –0.231 | –0.231 | –0.230 | –0.230 | –0.229 |
| C(20) | –0.247 | –0.245 | –0.245 | –0.245 | –0.246 | –0.246 | –0.246 | –0.246 | –0.247 | –0.247 | –0.248 | –0.249 | –0.250 | –0.251 | –0.252 | –0.254 | –0.256 | –0.260 | –0.266 | –0.277 | –0.288 |
| H(21) | 0.321 | 0.317 | 0.317 | 0.316 | 0.313 | 0.313 | 0.312 | 0.312 | 0.312 | 0.311 | 0.311 | 0.310 | 0.306 | 0.304 | 0.302 | 0.300 | 0.298 | 0.290 | 0.282 | 0.273 | 0.269 |
| H(22) | 0.272 | 0.272 | 0.271 | 0.271 | 0.270 | 0.270 | 0.270 | 0.270 | 0.270 | 0.269 | 0.269 | 0.269 | 0.268 | 0.268 | 0.267 | 0.266 | 0.264 | 0.262 | 0.257 | 0.248 | 0.242 |
| H(23) | 0.265 | 0.265 | 0.264 | 0.264 | 0.264 | 0.264 | 0.264 | 0.263 | 0.263 | 0.263 | 0.263 | 0.262 | 0.262 | 0.261 | 0.261 | 0.260 | 0.258 | 0.256 | 0.251 | 0.241 | 0.234 |
| H(24) | 0.267 | 0.267 | 0.267 | 0.267 | 0.267 | 0.267 | 0.267 | 0.266 | 0.266 | 0.266 | 0.266 | 0.265 | 0.265 | 0.264 | 0.264 | 0.263 | 0.261 | 0.259 | 0.254 | 0.244 | 0.238 |
| H(25) | 0.282 | 0.283 | 0.282 | 0.283 | 0.283 | 0.283 | 0.283 | 0.282 | 0.282 | 0.282 | 0.281 | 0.281 | 0.281 | 0.280 | 0.279 | 0.278 | 0.276 | 0.273 | 0.267 | 0.253 | 0.247 |
| Al(26) | 1.505 | 1.506 | 1.508 | 1.509 | 1.514 | 1.516 | 1.517 | 1.518 | 1.519 | 1.520 | 1.521 | 1.521 | 1.522 | 1.523 | 1.525 | 1.529 | 1.533 | 1.543 | 1.554 | 1.569 | 1.589 |
| C(27) | –0.906 | –0.906 | –0.906 | –0.906 | –0.906 | –0.907 | –0.907 | –0.906 | –0.906 | –0.906 | –0.906 | –0.906 | –0.906 | –0.905 | –0.905 | –0.905 | –0.904 | –0.903 | –0.902 | –0.901 | –0.901 |
| Cl(28) | –0.635 | –0.634 | –0.634 | –0.634 | –0.635 | –0.635 | –0.636 | –0.636 | –0.637 | –0.638 | –0.638 | –0.639 | –0.641 | –0.643 | –0.645 | –0.649 | –0.655 | –0.662 | –0.678 | –0.709 | –0.732 |
| Cl(29) | –0.618 | –0.619 | –0.620 | –0.621 | –0.628 | –0.628 | –0.630 | –0.631 | –0.632 | –0.633 | –0.635 | –0.636 | –0.637 | –0.639 | –0.641 | –0.644 | –0.648 | –0.655 | –0.664 | –0.689 | –0.705 |
| C(30) | –0.591 | –0.590 | –0.590 | –0.591 | –0.591 | –0.590 | –0.590 | –0.590 | –0.590 | –0.590 | –0.590 | –0.590 | –0.590 | –0.590 | –0.590 | –0.590 | –0.591 | –0.591 | –0.590 | –0.589 | –0.589 |
| H(31) | 0.217 | 0.216 | 0.215 | 0.215 | 0.215 | 0.215 | 0.215 | 0.215 | 0.214 | 0.214 | 0.214 | 0.214 | 0.214 | 0.214 | 0.213 | 0.213 | 0.214 | 0.214 | 0.214 | 0.214 | 0.214 |
| H(32) | 0.225 | 0.224 | 0.223 | 0.224 | 0.224 | 0.223 | 0.223 | 0.222 | 0.222 | 0.222 | 0.222 | 0.221 | 0.221 | 0.221 | 0.220 | 0.220 | 0.219 | 0.218 | 0.217 | 0.216 | 0.214 |
| H(33) | 0.211 | 0.210 | 0.210 | 0.211 | 0.210 | 0.210 | 0.209 | 0.209 | 0.209 | 0.209 | 0.209 | 0.209 | 0.211 | 0.210 | 0.210 | 0.209 | 0.210 | 0.209 | 0.208 | 0.206 | 0.204 |
| H(34) | 0.210 | 0.210 | 0.210 | 0.209 | 0.210 | 0.210 | 0.210 | 0.210 | 0.209 | 0.209 | 0.209 | 0.209 | 0.207 | 0.207 | 0.207 | 0.207 | 0.207 | 0.207 | 0.206 | 0.205 | 0.206 |
| H(35) | 0.205 | 0.205 | 0.204 | 0.204 | 0.204 | 0.204 | 0.204 | 0.203 | 0.203 | 0.203 | 0.203 | 0.202 | 0.202 | 0.202 | 0.201 | 0.201 | 0.200 | 0.199 | 0.197 | 0.194 | 0.193 |
Таблица 3.
Заряды на всех атомах изучаемой молекулярной системы вдоль координаты реакции взаимодействия комплексного катализатора AlCl2C2H5 – соляная кислота (Cα) с изобутиленом
| Атом | Номер ступени взаимодействия | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | |
| C(1) | –0.427 | –0.428 | –0.430 | –0.432 | –0.435 | –0.443 | –0.445 | –0.449 | –0.455 | –0.464 | –0.479 | –0.496 | –0.522 | –0.543 | –0.567 | –0.592 | –0.613 | –0.660 | –0.698 | –0.701 | –0.704 |
| C(2) | –0.088 | –0.090 | –0.091 | –0.093 | –0.094 | –0.099 | –0.102 | –0.103 | –0.103 | –0.101 | –0.090 | –0.078 | –0.058 | –0.043 | –0.022 | 0.003 | 0.036 | 0.104 | 0.193 | 0.203 | 0.206 |
| C(3) | –0.604 | –0.605 | –0.605 | –0.605 | –0.605 | –0.614 | –0.615 | –0.615 | –0.615 | –0.615 | –0.614 | –0.615 | –0.617 | –0.619 | –0.623 | –0.629 | –0.643 | –0.672 | –0.698 | –0.704 | –0.705 |
| C(4) | –0.603 | –0.603 | –0.604 | –0.604 | –0.605 | –0.601 | –0.601 | –0.601 | –0.601 | –0.601 | –0.602 | –0.604 | –0.606 | –0.608 | –0.611 | –0.616 | –0.625 | –0.644 | –0.694 | –0.702 | –0.706 |
| H(5) | 0.218 | 0.219 | 0.220 | 0.222 | 0.224 | 0.243 | 0.246 | 0.250 | 0.253 | 0.258 | 0.262 | 0.268 | 0.275 | 0.283 | 0.294 | 0.306 | 0.321 | 0.333 | 0.291 | 0.283 | 0.279 |
| H(6) | 0.215 | 0.216 | 0.217 | 0.219 | 0.220 | 0.220 | 0.223 | 0.225 | 0.228 | 0.232 | 0.236 | 0.241 | 0.246 | 0.254 | 0.262 | 0.273 | 0.286 | 0.294 | 0.288 | 0.286 | 0.282 |
| H(7) | 0.222 | 0.223 | 0.223 | 0.224 | 0.225 | 0.253 | 0.255 | 0.256 | 0.258 | 0.259 | 0.258 | 0.261 | 0.262 | 0.268 | 0.274 | 0.285 | 0.308 | 0.345 | 0.285 | 0.281 | 0.280 |
| H(8) | 0.224 | 0.225 | 0.225 | 0.226 | 0.227 | 0.225 | 0.227 | 0.228 | 0.229 | 0.230 | 0.231 | 0.233 | 0.235 | 0.238 | 0.242 | 0.248 | 0.259 | 0.276 | 0.372 | 0.388 | 0.390 |
| H(9) | 0.209 | 0.211 | 0.213 | 0.214 | 0.216 | 0.208 | 0.210 | 0.212 | 0.214 | 0.217 | 0.220 | 0.224 | 0.227 | 0.232 | 0.238 | 0.247 | 0.255 | 0.259 | 0.278 | 0.279 | 0.281 |
| H(10) | 0.224 | 0.225 | 0.225 | 0.226 | 0.227 | 0.228 | 0.229 | 0.230 | 0.231 | 0.232 | 0.234 | 0.236 | 0.238 | 0.241 | 0.245 | 0.250 | 0.259 | 0.270 | 0.279 | 0.281 | 0.282 |
| H(11) | 0.219 | 0.219 | 0.220 | 0.220 | 0.221 | 0.218 | 0.219 | 0.220 | 0.221 | 0.223 | 0.224 | 0.226 | 0.228 | 0.232 | 0.236 | 0.243 | 0.252 | 0.264 | 0.267 | 0.277 | 0.282 |
| H(12) | 0.210 | 0.212 | 0.213 | 0.215 | 0.217 | 0.210 | 0.212 | 0.214 | 0.216 | 0.219 | 0.222 | 0.226 | 0.229 | 0.234 | 0.241 | 0.251 | 0.270 | 0.292 | 0.375 | 0.386 | 0.390 |
| H(13) | 0.285 | 0.285 | 0.285 | 0.286 | 0.286 | 0.283 | 0.283 | 0.281 | 0.279 | 0.277 | 0.274 | 0.270 | 0.268 | 0.265 | 0.265 | 0.273 | 0.297 | 0.335 | 0.377 | 0.385 | 0.395 |
| Cl(14) | –0.258 | –0.262 | –0.266 | –0.270 | –0.275 | –0.274 | –0.279 | –0.284 | –0.289 | –0.295 | –0.302 | –0.311 | –0.322 | –0.340 | –0.369 | –0.421 | –0.510 | –0.602 | –0.654 | –0.668 | –0.670 |
| Al(15) | 1.426 | 1.427 | 1.428 | 1.429 | 1.429 | 1.435 | 1.436 | 1.437 | 1.439 | 1.441 | 1.443 | 1.446 | 1.448 | 1.453 | 1.458 | 1.466 | 1.477 | 1.485 | 1.479 | 1.476 | 1.476 |
| C(16) | –0.902 | –0.902 | –0.902 | –0.902 | –0.902 | –0.901 | –0.901 | –0.901 | –0.900 | –0.900 | –0.900 | –0.899 | –0.898 | –0.898 | –0.896 | –0.894 | –0.891 | –0.888 | –0.887 | –0.887 | –0.887 |
| Cl(17) | –0.552 | –0.553 | –0.553 | –0.554 | –0.554 | –0.561 | –0.561 | –0.563 | –0.564 | –0.566 | –0.569 | –0.571 | –0.575 | –0.579 | –0.584 | –0.593 | –0.607 | –0.625 | –0.659 | –0.669 | –0.674 |
| Cl(18) | –0.557 | –0.557 | –0.558 | –0.558 | –0.559 | –0.569 | –0.571 | –0.574 | –0.576 | –0.579 | –0.580 | –0.584 | –0.587 | –0.592 | –0.600 | –0.610 | –0.628 | –0.651 | –0.671 | –0.670 | –0.670 |
| C(19) | –0.595 | –0.594 | –0.594 | –0.594 | –0.593 | –0.595 | –0.595 | –0.595 | –0.595 | –0.595 | –0.595 | –0.595 | –0.595 | –0.595 | –0.594 | –0.593 | –0.593 | –0.593 | –0.593 | –0.593 | –0.593 |
| H(20) | 0.244 | 0.244 | 0.243 | 0.243 | 0.243 | 0.244 | 0.244 | 0.243 | 0.243 | 0.242 | 0.242 | 0.242 | 0.241 | 0.240 | 0.238 | 0.236 | 0.233 | 0.229 | 0.227 | 0.226 | 0.226 |
| H(21) | 0.245 | 0.244 | 0.244 | 0.244 | 0.243 | 0.243 | 0.243 | 0.243 | 0.242 | 0.242 | 0.241 | 0.241 | 0.240 | 0.239 | 0.238 | 0.235 | 0.232 | 0.228 | 0.227 | 0.226 | 0.226 |
| H(22) | 0.211 | 0.211 | 0.211 | 0.211 | 0.210 | 0.213 | 0.213 | 0.213 | 0.212 | 0.212 | 0.212 | 0.212 | 0.211 | 0.211 | 0.210 | 0.209 | 0.207 | 0.207 | 0.207 | 0.206 | 0.207 |
| H(23) | 0.223 | 0.222 | 0.222 | 0.221 | 0.221 | 0.222 | 0.221 | 0.221 | 0.220 | 0.220 | 0.219 | 0.219 | 0.218 | 0.217 | 0.215 | 0.212 | 0.208 | 0.204 | 0.201 | 0.201 | 0.200 |
| H(24) | 0.213 | 0.213 | 0.213 | 0.213 | 0.213 | 0.211 | 0.211 | 0.211 | 0.211 | 0.211 | 0.211 | 0.211 | 0.211 | 0.211 | 0.211 | 0.210 | 0.210 | 0.209 | 0.207 | 0.207 | 0.207 |
Рассмотрим процесс инициирования изобутилена в присутствии комплексного катализатора этилалюминийдихлорид–вода (рис. 1, 2). В процессе реакции происходят одновременный разрыв связей O(13)–H(14) и превращение двойной связи C(1)=C(2) в одинарную и формирование новой связи – C(2)–H(14) и противоиона (AlCl2C2H5–OH)–. При этом формируется инициирующая частица H+δ(14), которая присоединяется к наиболее гидрогенизированному атому изобутилена C(1). Заряд на инициирующей частице H+δ(14) возрастает в процессе реакции от +0.5 до +0.6 (см. табл. 1), что соответствует весьма существенному увеличению кислотной силы АЦ катализатора в реакционной среде. Энергетический барьер реакции равен 113 кДж/моль, а энтальпия равна –24 кДж/моль (см. рис. 3). Реакция экзотермична и идет по схеме согласованных взаимодействий.
Моделирование реакции инициирования изобутилена в присутствии комплексного катализатора этилалюминийдихлорид–фенол представлено на рис. 4, 5. В процессе взаимодействия компонентов реакции происходят одновременный разрыв связей O(14)–H(13) и превращение двойной C(1)=C(2) связи в одинарную и формирование новой связи – C(1)–H(13) и противоиона (AlCl2C2H5–OC6H5)–. При этом формируется инициирующая частица H+δ(13), которая присоединяется к наиболее гидрогенизированному атому изобутилена C(1). Заряд на инициирующей частице H+δ(13) возрастает в процессе реакции от +0.5 до +0.6 (см. табл. 2), что (как и в случае с аквакомплексом этилалюминийдихлорида) соответствует увеличению кислотной силы АЦ катализатора в реакционной среде. Энергетический барьер реакции составляет 79 кДж/моль, а тепловой эффект равен –76 кДж/моль (см. рис. 6). Реакция носит эндотермический характер и проходит по схеме согласованных взаимодействий.
На рис. 7, 8 представлены исходная и конечная атомно-молекулярные структуры взаимодействия комплексного катализатора этилалюминийдихлорид – соляная кислота. Анализ изменения длин связей показал, что в процессе реакции происходят обычное акцептирование протона H+δ(13) из каталитического комплекса (разрыв связи H(13)–Cl(14)) и присоединение его к α-углеродному атому изобутилена по правилу Марковникова (C(1)–H(13)). Двойная связь C(1)=C(2) при этом превращается в одинарную, и формируется противоион (AlCl3C2H5)–. При этом формируется инициирующая частица H+δ(13), которая присоединяется к наиболее гидрогенизированному атому изобутилена C(1). Заряд на инициирующей частице H+δ(13) возрастает в процессе реакции от +0.3 до +0.4 (см. табл. 3), что соответствует резкому возрастанию кислотной силы АЦ катализатора в реакционной среде, как и в случае с катализаторами C2H5AlCl2–H2O и C2H5AlCl2–HOC6H5 (см. табл. 1–3, из которых также видно, что закон сохранения заряда четко работает на каждой стадии взаимодействия катализатора и изобутилена). Тепловой эффект реакции равен +129 кДж/моль (см. рис. 9). Реакция экзотермична, носит безбарьерный характер и проходит по схеме акцептирования протона из каталитического комплекса.
Изменение зарядов на атомах, поведение фрагментов реакции, разрывы и формирования новых связей свидетельствуют о том, что реакция инициирования изоолефинов с катализаторами этилалюминийдихлорид–вода и этилалюминийдихлорид–фенол идет по схеме согласованных взаимодействий, а с катализатором этилалюминийдихлорид – соляная кислота – по схеме акцептирования протона из каталитического комплекса. Из табл. 4 видно, что энергия активации инициирования изобутилена при атаке на α-углеродный атом на 50 кДж/моль больше, чем при атаке на β-углеродный (катализатор–вода), в реакции фенолом – на 76 кДж/моль, а с соляной кислотой – на 113 кДж/моль, что находится в полном соответствии с правилом Марковникова. Механизмы инициирования при атаке инициирующей частицы на β-углеродный атом аналогичны, но менее энергетически выгодны. Также необходимо отметить (см. табл. 4), что рост энергии активации в ряду изучаемых катализаторов, как в растворителе (гептан), так и в газовой фазе, способствует увеличению селективности этих инициаторов из фракции C4, а это, в свою очередь, находится в полном соответствии с классическим правилом катионной полимеризации олефинов: увеличение кислотной силы АЦ катализаторов электрофильных реакций олигомеризации (полимеризации, теломеризации, изомеризации и т.д.) способствует усилению их активности, но уменьшает селективность их процесса [1]. В данном случае это очевидно еще и потому, что pKa комплекса C2H5AlCl2–H2O гораздо меньше, чем у C2H5AlCl2–HCl [1, 17]. Кроме того, важным моментом является то, что полученные нами значения Ea, равны 76 кДж/моль (без растворителя) и 76–102 кДж/моль (в гептане) в присутствии аквакомплекса алюмоксана как продукта превращения C2H5AlCl2–H2O [18] меньше, чем значения Ea, равны 113 кДж/моль (без растворителя) и 92–110 кДж/моль (в гептане) в присутствии исходного аквакомплекса этилалюминийдихлорида. Причем значение Ea аквакомплекса алюмоксана близко к аналогичному значению катализатора C2H5AlCl2–HOC6H5, по селективности занимающего промежуточное положение в ряду изучаемых катализаторов, и равно 76%. Следовательно, можно утверждать, что активным центром, максимально ответственным за инициирование процесса олигомеризации (полимеризации, теломеризации, изомеризации и т.д.), является исходный аквакомплекс этилалюминийдихлорида, селективность которого стремится к 100%, а не аквакомплекс алюмоксана.
Таблица 4.
Энергии активации (Ea), тепловые эффекты (Q) и селективность (S) реакции инициирования изобутилена из фракции C4 (катализатор этилалюминийдихлорид – вода/фенол/соляная кислота)
| Субстрат | Катализатор | Координата реакции Н–Сα | Координата реакции Н–Cβ | S, % | |
|---|---|---|---|---|---|
| Ea*, кДж/моль | Ea**, кДж/моль | Ea*, кДж/моль | |||
| Изобутилен | AlCl2C2H5–H2O | 113 | 92–110 | 161 | 100 |
| AlCl2C2H5–HOC6H5 | 79 | 76–79 | 155 | 79 | |
| AlCl2C2H5–HCl | 0 | 0 | 113 | 53 | |
ЗАКЛЮЧЕНИЕ
Таким образом, был изучен механизм инициирования изобутилена в присутствии комплексных катализаторов этилалюминийдихлорид–вода, этилалюминийдихлорид–фенол, этилалюминийдихлорид – соляная кислота. Оценена энергетика этих реакций, получены значения ее энергетического барьера и энтальпии. Показано, что энергия активации инициирования изобутилена при атаке на α-углеродный атом больше, чем на β-углеродный. Установлено, что изученные реакции имеют барьерный характер и в присутствии катализатора с водой (реакция экзотермична) и фенолом (реакция эндотермична) идут по схеме согласованных взаимодействий. В присутствии же соляной кислотой реакция безбарьерна, экзотермична и представляет собой обычное акцептирование протона из каталитического комплекса. Очевидно, что полученные данные квантовохимических расчетов механизма инициирования изобутилена в присутствии катализаторов этилалюминийдихлорид–вода (фенол, соляная кислота) могут способствовать более глубокому пониманию селективности действия этих инициаторов.
Список литературы
Бабкин В.А., Заиков Г.Е., Минскер К.С. Квантовохимический аспект катионной полимеризации олефинов. Уфа: Гилем, 1996.
Петрова В.Д., Ржевская Н.Н., Щербакова Н.В., Сангалов Ю.А., Минскер К.С. // Докл. АН СССР. 1977. Т. 233. № 4. С. 602.
Петрова В.Д., Ржевская Н.Н., Щербакова Н.В., Сангалов Ю.А., Минскер К.С. // Изв. АН СССР. Сер. хим. 1978. № 6. С. 1373.
Разуваев Г.А., Сангалов Ю.А., Ясман Ю.Б., Минскер К.С. // Докл. АН СССР. Сер. хим. 1978. Т. 239. № 2. С. 338.
Кольцов Н.И. // Хим. физика. 2020. Т. 39. № 9. С. 23; https://doi.org/10.31857/S0207401X2009006X
Тереза А.М., Агафонов Г.Л., Андержанов Э.К. и др. // Хим. физика. 2020. Т. 39. № 8. С. 58; https://doi.org/10.31857/S0207401X20080129
Тарасов Д.Н., Тигер Р.П. // Хим. физика. 2019. Т. 38. № 5. С. 45; https://doi.org/10.1134/S0207401X19050133
Волохов В.М., Зюбина Т.С., Волохов А.В. и др. // Хим. физика. 2021. Т. 40. № 1. С. 3; https://doi.org/10.31857/S0207401X21010131
Цирельсон В.Г. Квантовая химия. Молекулы, молекулярные системы и твердые тела. М.: Бином, 2010.
Babkin V.A., Andreev D.S., Ignatov A.V. et al. // Oxid. Commun. 2019. V. 42. № 1. P. 56.
Babkin V.A., Kozhuhova A.V., Vashuta Yu.A. et al. // Oxid. Commun. 2019. V. 42. № 1. P. 275.
Babkin V.A., Andreev D.S., Ignatov A.V. et al. // Oxid. Commun. 2020. V. 43. № 1. P. 24.
Babkin V.A., Andreev D.S., Ignatov A.V. // Oxid. Commun. 2020. V. 43. № 2. P. 171.
Granovsky A.A. Firefly version 8 // 2013; http://classic.chem.msu.su/gran/firefly/index.html
Schmidt M.W., Baldridge K.K., Boatz J.A. // J. Comput. Chem. 1993. V. 14. P. 1347.
Bode B.M., Gordon M.S. // J. Molec. Graphics. 1998. № 16. P. 133.
Olah G.A. Friedel-Crafts Chemistry. N.Y.: J. Wiley and Sons, 1973.
Pasynkiewicz S., Boleslawski M., Sadownik A. // J. Organomet. Chem. 1976. V. 113. № 4. P. 303.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


