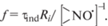Химическая физика, 2022, T. 41, № 7, стр. 18-22
Кинетический изотопный H/D-эффект растворителя при окислении метиллинолеата в мицеллах Triton X-100
И. В. Москаленко 1, *, И. В. Тихонов 1
1 Ярославский государственный университет им. П.Г. Демидова
Ярославль, Россия
* E-mail: i.v.m.rostov.yar@gmail.com
Поступила в редакцию 08.07.2021
После доработки 01.10.2021
Принята к публикации 20.11.2021
- EDN: LTLXKJ
- DOI: 10.31857/S0207401X22070123
Аннотация
Исследовано влияние тяжелой воды на скорость окисления метиллинолеата в мицеллах Triton X-100. Установлено, что скорость окисления в тяжелой воде повышается за счет обмена гидропероксидных радикалов $\left( {{\text{HO}}_{2}^{ \bullet }} \right)$ на дейтеропероксидные $\left( {{\text{DO}}_{2}^{ \bullet }} \right),$ что приводит к уменьшению скорости обрыва цепей. Образование ${\text{DO}}_{2}^{ \bullet }$ подтверждено уменьшением коэффициентов ингибирования нитроксильными радикалами, а реакция ${\text{DO}}_{2}^{ \bullet }$ с молекулой метиллинолеата – снижением скорости окисления в присутствии супероксиддисмутазы.
Гидропероксидный радикал $\left( {{\text{HO}}_{2}^{ \bullet }} \right)$ играет важную роль в механизме окисления органических соединений, в том числе полиненасыщенных жирных кислот (ПНЖК) в биологических системах [1–5]. Его участие проявляется, в частности, в обнаруженном кинетическом изотопном H/D-эффекте (КИЭ) [6–8]. Предполагается, что замена водорода на дейтерий может сказаться и на процессах инициирования цепного окисления ПНЖК [9]. Ведущиеся в этом направлении исследования очень важны, поскольку обнаружено, что тяжелая вода (D2O) может сдерживать распространение раковых клеток [10]. При этом практически не изучено влияние D2O на кинетику окисления ПНЖК.
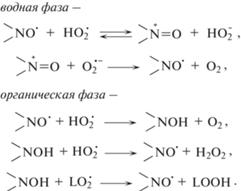
В качестве кинетической модели окисления клеточных мембран удобно использовать инициированное 2,2'-азобис(2-амидинопропан)дигидрохлоридом (AAPH) окисление эфиров ПНЖК, в частности метиллинолеата (LH), в мицеллах Triton X-100 [7]. В данном процессе образуется радикал ${\text{HO}}_{2}^{\centerdot }$ [11]:
водная фаза –
(2)
${\text{HO}}_{2}^{ \bullet } \leftrightarrow {{{\text{H}}}^{ + }} + {\text{O}}_{2}^{{ \bullet --}},$(3)
$2{\text{HO}}_{2}^{ \bullet } \to {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}} + {{{\text{O}}}_{2}};$диффузия –
органическая фаза –
Учитывая, что в водной фазе гидропероксидный радикал диссоциирует по реакции (2) [12], в тяжелой воде обратный процесс ассоциации ${\text{O}}_{2}^{{ \bullet --}}$ будет происходить с катионом D+ по приведенной ниже реакции, в результате которой образуется дейтеропероксидный радикал:
(4)
${\text{DO}}_{2}^{ \bullet } \leftrightarrow {{{\text{D}}}^{ + }} + {\text{O}}_{2}^{{ \bullet {\text{ }}--}}.$Таким образом, окисление метиллинолеата в мицеллах в среде тяжелой воды является удобной системой для исследования реакционной способности ${\text{DO}}_{2}^{ \bullet }$ в реакциях окисления ПНЖК.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовались следующие реактивы: азоинициатор – AAPH, мицеллообразователь
– Triton X-100, субстрат окисления – метиллинолеат, ингибитор – 2,2,5,7,8-пентаметилхроман-6-ол
(C1); все реактивы производства компании Sigma-Aldrich (USA). Супероксиддисмутаза
(СОД) из бычьей печени применялась как акцептор супероксидных радикалов. Нитроксильные
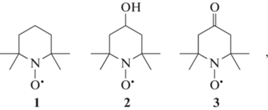
радикалы  :
:
Фосфатный буфер с рН(pD) = 7.4 готовили из растворов NaH2PO4 и Na2HPO4 на основе деионизованной воды (H2O) или тяжелой воды (D2O). Значения pD измеряли на стеклянном электроде, используя соотношение pD = pH + 0.41 [13]. Растворы на основе H2O очищали от следов металлов переменной валентности с помощью смолы Chelex-100 производства компании Bio-Rad Lab., Inc. (USA). В растворы на основе D2O добавляли Трилон В (Sigma-Aldrich, USA), общая концентрация которого в растворах составляла 5 мМ.
Окисление LH (0.01 моль ⋅ л–1) исследовали в мицеллах Triton X-100 (0.05 моль ⋅ л–1) в фосфатном буфере (0.05 моль ⋅ л–1, pH(pD) = 7.4) под действием инициатора AAPH (0.008 моль ⋅ л–1) при 310 K. Кинетику поглощения кислорода при окислении LH изучали с использованием кислородного биологического монитора YSI 5300A (USА). Скорость инициирования Ri определяли методом ингибиторов по времени окончания периода индукции τind с помощью соотношения
где [In H] – концентрация C1. Величины τind определяли интегральным методом [14] по уравнениюКоэффициент ингибирования (f) для  определяли по уравнению
определяли по уравнению
Значения логарифмов коэффициентов распределения (lg P) в системе октанол–вода взяты из работы [15].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
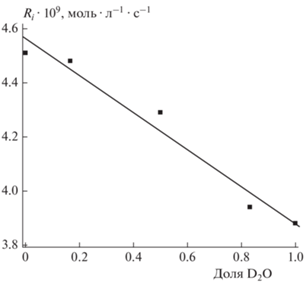
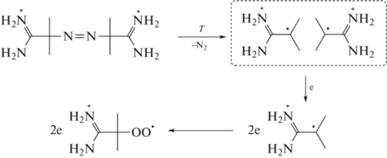
Скорость окисления (R) метиллинолеата в растворе на основе тяжелой воды несколько выше, чем в растворе легкой воды: 2.4 ⋅ 10–7 моль ⋅ л–1 ⋅ c–1 и 2.0 ⋅ 10–7 моль ⋅ л–1 ⋅ c–1 соответственно. Радикально-цепное окисление протекает по сложному механизму (см. выше), поэтому некорректно сравнивать скорости окисления напрямую. Наиболее удобной величиной для определения КИЭ является длина цепи ν = R/Ri. Для ее определения необходимо уточнить значение скорости инициирования ААРН в тяжелой воде. На рис. 1 представлена зависимость скорости инициирования от доли тяжелой воды. Эта зависимость является линейной функцией. Из рис. 2 видно, что при одинаковой концентрации ингибитора период индукции выше в случае раствора на основе тяжелой воды. Для стадии инициирования КИЭ = Ri(H2O)/Ri(D2O) = = 1.16 ± 0.10. Низкие значения КИЭ характерны для реакций ионного обмена [16]. Видимо, данный эффект связан с уменьшением доли протонирования амидиновых групп AAPH [17] в тяжелой воде (Схема 1 ). Это может уменьшать кулоновское отталкивание генерируемых углерод-центрированных радикалов, что приводит к более низкой эффективности выхода радикала из клетки (e) и уменьшению Ri [17].
Схема 1 . Клеточный эффект при распаде AAPH
Рис. 2.
Кинетические кривые окисления LH в мицеллах без ингибитора (1, 2) и в присутствии 6 · 10–6 моль · л–1 C1 (3, 4) в среде H2O (1, 3) и D2O (2, 4).

Длина цепи окисления по данным рис. 2 составила 44 ± 4 для легкой воды и 62 ± 6 для тяжелой воды. Таким образом, кинетический изотопный эффект окисления метиллинолеата в мицеллах будет равен КИЭ = ν(H2O)/ν(D2O) = 0.71 ± 0.07. Причинами увеличения длины цепи могут быть уменьшение скорости обрыва цепи и/или увеличение скорости передачи цепи между мицеллами.
Константа скорости обрыва цепи по реакции (3) для ${\text{DO}}_{2}^{ \bullet }$ значительно ниже, чем для ${\text{HO}}_{2}^{ \bullet }$ [18]. Превращением ${\text{HO}}_{2}^{ \bullet }$ в ${\text{DO}}_{2}^{ \bullet }$ в среде тяжелой воды можно объяснять увеличение скорости окисления. Таким образом,
нужно доказать сам факт образования радикала ${\text{DO}}_{2}^{ \bullet }$ и убедиться, что он продолжает цепи окисления. Наличие ${\text{DO}}_{2}^{ \bullet }$ можно зафиксировать с помощью нитроксильных радикалов: известно, что  не реагирует с ${\text{DO}}_{2}^{ \bullet },$ что снижает коэффициент ингибирования [19, 20]. В работах [21, 22] показано, что при окислении LH в мицеллах происходит регенерация нитроксильных радикалов,
механизм которой представлен ниже:
не реагирует с ${\text{DO}}_{2}^{ \bullet },$ что снижает коэффициент ингибирования [19, 20]. В работах [21, 22] показано, что при окислении LH в мицеллах происходит регенерация нитроксильных радикалов,
механизм которой представлен ниже:
Регенерация  идет при взаимодействии с ${\text{HO}}_{2}^{ \bullet }$ как в органической фазе через образование гидроксиламина [19, 23], так и в водной фазе через образование оксоаммониевого катиона [24, 25].
идет при взаимодействии с ${\text{HO}}_{2}^{ \bullet }$ как в органической фазе через образование гидроксиламина [19, 23], так и в водной фазе через образование оксоаммониевого катиона [24, 25].
В табл. 1 приведены значения f для ряда нитроксильных радикалов, имеющих различные значения lg P. Из этой таблицы видно, что падение f тем сильнее, чем выше липофильность  . Таким образом, при замене H2O на D2O снижение степени регенерации происходит преимущественно в органической фазе, поскольку
отрыв нитроксильным радикалом атома дейтерия от радикала ${\text{DO}}_{2}^{ \bullet }$ гораздо менее вероятен, чем отрыв атома водорода от радикала ${\text{HO}}_{2}^{ \bullet }.$ В водной же среде аналогичная реакция протекает по механизму переноса электрона,
который менее подвержен влиянию изотопных эффектов.
. Таким образом, при замене H2O на D2O снижение степени регенерации происходит преимущественно в органической фазе, поскольку
отрыв нитроксильным радикалом атома дейтерия от радикала ${\text{DO}}_{2}^{ \bullet }$ гораздо менее вероятен, чем отрыв атома водорода от радикала ${\text{HO}}_{2}^{ \bullet }.$ В водной же среде аналогичная реакция протекает по механизму переноса электрона,
который менее подвержен влиянию изотопных эффектов.
Таблица 1.
Значения коэффициентов ингибирования для ряда нитроксильных радикалов в среде H2O и D2O
 |
f(H2O) | f(D2O) | f(H2O)/f(D2O) | lg P |
|---|---|---|---|---|
| 1 | 3.23 | 1.36 | 2.38 | 1.40 |
| 2 | 5.2 | 2.9 | 1.79 | 0.90 |
| 3 | 1.15 | 0.7 | 1.64 | 0.50 |
Для  1 определены значения f в смесях D2O и H2O (табл. 2). Как видно, коэффициент ингибирования падает при увеличении доли тяжелой воды. Можно
полагать, что в результате реакций (2) и (4) происходит частичная замена ${\text{HO}}_{2}^{ \bullet }$ на ${\text{DO}}_{2}^{ \bullet },$ что приводит к уменьшению значений f.
1 определены значения f в смесях D2O и H2O (табл. 2). Как видно, коэффициент ингибирования падает при увеличении доли тяжелой воды. Можно
полагать, что в результате реакций (2) и (4) происходит частичная замена ${\text{HO}}_{2}^{ \bullet }$ на ${\text{DO}}_{2}^{ \bullet },$ что приводит к уменьшению значений f.
Таблица 2.
Зависимость коэффициентов ингибирования для  1 от изотопного состава растворителя
1 от изотопного состава растворителя
| Доля тяжелой воды | f |
|---|---|
| 0 | 3.25 |
| 0.2 | 3.08 |
| 0.5 | 2.95 |
| 0.84 | 1.59 |
| 1 | 1.36 |
При окислении LH в среде D2O происходит передача цепи между мицеллами при участии радикалов ${\text{HO}}_{2}^{ \bullet }$ (${\text{DO}}_{2}^{ \bullet }$), как и в среде H2O [11, 21]. Это подтверждается влиянием СОД на кинетику процесса. При концентрации СОД 100 Ед/мл скорость окисления LH в среде D2O снизилась на 24.3%. Супероксидиддисмутаза селективно реагирует с ${\text{O}}_{2}^{{ \bullet - }},$ снижая тем самым концентрацию ${\text{HO}}_{2}^{ \bullet }$ [11, 22], а следовательно, и концентрацию ${\text{DO}}_{2}^{ \bullet }.$ В результате уменьшается эффективность передачи цепи между мицеллами, что приводит к снижению скорости окисления LH в среде D2O.
ЗАКЛЮЧЕНИЕ
Образующийся при окислении метиллинолеата гидропероксидный радикал в результате обратимого
депротонирования/протонирования обменивается в тяжелой воде на радикал ${\text{DO}}_{2}^{ \bullet },$ который также ведет цепи окисления, но значительно медленнее участвует в их обрыве.
Подтверждением образования ${\text{DO}}_{2}^{ \bullet }$ является снижение коэффициента ингибирования нитроксильными радикалами, которое связано
с невозможностью реакции ${\text{DO}}_{2}^{ \bullet }$ с  . Кинетический изотопный эффект растворителя при окислении метиллинолеата в мицеллах
составил 0.71. При этом в тяжелой воде незначительно снижается скорость инициирования.
. Кинетический изотопный эффект растворителя при окислении метиллинолеата в мицеллах
составил 0.71. При этом в тяжелой воде незначительно снижается скорость инициирования.
Авторы благодарят профессора Е.М. Плисса за полезную дискуссию.
Работа выполнена при поддержке Российским научным фондом (грант 20-13-00148).
Список литературы
Рогинский В.А. // Кинетика и катализ. 1996. Т. 37. № 4. С. 521.
Yin H., Xu L., Porter N.A. // Chem. Rev. 2011. V. 111. № 10. P. 5944.
Panov A. // Mol. Biol. 2018. V. 52. № 3. P. 295.
Poon J., Zilka O., Pratt D.A. // J. Amer. Chem. Soc. 2020. V. 142. № 33. P. 14331.
Пучков С.В., Непомнящих Ю.В. // Хим. физика. 2020. Т. 39. № 3. С. 42.
Тихонов И.В., Москаленко И.В., Плисс Е.М. и др. // Хим. физика. 2017. Т. 36. № 5. С. 14.
Москаленко И.В., Тихонов И.В., Плисс Е.М. и др. // Хим. физика. 2018. Т. 37. № 11. С. 25.
Soloviev M., Moskalenko I., Pliss E. // Reac. Kin. Mech. Cat. 2019. V. 127. № 2. P. 561.
Pinchuk I., Lichtenberg D. // Chem. Phys. Lipids. 2017. V. 205. P. 42.
Fulczyk A., Lata E., Talik E., Kowalska T., Sajewicz M. // Front. Chem. 2020. V. 8. P. 541.
Roginsky V., Barsukova T. // Chem. Phys. Lipids. 2001. V. 111. № 1. P. 87.
Bielski B.H.J., Cabelli D.E., Arudi R.L. // J. Phys. Chem. Ref. Data. 1985. V. 14. № 4. P. 1041.
Covington A.K., Paabo M., Robinson R.A., Bates R.G. // Anal. Chem. 1968. V. 40. № 4. P. 700.
Loshadkin D., Roginsky V., Pliss E. // Intern. J. Chem. Kinet. 2002. V. 34. № 3. P. 162.
Wang Y., Xiao J., Suzek T.O. et al. // Nucleic Acids Res. 2011. V. 40. № D1. P. D400.
Amorati R., Baschieri A., Morroni G., Gambino R., Valgimigli L. // Chem. Eur. J. 2016. V. 22. № 23. P. 7924.
Musialik M., Kita M., Litwinienko G. // Org. Biomol. Chem. 2008. V. 6. №. 4. P. 677.
Assali M., Rakovsky J., Votava O., Fittschen C. // Intern. J. Chem. Kinet. 2020. V. 52. № 3. P. 197.
Baschieri A., Valgimigli L., Gabbanini S. et al. // J. Amer. Chem. Soc. 2018. V. 140. № 32. P. 10354.
Harrison K.A., Haidasz E.A., Griesser M., Pratt D.A. // Chem. Sci. 2018. V. 9. № 28. P. 6068.
Тихонов И.В., Плисс Е.М., Бородин Л.И., Кузнецова Т.А., Сень В.Д. // Изв. АН. Сер. хим. 2015. №. 10. С. 2438.
Тихонов И.В., Плисс Е.М., Бородин Л.И., Сень В.Д. // Хим. физика. 2017. Т. 36. № 6. С. 20.
Pliss E., Soloviev M., Sen’ V. et al. // Reac. Kinet. Mech. Cat. 2021. V. 132. № 2. P. 617.
Sen V.D., Tikhonov I.V., Borodin L.I. et al // J. Phys. Org. Chem. 2015. V. 28. № 1. P. 17.
Тихонов И.В., Бородин Л.И., Плисс Е.М. // Хим. физика. 2020. Т. 39. № 11. С. 3.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика