Химическая физика, 2022, T. 41, № 7, стр. 32-38
Термическое разложение 1-[2,2-бис(метокси-NNO-азокси)этил]-3,4-динитро-1H-пиразола
Б. Л. Корсунский 1, 2, В. В. Захаров 1, *, Т. С. Ларикова 1, И. Н. Зюзин 1, Н. В. Чуканов 1, **, В. В. Неделько 1
1 Институт проблем химической физики Российской академии наук
Черноголовка, Россия
2 ФИЦ химической физики им. Н.Н. Семёнова Российской академии наук
Москва, Россия
* E-mail: vzakh@icp.ac.ru
** E-mail: chukanov@icp.ac.ru
Поступила в редакцию 18.12.2020
После доработки 15.02.2021
Принята к публикации 22.02.2021
- EDN: OPQQOR
- DOI: 10.31857/S0207401X22070081
Аннотация
С использованием изотермических и неизотермических методов изучена кинетика термического разложения соединения 1-[2,2-бис(метокси-NNO-азокси)этил]-3,4-динитро-1H-пиразола в широком диапазоне температур. Определены состав газообразных продуктов, теплота плавления и теплота термического разложения. Ниже температуры плавления реакция протекает с ярко выраженным самоускорением и не может быть описана простыми кинетическими законами. Расчетным путем установлены эффективные энергии активации процесса, которые уменьшаются по мере увеличения степени превращения. Полученные результаты объяснены с точки зрения общих представлений о механизме термического разложения твердых органических веществ. В жидкой фазе реакция протекает со слабым самоускорением. Для нее также определены эффективные энергии активации. Выдвинуто предположение, что реакция протекает по последовательному механизму с промежуточным образованием циклического продукта. Сделан вывод о высокой термической устойчивости исследуемого 1-[2,2-бис(метокси-NNO-азокси)этил]-3,4-динитро-1H-пиразола и о сильной зависимости термостабильности соединений этого класса от числа нитрогрупп в пиразольном цикле.
ВВЕДЕНИЕ
Алкокси-NNO-азоксисоединения (N-алкил-N'-алкоксидиазен-N-оксиды) образуют относительно новый класс энергоемких соединений [1–3]. Интересной особенностью этих веществ является то, что они имеют одинаковый с широко применяемыми нитраминами (а именно к числу нитраминов принадлежат наиболее мощные из всех известных взрывчатых веществ) элементный состав, но превосходят их по энтальпии образования [4], а также по термической [5] и химической стабильности [6–10].
Число выполненных кинетических исследований алкокси-NNO-азоксисоединений невелико, но при этом были получены весьма интересные результаты. В работе [5] изучена кинетика термического разложения N-алкил-N'-метоксидиазен-N-оксидов в газовой фазе. Реакция с высокой точностью описывается уравнением первого порядка. Однако выяснилось, что кинетика процесса сильно зависит от природы алкильного заместителя. При участии алкильных заместителей CH3 и (CH3)3CCH2 энергии активации лежат в диапазоне 48.8–49.2 ккал/моль, а предэкспоненциальные факторы – 1014.5–1014.6 с–1. На основании этих результатов, информации по составу образующихся продуктов, а также сравнения с литературными данными для родственных нитросоединений был сделан вывод о том, что лимитирующей стадией распада двух вышеупомянутых веществ является мономолекулярный гомолитический распад связи N–O. Однако при участии алкила (CH3)3C ситуация резко изменилась: значение энергии активации упало до 35.4 ккал/моль, а предэкспоненциальный множитель составил 1013.3 с–1. Такой резкий скачoк в реакционной способности авторы объяснили тем, что замена алкильного заместителя привела к изменению механизма: теперь уже процесс лимитировался не разрывом связи N–O, а осуществлялся через пятичленное циклическое переходное состояние.
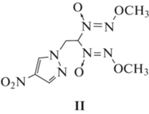
Еще один представитель алкокси-NNO-азоксисоединений, N-[2,2-бис(метокси-NNO-азокси)этил]-4-нитропиразол, исследован в работе [11] методами дифференциальной сканирующей калориметрии (ДСК), термогравиметрии (ТГ), масс-спектрометрии и ИК-спектроскопии. Из данных по тепловыделению и потере массы авторы, применив формулы Киссинджера и Озавы, определили, что значения энергии активации изученной реакции находятся в диапазоне 40.3–41.4 ккал/моль, а предэкспоненциальный фактор – в интервале 1013.1–1013.6 с–1. Полученные величины оказались близки к тем, что были найдены в работе [5] для N-алкил-N'-метоксидиазен-N-оксидов в газовой фазе. Поэтому, по мнению авторов [11], близки и механизмы.
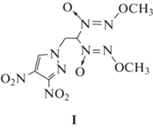
Следует отметить, что при оценке кинетических параметров методами Киссинджера и Озавы первый кинетический порядок реакции постулируется изначально. Поэтому в настоящее время мы ничего не можем сказать о кинетическом поведении алкокси-NNO-азоксисоединений в конденсированном состоянии. В связи с этим в развитие работы [11] мы изучили термическое разложение как в изотермических, так и в неизотермических условиях близкого аналога исследованного в упомянутой работе вещества – 1-[2,2-бис(метокси-NNO-азокси)этил]-3,4-динитро-1H-пиразола (I) [12]. Соединение I было предложено в качестве компонента смесевых твердых ракетных топлив [13]:
Это вещество принадлежит к числу полифункциональных соединений, так как содержит две различные энергоемкие группы – диазеноксидную и 3,4-динитро-1Н-пиразольную. Каждая из этих групп может оказывать влияние на кинетику термического разложения. Подобные эффекты наблюдались ранее при исследовании бифункциональных энергоемких веществ, содержащих тринитрометильную и 1,3,5-триазиновую группы [14, 15].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Соединение 1-[2,2-бис(метокси-NNO-азокси)этил]-3,4-динитро-1H-пиразол (I) синтезировано по известной методике [12]. Его температура плавления (186 °С), ИК-спектры и ЯМР(1Н, 13С и 15N)-спектры соответствовали литературным данным [12]. Перед началом работ вещество перекристаллизовывали из этанола. Чистота продукта подтверждена данными элементного анализа. Найдено, %: C – 25.28, H – 2.97, N – 33.66. C7H10N8O8. Вычислено, %: C – 25.16, H – 3.02, N – 33.53.
Термическое разложение соединения I в неизотермическом режиме изучено методами ДСК и ТГ с использованием синхронного термического анализатора STA 409C Luxx (Netzsch, Германия), сопряженного с квадрупольным масс-спектрометром QMS 403C Aëolos (Netzsch, Германия), в диапазоне температур 30–350 °С, при продувке аргоном со скоростью 40 мл/мин, скорости нагрева – 5 °С/мин и массе навески – 1.4 мг. Масс-спектрометрический анализ газообразных продуктов термического разложения соединения I проводился при энергии ионизирующих электронов, равной 70 эВ.
Кинетику термического разложения в изотермических условиях изучали по потере массы с использованием автоматических термовесов АТВ-5 (Россия). Навеска исходного образца в среднем составляла 8.0 мг.
ЭКСПЕРИМЕНТАЛЬНЫЕ РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На рис. 1 представлены кривые ДСК, ТГ-анализа и масс-спектрометрии, полученные при скорости нагрева образца исследуемого вещества, равной 5 °С/мин. Теплота плавления составила 9.1 ккал/моль.
Рис. 1.
Кривые ДСК, ТГ-анализa и масс-спектрометрии, иллюстрирующие термическое разложение соединения I при скорости нагрева образца 5 °C/мин; цифры при кривых обозначают массы (точнее, m/e), регистрируемые в масс-спектре.
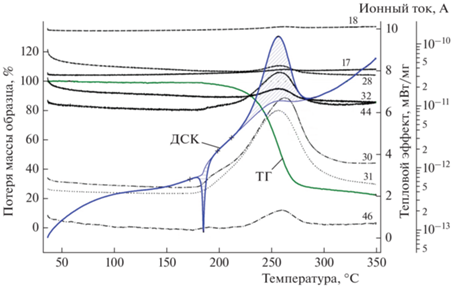
Разложение соединения I проявляется на кривой ДСК в виде асимметричного экзотермического пика в температурном диапазоне 210–290 °C; теплота разложения найдена равной 83.7 ккал/моль. Конечная потеря массы конденсированного вещества в изученных условиях достигает почти 80%.
Масс-спектрометрический анализ газообразных продуктов разложения, проведенный синхронно с исследованием тепловых эффектов и потери массы образца соединения I, показал, что при скорости нагрева 5.0 град/мин основными газообразными продуктами являются N2O, H2O, NO2, NO, СН3ОН и N2. Зарегистрирован также пик при m/e = 31, относящийся к катион-радикалу CH3O+.
На рис. 2 приведены кинетические кривые термического разложения I в изотермическом режиме. Как видно из рисунка, в результате реакции масса образца уменьшается в среднем на 72%, и остается твердый остаток. Поэтому именно эту потерю массы (72%) принимали за 100% превращения. Кинетические кривые 1–5 на рисунке соответствуют разложению ниже температуры плавления, а кривые 6–10 – выше нее. Масштаб рисунка таков, что кривые 6–10, соответствующие разложению в жидкой фазе, почти сливаются между собой. Поэтому эти кривые выделены в отдельный рис. 3.
Рис. 2.
Кинетические кривые потери массы при термическом разложении соединения I для различных температур (°С): 1 – 160, 2 – 165, 3 – 170, 4 – 175, 5 – 180, 6 – 200, 7 – 210.5, 8 – 220, 9 – 230, 10 – 240.
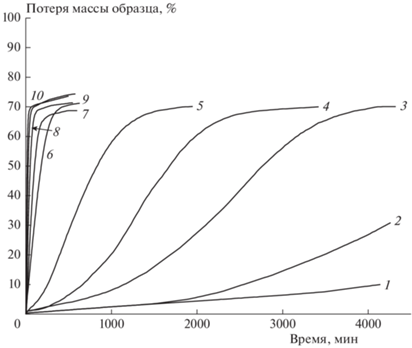
Рис. 3.
Кинетические кривые потери массы при термическом разложении соединения I в жидкой фазе для различных температур (°С): 1 – 200, 2 – 210.5, 3 – 220, 4 – 230, 5 – 240.
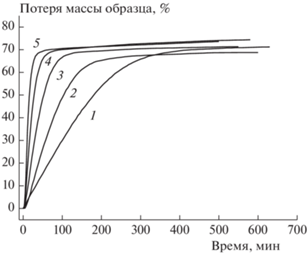
Как видно из приведенных рисунков, ниже температуры плавления кинетические кривые имеют ярко выраженный S-образный (самоускоряющийся) характер. В то же время для жидкофазного разложения такое самоускорение не просматривается. Следовательно, S-образный характер кинетических кривых имеет не химическую, а физическую природу, обусловленную спецификой твердофазного процесса. Известно, что многие твердофазные реакции являются топохимическими. Их протекание связано с появлением и ростом зародышей. Для таких реакций как раз и характерна S-образная кинетика.
Попытки описания твердофазного разложения единой кинетической зависимостью (применялись уравнения автокатализа с разными кинетическими порядками, Праута–Томпкинса, Ерофеева) не увенчались успехом. Впрочем, это не удивительно, учитывая как сложность химического механизма, так и особенности топохимического процесса. Есть еще одна причина столь сложного кинетического поведения. В термовесовом методе, который фактически фиксирует кинетику образования конечных продуктов, априорно предполагается, что в ходе процесса состав образующихся продуктов не меняется. Между тем из рис. 1 видно, что в нашем случае это далеко не так: состав газообразных (а следовательно, и конденсированных) продуктов заметно меняется. В литературе описано множество подобных случаев, когда кинетику термического разложения твердого вещества не удается описать единым уравнением [13]. Напомним, что применение часто используемого в твердофазной кинетике уравнения Аврами предполагает использование разных его вариантов при различных степенях превращения [16].
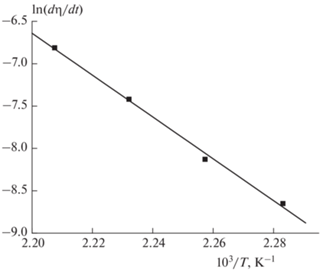
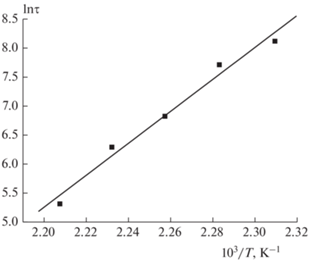
С учетом вышесказанного для получения количественной информации мы построили в аррениусовских координатах температурные зависимости скоростей и времен при заданной степени превращения (метод изоконверсионной кинетики). Примеры таких зависимостей показаны на рис. 4 и 5. Как видно, экспериментальные данные хорошо спрямляются в координатах уравнения Аррениуса.
Рис. 4.
Температурная зависимость времени превращения τ соединения I при η = 10% (η – степень превращения).
Величины эффективных энергий активации, определенные упомянутыми способами, приведены в табл. 1 и 2. В целом данные обеих таблиц не вполне совпадают. Это связано с тем, что приведенные в них значения энергий активации являются не истинными, а эффективными величинами, а суммарная скорость реакции не подчиняется закону действующих масс. Тем не менее прослеживается общая тенденция: с увеличением степени превращения эффективная энергия активации (с учетом экспериментальных погрешностей) уменьшается. Такой результат можно объяснить как особенностями химического механизма реакции (а именно сменой доминирующей реакции на промежуточной стадии разложения – например, вследствие вовлечения в реакцию промежуточного продукта разложения), так и физическими факторами, которые являются специфическими особенностями кинетики термического разложения многих твердых органических веществ [17]. Дело в том, что по мере разложения твердого органического вещества нередко образуются жидкие продукты, в которых твердый субстрат частично растворяется. Таким образом, уже при малых степенях превращения реакция приобретает двухфазный характер: она протекает как в твердой, так и в жидкой фазе, причем с увеличением степени превращения вклад жидкофазного превращения возрастает. Соответственно происходит постепенное уменьшение эффективной энергии активации. Аналогичное влияние на кинетику разложения могут оказывать и другие физические факторы, например, увеличение степени дефектности кристаллов вплоть до их аморфизации или возрастание механических напряжений в кристалле вследствие образования зародышей новой фазы.
Таблица 1.
Кинетические параметры термического разложения соединения I, определенные по температурной зависимости времен при заданной степени превращения
| Степень превращения, % | Эффективная энергия активации, ккал/моль | |
|---|---|---|
| твердая фаза | расплав | |
| 10 | 55.1 ± 4.4 | 19.4 ± 2.1 |
| 20 | 59.2 ± 7.2 | 24.2 ± 1.4 |
| 30 | 57.4 ± 7.1 | 27.0 ± 1.3 |
| 40 | 55.6 ± 6.4 | 28.6 ± 1.1 |
| 50 | 51.3 ± 11.5 | 29.7 ± 0.8 |
| 60 | 48.9 ± 10.6 | 30.2 ± 0.7 |
| 70 | 46.1 ± 10.1 | 30.5 ± 0.6 |
| 80 | 43.8 ± 8.8 | 31.2 ± 0.6 |
Таблица 2.
Кинетические параметры термического разложения соединения I, определенные по температурной зависимости скорости реакции при заданной степени превращения
| Степень превращения, % | Эффективная энергия активации, ккал/моль | |
|---|---|---|
| твердая фаза | расплав | |
| 7 | 56.4 ± 2.0 | 27.2 ± 1.4 |
| 30 | 49.1 ± 2.1 | 33.6 ± 0.8 |
Перейдем к рассмотрению термического разложения в жидкой фазе. Выше говорилось, что, в отличие от твердофазного процесса, в расплаве реакция протекает практически без самоускорения (см. рис. 2). Точнее, самоускорение есть, но оно чаще проявляется лишь как замедление снижения скорости разложения с течением времени по сравнению с реакцией первого порядка.
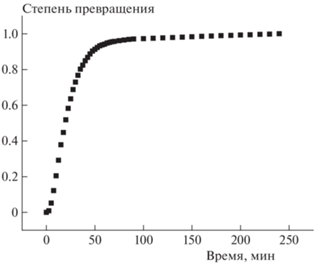
В качестве примера на рис. 6 приведена кинетическая кривая разложения при 230 °С в укрупненном масштабе. Подобного рода зависимости характерны для последовательных реакций. В частности, они наблюдались и для термического разложения нитросоединений [18]. То обстоятельство, что с увеличением степени превращения энергия активации возрастает (см. табл. 1 и 2), может свидетельствовать о том, что вторая стадия реакции протекает медленнее первой. Таким образом, плавление не объясняет самоускорения (иначе энергия активации уменьшалась бы вследствие снятия тормозящего эффекта).
Рис. 6.
Кинетика термического разложения соединения 1-[2,2-бис(метокси-NNO-азокси)этил]-3,4-динитро-1H-пиразола при 230 °С.
Представляется, что при применении метода изоконверсионной кинетики к двух- или многостадийным реакциям использование скорости при данной степени превращения (как температурно-зависимого параметра) более корректно, чем использование времени достижения данной степени превращения, τ. Действительно, величина τ зависит как от констант скорости процессов, протекающих на начальных стадиях разложения, так и от кинетических параметров последующих стадий. В то же время скорость реакции отражает главным образом вклад реакции, доминирующей при данной степени превращения. Этот вывод подтверждается экспериментальными данными: эффективная энергия активации, определенная по температурной зависимости величины τ для степени превращения, равной 10%, в расплаве имеет нереально низкое значение – 19.4 ккал/моль (табл. 1), тогда как использование величины скорости реакции на глубине реакции 7% (как температурно-зависимого параметра) приводит к более реалистичному значению эффективной энергии активации, равному 27.2 ккал/моль (см. табл. 2).
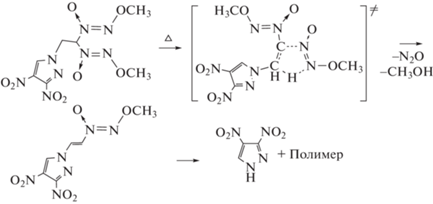
В работе [5] обсуждаются два возможных механизма термического разложения алкокси-NNO-азоксисоединений: через гомолитический разрыв связи N–O и через циклическое переходное состояние. В нашем случае гомолитический разрыв связи N–O исключен, ибо энергия диссоциации связи N–O близка к 50 ккал/моль, что значительно больше величин, представленных в табл. 1 и 2. Поэтому наиболее вероятным представляется протекание реакции по последовательному механизму с образованием промежуточного продукта, возможно, того же типа, что и предложенный в работе [5]:
Подтверждением такого механизма термического разложения соединения I могут служить также обнаруженные в масс-спектрах газообразных продуктов разложения пики, соответствующие CH3OH и N2О (см. рис. 1).
Кстати, именно такой механизм (без подробного кинетического анализа) предлагается для описания процесса распада родственного исследованному в настоящей работе вещества – N-[2,2-бис(метокси-NNO-азокси)этил]-4-нитропиразолу (II) [11]:
Полученные результаты позволяют сделать вывод о том, что соединение I обладает высокой термической устойчивостью. В то же время сопоставление результатов, представленных на рис. 1 с соответствующими данными работы [11] показывает, что это вещество – менее стабильно, чем соединение II. Таким образом, введение второй нитрогруппы в пиразольный цикл приводит к заметному снижению термостабильности. Это согласуется с выводами авторов работы [5] о сильной зависимости термической стабильности алкокси-NNO-азоксисоединений от природы заместителей.
Работа выполнена по теме государственного задания ИПХФ РАН, регистрационный номер AAAA-A19-119101690058-9 и по теме государственного задания ФИЦ химической физики им. Н.Н. Семёнова, регистрационный номер АААА-А17-117040610346-5.
Список литературы
Зюзин И.Н., Лемперт Д.Б. // Изв. АН СССР. Сер. хим. 1985. № 4. С. 831.
Зюзин И.Н., Нечипоренко Г.Н., Головина Н.И. и др. // Там же. 1997. № 8. С. 1486.
Зюзин И.Н., Головина Н.И., Федоров Б.С. и др. // Там же. 2003. № 3. С. 726.
Кирпичев Е.П., Зюзин И.Н., Авдонин В.В. и др. // ЖФХ. 2006. Т. 80. № 9. С. 1543.
Зюзин И.Н., Лемперт Д.Б., Нечипоренко Г.Н. // Изв. АН СССР. Сер. хим. 1988. № 7. С. 1506.
Зюзин И.Н., Лемперт Д.Б. // Журн. общ. химии. 2010. Т. 80. № 9. С. 1473.
Зюзин И.Н., Лемперт Д.Б. // Кинетика и катализ. 2011. Т. 52. № 1. С. 19.
Зюзин И.Н., Лемперт Д.Б. // Журн. общ. химии. 2012. Т. 82. № 6. С. 947.
Зюзин И.Н., Лемперт Д.Б. // Там же. № 11. С. 1928.
Зюзин И.Н., Лемперт Д.Б. // Там же. 2014. Т. 84. № 5. С. 738.
Захаров В.В., Чуканов Н.В., Зюзин И.Н., Неделько В.В., Корсунсий Б.Л. // Хим. физика. 2019. Т. 38. № 2. С. 3; https://doi.org/10.1134/S0207401X19020146
Зюзин И.Н., Супоницкий К.Ю., Далингер И.Л. // Химия гетероцикл. соединений. 2017. Т. 53. № 6/7. С. 702.
Зюзин И.Н., Казаков А.И., Лемперт Д.Б. и др. // Физика горения и взрыва. 2019. Т. 55. № 3. С. 92; https://doi.org/10.15372/FGV20190310
Захаров В.В., Чуканов Н.В., Шилов Г.В., Малков Г.В., Шастин А.В., Корсунский Б.Л. // Хим. физика. 2019. Т. 38. № 4. С. 45; https://doi.org/10.1134/S0207401X19040137
Корсунский Б.Л., Ларикова Т.С., Захаров В.В., Неделько В.В., Чуканов Н. В., Шастин А.В., // Хим. физика. 2019. Т. 38. № 8. С. 64; https://doi.org/10.1134/S0207401X19080065
Барре П. Кинетика гетерогенных процессов. Пер. с фр. М.: Мир, 1976.
Манелис Г.Б., Дубовицкий Ф.И. // Докл. АН СССР. 1959. Т. 126. № 4. С. 813.
Корсунский Б.Л., Дубовицкий Ф.И. // Докл. АН СССР. 1964. Т. 155. № 2. С. 402.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика