Химическая физика, 2022, T. 41, № 7, стр. 57-66
Окисление нитрованной целлюлозы микробным сообществом активного ила
Е. А. Саратовских 1, *, Л. В. Авдеева 1, В. А. Щербакова 2, Р. Н. Яруллин 3
1 Институт проблем химической физики Российской академии наук
Черноголовка, Россия
2 Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина, Российской академии наук
Пущино, Россия
3 Казанский (Приволжский) федеральный университет
Казань, Россия
* E-mail: easar@icp.ac.ru
Поступила в редакцию 02.07.2021
После доработки 03.11.2021
Принята к публикации 20.11.2021
- EDN: CRXRCA
- DOI: 10.31857/S0207401X22070147
Аннотация
Исследовано окисление нативной и обработанной с помощью ультрафиолетового излучения и озона (УФ + озон) нитрованной целлюлозы (НЦ) под действием сообщества микроорганизмов активного ила (АИ) очистных сооружений, а также при совместном культивировании АИ с сульфатвосстанавливающими бактериями Desulfovibrio (D.) desulfuricans (штамм ВКМ В-1388) и микроскопическими грибами Fusarium (F.) solani (штамм BKM F-819). Показано, что использование предварительной обработки значительно повышает степень разложения НЦ при ее последующей биодеградации с помощью симбиоза микроорганизмов АИ с бактериями D. desulfuricans и грибами F. solani. Применение мутагенной обработки АИ нитрозометилмочевиной позволяет биоценозу микроорганизмов активного ила с загрязнителем – НЦ сохранять высокую окисляющую способность с хорошими седиментационными свойствами в течение 65 сут инкубации. Степень разложения НЦ составила 24.36%.
ВВЕДЕНИЕ
Исследования в области высокоэнергетических полимеров, начатые еще лауреатом Нобелевской премии академиком Н.Н. Семеновым [1], не потеряли своей актуальности и в настоящее время. Они охватывают широкий круг задач [2, 3]. Однако с каждым годом всe более актуальной становится экологическая сторона вопроса. В процессе промышленного производства нитратов целлюлозы образуется значительное количество стоков, содержащих трудноразлагающиеся поллютанты, в том числе и нитрованную целлюлозу (НЦ). Разработка методов и технологических приемов, направленных на ускорение разложения соединений, находящихся в отходах производства НЦ, позволит решить экологические проблемы, связанные с ее накоплением, и снизить отрицательную нагрузку на окружающую среду.
Известно, что наиболее перспективными и экологически безопасными являются биологические методы утилизации ксенобиотиков [4–6]. Очистка любых сточных вод проводится на очистных сооружениях, завершающей стадией работы которых является биологическая обработка воды в аэротенках, работающих на активном иле (АИ). Последний представляет собой сложный биоценоз большого числа микроорганизмов, в основном бактерий, у которых клетки находятся в среде растворимых или слаборастворимых внеклеточных полимерных образований – полисахаридов, протеинов, рибонуклеиновых и дезоксирибонуклеиновых кислот.
Существуют варианты применения метода химического мутагенеза, разработанного Рапопортом [7], для увеличения окисляющей способности (ОС) АИ в отношении трудно или практически не разлагаемых химических загрязняющих веществ [7–9]. При этом ферментативная активность микроорганизмов АИ увеличивается более чем в 2 раза [10]. Например, использование генетического метода [11, 12] позволило ускорить процесс деструкции бензола и синтетических жирозаменителей при применении в качестве мутагена нитрозометилмочевины (НММ).
В различных отраслях промышленности находят применение микроорганизмы [13]. Ранее при исследовании биологического разложения НЦ сульфатредуцирующими бактериями Desulfovibrio (D.) desulfuricans [14] и мицелиальным грибом Fusarium (F.) solani [15, 16] мы показали, что предварительная обработка нитроцеллюлозы УФ‑облучением и озоном способствовала более глубокой ее биодеградации. Деградация обработанной таким образом НЦ смешанной культурой из F. solani и D. desulfuricans приводила к уменьшению содержания азота с 13.38 до 10.03%, а среднечисловой (Mn) и средневесовой (Mw) молекулярной массы (ММ) – в 3 и 2 раза соответственно.
Цель настоящей работы – оценка возможности применения в процессе очистки стоков промышленного производства НЦ активного ила очистных сооружений, подвергнутого мутагенной обработке, в сочетании с инкубацией с грибами F. solani и бактериями D. desulfuricans.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы. Для приготовления микробиологических сред, буферных систем и выполнения физико-химических исследований использовали реагенты и растворители производства компаний Sigma-Aldrich (USА), BioRad (USА) и Реахим (Россия).
Для исследований использовали образцы НЦ, предоставленные Казанским пороховым заводом, марки “М/л 26 432-01” с содержанием азота 13.38% (масса элементарного звена макромолекулы – 284.4, степень полимеризации – 1140, ММ – 324 216) согласно ГОСТ Р50461-92.
Микроорганизмы. В работе использовали мицелиальный гриб F. solani (штамм BKM F-819) и сульфатвосстанавливающую бактерию D. desulfuricans (штамм ВКМ В-1388), полученные из Всероссийской коллекции микроорганизмов Института биохимии и физиологии микроорганизмов им Г.К. Скрябина ФИЦ “Пущинский научный центр биологических исследований РАН”. Культивирование микроорганизмов проводили, как описано ранее [15].
В качестве консорциума микроорганизмов использовали АИ, отобранный из аэротенка на очистных сооружениях ВКХ ФГУП “Управление эксплуатации НЦЧ РАН” в г. Черноголовка Московской области. Активный ил имел буро-коричневый цвет со слегка болотистым запахом без преобладания запаха химических примесей.
Мутагенная обработка АИ. В качестве мутагенного агента была использована N-метил-N-нитрозомочевина марки “х.ч.” (Sigma, США) в концентрации 0.07% (в/о). Обработка АИ проводилась через 4 сут контакта АИ с исследуемой НЦ. Обработку проводили в течение 18 ч [7]. На 29-е сутки от начала эксперимента АИ был подвергнут повторной обработке нитрозометилмочевиной также в течение 18 ч. Исследования выполнялись параллельно как на исходном, так и на обработанном АИ.
Биодеградацию НЦ культурами бактерий и грибов проводили согласно методу, описанному в работе [16]. Варианты исследования биологической деградации НЦ с использованием микроорганизмов приведены в табл. 1. Эксперименты по исследованию биологического окисления НЦ под действием микробного сообщества АИ проводили в лабораторных стеклянных реакторах объемом 3 л при естественном освещении с продувом воздухом, содержащих 1000 мл питательной среды, 200 мл АИ и 10 г/л НЦ. В первой серии экспериментов в реакторы №№ 1, 3, 5 загружали исходную НЦ, во второй серии в реакторы №№ 2, 4, 6 загружали обработанную НЦ (НЦобр).
Таблица 1.
Варианты экспериментов по исследованию биологической деградации нитроцеллюлозы
| № реактора | Состав | Объем среды, мл | Объем посеянных бактерий, мл | Кол-во посев. грибов, косяки | Объем АИ, мл | Концентрация НЦ, г/л |
|---|---|---|---|---|---|---|
| Контроль | Активный ил (АИ) | 1000 | – | – | 200 | – |
| 1 | АИ + НЦ | 500 | – | – | 100 | 5 |
| 2 | АИ + НЦобр | 1000 | – | – | 200 | 10 |
| 3 | АИ + НЦ + D. desulfuricans + F. solani | 1000 | 50 | 3 × 2 | 200 | 10 |
| 4 | АИ +НЦобр + D. desulfuricans + + F. solani | 1000 | 50 | 3 × 2 | 200 | 10 |
| 5 | АИ + НММ + НЦ | 1000 | – | – | 200 | 10 |
| 6 | АИ + НММ + НЦобр + D. desulfuricans + F. solani | 1000 | 50 | 3 × 2 | 200 | 10 |
В вариантах, предусматривающих исследование окисления НЦ под влиянием АИ, бактерий и грибов, к раствору АИ в питательной среде добавляли культуры бактерии D. desulfuricans и гриба F. solani, как описано выше (реакторы №№ 3, 4 и 6). Пробы для анализа отбирали на 5-, 16-, 36-е и 65-е сут от начала эксперимента в объеме 50 мл после механического перемешивания раствора. Обработку НЦ ультрафиолетом и озоном, выделение НЦ из раствора, определение концентраций азота и других элементов в НЦ, нитрата и нитрита, вязкости и молекулярно-массового распределения (ММР) НЦ проводили, как описано ранее [15].
Изменения состояния активного ила. Исходный АИ перед началом экспериментов имел плотность по весу в 6.86 г/дм3. Объем осажденного АИ за 30 мин в цилиндре объемом 500 мл составил 30 мл, т.е. что составляет 940 см3/дм3. Иловый индекс был равен 137 см3/г. Видовой состав АИ определяли по методу, описанному в работах [17, 18] с использованием светового микроскопа “МБИ-6” производства завода ЛОМО (Ленинград, СССР).
Погрешности измерений и статистическая обработка экспериментальных данных. В холостом опыте установили, что общая потеря массы НЦ в процессе растворения и центрифугирования может достигать 6%. С использованием этих данных определяли количество выделенной НЦ в изолированных растворах.
При определении концентраций элементов C, H, S, N предел обнаружения составлял <40 ppm; стандартное отклонение результатов – не более 0.1%. Определение концентрации нитрата происходит при колебании величин измерений примерно на 0.1% от измеряемой величины. Измерение вязкости одного и того же образца проводили три раза. Погрешность измерений составляет ±0.35% от измеряемых значений.
Все эксперименты выполнены в трех повторностях. Статистическую обработку экспериментальных данных проводили путем определения их средних арифметических и стандартных ошибок. Достоверность измерений оценивали с помощью критерия Стьютента, считая разницу достоверной при значении Р ≤ 0.05.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Степень биологического окисления НЦ
Как видно из табл. 1, были проведены исследования биодеградации нитроцеллюлозы и НЦ, предварительно обработанной УФ-облучением и озоном, в нескольких вариантах: с добавлением активного ила и АИ, обработанного мутагеном, а также с добавлением грибов и бактерий. Биодеструкция оценивалась по изменению характеристических параметров: рН, вязкости и ММР, содержанию С, Н, N в НЦ, появлению нитратов и нитритов в растворе, изменению величины тепловыделения образцов. Ни в одном из исследованных образцов НЦ, отобранных из реакторов №№ 1–6, сера не была обнаружена (табл. 2). Водный раствор исходной НЦ имеет рН, соответствующий слабокислой среде. Обнаруженное в ней содержание ${\text{NO}}_{3}^{ - }$ колебалось от 5.94 до 6.24 мкг/мл; присутствия ${\text{NO}}_{2}^{ - }$ не обнаружено. В контрольном реакторе, содержавшем только АИ за 65 сут инкубации, рН возрастает от 6.5 до 7.68. Содержание нитратов и нитритов в этом реакторе незначительное: максимальное содержание нитратов составило 2.63 мкг/мл, нитритов – 0.44 мкг/мл.
Таблица 2.
Содержание углерода, водорода в НЦ, нитрат- и нитрит-ионов в среде роста микроорганизмов и АИ после биодеградации
| № реактора | Время инкубации, сут | рН | Содержание | |||
|---|---|---|---|---|---|---|
| С, мас.% | Н, мас.% | ${\text{NO}}_{3}^{ - }$, мкг/мл | ${\text{NO}}_{2}^{ - }$, мкг/мл | |||
| Контроль | 0 | 6.50 | н.о | н.о | н.о | н.о |
| 5 | 7.04 | н.о | н.о | н.о | н.о | |
| 16 | 7.15 | н.о | н.о | 2.13 ± 0.02 | 0.15 ± 0.001 | |
| 38 | 7.45 | н.о | н.о | 1.62 ± 0.02 | 0.44 ± 0.002 | |
| 65 | 7.68 | н.о | н.о | 2.63 ± 0.01 | 0.35 ± 0.001 | |
| 1 | 0 | 6.50 | н.о | н.о | н.о | н.о |
| 5 | н.о | 31.23 ± 0.20 | 3.570 ± 0.01 | 4.30 ± 0.02 | н.о | |
| 16 | 8.39 | 27.07 ± 0.15 | 3.264 ± 0.01 | 3.64 ± 0.02 | н.о | |
| 38 | 5.98 | 26.46 ± 0.22 | 3.135 ± 0.05 | 2.02 ± 0.01 | 12.48 ± 0.05 | |
| 65 | 5.73 | 25.70 ± 0.14 | 2.794 ± 0.02 | 16.03 ± 0.05 | н.о | |
| 2 | 0 | 5.00 | н.о | н.о | н.о | н.о |
| 5 | н.о | 29.44 ± 0.25 | 3.744 ± 0.02 | 12.90 ± 0.04 | н.о | |
| 16 | 8.15 | 24.92 ± 0.19 | 2.606 ± 0.05 | 7.58 ± 0.03 | н.о | |
| 38 | 6.99 | 25.80 ± 0.11 | 3.038 ± 0.03 | 2.02 ± 0.01 | 0.18 ± 0.001 | |
| 65 | 6.40 | 25.16 ± 0.13 | 2.721 ± 0.05 | 17.50 ± 0.02 | 44.6 ± 0.08 | |
| 3 | 0 | 6.00 | н.о | н.о | н.о | н.о |
| 5 | н.о | 29.92 ± 0.12 | 3.810 ± 0.02 | 3.80 ± 0.01 | н.о | |
| 16 | 8.60 | 26.01 ± 0.18 | 2.993 ± 0.02 | 8.08 ± 0.04 | н.о | |
| 38 | 6.84 | 25.91 ± 0.22 | 2.759 ± 0.01 | 3.03 ± 0.02 | 0.15 ± 0.001 | |
| 65 | 6.34 | 25.00 ± 0.15 | 2.865 ± 0.05 | 6.62 ± 0.03 | 23.4 ± 0.003 | |
| 4 | 0 | 4.50 | н.о | н.о | н.о | н.о |
| 5 | н.о | 32.52 ± 0.15 | 4.333 ± 0.02 | 10.86 ± 0.05 | н.о | |
| 16 | 8.21 | 27.59 ± 0.20 | 2.970 ± 0.03 | 16.90 ± 0.03 | 0.57 ± 0.002 | |
| 38 | 7.00 | 27.55 ± 0.14 | 3.396 ± 0.02 | 7.37 ± 0.02 | 0.99 ± 0.001 | |
| 65 | 5.41 | 26.58 ± 0.15 | 3.213 ± 0.01 | 4.04 ± 0.02 | 2.52 ± 0.002 | |
| 5 | 0 | |||||
| 5 | 28.54 ± 0.11 | 3.550 ± 0.03 | ||||
| 16 | 25.01 ± 0.18 | 2.621 ± 0.02 | ||||
| 38 | 25.55 ± 0.20 | 2.976 ± 0.05 | ||||
| 65 | 25.96 ± 0.21 | 2.845 ± 0.03 | ||||
| 6 | 0 | |||||
| 5 | 29.65 ± 0.15 | 3.683 ± 0.03 | ||||
| 16 | 26.49 ± 0.18 | 2.902 ± 0.02 | ||||
| 38 | 25.91 ± 0.11 | 3.477 ± 0.02 | ||||
| 65 | 26.09 ± 0.18 | 2.895 ± 0.02 | ||||
В реакторах №№ 1–4 величина рН от начала эксперимента к 16-м суткам возрастает от значений, соответствующих нейтральной и слабокислой средам до 8.15–8.60, а к 65-м суткам снижается до значений 5.41–6.40. В процессе биодеградации количество нитрат-ионов в среде роста АИ в реакторе № 1 на 38-е сутки незначительно отличается от контрольного и только к 65-м суткам возрастает значительно – до 16.03 мкг/мл. В реакторе № 2, содержащем НЦобр и АИ, картина принципиально иная: через 5 сут инкубации содержание ${\text{NO}}_{3}^{ - }$ составляет 12.9 мкг/мл. Затем концентрация нитрата падает, практически до показателей из контрольного реактора и только на 65-е сутки вновь возрастает до 17.5 мкг/мл. В реакторе № 4 (АИ + НЦобр + D. desulfuricans + F. solani) на 5-е сутки инкубации содержание нитрат-ионов значительное – 10.86 мкг/мл, к 16-м суткам еще более возрастает – до 16.9 мкг/мл; а к 38-м суткам начинает снижаться. Инкубация НЦ с АИ во всех исследованных вариантах приводит к уменьшению содержания азота к 65-м суткам (рис. 1). Предварительная обработка НЦ с помощью УФ-облучения и озона повышает скорость разложения НЦ на АИ. Так, содержание азота через 38 сут инкубации в реакторе № 2 (10.38%) ниже, чем в реакторе № 1 (10.97%). Аналогично, в реакторе № 4 азота меньше, чем в реакторе № 3, а в реакторе № 6 его меньше, чем в реакторе № 5.
Рис. 1.
Изменение содержания азота в образцах НЦ, инкубированных с АИ: 1 – АИ + НЦ, 2 – АИ + НЦобр, 3 – АИ + + НЦ + D. desulfuricans + F. solani, 4 – АИ + НЦобр + D. desulfuricans + F. solani, 5 – АИ + НММ + НЦ, 6 – АИ + НММ + + НЦобр + D. desulfuricans + F. solani.
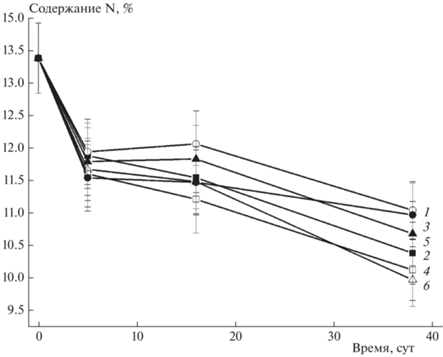
Использование АИ, обработанного мутагеном НММ, оказывает дополнительное положительное действие на процесс окисления НЦ. К 38-м суткам инкубации содержание азота в реакторе № 5 (10.12%) и тем более в реакторе № 6 (9.97%) значительно ниже, чем в реакторе № 1 (10.97%) и реакторе № 2 (10.38%).
Добавление к АИ бактерий и грибов, т.е. попытка создать симбиоз микроорганизмов, не приводит к значительному влиянию на степень разложения НЦ. Содержание азота в реакторе № 3 стабильно было выше на протяжении всего эксперимента (от 5 до 38 сут), чем в реакторе № 1, содержавшем только АИ. Низкое содержание азота (11.21%) в образцах достигается в реакторе № 4, в котором к АИ добавлены бактерии и грибы при использовании НЦобр, уже к 16-м суткам. Содержание азота в этом реакторе к 38-м суткам экспозиции снижается до 10.68%. Наименьшее содержание азота за 38 сут инкубации достигается в аналогичном варианте обработки, но в присутствии АИ, обработанного НММ (реактор № 6). В этом варианте содержание азота составило 10.12%, максимальная потеря азота – 3.26%, а степень разложения по азоту составляет, соответственно, 24.36%.
В реакторе № 6 наблюдается результат влияния всех использованных воздействий на НЦобр, однако, снижение содержания азота в нем незначительно по сравнению с реактором № 4. Это дает основания задуматься о целесообразности введения дополнительной технологической операции в реальном технологическом процессе.
Изменение вязкости и молекулярно-массовых характеристик в процессе окисления НЦ
В процессе исследования биологического разложения НЦ для каждой отобранной пробы были определены: вязкость ацетоновых растворов, среднечисленная (Mn) и средневесовая молекулярная масса (Mw), полидисперсность (Mw/Mn). Процесс биологического окисления НЦ может происходить путем отщепления групп ${\text{NO}}_{2}^{ - }$ и ${\text{NO}}_{3}^{ - }$ либо путем разрыва связи C–C. Если наличие нитрат- и нитрит-ионов может служить доказательством протекания реакции в первом направлении, то изменение вязкости связано с молекулярным весом полимера и демонстрирует способность микроорганизмов расщеплять эту связь. Результаты измерения вязкости растворов НЦ в ацетоне показывают, что в результате инкубации НЦ с АИ происходит значительный рост величины как абсолютной, так и динамической вязкости по сравнению с контрольным образцом (табл. 3).
Таблица 3.
Изменение вязкости растворов в процессе биологической обработки нитроцеллюлозы
| Образец | Время, сут | Вязкость | Mn | Mw | |
|---|---|---|---|---|---|
| абсолютная, сПа | динамическая, cСт | ||||
| Ацетон (сравнение) | 0.28 ± 8 · 10–4 | 0.35 ± 7 · 10–4 | |||
| НЦисх | 0.58 ± 7 · 10–4 | 0.73 ± 8 · 10–4 | 8600 ± 30.1 | 27 500 ± 96.0 | |
| НЦобр | 0.50 ± 7 · 10–4 | 0.62 ± 7 · 10–4 | 6750 ± 24.4 | 20 200 ± 93.0 | |
| 1 | 5 | 2.01 ± 8 · 10–3 | 2.51 ± 8 · 10–3 | 19 300 ± 67.5 | 127 800 ± 440.0 |
| 16 | 2.04 ± 7 · 10–3 | 2.54 ± 8 · 10–3 | 13 800 ± 48.3 | 89 800 ± 300.0 | |
| 38 | 2.40 ± 7 · 10–3 | 2.99 ± 6 · 10–3 | 10 800 ± 32.5 | 77 630 ± 270.0 | |
| 2 | 5 | 8.44 ± 2 · 10–2 | 10.53 ± 3 · 10–2 | 12 600 ± 38.7 | 32 200 ± 96.9 |
| 16 | 10.24 ± 3 · 10–2 | 12.77 ± 3 · 10–2 | 11 000 ± 33.4 | 30 200 ± 95.0 | |
| 38 | 8.60 ± 3 · 10–2 | 10.72 ± 2 · 10–2 | 5350 ± 10.8 | 24 300 ± 90.7 | |
| 3 | 5 | 0.51 ± 8 · 10–4 | 0.64 ± 7 · 10–4 | 15 400 ± 50.1 | 40 800 ± 142.0 |
| 16 | 0.55 ± 7 · 10–4 | 0.69 ± 8 · 10–4 | 13 400 ± 47.6 | 49 500 ± 153.0 | |
| 38 | 0.45 ± 8 · 10–4 | 0.57 ± 7 · 10–4 | 13 900 ± 44.9 | 32 200 ± 97.3 | |
| 4 | 5 | 9.37 ± 2 · 10–2 | 11.69 ± 2 · 10–2 | 6600 ± 21.3 | 20 500 ± 90.6 |
| 16 | 10.97 ± 2 · 10–2 | 13.68 ± 3 · 10–2 | 4800 ± 12.5 | 18 400 ± 64.4 | |
| 38 | 13.25 ± 3 · 10–2 | 16.51 ± 2 · 10–2 | 5350 ± 11.3 | 23 640 ± 95.0 | |
| 5 | 5 | 5.98 ± 8 · 10–3 | 7.46 ± 1 · 10–2 | 15 500 ± 51.6 | 52 600 ± 155.0 |
| 16 | 8.52 ± 2 · 10–2 | 10.62 ± 2 · 10–2 | 13 400 ± 40.7 | 32 200 ± 98.7 | |
| 38 | 13.34 ± 3 · 10–2 | 16.62 ± 3 · 10–2 | 19 640 ± 63.3 | 51 950 ± 150.0 | |
| 6 | 5 | 4.41 ± 8 · 10–3 | 5.49 ± 6 · 10–3 | 14 500 ± 47.3 | 45 700 ± 148.0 |
| 16 | 4.75 ± 8 · 10–3 | 5.92 ± 8 · 10–3 | 12 300 ± 35.5 | 37 700 ± 98.4 | |
| 38 | 3.10 ± 7 · 10–3 | 3.86 ± 6 · 10–3 | 17 080 ± 53.9 | 48 500 ± 149.0 | |
Примечание: номера образцов соответствуют составам из табл. 1.
Видно, что НЦобр имеет несколько меньшую вязкость в растворе ацетона, чем исходная НЦ. Во всех вариантах исследования (кроме эксперимента в реакторе № 3) уже к 5-м суткам инкубации наблюдается значительное увеличение вязкости раствора НЦ в ацетоне по сравнению с исходной. Вязкость нарастает до 16 сут инкубации, а затем снижается в реакторах №№ 2, 3, 4 и 6. Совсем иная картина наблюдается в реакторе № 3, содержащем исходную НЦ. В этом реакторе вязкость ацетоновых растворов ацетона остается близкой к исходным значениям в течение всего времени инкубации (38 сут). Самые высокие показатели вязкости – 13.25 для абсолютной вязкости и 16.51 для динамической наблюдаются в реакторе № 4, где использована НЦ, обработанная УФ-облучением и озоном. Вязкость растворов НЦ после инкубации с АИ, подвергнутым мутагенной обработке (реакторы № 5 и № 6), также выше, чем у исходной нитроцеллюлозы. Причем вязкость растворов росла в зависимости от времени биологического воздействия на НЦ. Применение обработки нитрозометилмочевиной в реакторе № 6, содержащем НЦобр, приводило к снижению вязкости по сравнению с результатами, полученными в реакторах № 4 и № 5. Однако в реакторе № 6 абсолютная и динамическая вязкости были в 2–2.5 раза выше, чем в реакторе № 1 и почти в 10 раз выше, чем в исходной НЦ.
Известно, что высокая вязкость полимерных растворов обусловлена большими размерами макромолекул и их нитевидным строением. Вязкость возрастает с увеличением длины макромолекулы и степени ее вытянутости [19], а также с увеличением сил межмолекулярного взаимодействия, поскольку затрудняется скольжение цепей относительно друг друга. Клубкообразные макромолекулы быстрее перемещаются в растворителе и не столь сильно затрудняют движение молекул растворителя. Благодаря этому уменьшается коэффициент внутреннего трения, что приводит к снижению вязкости раствора.
Полученные нами данные об изменении вязкости растворов однозначно свидетельствуют, что деформация молекул НЦ и НЦобр в реакторах №№ 1–6, за исключением реактора № 3, приводила к преобразованию клубкообразных молекул в линейные структуры. Вероятно, в реакторе № 3 по неизвестным причинам этого изменения не произошло.
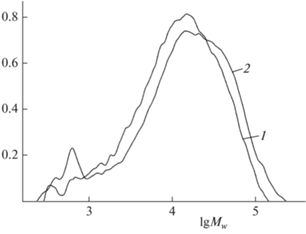
Для углубленного анализа изменений состояния НЦ в процессе биологической деструкции также был выполнен контроль молекулярно-массового распределения образцов (табл. 3). Видно, что первоначальная обработка НЦ (УФ + озон) способствует уменьшению ММ полимера при дальнейшей инкубации в присутствии микроорганизмов в аналогичных вариантах – Mn в образцах из реактора № 1 (АИ + НЦ) изменяется в зависимости от времени выдержки: Mn = 19 300, 13 800, 10 800. В реакторе № 2, в котором использована НЦобр, молекулярная масса составила 12 600, 11 000, 5350 в эти же промежутки времени инкубации. Такая же картина сохраняется и в других парных вариантах обработки: в реакторах № 3 и № 4, № 5 и № 6. Добавление бактерий D. desulfuricans штамма ВКМ В-1388 и грибов F. solani штамма ВКМ F-819 к АИ в реакторе № 4, содержащем НЦобр, приводит к тому, что значения Mn (6600, 4800, 5350) и Mw (20 500, 18 400, 23 640) образцов из этого реактора в 2–2.8 раз ниже, чем в реакторе № 3: Mn = 6600, 4800, 5350 за 5, 16 и 38 сут обработки соответственно. Это самые низкие значения ММ из всех вариантов обработки. Следует отметить, что эффект снижения ММ в образцах из всех реакторов наблюдается уже через первые 5 сут инкубации. В реакторах №№ 3–6 минимальные значения ММ наблюдаются на 16-е сутки инкубации и несколько возрастают к 38-м суткам. Кривые ММР исходных образцов имеют близкие характеристики (рис. 2). Кривые ММР для образцов из реакторов, содержащих НЦобр, показывают наилучшие результаты (рис. 3).
Рис. 3.
Кривые ММР образцов НЦобр после 16 сут микробиологической обработки: 1 – НЦобр, 2 – реактор № 3 (АИ + НЦ + D. desulfuricans + F.solani), 3 – реактор № 6 (АИ + НММ + НЦобр + D. desulfuricans + F. solani), 4 – реактор № 4 (АИ + НЦобр + D. desulfuricans + F. solani), 5 – реактор № 2 (АИ + НЦобр).
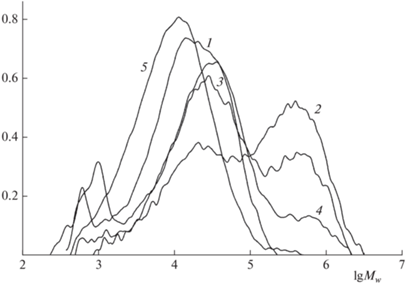
Из кривых, представленных на рис. 3, видно, что инкубация НЦ с АИ приводит к возникновению низкомолекулярных фракций полимера, что может свидетельствовать о расщеплении связи C–C ферментами микроорганизмов, присутствующих в биоценозе АИ. В результате биологической обработки с АИ и дополнительного введения бактерий D. desulfuricans и грибов F. solani в реакторе № 4 НЦобр уже через 5 сут образуется значительное количество низкомолекулярных продуктов. Доля этих фракций нарастает по мере увеличения времени биологической обработки и доходит до 99–92%.
Влияние НЦ на свойства АИ
Гидробиоценоз исходного АИ после 22 сут инкубации с НЦ разнообразен по видовому составу и обладает низкой активностью. В целом, состояние АИ можно оценить как удовлетворительное: прозрачная надиловая вода, осадок и “хлопок” – плотные (табл. 4). Гидробиоценоз предварительно подвергшегося мутагенной обработке активного ила после 22 сут инкубации с НЦ сохраняет видовое разнообразие эукариотных микроорганизмов и низкую активность, однако надиловая вода становится слегка мутной, а “хлопок” – средний по плотности.
Таблица 4.
Гидробиологический состав активного ила
| Организм | Исходный АИ | Через 22 сут инкубации с НЦ | |
|---|---|---|---|
| исходный АИ | АИ, обработанный НММ | ||
| Водоросли (Algae) | |||
| Spirulina | + | ||
| Thiotrix sp. | + | + | |
| Zoogloea ramigera | + | ||
| Нитчатые водные грибы Гифомицеты | + | ||
| Простейшие (Protozoa) | |||
| Amoeba sp. | + | + | |
| Amoeba proteus | + | ||
| Arcella vulgaris | + | + | |
| Centropyxis aculeata | + | + | |
| Diatomae | + | + | |
| Litonotus sp. | + | ||
| Nematoda | + | + | |
| Pamphagus hyalinus | + | + | |
| Инфузории свободноплавающие (Infusoria) | |||
| Amphiertus sp. | |||
| Aspidisca sp. | + | + | |
| Rabdophriya | + | ||
| Thuricola similis | + | ||
| Реснитчатые инфузории (Gastrotricha) | |||
| Chaetonotus sp. | много | + | + |
| Инфузории прикреплeнные (Sessilida) | |||
| Epistylis sp. | + | + | |
| Vorticella alba | + | ||
| Vorticella convularia | + | + | |
| Vorticella microstoma | + | ||
| Коловратки (Ploimida) | |||
| Colurella sp. | + | ||
| Lecane sp. | + | ||
| Rotaria rotatoria | + | + | |
До начала эксперимента в контрольном образце АИ идентифицированы 17 видов простейших организмов: представители водорослей, амеб, прикреплeнных инфузорий, флагеллаты. Однако после введения загрязнителя происходило уменьшение числа регистрируемых видов до семи. Обработка мутагеном НММ приводила к качественному изменению состава АИ и увеличению регистрируемого видового разнообразия: биоценоз представлен двумя типами водорослей и четырьмя классами беспозвоночных (реснитчатые, жгутиконосцы, нематоды, коловратки), заметно увеличивалась и численность простейших.
Показателем качества АИ является его иловый индекс (ИИ), характеризующий состояние АИ и его седиментационные свойства [20]. Как правило, АИ, обладающий хорошими седиментационными свойствами, характеризуется величиной ИИ, составляющей от 60–90 до 120–150 мг/л. Резкое увеличение ИИ может быть связано как со слишком высокими, так и слишком низкими нагрузками на АИ, в результате чего наблюдается его “вспухание”. При высоких значениях ИИ, активный ил будет выноситься из вторичного отстойника вместе с очищенной водой, ухудшая степень ее очистки. Величины ИИ для АИ после 65 сут инкубации с НЦ представлены в табл. 5.
Таблица 5.
Изменение илового индекса АИ
| Реактор | Вес сухого АИ, г | Содержание АИ, см3/дм3 | Иловый индекс, см3/г | рН |
|---|---|---|---|---|
| Исходный АИ | 6.86 ± 0.003 | 940 ± 3.5 | 137.00 | 7.53 |
| Контроль 1 (АИ) | 0.76 ± 0.001 | 40 ± 0.30 | 52.36 | 7.68 |
| Контроль 2 (АИ + НММ) | 0.91 ± 0.002 | 80 ± 0.60 | 88.11 | 7.40 |
| Реактор № 1 (АИ + НЦ) | 0.76 ± 0.002 | 100 ± 0.90 | 131.58 | 5.73 |
| Реактор № 2 (АИ + НЦобр) | 0.96 ± 0.001 | 80 ± 0.40 | 83.07 | 6.40 |
| Реактор № 3 (АИ + НЦ + б + г) | 2.25 ± 0.002 | 100 ± 0.80 | 42.53 | 6.34 |
| Реактор № 4 (АИ + НЦобр + б + г) | 1.51 ± 0.002 | 64 ± 0.60 | 44.45 | 7.00 |
| Реактор № 5 (АИ + НММ + НЦ) | 1.39 ± 0.001 | 130 ± 0.95 | 93.86 | 6.53 |
| Реактор № 6 (АИ + НММ + НЦобр + б + г) | 2.10 ± 0.001 | 126 ± 0.95 | 59.95 | 6.82 |
В контрольном реакторе АИ сильно терял свои окислительные свойства (контроль 1, табл. 5), что происходило, вероятно, из-за недостаточной аэрации. Проведенная обработка нитрозометилмочевиной позволила сдерживать уменьшение ИИ, т.е. способствовала поддержанию окислительной способности АИ в течении 65 сут (контроль 2, табл. 5). Как видно из табл. 5, присутствие как обработанной, так и нативной НЦ снижает показатели ИИ. Самый низкий ИИ зафиксирован в реакторах № 3 и № 4, в которых к АИ были добавлены бактерии и грибы. Такой ил обладает хорошими седиментационными свойствами, однако для него также характерна низкая скорость прироста биомассы, связанная с понижением активности его метаболизма, что в результате не позволяет поддерживать необходимую нагрузку на АИ [20]. В аналогичном варианте биологической обработки – в реакторах № 5 и № 6 АИ был обработан НММ. В результате снижение ИИ в них не столь заметное и остается в рамках, требуемых для илового индекса в АИ химических комбинатов: 50–90 см3/г [21].
Анализ состояния АИ после инкубации с НЦ в течение 65 сут показывает, что сообщество простейших и грибов сохранило свое разнообразие. Вероятно, эти микроорганизмы участвовали в деградации НЦ [22]. Предварительная обработка нитрозометилмочевиной позволяет в значительной степени сохранять окислительные свойства АИ и не приводит к образованию взвешенных частиц с высокой плотностью [20], т.е. к “слипанию” частиц НЦ. Использование мутагенной обработки АИ стабилизирует значение ИИ, что указывает на создание условий, оптимальных для жизнедеятельности биоценоза АИ в данном процессе очистки НЦ, а также на правильность выбора режима эксплуатации установки аэробной биологической очистки.
ЗАКЛЮЧЕНИЕ
В проведенном исследовании установлено, что НЦ разлагается биологическими деструкторами – микроорганизмами. За период до 38 сут пребывания под действием различных микроорганизмов – потенциальных биологических деструкторов степень биодеградации НЦ исследованными микроорганизмами составила 24.36%.
Из отдельных видов микроорганизмов наиболее существенные результаты разложения НЦ достигнуты при окислении НЦ мицелиальным грибом F. solani штамма BKM F-819. Использование предварительной обработки УФ-облучением и озоном значительно повышает степень разложения НЦ. Для биодеградации эффективно создание симбиоза микроорганизмов D. desulfuricans (штамм ВКМ В-1388) и F. solani (штамм BKM F-819) с биоценозом микроорганизмов АИ.
Показано, что применение мутагенной обработки АИ нитрозометилмочевиной позволяет биоценозу микроорганизмов активного ила с высокотоксичным и трудноразлагаемым загрязнителем – НЦ сохранять высокую окисляющую способность с хорошими седиментационными свойствами в течение 65 сут инкубации.
Работа выполнена в рамках госзадания № 0089-2019-0014 (регистрационный номер АААА-А19-119071890015-6).
Список литературы
Трофимов В.С., Веретенников В.А., Петров Е.В. // Хим. физика. 2021. Т. 40. № 4. С. 63; https://doi.org/10.31857/S0207401X21040129
Анпилова А.Ю., Масталыгина Е.Е., Храмеева Н.П., Попов А.А. // Хим. физика. 2020. Т. 39. № 1. С. 66; https://doi.org/10.31857/S0207401X20010021
Назин Г.М., Дубихин В.В., Гончаров Т.К. и др. // Хим. физика. 2021. Т. 40. № 7. С. 16; https://doi.org/10.31857/S0207401X21070050
Gallo B., Allen A., Bagalawis R.L. et al. // Microbial degradation of nitrocellulose. Nitrocellulose fines separation and treatment workshop proceedings. Champaign, IL: US Army Construction Engineering Research Laboratory, 1993.
White G.F., Snape J.R. // J. Gen. Microbiol. 1993. V. 139. P. 1947; https://doi.org/10.1099/00221287-139-9-1947
Попов А.А., Зыкова А.К., Масталыгина Е.Е. // Хим. физика. 2020. Т. 39. № 6. С. 71; https://doi.org/10.31857/S0207401X20060096
Применение химических мутагенов в защите среды от загрязнения и в сельско-хозяйственной практике / Под ред. Рапопорта И.А. М.: Наука, 1981.
Человек и среда его обитания / Под ред. Лисичкина Г.В., Чернова Н.Н. М.: Мир, 2003.
Жмур Н.С. Технологические и биохимические процессы очистки сточных вод на сооружениях с аэротенками. М.: Акварос, 2003.
Силантьева Н.С., Замелин В.И., Федосова Н.Ф. // Применение химических мугагенов в защите среды от загрязнения и в сельско-хозяйственной практике / Под ред. Рапопорта И.А. М.: Наука, 1981. С. 49–52.
Лебедь Э.С., Загустина Н.А., Бартошевич Ю.Э., Безбородов А.М. // Там же. С. 71–73.
Ванифатьева М.Т., Филиппов Н.А., Сергиенко З.М. // Там же. С. 41–42.
Калинина И.Г., Иванов В.Б., Семенов С.А. и др. // Хим. физика. 2021. Т. 40. № 6. С.71; https://doi.org/10.31857/S0207401X21060054
Саратовских Е.А., Казаков А.И., Хрячков В.А., Яруллин Р.Н. // Рос. хим. журн. 2016. Т. LX. № 4. С. 106.
Хрячков В.А., Е.А. Саратовских Е.А., Яруллин Р.Н., Куликов А.В. // Хим. физика. 2017. Т. 36. № 8. С. 82; https://doi.org/10.7868/S0207401X17080052
Саратовских Е.А., Щербакова В. А., Саратовских Е. А., Яруллин Р.Н. // Прикл. биохимия и микробиол. 2018. Т. 54. № 1. С. 55; https://doi.org/10.7868/S0555109918010075
Беляева М.А., Гюптер Л.И. // Биолог. науки. 1969. № 7. С. 89.
Липеровская Е.С. Итоги науки и техники. Общая экология. Биоценология. Гидробиология. Т. 4. Сер. М.: ВИНИТИ, 1977. С. 25.
Лосев И.П., Тростянская Е.Б. Химия синтетических полимеров. М.: Госхимиздат, 1960.
Яковлев С.В., Ганин Б.А., Матросов А.С., Кольчугин Б.М. Совместная обработка осадков сточных вод и осадков, образующихся на водопроводных станциях. М.: Стройиздат, 1990.
Ласков Ю.М., Воронов Ю.В., Калицун В.И. Примеры расчетов канализационных сооружений. М.: Стройиздат, 1987.
Ксенофонтов Б.С. Очистка сточных вод: флотация и сгущение осадка. М.: Химия, 1992.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика