Химическая физика, 2022, T. 41, № 7, стр. 11-17
Влияние кварца на хранение фтороводородных смесей
В. Я. Агроскин 1, *, Б. Г. Бравый 1, Г. К. Васильев 1, В. И. Гурьев 1, С. А. Каштанов 1, Е. Ф. Макаров 1, С. А. Сотниченко 1, Ю. А. Чернышев 1
1 Институт проблем химической физики Российской академии наук
Черноголовка, Россия
* E-mail: agroskin@mail.ru
Поступила в редакцию 21.06.2021
После доработки 29.09.2021
Принята к публикации 20.10.2021
- EDN: NHHRIC
- DOI: 10.31857/S0207401X22070020
Аннотация
Экспериментально и теоретически исследовано влияние кварца на возможность хранения фтороводородных смесей, используемых в химическом лазере, работающем на смеси фтора с водородом. Показано, что в присутствии кварца происходит автокаталитическая реакция. Предложен механизм, описывающий химические процессы.
ВВЕДЕНИЕ
Процесс приготовления и хранения реакционной смеси имеет принципиальное значение для работы лазера на смеси фтора с водородом (дейтерием). Особенно это имеет значение для лазеров с большими объемами реакционной среды – более нескольких литров. Это связано с тем, что даже незначительная наработка фтористого водорода в процессе смешивания реагентов и хранения газовой смеси до ее инициирования может значительно ухудшить как энергетические, так и спектральные характеристики лазера [1]. Известно, что определяющая роль в наработке фтористого водорода в результате медленной реакции связана с инициированием активных частиц на стенках реакционного сосуда [2, 3]. В связи с этим имеют большое значение материалы, используемые для изготовления реактора. Известно, что использование кварца для изготовления реактора, а также для ламп, которые часто используются для инициирования реакционной смеси и помещаются внутрь реакционной среды, существенно ускоряет протекание медленной реакции [4]. Таким образом, описание химических процессов, приводящих к наработке фтористого водорода на стадии приготовления и хранения реакционной смеси, имеет важное значение как для проектирования, так и для практического использования химических лазеров, работающих на смеси фтора с водородом.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В настоящей работе мы исследовали протекание медленной реакции фтора с водородом. Составы реакционных газовых смесей были близки к используемым в химических фтороводородных лазерах и кроме фтора с водородом содержали небольшие добавки молекулярного кислорода для стабилизации смеси. Кроме того, реакционные смеси разбавляли инертными газами, в качестве которых использовали гелий и аргон. Реакционный сосуд представлял собой трубу из тефлона с внутренним диаметром 80 мм и длиной 500 мм, которая по концам была герметично уплотнена фланцами из нержавеющей стали. В каждом фланце были установлены оптические окна из флюорита (CaF2). В ходе опытов контролировали изменение концентрации F2 по поглощению излучения УФ-света с длиной волны λ = 254 нм. Также проводили контроль за изменением полного давления газовой смеси. Полный объем кюветы составлял 2.2 л.
Эксперименты проводили при температуре 298 К. В основной серии экспериментов в реакционную кювету помещали вкладыши из кварцевых пластин. Площадь поверхности кварца составляла 1100 см2. Пластины распределяли равномерно по длине и диаметру кюветы. В начале были проведены опыты без кварцевых пластин, в результате которых было показано, что по крайней мере в течение 2 ч концентрация фтора не изменяется (с точностью 3%), т.е. смесь остается стабильной. Также концентрация фтора не изменялась в том случае, когда в кювету, содержащую кварцевые пластины, напускали газовую смесь, содержащую фтор и инертный газ без водорода.
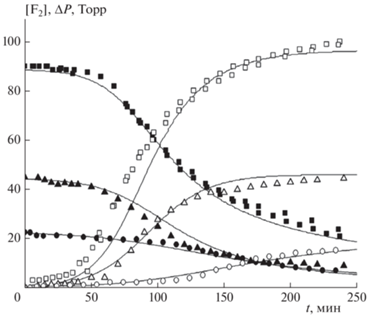
В экспериментах с кварцевыми вкладышами, так же как и в работе [4], происходила реакция, о чем можно было судить по изменению как концентрации фтора, так и полного давления в реакционном сосуде. При этом реакция носила автокаталитический характер. В экспериментах изменяли состав смеси и полное исходное давление. На рис. 1 символами представлены экспериментальные зависимости изменения парциального давления фтора и убыли полного давления ΔP для трех смесей одинакового состава при разных начальных давлениях. Оценки показывают, что минимальные скорости убыли концентрации фтора в наших экспериментах (начальные стадии реакции) составляли (0.5÷5) · 1013 см–3 · с–1, максимальные скорости (средняя стадия реакции) – (2÷6) · 1014 см–3 · с–1. Сплошными кривыми показаны расчетные зависимости (см. далее). Из рис. 1 видно, что наблюдается тенденция к увеличению характеристического времени реакции (время, при котором уменьшение давления фтора составляет половину от максимального падения его давления) с уменьшением начального давления смеси.
Рис. 1.
Кинетические кривые изменения концентрации F2 (темные символы) и убыли давления ΔP (светлые символы) при трех значениях начального давления смеси состава F2 : Н2 : О2 : Не = 12 : 12 : 1.6 : 74.4 : Р0 = 750 Торр (◼, ◻), 375 Торр (▲, △) и 190 Торр (⚫, ⚪). Сплошные кривые – расчетные зависимости.
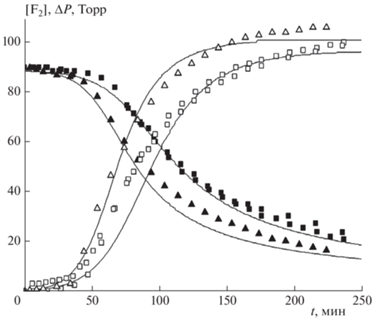
На рис. 2 приведены зависимости изменения парциального давления фтора и убыли полного давления от времени при двух разных давлениях газа-разбавителя (Не). Видно, что с уменьшением давления газа-разбавителя характеристическое время реакции уменьшается.
Рис. 2.
Кинетические кривые изменения концентрации F2 (темные символы) и убыли давления ΔP (светлые символы) для двух разных давлений газа-разбавителя: Не = 558 Торр (◼, ◻), 183 Торр (▲, △). Исходное содержание остальных газов: F2 – 90 Торр, Н2 – 90 Торр, О2 – 12 Торр. Сплошные кривые – расчетные зависимости.
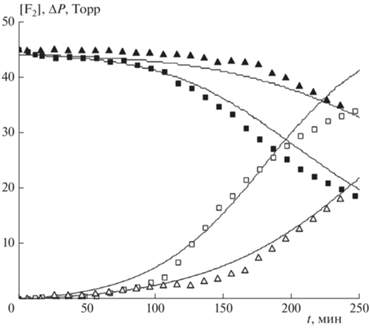
На рис. 3 представлены кинетические кривые, показывающие влияние концентрации кислорода на ход реакции. Видно, что увеличение начальной концентрации кислорода приводит к заметному замедлению реакции. Замена гелия как газа-разбавителя на аргон приводит к замедлению скорости реакции (см. рис. 4).
Рис. 3.
Кинетические кривые изменения концентрации F2 (темные символы) и убыли давления ΔP (светлые символы) для двух разных начальных парциальных давлений кислорода: О2 – 12 Торр (◼, ◻), 24 Торр (▲, △). Остальные газы: F2 – 90 Торр, Н2 – 90 Торр и He – до полного давления в 760 Торр. Сплошные кривые – расчетные зависимости.
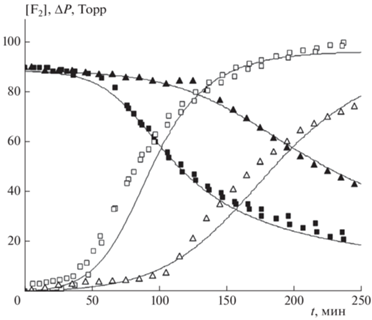
Рис. 4.
Кинетические кривые изменения концентрации F2 (темные символы) и убыли давления ΔP (светлые символы) смеси состава F2 : Н2 : О2 : Не(◼, ◻)/Ar(▲, △) = 45 : 45 : 12 : 273 Торр. Сплошные кривые – расчетные зависимости. Эффективность использования Ar в качестве третьей частицы в реакции обрыва цепи для согласования расчетов с экспериментом считали равной 1.45 по отношению к Не.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Из литературных данных известно, что образующийся в химической реакции фтористый водород хорошо взаимодействует с поверхностью кварца [5]. При этом стадии реакции предшествует адсорбция фтористого водорода на поверхность кварца, что сопровождается уменьшением давления газовой смеси. В результате реакции адсорбированного HF с кварцем образуются SiF4, H2O и H2SiF6 [5]. Кремнефтористоводородная кислота существует только в виде раствора, над которым в газовой фазе присутствуют продукты ее разложения SiF4 и HF. В связи с этим очевидно, что убыль давления не коррелирует c наработкой фтористого водорода в газовой фазе. Из экспериментальных данных по убыли давления следует, что количество HF, адсорбированного на поверхности кварца, способно многократно (~1000 слоев) закрыть эту поверхность. С другой стороны, образующийся на поверхности кварца раствор продуктов реакции экранирует ее, препятствуя непосредственному взаимодействию HF с SiO2; при этом HF может частично растворяться в этом растворе [6].
Для получения количественной информации об адсорбции HF на поверхности кварца в условиях наших экспериментов были проведены дополнительные опыты по исследованию этого процесса. Для этого в реакционную кювету напускался чистый HF и контролировалось падение давления в кювете. Фтористый водород получали из фтора и водорода с последующей очисткой путем его перемораживания с использованием жидкого азота.
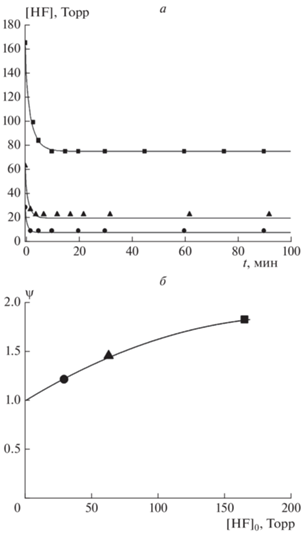
На рис. 5а представлены результаты измерений при трех начальных концентрациях фтористого водорода. Из этого рисунка видно, что в начальный период времени наблюдается быстрое падение давления, что, очевидно, обусловлено адсорбцией HF на поверхности кварца. Далее этот процесс замедляется и давление выходит на постоянный уровень. Для описания всех полученных зависимостей был предложен механизм, учитывающий как адсорбцию молекул HF на поверхности кварца, так и десорбцию продуктов реакции, в качестве которых рассматривался только тетрафторид кремния (считали, что вклад других продуктов реакции в изменение давления незначителен):
(1)
$\begin{gathered} \frac{{d[{\text{HF}}]}}{{dt}} = - \frac{1}{4}[{\text{HF}}]{{v}_{{{\text{HF}}}}}\frac{S}{V} \times \\ \times \,\,\left\{ {{{{{E}_{0}} - {{E}_{1}}({{{[{\text{HF}}]}}_{0}} - [{\text{HF}}])} \mathord{\left/ {\vphantom {{{{E}_{0}} - {{E}_{1}}({{{[{\text{HF}}]}}_{0}} - [{\text{HF}}])} {{{{[{\text{HF}}]}}_{0}}}}} \right. \kern-0em} {{{{[{\text{HF}}]}}_{0}}}}} \right\}, \\ [{\text{Si}}{{{\text{F}}}_{4}}] \approx \frac{1}{4}\left\{ {{{{[{\text{HF}}]}}_{0}} - [{\text{HF}}]} \right\}, \\ \end{gathered} $Рис. 5.
Кривые адсорбция HF на поверхность кварца при различных значениях его концентрации: ◼ – 165 Торр, ▲ – 63 Торр, ⚫ – 28.5 Торр. Сплошные кривые – расчетные зависимости: а – временная, б – зависимость ψ = P∞/([HF]0/4) от [HF]0, где P∞ – конечный уровень давления в газовой фазе.
Из литературных данных известно (см., например, [6]), что на начальной стадии фтористый водород реагирует с кварцем с образованием тетрафторида кремния и воды: 4HF + SiO2 = SiF4 + 2H2O. При этом SiF4 в силу его летучести выделяется в газовую фазу, а молекулы воды остаются адсорбированными на поверхности. В связи с этим считали, что в газовой фазе присутствуют только молекулы HF и SiF4. По мере наработки воды на поверхности начинает накапливаться кремнефтористоводородная кислота по следующей реакции: SiF4 + 2HF + + aq = H2SiF6 + aq, где aq – вода на поверхности кварца [7].
Полное превращение HF в SiF4 уменьшило бы давление газовой смеси в 4 раза. В проведенных экспериментах конечный уровень давления превышал эту величину. Последнее свидетельствует о том, что процесс останавливался раньше, чем происходило полное превращение HF.
На рис. 5б представлена зависимость ψ = = P∞/([HF]0/4) от [HF]0 (P∞ – конечный уровень давления в газовой фазе), из которой видно, что полное превращение HF в SiF4 происходит только при небольших начальных концентрациях HF. Это подтверждает высказанное предположение, что конденсированные на поверхности продукты реакции останавливают процесс взаимодействия HF с кварцем.
Расчетные зависимости изменения давления газа в кювете от времени с использованием системы уравнений (1) представлены на рис. 5а сплошными линиями. Все проведенные в настоящей работе расчеты осуществлялись на персональном компьютере с использованием метода Рунге–Кутта четвертого порядка. Использованные в системе (1) подгоночные безразмерные параметры Е0 и Е1 представлены в табл. 1. Из этой таблицы видно, что параметры E0 и E1 зависят от начальной концентрации фтористого водорода, [HF]0. Это может быть объяснено тем, что поверхность кварца обладает неравномерной адсорбционной способностью – есть участки, на которых адсорбция происходит более эффективно, и участки с малой адсорбционной способностью. На начальной стадии реакция происходит на наиболее активных центрах, которые по мере реакции выбывают из химического процесса, и наибольший вклад в процесс начинают вносить менее активные участки. В конечном итоге наступает момент, когда реакция полностью прекращается.
Таблица 1.
Значения эмпирических коэффициентов Е0 и Е1 для разных начальных концентраций HF0
| [HF0], Торр | E0 | E1 |
|---|---|---|
| 28.5 | 1.2 ⋅ 10–5 | 1.39 ⋅ 10–6 |
| 63 | 3.1 ⋅ 10–6 | 1.72 ⋅ 10–7 |
| 165 | 8.0 ⋅ 10–7 | 2.00 ⋅ 10–8 |
Что касается темновой реакции фтора с водородом, то продукты взаимодействия HF с кварцем (в основном H2O и H2SiF6), модифицируя его поверхность, приводят к увеличению скорости зарождения цепей (образованию атомов F) и тем самым ускоряют эту реакцию. Для описания основных экспериментальных результатов была рассмотрена следующая известная схема (см., например, [3, 4]) химических процессов (учитывались только быстрые процессы в газовой фазе, приводящие к убыли молекул F2):
(2)
$\begin{gathered} {{{\text{F}}}_{2}} + стенка \to 2{\text{F}} + стенка, \\ {\text{F}} + {{{\text{H}}}_{2}}\xrightarrow{{{{k}_{1}}}}{\text{HF}} + {\text{H,}} \\ {\text{H}} + {{{\text{F}}}_{2}}\xrightarrow{{{{k}_{2}}}}{\text{HF}} + {\text{F,}} \\ {\text{H}} + {{{\text{O}}}_{2}} + {\text{M}}\xrightarrow{{{{k}_{3}}}}{\text{H}}{{{\text{O}}}_{2}} + {\text{M,}} \\ {\text{H}}{{{\text{O}}}_{2}} + {\text{H}}{{{\text{O}}}_{2}}\xrightarrow{{{{k}_{4}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{2}} + {{{\text{O}}}_{2}}. \\ \end{gathered} $Значения констант k1–k4 были взяты из базы данных [8]: k1 = 1.6 · 1013 см3 · моль–1 · с–1, k2 = 0.9 · · 1012 см3 · моль–1 · с–1, k3 = 1.1 · 1016 см6 · моль–2 · с–2, k4 = 2.1 · 1012 см3 · моль–1 · с–1. Процесс зарождения цепей описывали следующим выражением:
При решении системы уравнений (2) вероятность диссоциации молекулы F2 при столкновении с поверхностью кварца представляли следующей зависимостью:
Считали, что образующийся в объеме HF полностью адсорбируется на поверхности кварца, а получающийся в ходе реакции SiF4 переходит в объем, что приводит к изменению давления в кювете. Изменение давления в кювете выражается следующей зависимостью:
Таблица 2.
Значения эмпирических констант L0–L5 для расчета изменения давления для разных исходных составов смесей
| [F2] + [H2] + [O2] + [He/Ar], Торр | L0 | L1 | L2 | L3 | L4 | L5 |
|---|---|---|---|---|---|---|
| 90 + 90 + 12 + 558 | 2.00 ⋅ 10–11 | 6.30 ⋅ 10–9 | –5.88 ⋅ 10–9 | 2.00 | 0.00 | –1.00 |
| 90 + 90 + 12 + 183 | 2.00 ⋅ 10–11 | 6.30 ⋅ 10–9 | –5.88 ⋅ 10–9 | 2.00 | 0.00 | –0.90 |
| 90 + 90 + 24 + 546 | 2.00 ⋅ 10–11 | 6.30 ⋅ 10–9 | –5.88 ⋅ 10–9 | 2.00 | 0.00 | –1.00 |
| 45 + 45 + 6 + 279 | 2.00 ⋅ 10–11 | 2.50 ⋅ 10–9 | 0.00 | 1.80 | 0.00 | –0.80 |
| 45 + 45 + 12 + 273 | 2.00 ⋅ 10–11 | 2.50 ⋅ 10–9 | 0.00 | 2.00 | 0.00 | –1.00 |
| 45 + 45 + 12 + (273) | 2.00 ⋅ 10–11 | 2.50 ⋅ 10–9 | 0.00 | 2.00 | 0.00 | –1.00 |
| 22.5 + 22.5 + 3 + 139.5 | 2.00 ⋅ 10–11 | 7.26 ⋅ 10–10 | 0.00 | 0.60 | 0.50 | 0.00 |
На рис. 1–4 сплошными кривыми приведены рассчитанные зависимости. Временны́е изменения давления в реакционном сосуде в основном коррелируют с зависимостями убыли молекулярного фтора. На ход кривых изменения давления кроме адсорбции молекул фтористого водорода оказывает влияние десорбция продуктов реакции с поверхности кварца. Влияние десорбции на изменение давления учитывалось в расчетах введением коэффициентов L4 и L5.
В ходе расчетов было получено, что концентрация молекул перекиси водорода в газовой смеси в процессе реакции может превысить давление насыщенных паров, что должно приводить к образованию аэрозоля. Чтобы подтвердить это, нами были проведены отдельные эксперименты. Через реакционную кювету пропускался луч He–Ne-лазера с λ = 632.8 нм. Для увеличения оптического пути луч лазера пропускался через кювету три раза. Изменение интенсивности излучения контролировали с помощью фотоприемника. Было показано, что в ходе химической реакции происходит ослабление интенсивности излучения прошедшего через оптическую кювету, что, очевидно, подтверждает правильность сделанных расчетов.
В заключение отметим, что наличие кварца в реакционном объеме ухудшает возможность длительного хранения реакционных смесей фтороводородного лазера, что в конечном итоге может приводить к существенным изменениям энергетических и спектральных характеристик данного лазера. В связи с этим желательно исключить использование кварца при изготовлении лазерного реактора. Например, его можно заменить сапфиром или использовать для его защиты специальные покрытия, которые должны быть химически устойчивы и прозрачны в УФ-области спектра.
ВЫВОДЫ
1. Подтвержден автокаталитический характер и исследована кинетика медленной реакции в смеси фтора с водородом в присутствии кварцевой поверхности.
2. Показано, что этот сложный процесс для типичных лазерных смесей может быть описан простой схемой только с одним гетерогенным процессом – диссоциацией молекул фтора.
3. Ни диффузия, ни другие гетерогенные реакции в данных условиях не лимитируют процесс выгорания фтора.
4. Для увеличения времени работоспособности лазерной смеси в процессе ожидания пуска предлагается исключить использование кварца при изготовлении лазерного реактора. При невозможности заменить кварцевые элементы конструкции время сохранности смеси (зависит от отношения Sкварца/Vкюветы) необходимо уточнить экспериментально для соответствующей конструкции лазера.
Работа выполнена при финансовой поддержке госзаданием (регистрационный номер ААА-А19-119070790003-7).
Список литературы
Батовский О.М., Гурьев В.И. // Квантовая электрон. 1974. Т. 1. № 3. С. 676.
Рысс И.Г. Химия фтора и его неорганических соединений. М.: Госхимиздат, 1956. С. 33.
Федотов В.Г., Чайкин А.М. // Докл. АН СССР. 1972. Т. 203. № 2. С. 406.
Агроскин В.Я., Васильев Г.К., Кирьянов В.И., Макаров Е.Ф., Чернышев Ю.А. // Докл. АН СССР. 1975. Т. 225. № 4. С. 830.
Monk D.J., Soane D.S., Howe R.T. // Thin Solid Films. 1993. 232. P. 1; https://doi.org/10.1016/0040-6090(93)90752-B
Helms C.R., Deal B.E. // J. Vac. Sci. Technol. 1992. A. V. 10. № 4. P. 806; https://doi.org/10.1116/1.577676
Кочетков С.П., Смирнов Н.Н., Ильин А.П. Концентрирование и очистка экстракционной фосфорной кислоты. Иваново: Ивановский государственный химико-технологический университет, 2007. С. 304.
NIST Chemical Kinetics Database, Standard Reference Database 17, Ver. 7.0 (Web Version), Release 1.6.8, Data Version 2015. 09.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


