Химическая физика, 2022, T. 41, № 5, стр. 371-43
Химический состав высокоширотной средней атмосферы Северного полушария и его изменение в 21-м веке
И. К. Ларин *
Федеральный исследовательский центр химической физики им. Н.Н. Семёнова
Российской академии наук
Москва, Россия
* E-mail: iklarin@narod.ru
Поступила в редакцию 26.05.2021
После доработки 28.06.2021
Принята к публикации 20.07.2021
- EDN: TQKTHR
- DOI: 10.31857/S0207401X22050089
Аннотация
Рассмотрены химический состав высокоширотной средней атмосферы Северного полушария, включая тропосферу, стратосферу и мезосферу, и его изменение в XXI веке. Исходные данные были получены с помощью интерактивной радиационно-химической двумерной модели SOCRATES, позволяющей рассчитывать высотные профили компонент с шагом 1 км в широтной зоне 85° ю.ш.–85° с.ш. с шагом 5°. В качестве начальных условий использовался сценарий Межправительственной группы экспертов по изменению климата (IPCC) RCP 4.5 для условий июня и января 2000 и 2100 годов и 50° с.ш. Для этих условий были получены высотные профили и общее содержание долгоживущих компонент: N2O, CH4 и CO2; хлорфторуглеродов ХФУ-10 (CCl4), ХФУ-11 (CCl3F), ХФУ-12 (CCl2F2), ХФУ-113 (CCl2FCClF2), ХФУ-114 (CClF2CClF2), ХФУ-115 (CClF2CF3); галона-2011 (CBrClF2), галона-1301 (CBrF3); гидрохлорфторуглерода ГХФУ-22 (CHClF2); кислот HF, HCl, HBr, HNO3; малых атмосферных составляющих: CH2O, O3, O(3P), O(1D), H, OH, HO2, H2O2, Cl, Cl2, ClO, OClO, HOCl, ClONO2, ClNO2, Cl2O2, N, NO, NO2, NO3, N2O5, HO2NO2, Br, BrO, HOBr, BrONO2, BrCl, а также химических семейств Ox (O3 + O(3P)), HOx (OH + HO2), NOx (NO + NO2 + NO3), ClOx (Cl + ClO) и BrOx (Br + BrO). Показано, в частности, что для июня 2100 года по сравнению с июнем 2000 года относительное (в %) изменение общего содержания компонент семейства ClOx в стратосфере составило –57.5%, семейства Ox – +4.0%, BrOx – 25.7%, NOx + 13.9% и HOx – ‒4.1%. В январе соответствующие данные для ClOx составили –59.1%, для Ox – +7.3%, для BrOx – –26.2%, для NOx – +7.1% и для HOx – –3.6%. Аналогичные сравнения были выполнены для других компонент, упомянутых выше. Практически все химически активные компоненты показали заметную чувствительность к смене сезона.
1. ВВЕДЕНИЕ
Химический состав атмосферы и его изменение во времени – наиболее важные характеристики окружающей среды, позволяющие судить не только о современном состоянии последней с точки зрения степени ее безопасности для экологии и человека, но и (при надежности прогнозов) о будущих угрозах самому существованию людей на земле. Убедительным примером подобной ситуации может служить недавний “озоновый кризис”, имевший место в конце прошлого века. Известно, что в результате выброса антропогенных хлорфторуглеродов содержание общего озона в средних широтах Северного полушария в конце XX века уменьшилось на 4–6%, что составило треть от разницы между количеством озона сегодня и 400 миллионов лет назад, когда накопленный к тому времени озоновый слой приобрел достаточную толщину, чтобы позволить жизни выйти из океана, где ее защищала от опасного солнечного ультрафиолетового излучения толща воды, на поверхность земли, под защиту озонового слоя [1]. Прогнозы изменений озонового слоя указывали на возможность его дальнейшего истощения вплоть до уровня, который имел место 400 миллионов лет назад. При дальнейшем неконтролируемом увеличении производства хлорфторуглеродов это вполне может произойти, и тогда земной жизни снова пришлось бы спасаться в океане. К счастью, решение проблемы было найдено. Замечательной особенностью этой находки было то, что решение было найдено теоретически, причем тогда (1974 г.), когда еще не было ни малейших признаков воздействия хлорфторуглеродов на озоновый слой. В дальнейшем они появились. Именно благодаря мониторингу атмосферных содержаний озона и хлорфторуглеродов, изменявшихся противоположным образом, было окончательно доказано, что предложенное решение спасения озонового слоя (а заодно и человечества) было правильным, причем единственно правильным (имеется в виду решение о запрете производства озоноразрушающих веществ, приведшее к принятию международных соглашений в форме Монреальского протокола и поправок к нему). Недаром его авторы (Молина, Роуланд и Крутцен) были удостоены Нобелевской премии, которая была присуждена им в 1995 году – 21 год спустя после сделанного открытия.
Современная проблема глобального потепления также непосредственно связана с химическим составом атмосферы и требует непрерывного и тщательного слежения за атмосферным содержанием парниковых газов и их изменением. Особое значение это имеет для российской высокоширотной зоны в связи с угрозой таяния вечной мерзлоты, занимающей 60% общей площади РФ.
2. РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
2.1. Тропосфера
Тропосфера прилегает непосредственно к земной поверхности, располагаясь на высотах 0‒10 км. Поэтому именно в тропосферу поступают природные и антропогенные компоненты, эмитируемые с поверхности Земли. К ним относятся парниковые газы ‒ углекислый газ (CO2), закись азота (N2O), метан (CH4) и водяной пар, а также озон (образующийся в самой атмосфере); озоноразрушающие хлорфторуглероды, включая четыреххлористый углерод (CCl4), ХФУ-11 (CCl3F), ХФУ-12 (CCl2F2), ХФУ-113 (CCl2FCClF2), ХФУ-114 (CClF2CClF2), ХФУ-115 (CClF2CF3), галон-1211 (CBrClF2), галон-1301 (CBrF3) и их озонобезопасные заменители типа гидрохлорфторуглерода ГФУ-22 (CHClF2), причем и те, и другие обладают парниковыми свойствами. Однако тропосфера служит не только резервуаром для хранения долгоживущих компонент. В ней протекают разнообразные окислительные процессы. В связи с этим следует указать, что из приведенных выше соединений на химический состав тропосферы значительное влияние оказывает водяной пар вместе с тропосферным озоном. Эта пара обеспечивает образование первичного тропосферного окислителя ‒ гидроксильного радикала ОН по следующей схеме:
(1)
${{{\text{O}}}_{3}} + h\nu \xrightarrow{{J_{{{{{\text{O}}}_{{\text{3}}}}}}^{{\text{*}}}}}{\text{O}}{{{\text{(}}}^{1}}D{\text{)}} + {{{\text{O}}}_{2}},\,\,\,\,\lambda \leqslant 310\,\,{\text{нм}};$(2)
${\text{O}}{{(}^{1}}D) + {{{\text{H}}}_{{\text{2}}}}{\text{O}}\xrightarrow{{{{k}_{{{\text{O}}{{{\text{(}}}^{1}}D{\text{)}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}}}{\text{OH}} + {\text{OH}},$(3)
${\text{C}}{{{\text{H}}}_{4}} + {\mathbf{OH}}\xrightarrow{{{{k}_{{{\text{C}}{{{\text{H}}}_{4}} + {\text{OH}}}}}}}{\text{C}}{{{\text{H}}}_{3}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}},$(4)
${\text{C}}{{{\text{H}}}_{3}} + {{{\text{O}}}_{2}}\xrightarrow{{{{k}_{{{\text{C}}{{{\text{H}}}_{3}} + {{{\text{O}}}_{2}}}}}}}{\text{C}}{{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}_{2}},$(5)
${\text{C}}{{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}_{2}} + {\text{NO}}\xrightarrow{{{{k}_{{{\text{C}}{{{\text{H}}}_{3}}{{{\text{O}}}_{2}} + {\text{NO}}}}}}}{\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{O}} + {\text{N}}{{{\text{O}}}_{2}},$(6)
${\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{O}} + {{{\text{O}}}_{2}}\xrightarrow{{{{k}_{{{\text{C}}{{{\text{H}}}_{3}} + {{{\text{O}}}_{2}}}}}}}{\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{O}} + {\text{H}}{{{\text{O}}}_{2}},$(7)
${\text{H}}{{{\text{O}}}_{2}} + {\text{NO}}\xrightarrow{{{{k}_{{{\text{H}}{{{\text{O}}}_{2}} + {\text{NO}}}}}}}{\mathbf{OH}} + {\text{N}}{{{\text{O}}}_{2}},$(8)
$2{\text{N}}{{{\text{O}}}_{2}} + h\nu \xrightarrow{{{{J}_{{{\text{N}}{{{\text{O}}}_{2}} + h\nu }}}}}2{\text{NO}} + 2{\text{O}},$(9)
$\underline {2{\text{O}} + 2{{{\text{O}}}_{2}}\xrightarrow{{{{k}_{{{\text{O}} + {{{\text{O}}}_{2}}}}}}}2{{{\text{O}}}_{3}}.\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,} $Из схемы (3)‒(9) видно, что процесс протекает цепным путем, поскольку “потерянный” в реакции (3) гидроксильный радикал ОН вновь “возрождается” в реакции (7). Следует указать, что подобным образом (т.е. с образованием озона) окисление метана протекает при достаточно высокой концентрации NO, превышающей примерно 5–15 ppt. При меньших концентрациях NO процесс развивается несколько иначе:
(3)
${\text{C}}{{{\text{H}}}_{4}} + {\mathbf{OH}}\xrightarrow{{{{k}_{{{\text{C}}{{{\text{H}}}_{4}} + {\text{OH}}}}}}}{\text{C}}{{{\text{H}}}_{3}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}},$(4)
${\text{C}}{{{\text{H}}}_{3}} + {{{\text{O}}}_{2}}\xrightarrow{{{{k}_{{{\text{C}}{{{\text{H}}}_{3}} + {{{\text{O}}}_{2}}}}}}}{\text{C}}{{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}_{2}},$(10)
${\text{C}}{{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}_{2}} + {\text{H}}{{{\text{O}}}_{2}}\xrightarrow{{{{k}_{{{\text{C}}{{{\text{H}}}_{3}}{{{\text{O}}}_{2}} + {\text{H}}{{{\text{O}}}_{2}}}}}}}{\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{OOH}} + {{{\text{O}}}_{2}},$(12)
${\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{OOH}} + h\nu \xrightarrow{{{{J}_{{{\text{C}}{{{\text{H}}}_{3}}{\text{OOH}} + h\nu }}}}}{\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{O}} + {\text{OH}},$(13)
$\underline {{\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{O}} + {{{\text{O}}}_{2}}\xrightarrow{{{{k}_{{{\text{C}}{{{\text{H}}}_{3}}{\text{O}} + {{{\text{O}}}_{2}}}}}}}{\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{O}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}} $Видно, что в этом случае озон не образуется, а образуются только формальдегид (CH2O) и вода. По той же схеме, что и в случае метана, происходит окисление многочисленных так называемых летучих органических соединений естественного (терпены) и антропогенного (четыреххлористый углерод) происхождений. Достаточное количество NO обеспечивается при выполнении условия [NO] > (k10/k5)[HO2], где k10 и k5 ‒ константы скорости реакций (10) и (5), соответственно; [HO2] ‒ концентрация HO2 в см–3.
Аналогичным образом происходит окисление угарного газа CO (также с участием NO):
(14)
${\text{CO}} + {\mathbf{OH}}\xrightarrow{{{{k}_{{{\text{CO}} + {\text{OH}}}}}}}{\text{C}}{{{\text{O}}}_{2}} + {\text{H}},$(15)
${\text{H}} + {{{\text{O}}}_{2}}\xrightarrow{{{{k}_{{{\text{H}} + {{{\text{O}}}_{2}}}}}}}{\text{H}}{{{\text{O}}}_{2}},$(7)
${\text{H}}{{{\text{O}}}_{2}} + {\text{NO}}\xrightarrow{{{{k}_{{{\text{H}}{{{\text{O}}}_{2}} + {\text{NO}}}}}}}{\text{N}}{{{\text{O}}}_{2}} + {\mathbf{OH}},$(8)
${\text{N}}{{{\text{O}}}_{2}} + h\nu \xrightarrow{{{{J}_{{{\text{N}}{{{\text{O}}}_{2}} + h\nu }}}}}{\text{NO}} + {\text{O}},$(9)
$\underline {{\text{O}} + {{{\text{O}}}_{2}}\xrightarrow{{{{k}_{{{\text{O}} + {{{\text{O}}}_{2}}}}}}}{{{\text{O}}}_{3}}.\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,} $Здесь тоже идет цепной процесс (реакции (14)‒(9)) и также необходимо определенное количество NO. Но в отличие от метана при недостатке NO озон будет не образовываться, а разрушаться, причем с той же скоростью:
(14)
${\text{CO}} + {\mathbf{OH}}\xrightarrow{{{{k}_{{{\text{CO}} + {\text{OH}}}}}}}{\text{C}}{{{\text{O}}}_{2}} + {\text{H}},$(16)
${\text{H}} + {{{\text{O}}}_{2}}\xrightarrow{{{{k}_{{{\text{H}} + {{{\text{O}}}_{2}}}}}}}{\text{H}}{{{\text{O}}}_{2}},$(17)
$\underline {{\text{H}}{{{\text{O}}}_{2}} + {{{\text{O}}}_{3}}\xrightarrow{{{{k}_{{{\text{HO}} + {{{\text{O}}}_{3}}}}}}}{\mathbf{OH}} + 2{{{\text{O}}}_{2}}} $Достаточное количество NO обеспечивается при выполнении условия [NO] > k17[O3]k7, где k17 и k7 ‒ константы скорости реакций (17) и (7), соответственно; [O3] ‒ концентрация O3 в см–3.
Помимо этого радикалы OH участвуют в реакциях со всеми H-содержащими малыми компонентами, включая озонобезопасные гидрохлорфторуглероды, обеспечивая их относительно малое время жизни и “озоновую безопасность”.
Представление об изменении химического состава тропосферы в XXI веке дает табл. 1, в которой показано относительное (в %) изменение содержания парниковых и других малых атмосферных составляющих в тропосфере, включая CO2, N2O, CH4, H2O, CO, H2, O3, ХФУ-10 (CCl4), ХФУ-11 (CCl3F), ХФУ-12 (CCl2F2), ХФУ-113 (CCl2FCClF2), ХФУ-114 (CClF2CClF2), ХФУ-115 (CClF2CF3), гидрохлорфторуглерод ГХФУ-22 (CHClF2), галон-1211 (CBrClF2) и галон-301 (CBrF3), в июне 2100 года по сравнению с июнем 2000 года (отнесенное к содержанию соответствующей компоненты в 2000 году) на 70° с.ш. Все данные, приведенные в табл. 1, рассчитаны с использованием двумерной интерактивной модели SOCRATES [2] и сценариев IPCC RCP 4.5 в качестве исходных данных [3]. Величина эффекта определялась по формуле
(I)
${\text{Эффект}} = {{100({{X}_{{2100}}} - {{X}_{{2000}}})} \mathord{\left/ {\vphantom {{100({{X}_{{2100}}} - {{X}_{{2000}}})} {{{X}_{{2000}}}}}} \right. \kern-0em} {{{X}_{{2000}}}}},$Таблица 1.
Относительное (в %) изменение тропосферного содержания малых компонент в 2100 г. по сравнению с 2000 г. (июнь, 70° с.ш.), отнесенного к содержанию компоненты в 2000 г.
| Компонента | Эффект, % | Компонента | Эффект, % |
|---|---|---|---|
| CO2 | 45.7 | ХФУ-11 | –87.9 |
| N2O | 19.9 | ХФУ-12 | –65.6 |
| CH4 | –7.00 | ХФУ-113 | –67.7 |
| H2O | 0.025 | ХФУ-114 | –26.7 |
| CO | –6.41 | ХФУ-115 | –5.71 |
| H2 | –9.31 | ГХФУ-22 | –97.3 |
| O3 | 1.95 | галон-l1211 | –98.0 |
| ХФУ-10 | –98.7 | галон-l1301 | –42.4 |
2.2. Стратосфера
С химической точки зрения стратосфера (расположенная на высотах 10‒55 км) является основной областью атмосферы, где происходит образование и разрушение атмосферного озона, что в конечном итоге приводит к определенному балансу всех фотохимических факторов, которые определяют стационарное (или близкое к нему) состояние озонового слоя Земли. Укажем также, что в стратосфере содержится около 90% всего атмосферного озона. В настоящее время установлено, что единственным источником озона (не только в стратосфере, но и во всей атмосфере) является молекулярный кислород, который под действием коротковолнового излучения фотодиссоцирует на атомы с дальнейшим прилипанием образовавшихся атомов O к молекулам O2:
(18)
${{{\text{O}}}_{2}} + h\nu \xrightarrow{{{{J}_{{{{{\text{O}}}_{2}}}}}}}{\text{O}}{{(}^{3}}P) + {\text{O}}{{(}^{3}}P),\,\,\,\,\lambda \leqslant 242\,\,{\text{нм}};$(9)
${\text{O}}{{(}^{3}}P) + {{{\text{O}}}_{2}} + {\text{M}}\xrightarrow{{{{k}_{{{\text{O}} + {{{\text{O}}}_{2}}}}}}}{{{\text{O}}}_{3}} + {\text{M}}.$Дополняя реакции (18) и (9) реакцией
(19)
${\text{O}}{{(}^{3}}P) + {{{\text{O}}}_{3}}\xrightarrow{{{{k}_{{{\text{О}} + {{{\text{O}}}_{3}}}}}}}{{{\text{O}}}_{2}} + {{{\text{O}}}_{2}},$описывающей гибель озона в чисто кислородной атмосфере, получаем цикл Чепмена [5], предложенный в 1930 году. Хотя реакции (18), (9), (19) и не образуют цепного процесса, но именно реакция (19) будет определять гибель озона во всех цепных процессах разрушения озона, открытых тридцатью годами позднее.
Речь идет о так называемых каталитических циклах гибели озона, включая циклы Ox, HOx, NOx, ClOx и BrOx, влияние которых на озоновый слой подробно описано в монографии [6]. Роль отдельных циклов и история их открытия описываются в работах [7‒20]. Особо следует отметить работу [13] (1958 года), в которой впервые был предложен каталитический цикл разрушения стратосферного озона с участие радикалов OH. Ценность этого открытия заключалась в том, что была впервые предложена принципиальная схема каталитического цикла гибели озона. Подставляя в эту схему любой другой радикал вместо OH, можно было получить любой другой каталитический цикл разрушения озона. Однако прошло тринадцать лет, прежде чем Крутцен [8] догадался подставить в эту схему NO вместо OH и получил так называемый азотно-окисный цикл, а заодно и Нобелевскую премию. Другие вопросы, связанные с химией стратосферы и озонового слоя, разбираются в работах [9‒15]. В приведенных работах содержится информация, которая полностью описывает процессы, происходящие в стратосфере, и факторы, определяющие сегодняшнее и будущее состояния озонового слоя Земли. По этой причине мы не будем останавливаться на деталях цепного механизма разрушения стратосферного озона, а представим общую картину химического состава стратосферы и его изменения в XXI веке.
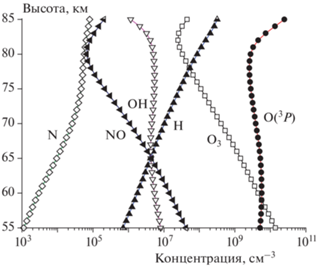
На рис. 1 представлены высотные профили некоторых стратосферных компонент, включая O3, O(3P), H, OH, N и NO для июня 2000-го года и 70° с.ш. Можно видеть, что наибольшей концентрацией обладает O3, а в верхней стратосфере – еще и O(3P). Далее идут NO, OH, H и N. Мы вернемся к этому рисунку в следующем разделе.
Рис. 1.
Вертикальные профили некоторых химически активных стратосферных компонент, полученные для условий июня 2000 г. и 70° с.ш.
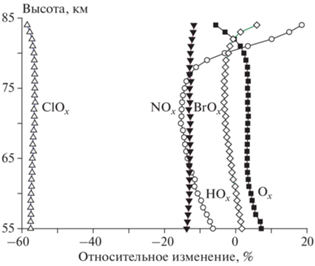
На рис. 2 показано относительное (%) изменение концентраций семейств Ox, HOx, NOx, ClOx и BrOx в июне 2100 года по сравнению с июнем 2000 года на 70° с.ш. Видно, что семейство нечетного кислорода “подросло” (особенно в верхней стратосфере), что объясняется существенным падением содержания разрушающих озон хлорного и бромного семейств в результате ограничительных мер Монреальского протокола и поправок к нему (Концентрация кислородного семейства выросла в верхней стратосфере на 30%, концентрация хлорного семейства упала на 50‒60%, а бромного ‒ на 30%.) Масштаб изменений концентрации семейства ClOx в течение XXI века и его отличие от изменений концентрации BrOx объясняется различиями в применении условий Монреальского протокола и его приложений в отношении хлор- и бромсодержащих антропогенных разрушителей озона.
Рис. 2.
Относительное (в %) изменение высотных профилей семейств Ox, HOx, NOx, ClOx и BrOx в июне 2100 г. по сравнению с июнем 2000 г. на широте 70° с.ш.
Описанные выше эффекты обусловлены главным образом внешними факторами, под которыми понимаются такие меры, как выполнение Монреальского протокола. Но помимо этих факторов содержания компонент семейств изменяются и под действием факторов внутренних, таких как изменение атмосферных условий при смене сезона. На рис. 3 показано относительное (в %) изменение концентраций семейств при переходе от января к июню в 2000 году на 70° с.ш. Показанный на рис. 3 эффект рассчитывался по формуле
(II)
${\text{Эффект}},{\text{ }}\% = {{[100({{X}_{{{\text{Jan}}}}} - {{X}_{{{\text{Jun}}}}})]} \mathord{\left/ {\vphantom {{[100({{X}_{{{\text{Jan}}}}} - {{X}_{{{\text{Jun}}}}})]} {{{X}_{{{\text{Jun}}}}}}}} \right. \kern-0em} {{{X}_{{{\text{Jun}}}}}}},$Рис. 3.
Относительное (в %) изменение высотных профилей семей при переходе от января к июню 2000 г. (70° с.ш.).
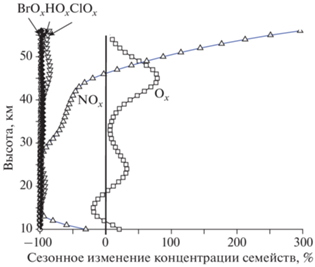
где XJan ‒ высотный профиль концентрации семейства X в январе 2000 года на 70° с.ш., а XJun ‒ то же в июне 2000 года на той же широте. Из формулы (II) видно, что отрицательный эффект не может быть меньше 100%, а положительный эффект может быть сколь угодно большим.
Можно видеть, что смена сезона приводит к существенным изменениям концентраций семейств, превосходящим изменения за 100 лет. Так, например, концентрация семейства Ox в верхней стратосфере изменяется более чем на 50%, а NOx ‒ на 250%. Сезонные изменения концентраций семейств HOx, ClOx и BrOx близки к максимальным, т.е. к –100%. Эти перемены связаны как с изменением условий протекания фотохимимческих и химических реакций (отсутствие солнечного света полярной ночью и более низкая температура в январе по сравнению с июнем), так и с изменением условий переноса. Что касается семейств HOx, ClOx и BrOx, то близость изменения их концентраций к –100% объясняется тем, что в условиях полярной ночи активные компоненты этих семейств, первоначально имеющие “летнюю” концентрацию, быстро исчезают в реакциях рекомбинации либо в реакциях с другими стратосферными компонентам, в результате чего XJan становится много меньше XJun, что и приводит к максимальному отрицательному эффекту. Положительные и достаточно высокие сезонные изменения концентрации семейства Ox объясняются исключительно влиянием динамических факторов, поскольку в их отсутствии они были бы равны нулю. Последнее объясняется тем, что озон не погибает ночью: без атомов O(3P), которые ночью быстро погибают в реакциях O(3P) + O2 → O3, молекулы озона хотя и могут реагировать друг с другом, но реакция O3 + O3 → 3O2 слишком медленная, она обеспечивает практически бесконечное время жизни озона. Поэтому озон, приносимый в высокие широты процессами глобальной циркуляции, в январе будет здесь консервироваться и накапливаться. Это приведет к тому, что его январское содержание станет больше июньского, что и подтверждается результатами расчетов. Аналогичным образом сезонное изменение концентраций семейства NOx без учета динамических процессов также было бы равно нулю, поскольку при любых изменениях содержания озона реакция O3 + NO → → NO2 + O2 может изменить только соотношение между концентрациями NO и NO2, но не их сумму. Это непосредственно видно из данных, представленных на рис. 3, где кривые для Ox и NOx ведут себя различным образом без какой-либо связи друг с другом. Масштаб изменений концентрации семейства ClOx в течение XXI века и их отличие от изменений концентрации BrOx объясняются различиями в применении условий Монреальского протокола и его приложений в отношении хлор- и бромсодержащих антропогенных разрушителей озона.
В целом, изменение химического состава стратосферы в XXI веке обусловлено главным образом прекращением производства антропогенных озоноразрушающих веществ и последующим естественным процессом удаления их из атмосферы, скорость которого определяется атмосферным временем жизни конкретного соединения. Совокупность этих процессов и определяет время восстановления озонового слоя Земли.
2.3. Мезосфера
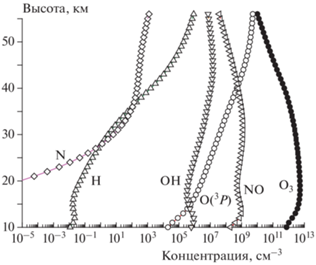
Мезосфера, расположенная на высотах 56–85 км, относится к средней атмосфере, в которой составляющие ее газы перемешаны. Это объясняется тем, что высотное распределение газов определяется процессами турбулентной диффузии, а не силами тяжести, как в термосфере и на бóльших высотах. Если бы никакие другие факторы (кроме диффузии) “не работали”, то высотное распределение любых атмосферных компонент, выраженное как отношение концентрации данной компоненты на данной высоте к концентрации основных газов атмосферы (N2 и O2) на той же высоте, т.е. в единицах volume mixing ratio, в координатах volume mixing ratio – высота имело бы вид вертикальных линий на всех высотах. В реальных условиях атмосферные компоненты участвуют в химических и фотохимических процессах, что искажает картину. Пример высотного распределения некоторых долгоживущих и короткоживущих атмосферных компонент в стратосфере и мезосфере для условий июня 2000 года и 70° с.ш. приведен на рис. 4. Можно видеть, что “вертикальное” распределение имеют только компоненты, живущие более 1000 лет, компоненты же с временами жизни порядка 100 лет добираются до мезосферы с большими потерями, а живущие менее 100 лет вообще могут не попасть в мезосферу. Заметим также, что отклонение высотного распределения компоненты вправо от вертикали означает наличие процесса ее образования в атмосфере, а отклонение влево – наличие процесса разрушения.
Рис. 4.
Высотные профили некоторых долгоживущих и короткоживущих атмосферных компонент в стратосфере и мезосфере. Цифры под названиями компонент означают атмосферное время жизни в годах (июнь 2000 г., 70° с.ш.).
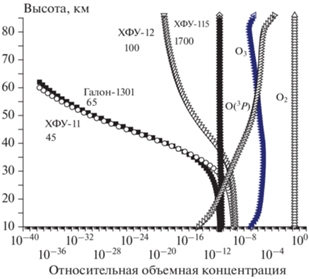
Имея в виду, что антропогенных веществ с атмосферными временами жизни более 1000 лет очень мало, можно заключить, что мезосфера представляет собой экологически чистую зону, практически не загрязненную антропогенными и природными выбросами с поверхности Земли. Поэтому химический состав мезосферы в значительной мере определяется природными компонентами атмосферы и коротковолновым УФ-излучением Солнца, которое мало изменяется со временем и вряд ли сколько-нибудь изменится за ближайшие 100 лет.
В качестве примера современного химического состава мезосферы на рис. 5 показаны концентрационные профили некоторых малых составляющих мезосферы для июня 2000 г. и 70° с.ш. Сопоставляя эти данные с данными, представленными на рис. 1, можно видеть, что концентрация озона в мезосфере продолжает уменьшаться с ростом высоты, что связано главным образом с уменьшением скорости тройных столкновений, в результате которых образуется озон (см. реакцию (9)). В то же время концентрация атомов О, которых в стратосфере было заметно меньше, чем молекул озона, в мезосфере растет и на высотах более 60 км начинает превосходить концентрацию O3, что также объясняется уменьшением скорости тройных столкновений, в которых погибают атомы кислорода. По той же причине происходит рост концентрации атомов H и N, причем концентрация H на высотах более 65 км начинает превосходить концентрацию радикалов OH.
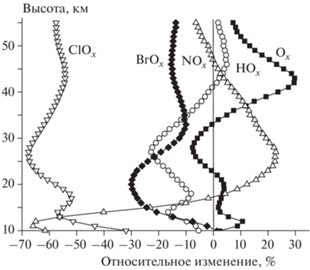
В целом можно констатировать, что химический состав мезосферы в значительной мере определяется естественными факторами и прежде всего – уровнем коротковолнового солнечного излучения, вследствие чего он (состав) претерпевает сравнительно слабые изменения со временем. Это, в частности, подтверждается данными, приведенными на рис. 6, где показано относительное изменение высотных профилей концентраций семейств Ox, HOx, NOx, ClOx и BrOx в июне 2100 года по сравнению с июнем 2000 года. Сравнение этих данных с данными, приведенными на рис. 2 для стратосферы, показывает, что изменения концентраций семейств за 100 лет в мезосфере значительно меньше, чем в стратосфере. Причины различий в изменениях концентраций семейств ClOx и BrOx в мезосфере те же, что и в стратосфере, не считая того, что в мезосфере очень мало содержание галонов, что, возможно, уменьшает “мезосферный” эффект в бромном семействе по сравнению со “стратосферным”.
ВЫВОДЫ
1. Рассмотрен химический состав высокоширотной средней атмосферы, включая тропосферу, стратосферу и мезосферу, и его изменение в XXI веке.
2. Показано, что основной причиной изменения химического состава тропосферы и стратосфуры в XXI веке являются меры, связанные с защитой озонового слоя (Монреальский протокол и поправки к нему).
3. Показано также, что компоненты химических семейств чрезвычайно чувствительны к смене сезона, и изменения их концентраций при переходе от зимы к лету значительно превосходят изменения, происходящие в течение столетия.
4. Показано, что химический состав мезосферы и его изменение определяются преимущественно естественными факторами.
Список литературы
Wayne R. Chemistry of Atmospheres. 2nd ed. Oxford, U.K.: Clarendon Press, 1991.
http://acd.ucar.edu/models/SOCRATES/
http://tntcat.iiasa.ac.at:8787/RcpDb/dsd?Action=htmlpage&page=welcome
Анисимов О.А., Белолуцкая М.А. // Метеоролог. и гидролог. 2002. № 6. С. 15.
Chapman S. // Met. Roy. Met. Soc. 1930. V. 3. P. 103.
Ларин И.К. Химическая физика озонового слоя. М.: РАН, 2018.
Hunt B.G. // J. Atmos. Sci. 1966. V. 23. P. 8.
Crutzen P.J. // J. Geophys. Res. 1971. V. 76. P. 7311.
Johnston, H.S. // Science. 1971. V. 173. P. 517.
Stolarski R.S., Cicerone R.J. // Can. J. Chem. 1974. V. 52. P. 1610.
Wofsy C., McElroy, Michael B. // Ibid. 1974. V. 52. P. 1582.
Molina M.J., Rowland F.S. // Nature. 1974. V. 249. P. 810.
McGrath W.D., Norish R.G.W. // Ibid. 1958. V. 182. P. 235.
Jacob D.J. Introduction to Atmospheric Chemistry. Princeton, USA: Princeton University Press, 1999.
Brasseur G.P., Solomon S. Aeronomy of the Middle Atmosphere. Dordrecht, Holland: Springer, 2005.
Ларин И.К. // Хим. физика. 2020. Т. 39. № 3. С. 85.
Ларин И.К. // Хим. физика. 2019. Т. 38. № 10. С. 65.
Ларин И.К. // Хим. физика. 2019. Т. 38. № 5. С. 81.
Ларин И.К., Алоян А.Е., Ермаков А.Н. // Хим. физика. 2021. Т. 40. № 5. С. 86.
Ларин И.К., Алоян А.Е., Ермаков А.Н. // Хим. физика. 2021. Т. 40. № 3. С. 80.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика