Химическая физика, 2022, T. 41, № 12, стр. 13-21
Термическая стабильность и эффективность в смесевых топливах тримолекулярного сокристаллизата энергоемкого полинитрамина CL-20 с H2O2 и H2O
А. И. Казаков 1, *, Д. Б. Лемперт 1, А. В. Набатова 1, К. Г. Горбовский 2, Н. В. Чуканов 1, Е. Л. Игнатьева 1, Д. В. Дашко 3, Л. С. Яновский 1, 4
1 Институт проблем химической физики Российской академии наук
Черноголовка, Россия
2 АО “Научно-исследовательский институт по удобрениям и инсектофунгицидам им. Я.В. Самойлова”
Череповец, Россия
3 СКТБ “Технолог”
Санкт-Петербург, Россия
4 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: akazakov@icp.ac.ru
Поступила в редакцию 29.11.2021
После доработки 08.12.2021
Принята к публикации 20.12.2021
- EDN: TIEXYY
- DOI: 10.31857/S0207401X22120056
Аннотация
Методами изотермической и неизотермической калориметрии и неизотермической термогравиметрии исследована термическая стабильность твердого моноклинного тримолекулярного комплекса (ТМК II), образованного молекулами 2,4,6,8,10,12-гексанитро-2,4,6,8,10,12-гексаазаизовюрцитана (CL-20), H2O2 и H2O в мольном отношении 2 : 0.8 : 0.2. Проведено сравнение эффективности в смесевых твердых топливах ТМК II с четырьмя полиморфами CL-20 (α, β, γ и ε).
ВВЕДЕНИЕ
Метод сокристаллизации широко применяется при получении высокоэнергетических материалов. Такие важные свойства, как плотность, термическая стабильность и чувствительность синтезируемых сокристаллизатов энергетических соединений зачастую отличаются в лучшую сторону от свойств как каждого из исходных компонентов, так и от свойств их механической смеси. Высокая чувствительность к механическим воздействиям сокращает возможности широкого применения известного уже около 30 лет [1] высокоэнергетического соединения 2,4,6,8,10,12-гексанитро-2,4,6,8,10,12-гексаазаизовюрцитана (CL-20). Поэтому исследователями интенсивно ведутся работы по поиску путей синтеза и исследованию физико-химических свойств сокристаллизатов на основе CL-20, в составе которых оба компонента обладают высокими энергетическими характеристиками. Получены и изучены сокристаллизаты CL-20 с октогеном (HMX) [2–4], 1,1-диамино-2,2-динитроэтиленом (FOX-7) [5, 6], гексогеном (RDX) [7, 8], тринитротолуолом (TNT) [9, 10], 2,4-динитро-2,4-диазапентаном (DNP) и 2,4-динитро-2,4-диазагептаном (DNG) [11]. Энергетические характеристики этих сокристаллизатов в первом приближении равны сумме характеристик исходных компонентов при одновременном снижении чувствительности сокристаллизата по сравнению с более чувствительным из исходных компонентов.
Второе направление модификации CL-20, повышающее баллистическую эффективность топлив на его основе, представляет собой синтез сокристаллизатов CL-20. В последних небольшие молекулы (H2O, H2O2, N2O4) помещаются в переменных количествах в структурные полости кристалла, не изменяя параметров элементарной ячейки [12–15], приводя таким образом к повышению плотности CL-20 и, как следствие, баллистической эффективности энергетических композиций на его основе.
В работах [14, 15] описан синтез, ИК-спектроскопические характеристики и кристаллическая структура тримолекулярных сокристаллизатов ТМК I и ТМК II с молекулами перекиси водорода и воды в мольном отношении CL-20 : Н2О2 : Н2О, равным 1.0 : 0.26 : 0.14 для ТМК I [14] и 2.0 : 0.8 : 0.2 для ТМК II [15]. В этих тримолекулярных комплексах малые молекулы располагаются в полостях каркасов, образованных молекулами CL-20. В ТМК I каркас имеет ромбическую симметрию и идентичен каркасу α-полиморфа CL-20. В ТМК II присутствуют молекулы CL-20 в двух разных конформационных состояниях, которые формируют смешанный каркас нового структурного типа, имеющий моноклинную симметрию.
Цель настоящей работы – определение кинетических закономерностей реакции термического разложения ТМК II, необходимых для расчета гарантийных сроков хранения при возможном его практическом применении, и оценка баллистической эффективности ТМК II как основного наполнителя смесевых твердых топлив.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Способ синтеза ТМК II и его кристаллическая структура описаны в работе [15]. Исследование кинетики термического превращения образца ТМК в изотермических условиях проводили на автоматическом дифференциальном микрокалориметре ДАК–1–2 [16] в стеклянных запаянных ампулах с внутренним объемом около 1 см3, не имеющих холодных частей, что позволяет сохранять все продукты превращения в зоне реакции. Навеска образца исследуемого вещества составляла примерно 10 мг, а величина отношения массы навески к свободному объему ампулы – примерно 5 · 10–3 г/см3 при всех указанных температурах испытаний. Термические превращения ТМК II в неизотермическом режиме изучали методами термогравиметрии (ТГ) и дифференциальной сканирующей калориметрии (ДСК) с использованием синхронного термического анализатора NETZSCH STA 449 F3 (Германия) в диапазоне температур 30–430 °С в потоке газообразного аргона (40 мл/мин) и скоростях нагрева 5, 7 и 10 К/мин. Для измерений использовали стандартные корундовые тигли (V = 85 мкл, d = 6.8 мм), завальцованные крышкой с отверстием, и держатель образца типа S (10% Rh–Pt). В качестве эталона использовали пустой тигель. Взвешивание осуществляли на внутренних весах анализатора с точностью ±10–4 мг. Масса навески составляла около 2 мг. Для обработки экспериментальных данных применяли программный пакет анализа NETZSCH Proteus Thermal Analysis. Перед измерением определяли базовую линию путем построения коррекции с пустыми тиглями. Анализ газов, образующихся в результате разложения образца, проводили с помощью подключенного к прибору квадрупольного масс-спектрометра.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Изотермическая микрокалориметрия
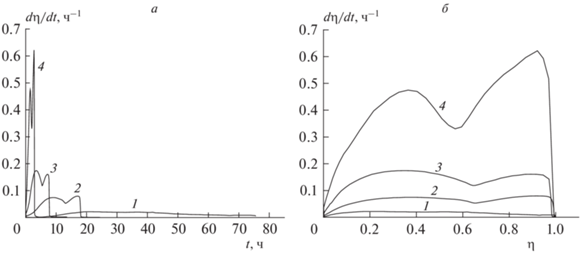
В температурном интервале 170–197 °С изучена кинетика термического разложения образца ТМК II в твердой фазе в изотермических условиях. На рис. 1 представлены зависимости скорости реакции термического разложения ТМК II от времени и глубины реакции. Процесс разложения ТМК II протекает с самоускорением. Ускорение процесса разложения ТМК II сложным образом зависит от времени и глубины разложения. Кривые скорости реакции имеют два экстремума и не описываются уравнением для автокаталитической реакции с целочисленными порядками по исходному веществу и продукту реакции. Известно, что при разложении CL-20 не образуется жидких продуктов [17], возможное растворение CL-20 в которых приводило бы к увеличению скорости реакции с глубиной превращения. Следовательно, и в случае разложения ТМК II, который в основном состоит из CL-20, автоускорение связано с топохимическим характером реакции, при котором идет прогрессирующее во времени зарождение и развитие реакционных центров. Падение скорости на промежуточной стадии и последующее ускорение может быть связано с потерей летучих компонентов и перекристаллизацией CL-20 в γ-полиморф, который термодинамически наиболее стабилен как полиморф при этих температурах, но, обладая структурой низкоплотного материала, разлагается быстрее из-за низкого тормозящего эффекта со стороны кристаллического поля [18].
Рис. 1.
Зависимость скорости реакции термического разложения образца ТМК II от времени (а) и глубины реакции (б): 1 – 170.0, 2 – 180.5, 3 – 190.7, 4 – 197.0 °С.
Скорость реакции находили по уравнению
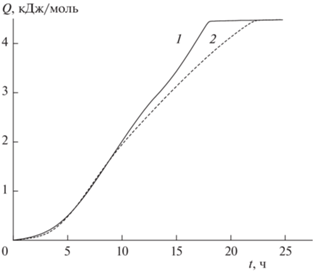
На рис. 2 представлены кинетические кривые тепловыделения при разложении ТМК II (кривая 1) и исходного ε-полиморфа CL-20 (кривая 2). Из рисунка видно, что скорости термического разложения ТМК II и ε-полиморфа CL-20 близки. В отдельном опыте с использованием метода ИК-спектроскопии было показано, что при температуре 180.5 °C за первые 5 ч все летучие компоненты удаляются из кристаллов и твердый остаток представляет собой γ-полиморф CL-20 с небольшой примесью аморфных продуктов разложения, с чем, возможно, полностью или частично связано ускорение. Дальнейшему разложению подвергается уже γ-полиморф CL-20, который является термодинамически стабильной модификацией этого соединения в условиях эксперимента [18].
Рис. 2.
Кинетические кривые тепловыделения при термическом разложении ТМК II (1) и ε-полиморфа CL-20 (2) при 180.5 °С.
В общем виде скорость термического разложения ТМК II в твердой фазе может быть представлена уравнением [19] вида
(1)
$\frac{{d\eta }}{{dt}} = k(T)f(\eta ) = A{\text{exp}}\left( { - \frac{E}{{RT}}} \right)f(\eta ),$Для обработки данных, полученных в изотермических условиях, используется уравнение
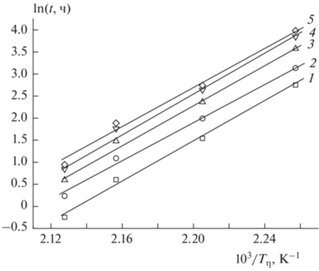
получаемое интегрированием уравнения (1) с последующим логарифмированием полученного выражения:Этот интегральный изоконверсионный метод определения кинетических параметров основан на предположении, что скорость реакции при постоянной глубине реакции η является функцией только температуры. Данный метод позволяет определить зависимости энергии активации E от η без предположений о явной форме функции f(η) при построении кривых зависимости от температуры значений времени t, соответствующим определенным, произвольно выбранным величинам глубины реакции η. Примеры определения Е для различных значений η представлены на рис. 3.
Рис. 3.
Зависимость ln t от 1/Tη для определения энергии активации изоконверсионным методом по изотермическим данным при разных значениях степени разложения η ТМК II: 1 – 0.1, 2 – 0.25, 3 – 0.5, 4 – 0.7, 5 – 0.8.
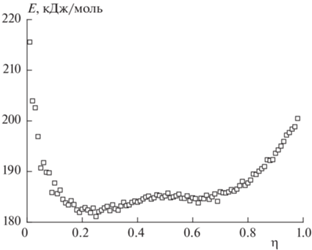
Полученные данные хорошо аппроксимируются прямыми линиями (коэффициент детерминации R2 – не менее 0.99). На рис. 4 приведена полученная зависимость Е от η.
Рис. 4.
Зависимость энергии активации Е от степени разложения η, полученная по изотермическим данным для ТМК II.
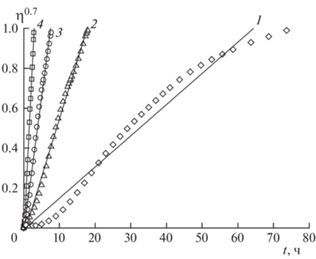
Изоконверсионный метод не позволяет определить коэффициент А и функции f(η) или g(η). Для решения этой задачи применили метод подбора модели (кинетического уравнения реакции), используя уравнение (2). Для полученных изотермических данных рассчитывали функции g(η) для различных моделей реакции (уравнения степенного закона, реакции первого порядка, одномерной, двухмерной и трехмерной диффузии, сжимающейся сферы и цилиндра, уравнения Аврами–Ерофеева [19]) при переменных заданных величинах η и строили графики зависимости в координатах g(η)–t. По тангенсу угла наклона прямой линии определяли значение константы k. Наиболее подходящей моделью для всех изотермических данных является степенная функция g(η) = ηn для n = 0.7. На рис. 5 показано применение указанной модели к экспериментальным данным.
Рис. 5.
Зависимость модели реакции g(η) = η0.7 от времени t при термическом разложении ТМК II при различных температурах: 1 – 170.0, 2 – 180.5, 3 – 190.7, 4 – 197.0 °С.
Установленная таким образом температурная зависимость константы скорости k описывается следующим уравнением:
k[1/c] = 1015.4 ± 1.8exp[–(176 ± 16) · 103/RT],
R = 8.314 Дж/К · моль.
Но подобранное кинетическое уравнение реакции не позволяет сделать заключение о механизме реакции из-за неоднозначной связи кинетического уравнения с механизмом процесса. Параметры Аррениуса являются фактически средними числами и не отражают изменений в механизме и кинетике с температурой и глубиной реакции [19]. Имеющиеся в литературе данные, различающиеся по аррениусовским параметрам констант реакции разложения CL-20 [17, 18, 20, 21], можно объяснить как использованием авторами различных кинетических уравнений для описания экспериментальных результатов, так и, главным образом, тем, что на реакционную способность кристаллов CL-20, а следовательно, на активационные параметры исследуемых образцов влияют распределение кристаллов по размерам, полиморфное состояние исходного образца и предшествующая дегидратация разного количества структурной и внеструктурной воды, в той или иной степени модифицирующая морфологию кристаллов [17]. Хотя разложению подвергается γ-полиморф CL-20, образующийся при нагревании любого полиморфа выше 150 °С, небезразлично, из какого исходного полиморфа он образовался [18], так как, например, превращение α-полиморф → → γ-полиморф происходит по механизму монокристалл → монокристалл, а превращение ε-полиморф → γ-полиморф – с диспергированием кристаллов [22].
Реакция термического разложения ТМК II в твердом состоянии показывает сложность взаимодействия различных химических и физических процессов, таких как собственно разложение в твердой фазе, реакция газообразных продуктов с твердым веществом, возгонка, полиморфные переходы, диффузия, адсорбция, десорбция и т.д. Эффективная энергия активации реакции в твердой фазе является величиной, определяемой энергиями активации этих процессов и их относительными вкладами в скорость суммарной реакции на разных глубинах реакции. Энергия активации реакции разложения ТМК II (рис. 4) при малых глубинах сначала уменьшается от ∼197 до почти 182 кДж/моль при 20%-ной глубине реакции и затем увеличивается до ∼198 кДж/моль по мере приближения к завершению реакции. В отличие от метода подбора кинетического уравнения, который дает единственное значение энергии активации для процесса (176 кДж/моль), изоконверсионная методика позволяет обнаруживать сложность механизма реакции в форме функциональной зависимости энергии активации от глубины реакции, которая могла быть скрыта при использовании метода подбора кинетического уравнения реакции [19].
Термогравиметрия (ТГ) и дифференциальная сканирующая калориметрия (ДСК)
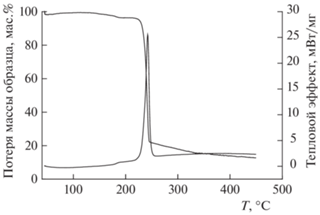
На рис. 6 представлены кривые ТГ анализа и ДСК образца ТМК II, полученные при скорости нагрева 5 К/мин. Кривая ТГ демонстрирует двухступенчатый процесс разложения. На первой стадии разложения, протекающей в интервале 150–200 °С, наблюдаемая потеря массы составляет 3.6 мас.%. Эта величина близка к теоретическому общему содержанию летучих компонентов (H2O2 и Н2О) в ТМК II, равному 3.4 мас.%. Далее происходит более глубокое разложение, которое начинается при ∼200 °С и завершается при температуре ∼260 °С. Потеря массы на этой стадии составляет 83.56 мас.%.
На кривой ДСК наблюдаются два экзотермических пика, соответствующих потерям массы на кривой ТГ. Первый пик соответствует температуре 188.2 °С, а его площадь – 27.2 Дж/г. По масс-спектрометрическим данным в температурном интервале первого экзотермического пика происходит выделение в газовую фазу кислорода и воды. Как следует из неизотермических гравиметрических данных, при температурах выше 160 °С имеет место выход летучих компонентов из ТМК II. Этот процесс может сопровождаться структурным переходом с образованием γ-полиморфа CL-20, который термодинамически стабилен в условиях эксперимента. Оба эти процесса должны происходить с поглощением тепла, однако проявлений эндотермических эффектов на кривой ДСК не наблюдается. Вероятно, это связано с тем, что эндотермический эффект полиморфного превращения маскируется экзотермическим, имеющим бóльшую абсолютную величину, эффектом термического разложения H2O2.
Второй (основной) пик при температуре 242.3 °С и площади, равной 2498 Дж/г, соответствует экзотермическому разложению образовавшегося γ-полиморфа CL-20. В продуктах разложения в высокотемпературной области методом масс-спектрометрии фиксируются: N2O, N2, CO, CO2, NO2, NO, HCN, продукты с массами 34, 43, 52 и следы продуктов с массами 229 и 243. Суммарная теплота разложения ТМК II, измеренная в неизотермических условиях, существенно меньше аналогичной величины, полученной в изотермических условиях (4400 Дж/г), что, вероятно, связано с уносом из реакционной зоны продукта реакции двуокиси азота NO2 с газом-носителем аргоном и уменьшением вклада в суммарную теплоту вторичных экзотермических реакций с ее участием.
Для неизотермических условий при постоянной скорости нагрева $\beta = \frac{{dT}}{{dt}}$ предполагается, что уравнение (1) принимает вид
Это предположение приемлемо для одностадийного процесса, для которого изменение в экспериментальных условиях от изотермических к неизотермическим не влияет на кинетику реакции [19].
Интегрирование уравнения (3) дает
(4)
$\begin{gathered} g(\eta ) = \int\limits_0^\eta {\frac{{d\eta }}{{f(\eta )}}} = \frac{{AE}}{{\beta R}}\left[ {\frac{{\exp ( - x)}}{x} - \int\limits_x^\infty {\frac{{\exp ( - x)}}{x}dx} } \right] = \\ = \frac{{AE}}{{\beta R}}p(x), \\ \end{gathered} $Интеграл уравнения (4) не имеет аналитического решения для неизотермической температурной программы. Поэтому был предложен ряд приближенных решений, которые легли в основу различных интегральных изоконверсионных методов [23]. Один из таких методов, изложенный в работе [24], позволяет получить наиболее точные значения Е:
(5)
$\begin{gathered} {\text{ln}} \frac{{{\beta }}}{{T_{{{\eta }}}^{{{\text{1}}{\text{.92}}}}}} \cong {\text{ln}} \frac{{AR}}{{Eg\left( {{\eta }} \right)}} + {\text{3}}{\text{.7545}} - \\ - \,\,{\text{1}}{\text{.92}}\ln E - {\text{1}}{\text{.0008}}\frac{E}{{R{{T}_{{{\eta }}}}}}. \\ \end{gathered} $Использование данных ТГ, полученных при интенсивностях нагрева 5, 7 и 10 К/мин и массе образца примерно 2 мг, позволило определить значения энергии активации для различных величин глубины разложения с использованием метода из работы [24] (уравнение (5). Примеры определения энергии Е для различных значений η представлены на рис. 7.
Рис. 7.
Зависимость ${\text{ln}}\left( {{{{\beta }} \mathord{\left/ {\vphantom {{{\beta }} {T_{{{\eta }}}^{{1.92}}}}} \right. \kern-0em} {T_{{{\eta }}}^{{1.92}}}}} \right)$ от 1/Tη для определения энергии активации методом из работы [24] при различных значениях степени разложения η ТМК II: величина η = 0.1, 0.25, 0.5, 0.7 и 0.8 для прямых 1, 2, 3, 4 и 5 соответственно.
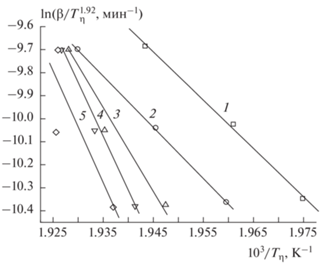
Рис. 8.
Зависимость энергии активации Е от степени разложения η ТМК II, полученная по неизотермическим данным методом из работы [24].
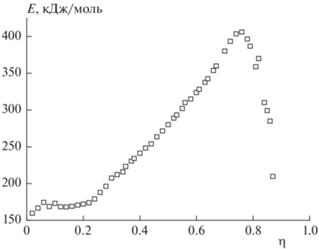
До значений η ≈ 0.2 энергия активации Е практически не изменяется и составляет около 170 кДж/моль. В дальнейшем величина Е стремительно растет и достигает 406 кДж/моль при η = = 0.76. Коэффициент детерминации R2 вычисления энергии активации Е по методу из работы [24] для значений ниже максимума составляет не менее 0.99, однако при значениях глубины реакции больше 0.76, когда энергия активации уменьшается, возрастает степень разброса точек.
Зависимость Е от η для неизотермических данных отличается от аналогичной зависимости, полученной для изотермических данных (см. рис. 4). Причина состоит в том, что изотермические и неизотермические эксперименты проводятся в разных температурных областях, а процессы в твердой фазе обычно протекают по многостадийной кинетике, которая легко изменяется с температурой.
Обработку с подбором кинетического уравнения, примененную к неизотермическим данным, не проводили. Обычно она приводит к параметрам Аррениуса, которые являются настолько неопределенными, что их нельзя сопоставлять с изотермическими величинами [19]. Имеет место кинетическая неоднозначность, приводящая к тому, что один и тот же процесс может быть описан как разными кинетическими уравнениями реакции, так и различными значениями энергии активации. Единственный приемлемый прием определения кинетических параметров из неизотермических данных представляет собой изоконверсионный способ кинетического анализа, не связанный с кинетическим уравнением реакции [23].
Оценка энергетического потенциала ТМК II как компонента смесевых твердых ракетных топлив
Переход от различных полиморфов CL-20 к ТМК II с одной стороны ведет к небольшому увеличению коэффициента кислородного баланса α от 0.80 до 0.83, но при этом и к снижению величины энтальпии образования. Величины плотностей различных полиморфов CL-20 и ТМК II (см. табл. 1) также существенно влияют на баллистические характеристики топливных композиций, содержащих указанные полиморфы или ТМК II в качестве основных наполнителей. Каждая из указанных характеристик (энтальпия образования, кислородный баланс и плотность) существенно влияет на баллистические параметры. Для сравнения баллистического потенциала ТМК II с α-, β-, γ- и ε-полиморфами CL-20 был проведен расчет удельного импульса Isp (при давлении в камере сгорания и на срезе сопла 4.0 и 0.1 МПа соответственно) и эффективных величин удельного импульса Ief(n) (характеризующих баллистическую эффективность топлива на разных ступенях) для бинарных топливных композиций (активное связующее + изучаемый основной наполнитель) при таком соотношении компонентов, чтобы обеспечить одинаковые объемные содержания связующего 19 об.% в разных композициях (т.е. при близких реологических характеристиках неотвержденной топливной массы). В качестве активного связующего (АС) принимали смесь C18.96H34.64N19.16O29.32 (поливнлметилтетразол, пластифицированный нитроглицерином с флегматизатором) с величиной энтальпии образования –757 кДж/кг и плотностью 1.49 г/см3 [25]. Расчетные исследования проводили стандартным способом, описанным во многих источниках [26, 27]. Энергетические характеристики твердых наполнителей представлены в табл. 1. Энтальпия образования $\left( {\Delta H_{f}^{^\circ }} \right)$ ТМК II рассчитана как аддитивная величина смеси 1 (ε-CL-20) + 1 (β-CL-20) + 0.8 H2O2 (газ) + 0.2 H2O (газ), поскольку согласно данным работы [29] энтальпии образования БМК на базе CL-20 примерно аддитивны парциальным вкладам своих составляющих, а согласно рентгено-структурному анализу примерно половина фрагментов CL-20 в ТМК II упакована в виде ε-полиморфа и другая половина – в виде β-полиморфа.
Таблица 1.
Основные характеристики компонентов исследуемых топлив
| Основной наполнитель | Формула | Энтальпия образования, кДж/кг | Плотность, г/см3 | α = 2O/(4C + H) |
|---|---|---|---|---|
| ТМК II | C12H14N24O25.8 | 701.1 | 1.959 [15] | 0.83 |
| α-CL-20 | C6H6N12O12 | 773 [30] | 1.960 [31] | 0.80 |
| β-CL-20 | C6H6N12O12 | 949 [28] | 1.985 [31] | 0.80 |
| γ-CL-20 | C6H6N12O12 | 898 [29] | 1.916 [31] | 0.80 |
| ε-CL-20 | C6H6N12O12 | 857 [32] | 2.044 [32] | 0.80 |
В табл. 2 приведены результаты расчета, а рис. 9 иллюстрирует полученные данные.
Таблица 2.
Расчетные величины Isp и Ief(n) топливных композиций АС + основной наполнитель при объемном содержании АС 19 ± 0.1%
| Основной наполнитель | AC, мас.% | ρ, г/см3 | Isp, с | Ief(1), с | Ief(2), с | Ief(3), с | |
|---|---|---|---|---|---|---|---|
| Тип | мас.% | ||||||
| α-CL-20 | 84.85 | 15.15 | 1.871 | 254.4 | 251.5 | 258.0 | 258.7 |
| β-CL-20 | 85.0 | 15.0 | 1.891 | 256.8 | 255.9 | 261.3 | 261.6 |
| γ CL-20 | 84.55 | 15.45 | 1.835 | 256.1 | 249.6 | 257.8 | 259.5 |
| ε-CL-20 | 85.4 | 14.6 | 1.936 | 255.6 | 259.2 | 262.4 | 261.5 |
| TMK II | 84.85 | 15.15 | 1.870 | 256.8 | 253.8 | 260.3 | 261.1 |
Рис. 9.
Величины Ief(1), Ief(2) и Ief(3) составов АС + наполнитель при объемном содержании АС 19 ± 0.1%.
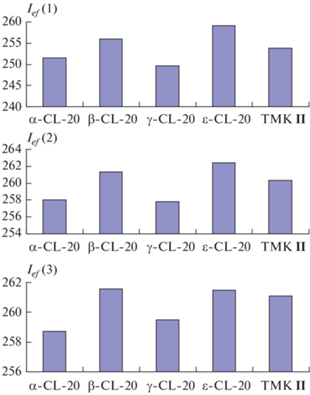
Видно, что ε-полиморф CL-20 на всех ступенях опережает остальные наполнители, только на верхней ступени он практически эквивалентен β-полиморфу. Но на верхней ступени, где преимущество в плотности ε-полиморфа менее значимо, чем на нижних ступенях, ТМК II уступает ему и β-полиморфу лишь 0.4–0.5 с по величине Ief(3). Преимущество ТМК II над α- и γ-полиморфами достаточно значительно (2.4 и 1.6 с соответственно). На второй ступени по величине Ief(2) ТМК II уступает ε- и β-полиморфам 2.1 и 1.0 с соответственно, но выигрывает у α- и γ-полиморфов 2.3 и 2.5 с соответственно. На нижней ступени преимущество ε- и β-полиморфов над ТМК II увеличивается до 5.4 и 2.1 с соответственно (в большей степени сказывается повышенная плотность ε- и β-полиморфов), преимущество же ТМК II по величине Ief(1) над α- и γ-полиморфами составляет 2.3 и 4.2 с соответственно.
ВЫВОДЫ
1. Установлено, что удаление в низкотемпературной области воды и продуктов разложения перекиси водорода из образца трехкомпонентного сокристаллизата CL-20 с молекулами перекиси водорода и воды не оказывает существенного влияния на скорость разложения ТМК II в высокотемпературном интервале.
2. При исследовании закономерностей реакции термического разложения ТМК II изотермическими и неизотермическими калориметрическими методами установлено, что процесс разложения на разных глубинах реакции лимитируется различными физико-химическими стадиями, что приводит к многообразной сложной зависимости энергии активации суммарной реакции от глубины реакции.
3. Баллистическая эффективность изученного образца тримолекулярного кристалла ТМК II в смесевых твердых топливах ниже, чем у ε- и β-полиморфов CL-20 на всех ступенях, но ТМК II выигрывает на всех ступенях у α- и γ-полиморфов.
Работа выполнена по темам государственного задания “Фундаментальные и проблемно-ориентированные исследования в области создания энергетических конденсированных систем (ЭКС) различного назначения” (регистрационный номер АААА-А19-119101690058-9) и “Комплексные фундаментальные и проблемно-ориентированные исследования в области физики и химии горения и тепломассообмена высокоэнергоемких твердых и жидких топлив (горючих) и материалов нового поколения для высокотемпературных камер сгорания прямоточных воздушно-реактивных двигателей (ПВРД)” (регистрационный номер АААА-А19-119120690042-9).
Список литературы
Nielsen A.T., Chafin A.P., Christian S.L. et al. // Tetrahedron. 1998. V. 54. P. 11793; https://doi.org/10.1016/S0040-4020(98)83040-8
Bolton O., Simke L.R., Pagoria P.F., Matzger A.J. // Cryst. Growth Des. 2012. V. 12. № 9. P. 4311; https://doi.org/10.1021/cg3010882
Herrmannsdörfer D., Klapötke T.M. // Ibid. 2021. V. 21. № 3. P. 1708; https://doi.org/10.1021/acs.cgd.0c01611
Herrmannsdörfer D., Stierstorfer J., Klapötke T.M. // Energ. Mater. Front. (China) 2021. V. 2. № 1. P. 51; https://doi.org/10.1016/j.enmf.2021.01.004
Ghosh M., Sikder A.K., Banerjee S., Talawar M.B., Sikder N. // Def. Technol. (China) 2020. V. 16. № 1. P. 188; https://doi.org/10.1016/j.dt.2019.05.018
Feng R., Zhang S., Ren F., Gou R., Gao L. // J. Mol. Model. 2016. V. 22. Article 123; https://doi.org/10.1007/s00894-016-2998-9
Song X., Wang Y., Zhao S., Li F. // RSC Adv. 2018. V. 8. № 59. P. 34126; https://doi.org/10.1039/c8ra04122a
Hang G.Y., Yu W.L., Wang T., Wang J.T. // J. Mol. Struct. 2017. V. 1141 P. 577; https://doi.org/10.1016/j.molstruc.2017.03.126
Bolton O., Matzger A.J. // Angew. Chem. Intern. Ed. 2011. V. 50. P. 8960; https://doi.org/10.1002/anie.201104164
Hang G.Y., Yu W.L., Wang T., Wang J.T. // J. Mol. Model. 2018. V. 24. № 7. P. 158; https://doi.org/10.1007/s00894-018-3697-5
Гончаров Т.К., Алиев З.Г., Алдошин С.М. и др. // Изв. АН. Сер. хим. 2015. № 2. С. 366; https://doi.org/10.1007/s11172-015-0870-1
Yudin N.V., Sinditskii V.P., Filatov S.A. et al. // Chem.PlusChem. 2020. V. 85. № 9. P. 1994; https://doi.org/10.1002/cplu.202000534
Bennion J.C., Chowdhury N.C., Kampf J.W., Matzger A.J. // Angew. Chem. Intern. Ed. 2016. V. 55. № 42. P. 13118; https://doi.org/10.1002/anie.201607130
Игнатьева Е.Л., Лемперт Д.Б., Чуканов Н.В., Шилов Г.В., Алдошин С.М. // Хим. физика. 2022. Т. 41. № 4. С. 7.
Чуканов Н.В., Шилов Г.В., Игнатьева Е.Л. и др. // Хим. физика. 2022.
Гальперин Л.Н., Колесов Ю.Р., Машкинов Л.Б., Тернер Ю.Э. // Тр. Шестой Всесоюз. конф. по калориметрии. Тбилиси: Мецниереба, 1973. С. 539.
Korsounskii B.L., Nedelko V.V., Chukanov N.V., Larikova T.S., Volk F. // Rus. Chem. Bull. 2000. V. 49. № 5. P. 812; https://doi.org/10.1007/BF02494701
Nedelko V.V., Chukanov N.V., Raevskii A.V. et al. // Propellants Explos. Pyrotech. 2000. V. 25. Issue 5. P. 255; https://doi.org/10.1002/1521-4087(200011)25:5<255:: AID-PREP255>3.0.CO;2-8
Vyazovkin S., Wight C.A. // Annu. Rev. Phys. Chem. 1997. V.48. P. 125; https://doi.org/10.1146/annurev.physchem.48.1.125
Patil D.G., Brill T.B. // Combust. and Flame. 1991. V. 87. P. 145.
Lobbecke S., Bohn M A., Pfeil A., Krause H. // Proc. 29th Intern. Annual Conf. of ICT. Karlsruhe. 1998. P. 145.
Чуканов Н.В., Захаров В.В., Корсунский Б.Л., Червонный А.Д., Возчикова С.А. // Горение и взрыв. 2018. Т. 11. № 2. С. 118; https://doi.org/10.30826/CE18110216
Vyazovkin S., Burnham A.K., Criado J.M. et al. // Thermochim. Acta. 2011. V. 520. P. 1; https://doi.org/10.1016/j.tca.2011.03.034
Starink M.J. // Ibid. 2003. V. 404. P. 163; https://doi.org/10.1016/S0040-6031(03)00144-8
Lempert D.B., Nechiporenko G.N., Manelis G.B. // Cent. Eur. J. Energetic Mater. 2006. V. 3. № 4. P. 73.
Гудкова И.Ю., Зюзин И.Н., Лемперт Д.Б. // Хим. физика. 2020. Т. 39. № 3. С. 53; https://doi.org/10.31857/S0207401X20030061
Дорофеенко Е.М., Шереметев А.Б., Лемперт Д.Б. // Хим. физика. 2019. Т. 38. № 10. С. 33; https://doi.org/10.1134/S0207401X19080041
Bourasseau S. // J. Energetic Mater. 1990. V. 8. № 5. P. 416; https://doi.org/10.1080/07370659008225432
Казаков А.И., Гончаров Т.К., Лемперт Д.Б. и др. // Физика горения и взрыва. 2018. Т. 54. № 1. С. 99; https://doi.org/10.15372/FGV20180113
Golfier M. et al. // Proc., 29th Intern. Ann. Conf. of ICT. Karlsruhe. 1998. V. 3. P. 1.
Сысолятин С.В., Лобанова А.А., Черникова Ю.Т., Сакович Г.В. // Успехи химии. 2005. Т. 74. № 8. С. 830; https://doi.org/10.1070/RC2005v074n08ABEH001179
Мирошниченко Е.А., Конькова Т.С., Иноземцев Я.О., Матюшин Ю.Н., Тушев Е.Б. // Горение и взрыв. 2011. № 4. С. 294.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика