Химическая физика, 2022, T. 41, № 12, стр. 7-12
Термическое разложение 1-[2,2-бис(метокси-NNO-азокси)этил]-пиразола
В. В. Захаров 1, *, И. Н. Зюзин 1, Б. Л. Корсунский 1, 2, Т. С. Ларикова 1, Н. В. Чуканов 1, **
1 Институт проблем химической физики Российской академии наук
Черноголовка, Россия
2 Федеральный исследовательский центр химической физики им. Н.Н. Семёнова Российской академии наук
Москва, Россия
* E-mail: vzakh@icp.ac.ru
** E-mail: chukanov@icp.ac.ru
Поступила в редакцию 30.08.2021
После доработки 17.01.2022
Принята к публикации 20.01.2022
- EDN: LRCEVW
- DOI: 10.31857/S0207401X2212010X
Аннотация
В изотермическом и неизотермическом режимах изучено термическое разложение 1-(2,2-бис(метокси-NNO-азокси)этил)пиразола (I). Теплоты плавления и термического разложения соединения I найдены равными соответственно –153.4 Дж/г (–9.0 ккал/моль) и 494.3 Дж/г (28.8 ккал/моль). Процесс термического разложения соединения I в открытой и замкнутой реакционных системах протекает по-разному. В открытой системе скорость процесса монотонно уменьшается в соответствии с кинетическим законом порядка 0.5. В замкнутой системе реакция протекает с самоускорением и описывается уравнением автокатализа со вторым кинетическим порядком по автокатализатору. На основании полученных данных процесса предложен механизм разложения, согласно которому первая стадия реакции протекает через циклическое пятичленное переходное состояние. Помимо этого, реакция подвержена автокатализу, в основном летучими продуктами, среди которых наиболее важную роль, по-видимому, играет пиразол. Автокатализ имеет основную природу.
ВВЕДЕНИЕ
Исследование термического разложения полифункциональных энергоемких веществ, молекулы которых содержат несколько реакционноспособных функциональных групп, зачастую связано с определенными трудностями, поскольку каждая из этих групп может вносить вклад в кинетику разложения. В последнее время нами изучен ряд соединений, содержащих две такие группы – диазеноксидную и нитропиразольную (пиразольный цикл содержал в разных положениях одну или две нитрогруппы) [1–3]. Ряд производных пиразолов предложен в качестве компонентов твердых ракетных топлив [4, 5].
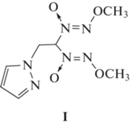
Настоящая работа посвящена исследованию термического разложения соединения 1-(2,2-бис(метокси-NNO-азокси)этил)пиразола (I).
Пиразольный цикл в молекуле соединения I не содержит заместителей. Незамещенный пиразол обладает очень высокой термической стабильностью и в реакции распада не может конкурировать с 2,2-бис(метокси-NNO-азокси)этильной группой. Согласно данным работы [6], энергия активации распада пиразола равна 71.3 ккал/моль, а по данным работы [7], она составляет 81.9 ккал/моль.
Что же касается алкокси-NNO-азоксисоединений, то их разложение изучалось как в газовой, так и в конденсированной фазах. В обоих случаях первой стадией процесса может быть гомолитический разрыв связи N–O. В газовой фазе реакция протекает с энергиями активации в интервале значений 48.8–49.2 ккал/моль и предэкспоненциальными множителями 1014.5–1014.6 с–1 [8]. В жидкой фазе соответствующие параметры равны 43.5–44.5 ккал/моль и 1014.6–1015.5 с–1 [9]. Однако, если молекула алкокси-NNO-азоксисоединения содержит атом водорода в β-положении, реакция может протекать по более выгодному маршруту – через пятичленное циклическое переходное состояние. В этом случае в газовой фазе реакция протекает с активационными параметрами, равными 35.4 ккал/моль и 1013.3 с–1, а в жидкой фазе – с параметрами 31.9–38.8 ккал/моль и 1011.9–1014.0 с–1.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез и очистка соединения I с температурой плавления 149.3–150.0 °С описаны в работе [10].
Термическое разложение соединения I в неизотермическом режиме изучалось методами дифференциальной сканирующей калориметрии (ДСК) и термогравиметрии (ТГ) с использованием синхронного термического анализатора STA 449F5 (Netzsch, Germany), сопряженного с квадрупольным масс-спектрометром QMS 403C Aeolos (Netzsch, Germany), в диапазоне температур 30–350 °С, при продувке аргоном со скоростью 40 мл/мин, скорости нагрева 4 °С/мин и массе навески 2.7 мг. Масс-спектрометрический анализ газообразных продуктов термического разложения проводился при энергии ионизирующих электронов, равной 70 эВ.
В изотермических условиях кинетика разложения соединения I изучалась двумя способами. Опыты по потере массы проводили в открытой реакционной системе с использованием автоматических термовесов АТВ-14М [11], а манометрические измерения газовыделения – в замкнутой системе с использованием стеклянных мембранных манометров Бурдона. При проведении термовесовых опытов образец массой ~8 мг помещали в кварцевый стаканчик и вводили в термостатированную часть установки (печь с электроподогревом). Рабочая часть манометра Бурдона, использовавшегося при манометрических измерениях, имела объем 3.5–4 мл, а величина навеска исследуемого вещества составляла 3.5–4 мг. Перед началом опыта реакционный сосуд откачивали до остаточного давления ~0.1 Торр. Термовесовые эксперименты проводили в интервале температур 155–205 °С, а манометрические – в интервале 175–190 °С.
ЭКСПЕРИМЕНТАЛЬНЫЕ РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
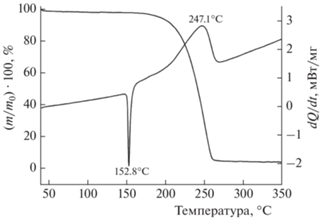
На рис. 1 приведены данные, полученные методами ДСК и ТГ для соединения I. Кривая ДСК содержит два пика – эндотермический и экзотермический. Первый из них отвечает плавлению, а второй – термическому разложению соединения I. Теплоты этих процессов равны соответственно –153.4 Дж/г (–9.0 ккал/моль) и 494.3 Дж/г (28.8 ккал/моль). Теплота взрыва соединения I неизвестна, но, если взять для нее разумную величину 1200–1300 кал/г (больше, чем у тротила, но меньше, чем у октогена), то это будет означать, что при термическом разложении I выделяется около 10% теплоты взрыва.
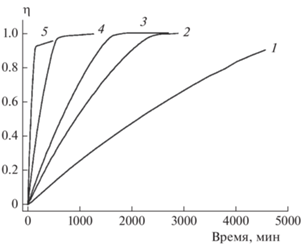
Кинетические кривые термического разложения соединения I, полученные в изотермических условиях, представлены на рис. 2 (термовесовые измерения) и 3 (манометрические измерения). Сопоставление этих рисунков показывает, что форма кинетических кривых существенно зависит от метода измерения. Если в манометрических опытах (замкнутая реакционная система) полученные кинетические кривые имеют четко выраженный самоускоряющийся характер, то в термогравиметрических экспериментах (открытая реакционная система) самоускорения нет и кинетические кривые точек перегиба не имеют. В то же время нельзя сказать, что в одной из использованных реакционных систем (открытой или замкнутой) реакция протекает быстрее или медленнее: при любой заданной температуре кинетические кривые, полученные термовесовым и манометрическим методами, практически накладываются друг на друга, лишь несколько различаясь по форме.
Рис. 2.
Кинетические кривые термического разложения соединения I (термовесовые измерения) при различных температурах: 1 – 155 °C, 2 – 165 °C, 3 – 170 °C, 4 – 185 °C, 5 – 205 °C; η – степень превращения.
В манометрических экспериментах после завершения опыта реакционный сосуд охлаждался до комнатной температуры, после чего измеряли давление остывших газов. Это позволило определить количество газов, не конденсирующихся при комнатной температуре. Оказалось, что 56–59% газов, образующихся при термическом разложении соединения I, при охлаждении до комнатной температуры не конденсируются. По данным масс-спектрометрических измерений, проводившихся в ходе термического анализа, среди этих продуктов идентифицированы CO, NO, CO2, N2O и СН3ОН. Молекулярный азот при термическом разложении соединения I не выделяется: в одном из опытов реакционную смесь, образующуюся при полном разложении I, охлаждали до –196 °С и остаточное давление оказалось равным нулю. Манометрические эксперименты позволили также определить полное количество образующихся газообразных продуктов: при температурах, при которых проводили опыты, в расчете на моль исходного соединения I выделяются 4.1 моля газов.
Кинетические кривые, показанные на рис. 2, точек перегиба не имеют. Поэтому можно было ожидать, что исследуемая реакция имеет определенный кинетический порядок. Однако оказывается, что это не так: в координатах ln(dη/dt) – ln(1 – η) (η – степень превращения) спрямления не наблюдается. В то же время в достаточно широком интервале степеней превращения кинетику реакции удалось описать уравнением порядка 0.5: dη/dt = = k(1 – η)0.5. Сказанное иллюстрируется рис. 4. На этом рисунке приведены данные для температуры 205 °С, а уравнение порядка 0.5 выполняется до степени превращения h = 0.87. При самых низких из исследованных температур это уравнение выполняется до η = 0.67. В табл. 1 приведены значения констант скорости реакций. Энергия активации и предэкспоненциальный множитель, найденные по этим величинам, равны соответственно 29.0 ± 0.3 ккал/моль и 109.2 ± 0.2 с–1.
Рис. 3.
Кинетические кривые термического разложения соединения I (манометрические измерения) при различных температурах: 1 – 175 °C, 2 – 185 °C, 3 – 190 °C, 4 – 195 °С, 5 – 205 °С.
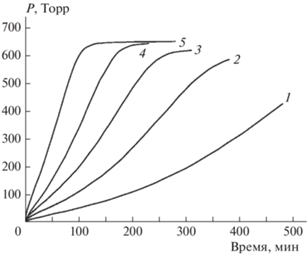
Рис. 4.
Кинетическая кривая термического разложения соединения I при температуре 205 °С (в координатах уравнения порядка 0.5); η – степень превращения.
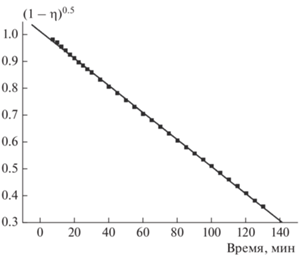
Таблица 1.
Значения констант скорости термического разложения соединения I по данным термовесовых измерений
| Температура, °С | Константа скорости, с–1 |
|---|---|
| 155 | 2.3 · 10–6 |
| 165 | 5.3 · 10–6 |
| 170 | 7.8 · 10–6 |
| 185 | 2.2 · 10–5 |
| 205 | 8.4 · 10–5 |
Как видно из данных, приведенных на рис. 3, кинетические кривые, полученные в манометрических экспериментах, имеют S-образный характер. Подобное поведение весьма характерно для энергоемких соединений. Зачастую такие зависимости удается описать уравнениями автокатализа. В нашем случае в широком интервале степеней превращения (до значений не ниже 0.6) кинетические данные удалось описать уравнением автокатализа со вторым порядком по автокатализатору: dη/dt = k1(1 – η) + k2η2(1 – η). Соответствующий пример показан на рис. 5, где по оси ординат отложена удельная скорость: (dη/dt)(1 – η)–1). Проведенный анализ показал, что величины k1 на два порядка меньше величин k2. Поэтому определить значения k1 с приемлемой точностью не удалось. В табл. 2 приведены значения k2 при разных температурах. Найденные по этим значениям энергия активации и предэкспоненциальный множитель равны соответственно (17.5 ± 1.8) ккал/моль и 104.9 ± 0.9 c–1.
Рис. 5.
Кинетическая кривая термического разложения соединения I при температуре 185 °С (в координатах уравнения автокатализа со вторым порядком по катализатору); η – степень превращения.
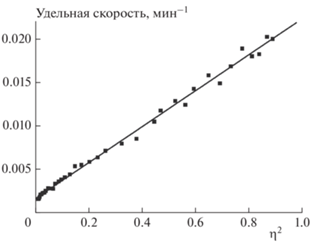
Таблица 2.
Значения констант скорости термического разложения соединения I по данным манометрических измерений
| Температура, °С | Константа скорости, с–1 |
|---|---|
| 175 | 2.5 · 10–4 |
| 185 | 3.4 · 10–4 |
| 190 | 4.3 · 10–4 |
| 195 | 6.3 · 10–4 |
| 205 | 8.0 · 10–4 |
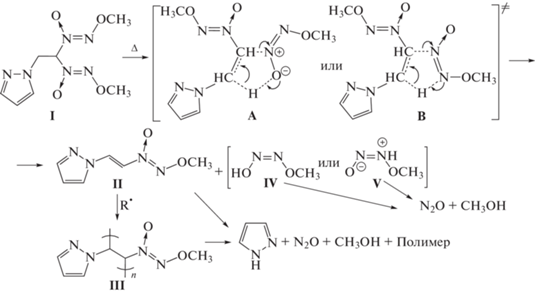
С учетом вышесказанного в молекуле соединения I имеется лишь одна реакционноспособная функциональная группа, ответственная за начало термического разложения – 2,2-бис(метокси-NNO-азокси)этильная. Поскольку эта группа содержит атомы водорода в β-положении, то логично предположить, что реакция должна протекать по упомянутому выше механизму через пятичленное циклическое переходное состояние. Этот механизм рассматривался ранее [2, 3, 8, 9], а применительно к I может иметь следующий вид:
Возможны два варианта циклического переходного состояния (A и B), выбор между которыми на основании продуктов реакции и кинетических параметров сделать сложно. Ранее рассматривалось только переходное состояние B [2, 3, 8, 9]. В этой схеме предполагается, что термическое разложение I протекает последовательно и включает в себя образование промежуточного продукта II и его полимеризацию с последующим разложением полимера III с образованием пиразола. Подобные процессы наблюдались ранее при синтезе метокси-NNO-азоксиэтена препаративным пиролизом 1,1-бис(метокси-NNO-азокси)этана [12, 13].
Энергия активации рассматриваемой реакции, полученная в термовесовых экспериментах, как отмечалось выше, равна 29.0 ккал/моль. Это несколько ниже, но, тем не менее, достаточно близко к вышеупомянутым для других диазеноксидов и приведенным в работе [9] величинам 31.9–38.8 ккал/моль.
Весьма странным и необычным является то, что кинетика термического разложения соединения I описывается уравнением порядка 0.5, выполняющимся до высоких степеней превращения. Уже это говорит о достаточно сложном механизме реакции (на приведенной выше схеме указаны лишь начальные стадии процесса) и трудности ее кинетической интерпретации. Отметим лишь некоторые обстоятельства. Поскольку в термовесовых экспериментах фиксируется потеря массы, т.е. выделение газообразных продуктов, нельзя ничего сказать о реакциях, возможно, протекающих в конденсированной фазе и не сопровождающихся газовыделением. Кроме того, осуществление процесса в массе (в расплаве) не исключает вклада в наблюдаемую кинетику диффузионных процессов. Наконец, в открытой системе низкий кинетический порядок может быть связан с ее негомогенностью и существенным вкладом в общую кинетику процесса испарения фазы продукта.
Исследование кинетики термического разложения конденсированных веществ с использованием термовесового и манометрического методов приводит, как правило, к сходным результатам, поскольку в обоих случаях регистрируется выделение одних и тех же газообразных продуктов. Однако, как видно из рис. 2 и 3, в нашем случае картина совершенно другая. Сопоставление данных этих рисунков показывает, что в открытой и замкнутой реакционных системах (соответственно, термовесовые и манометрические измерения) при одной и той же температуре процессы разложения соединения I происходят с близкими скоростями, но формы кинетических кривых совершенно различны: в открытой системе потеря массы происходит с монотонно уменьшающейся скоростью, тогда как в замкнутой системе наблюдается ярко выраженное самоускорение.
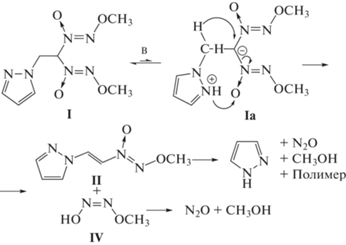
Полученный результат несомненно свидетельствует о том, что газообразные продукты реакции (сохраняющиеся в замкнутой системе, но удаляемые из открытой системы) оказывают ускоряющее (автокаталитическое) влияние на протекание реакции. Поскольку одним из продуктов термического разложения соединения I возможно является пиразол, распределенный в замкнутой реакционной системе между газовой и жидкой фазой и представляющий собой слабое основание, можно предположить, что упомянутый автокатализ имеет основную природу. Механизм такой основно-каталитической реакции можно представить следующей схемой (основание обозначено через В):
На схеме приведен один из возможных вариантов механизма реакции, когда основным катализатором служит пиразольный цикл той же молекулы с промежуточным образованием цвитер-ионного интермедиата Ia. В других вариантах основным катализатором может выступать как другая молекула I, так и пиразол – один из продуктов разложения.
Уместно отметить, что приведенный здесь механизм отличается от механизмов щелочного гидролиза алкокси-NNO-азоксисоединений без β-водородных атомов [14] и по существу аналогичен механизму реакции 1,1-бис(алкокси-NNO-азокси)-2-арилэтанов с KOH в диметилсульфоксиде (ДМСО) с образованием 1-(алкокси-NNO-азокси)-2-арилэтенов – конечной стадии однореакторного метода синтеза последних [15, 16]. Подобный механизм, по-видимому, реализуется и при разложении 1,1-бис(алкокси-NNO-азокси)этана – побочной реакции при синтезе последнего метилированием бис(алкокси-NNO-азокси)метана в условиях межфазного катализа [17].
Вполне возможно, что пиразол – не единственное основание, присутствующее в реакционной системе (заметим, что соединение I тоже обладает основными свойствами). Поэтому основно-каталитический процесс, фигурирующий в представленной схеме, в определенной степени может реализоваться и в термовесовых экспериментах, тем более, что этому есть еще одно подтверждение. В работах [2, 3] исследовалось термическое разложение веществ, структурно подобных соединению I, с тем лишь отличием, что в этих веществах пиразольный цикл содержал в качестве заместителей нитрогруппы. Даже одна нитрогруппа снижает основность пиразола на несколько порядков и тем самым практически обнуляет его каталитическую активность. Так и произошло в действительности: сравнение кинетических данных, полученных в настоящей работе, с результатами работ [2, 3] показало, что соединение I разлагается несколько быстрее, чем его аналоги, содержащие нитропиразольные группы.
Выше говорилось о том, что при термическом разложении соединения I образуется 4.1 моля газообразных продуктов в расчете на моль исходного вещества. Поскольку некоторая часть этих продуктов (в частности, пиразол) может находиться также и в конденсированной фазе (в растворенном или в связанном с полимерным остатком состоянии), то полученный результат хорошо согласуется с приведенными выше реакционными схемами, согласно которым из одного моля исходного вещества должно выделяться пять молей газообразных продуктов (по 2 моля N2O и СН3ОН и 1 моль пиразола).
Как отмечено выше, в замкнутой реакционной системе термическое разложение соединения I описывается уравнением автокатализа. Несколько удивительно то, что в нашем случае это уравнение имеет второй порядок по автокатализатору. По-видимому, это связано с тем, что по ходу реакции объем жидкой фазы сильно уменьшается (при термовесовых измерениях было показано, что в ходе разложения в газовую фазу переходит ~90% вещества). Уменьшение объема приводит к повышению концентрации автокатализатора. Таким образом, ускоряющее влияние пиразола обусловлено не только его каталитическим действием, но и увеличением его концентрации. Подобные эффекты должны приводить к увеличению порядка реакции по автокатализатору [18].
Работа выполнена по теме госзадания ИПХФ РАН (регистрационный номер AAAA-A19-119101690058-9) и по теме государственного задания ФИЦ химической физики им. Н.Н. Семёнова РАН 0082-2019-0006 (регистрационный номер АААА-А21-121011990037-8).
Список литературы
Захаров В.В., Чуканов Н.В., Зюзин И.Н., Неделько В.В., Корсунский Б.Л. // Хим. физика. 2019. Т. 38. № 2. С. 3;https://doi.org/10.1134/S0207401X19020146
Корсунский Б.Л., Захаров В.В., Ларикова Т.С., Зюзин И.Н., Чуканов Н.В., Неделько В.В. // Хим. физика. 2022. Т. 41. № 7. С. 32;https://doi.org/10.31857/S0207401X22070081
Захаров В.В., Корсунский Б.Л., Ларикова Т.С., Зюзин И.Н., Чуканов Н.В. // Хим. физика. 2022. Т. 41. № 9. С. 3;https://doi.org/10.31857/S0207401X22090126
Гудкова И.Ю., Зюзин И.Н., Лемперт Д.Б. // Хим. физика. 2020. Т. 39. № 3. С. 53; https://doi.org/10.31857/S0207401X20030061
Зюзин И.Н., Гудкова И.Ю., Лемперт Д.Б. // Хим. физика. 2020. Т. 39. № 9. С. 52; https://doi.org/10.31857/S0207401X20090149
Perez J.D., Yranzo G.I. // Bull. Soc. Chim. Fr. 1985. № 3. P. 473.
Da Silva G. // Chem. Phys. Lett. 2009. V. 474. № 1. P. 13.
Зюзин И.Н., Лемперт Д.Б., Нечипоренко Г.Н. // Изв. АН СССР. Сер. хим. 1988. № 7. С. 1506.
Zyuzin I., Lempert D., Prokudin V., Kirpichev E., Manelis G. // Proc. 36th Intern. Annu. Conf. ICT. Karlsruhe (Germany). 2005. P. 162.
Зюзин И.Н., Супоницкий К.Ю., Далингер И.Л. // Химия гетероцикл. соединений. 2017. Т. 53. № 6/7. С. 702.
Гальперин Л.Н., Колесов Ю.Р., Зеленов Н.А. // Измер. техника. 1981. № 4. С. 23.
Зюзин И.Н. // Журн. прикл. химии. 2009. Т. 82. № 10. С. 1677.
Грачев В.П., Зюзин И.Н., Курмаз С.В и др. // Изв. РАН. Сер. хим. 2020. № 12. С. 2312.
Зюзин И.Н., Лемперт Д.Б. // Журн. общ. химии. 2010. Т. 80. № 9. С. 1473.
Зюзин И.Н. // Изв. АН. Сер. хим. 1998. № 6. С. 1263.
Зюзин И.Н. // Журн. орган. химии. 2013. Т. 49. № 5. С. 697.
Зюзин И.Н. // Журн. орган. химии. 2013. Т. 49. № 4. С. 552.
Дубовицкий Ф.И., Манелис Г.Б., Мержанов А.Г. // ДАН СССР. 1958. Т. 121. № 4. С. 668.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика