Химическая физика, 2022, T. 41, № 12, стр. 22-25
Окисление кислородом двойной системы эпоксид стирола – п-толуолсульфокислота в растворе изопропанола
Л. В. Петров 1, *, В. М. Соляников 1
1 Институт проблем химической физики Российской академии наук
Черноголовка, Россия
* E-mail: plv@icp.ac.ru
Поступила в редакцию 06.12.2021
После доработки 15.04.2022
Принята к публикации 20.04.2022
- EDN: IMCIZV
- DOI: 10.31857/S0207401X22090084
Аннотация
Двойная система эпоксид стирола – п-толуолсульфокислота, окисляясь в растворе изопропилового спирта, инициирует его радикально-цепное окисление (РЦО). Для корректного измерения поглощения кислорода собственно двойной системой РЦО блокировали путем введения малых (~10–5 моль/л) концентраций ацетата Cu2+ – катализатора обрыва цепей окисления растворителя. Скорость окисления, измеренная с использованием этого приема, выражается как V = k [ЭС]0 [ТСК]1 при [ЭС] $ \gg $ [ТСК], где ЭС – эпоксид стирола, ТСК – п-толуолсульфокислота. Аррениусовская форма эффективной константы скорости имеет вид k [c–1] = 5.2 ∙ 1010exp(–85.0 кДж · моль–1/RT) при 333–348 K.
ВВЕДЕНИЕ
Поглощение кислорода двойной системой (ДС) эпоксид стирола (ЭС) – п-толуолсульфокислота (ТСК) впервые обнаружено в растворе изопропилового спирта (ИПС) [1], легко окисляющегося по радикально-цепному механизму. Позже установлено, что эта система гораздо медленнее, но поглощает кислород в инертном к окислению растворителе БУХ (90 об.% трет-бутанола, 10 об.% хлорбензола) [2]. С увеличением [ИПС] в смеси ИПС с БУХ от нуля до 10 моль/л поглощение кислорода возрастает на порядок [3]. В предположении, что возрастание это обусловлено исключительно радикально-цепным окислением (РЦО) ИПС при инициировании цепей двойной системой ЭС–ТСК, а окисление самой ДС в растворе ИПС пренебрежимо мало и по скорости близко к окислению в растворе БУХ, была изучена кинетика поглощения кислорода смесями ИПС с БУХ в присутствии ДСЭС–ТСК и рассчитаны скорости инициирования. Однако недавно получены данные, указывающие на сильную зависимость реакционноспособности ДСЭС–ТСК от природы спиртового растворителя. Поэтому целью этой работы было получение количественной характеристики окисляемости собственно системы ЭС–ТСК в среде ИПС. Задача эта непростая: из количественной характеристики брутто-окисления ДСЭС–ТСК в ИПС требовалось каким-то способом извлечь оценку вклада в брутто-окисление поглощения кислорода системой ЭС–ТСК, т.е. возникла необходимость полного подавления составляющей РЦО. Перспективным путем решения представлялось подавление радикально-цепного окисления ИПС посредством введения соответствующего ингибитора. Однако традиционные ингибиторы окисления – ароматические фенолы и амины в данном случае непригодны, так как малоэффективны в спиртовых средах [4–6]. Кроме того, в спиртовых растворах систем эпоксид – (ТСК или Cu2+) в присутствии ароматических фенолов или аминов поглощение кислорода заметно ускоряется [7–12]. Задача решена с применением растворимого медного катализатора обрыва цепей окисления вторичных спиртов [13]. Выбранный для работы катализатор – ацетат двухвалентной меди Cu(CH3COO)2∙H2O (Cu(Ac)2) обладал необходимой высокой активностью обрыва цепей окисления ИПС и сохранял ее в присутствии кислоты.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Скорости поглощения кислорода измеряли по стандартной методике на манометрической установке при постоянном давлении. Независимость скорости от режима перемешивания (от частоты встряхивания кварцевого реактора) проверяли на опыте. Кривые поглощения кислорода (фактически прямые на рис. 1) идут не из начала координат, так как отсчет времени опыта вели с момента погружения реактора в термостатирующую жидкость. Изопропанол марки “Ч” ректифицировали для очистки; катализатор обрыва цепи окисления, соль Cu(CH3COO)2∙H2O, реактив марки “ХЧ” использовали без предварительной обработки. Эпоксид стирола очищали двукратной вакуумной ректификацией.
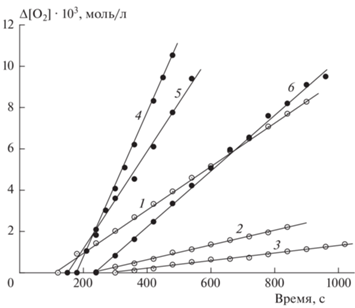
Рис. 1.
Примеры кинетических кривых поглощения кислорода при 343 K: изопропанолом в присутствии 0.03 моль/л азобисизобутиронитрила при [Cu(Ac)2] = 0.0 (1), 1.0 ∙ 10–6 (2), 2.7 ∙ 10–6 моль/л (3); раствором двойной системы ЭС–ТСК в изопропаноле при [ЭС] = 0.35 моль/л и [ТСК] = 3.8 ∙ 10–3 (4), 2.4 ∙ 10–3 (5) и 1.3 ∙ 10–3 моль/л (6).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
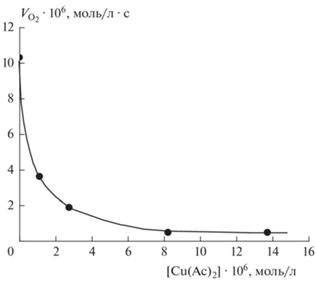
На рис. 1 представлены примеры кинетических кривых поглощения кислорода при инициированном радикально-цепном окислении ИПС (кривые 1–3) и при окислении двойной системы ЭС–ТСК (4–6) в растворе ИПС. На рис. 2 представлена зависимость скорости инициированного азобисизобутиронитрилом (АИБН) окисления ИПС от концентрации вводимого катализатора обрыва цепей Cu(Ac)2. Ингибирование окисления ацетатом меди весьма эффективно: при введении 8 ∙ 10–6 моль/л Cu(Ac)2 скорость инициированного окисления падает в ~20 раз. Именно высокая эффективность медной соли в подавлении радикально-цепной реакции окисления вторичного спирта обусловила выбор применения Cu(Ac)2 в качестве инструмента для определения величины вклада нерадикальной составляющей в брутто-скорости поглощения кислорода, т.е. вклада собственно окисления ДСЭС–ТСК.
Рис. 2.
Зависимость скорости окисления изопропанола, инициированного азобисизобутиронитрилом, от [Cu(Ac)2] при [АИБН] = 0.03 моль/л и 343 K.
Кривая 1 на рис. 3 представляет зависимость брутто-скорости поглощения кислорода при окислении ДСЭС–ТСК в растворе ИПС. Три экспериментальные точки этой кривой отмечены на оси ординат и являются исходными точками зависимостей 2–4 скоростей окисления от [Cu(Ac)2]. Зависимость величин предельно низких скоростей для кривых 2–4 рис. 3 (при 1 ∙ 10–5 < < Cu(Ac)2 < 2 ∙ 10–5 моль/л) от [ТСК], значения которых отложены на прямой 5, есть искомая величина скорости окисления собственно ДСЭС–ТСК в среде ИПС как функция [ТСК]. Скорость этого окисления пропорциональна [ТСК]. Техника получения зависимости V = f [ЭС] (рис. 4) проще, чем зависимости 5 рис. 3. Ввиду того, что данные рис. 2 и 3 убедили нас в надежности купирования вклада радикально-цепного окисления ИПС, последующие опыты окисления просто проводили в растворе ИПС, содержащем Cu(Ac)2 в блокирующей концентрации 1.35 ∙ 10–5 моль/л.
Рис. 3.
Зависимости, полученные в изопропаноле при [ЭС] = 0.35 моль/л и 343 K: брутто-скорости поглощения кислорода раствором ДСЭС–ТСК от [ТСК] (1); брутто-скорости окисления растворов ДСЭС–ТСК от [Cu(Ac)2] при [ТСК] = 3.8 ∙ 10–3 (2), 2.56 ∙ 10–3 (3), 1.28 ∙ 10–3 моль/л (4); 5 – скорости окисления ДСЭС–ТСК от [ТСК].
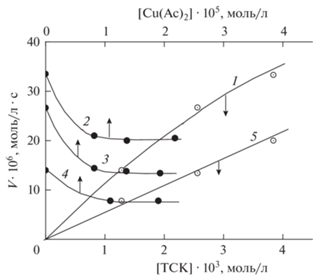
Рис. 4.
Зависимости скорости окисления ДСЭС–ТСК в изопропаноле при 343 K, [ТСК] = 2.56 ∙ 10–3, [Cu(Ac)2] = 1.35 ∙ 10–5 моль/л от [ЭС] (1) и логарифма скорости от температуры (2) при [ЭС] = 0.522 моль/л.
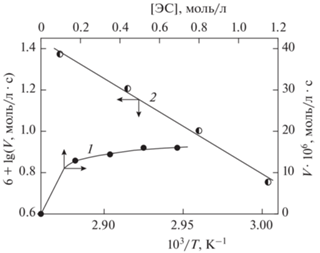
Кривая 1 на рис. 4 при [ЭС] $ \gg $ [ТСК] отвечает нулевому порядку реакции окисления ДСЭС–ТСК в среде ИПС по концентрации эпоксида: V = = k [ЭС]0 [ТСК]1. Эффективная псевдомономолекулярная константа скорости окисления ДСЭС–ТСК в изопропаноле, рассчитанная по тангенсу угла наклона прямой 5 рис. 3, равна k = = 5.2 ∙ 10–3 с–1, или в аррениусовской форме k = = 5.2 ∙ 1010exp(–85.0 кДж · моль–1/RT); энергия активации рассчитана из данных кривой 2 рис. 4.
При сопоставлении результатов этой работы с данными по окислению ДСЭС–ТСК в растворителе БУХ [2] обнаруживается явное сходство объектов изучения. Близки величины энергий активации в растворах ИПС и БУХ: 85.0 и 83.6 кДж/моль соответственно. Одинаковы выражения скоростей окисления в двух средах через концентрации реагентов, эпоксида и кислоты: V = k [ЭС]0 [ТСК]1. Однако при сравнении величин k в двух растворителях: kИПС = 5.2 ∙ 10–3 с–1 и kБУХ = 5.8 ∙ 10–4 с–1 [2], обнаруживается разница: ДСЭС–ТСК окисляется в растворе ИПС почти на порядок быстрей, чем в растворе БУХ. Обнаруженный факт добавляет вопросов при изучении конкуренции гетеро- и гомолитических маршрутов превращения ЭС, катализированного кислотами.
Ранее мы отмечали высокую чувствительность и избирательность реакций окисления двойных систем ЭС–кислота в отношении природы кислот-катализаторов: 1 : 0.05 : 0.0013 – соотношение величин каталитической активности в процессе окисления эпоксида стирола для хлорной, серной и п-толуолсерной кислот в среде нивелирующего спиртового растворителя БУХ [14]. Сравнение величин kИПС и kБУХ наводит на мысль, что полярный спиртовый растворитель, вероятно, является не просто средой окисления ДСЭС–ТСК, но участником реакции. Причем объяснение соотношения kИПС > kБУХ возможным участием в окислении слабой вторичной связи C–H изопропанола не подходит в свете результатов опытов с метанолом (см. ниже).
В смешанном растворителе ИПС с содержанием метанола 10 и 20 об.% при [ЭС] = 0.35, [ТСК] = = 3.8 ∙ 10–3, [Cu(Ac)2] = 1.37 ∙ 10–5 моль/л провели два опыта по окислению ДСЭС–ТСК. При 10%‑ном содержании метанола в растворе V = = 40.0 ∙ 10–6 моль/л · с, что ровно вдвое выше скорости окисления в растворе ИПС. При 20%-ном содержании метанола скорость еще выше: V = 46.0 ∙ 10–6 моль/л · с. Показательно, что эффективнее действует метанол именно в малых концентрациях, что явно указывает на его участие в окислении не как среды, а как реагента. Существенно, что слабых связей C–H в метаноле нет, а окисление в его присутствии ускоряется.
ЗАКЛЮЧЕНИЕ
С использованием нового экспериментального приема: введения катализатора обрыва цепи окисления вторичного спирта, изучена кинетика окисления ДСЭС–ТСК в растворе изопропанола. Впервые показано, что природа спирта-растворителя сильно влияет на скорость окисления и сделано предположение о возможной связи эффекта ускорения окисления с участием спиртов в качестве реагентов. В целом, работа показала необходимость широкого поиска в области изучения влияния природы растворителей на окисление двойных систем ЭС–кислота.
Работа выполнена по теме госзадания (регистрационный номер АААА–А19–119071890015–6).
Список литературы
Петров Л.В., Соляников В.М. // ДАН. 1995. Т. 345. № 2. С. 203.
Петров Л.В., Соляников В.М. // ДАН. 1996. Т. 350. № 3. С. 357.
Петров Л.В., Соляников В.М. // Нефтехимия. 1998. Т. 38. № 2. С. 128.
Эмануэль Н.М., Заиков Г.Е., Майзус З.К. Роль среды в радикально-цепных реакциях окисления органических соединений. М.: Наука, 1973. С. 209.
Денисов Е.Т., Азатян В.В. Ингибирование цепных реакций. Черноголовка: РАН, 1997. С. 96.
Русина И.Ф., Вепринцев Т.Л., Васильев Р.Ф. // Хим. физика. 2022. Т. 41. № 2. С. 12; https://doi.org/10.31857/S0207401X22020108
Петров Л.В., Соляников В.М. // Хим. физика. 2016. Т. 35. № 10. С. 21; https://doi.org/10.7868/S0207401X16100095
Петров Л.В., Соляников В.М. // Нефтехимия. 2017. Т. 57. № 4. С. 474; https://doi.org/10.7868/S0028242117040116
Петров Л.В., Соляников В.М. // Хим. физика. 2018. Т. 37. № 12. С. 28; https://doi.org/10.1134/S0207401X18120075
Петров Л.В., Соляников В.М. // Хим. физика. 2020. Т. 39. № 1. С. 19; https://doi.org/10.31857/S0207401X20010112
Петров Л.В., Соляников В.М. // Хим. физика. 2021. Т. 40. № 7. С. 11; https://doi.org/10.31857/S0207401X21070086
Петров Л.В., Соляников В.М. // Хим. физика. 2021. Т. 40. № 11. С. 9; https://doi.org/10.31857/S0207401X21110078
Денисов Е.Т. // Итоги науки и техники. Сер. “Кинетика и катализ”. М.: ВИНИТИ, 1987. Т. 17. С. 20.
Петров Л.В., Соляников В.М. // Нефтехимия. 2011. Т. 51. № 6. С. 467.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


