Химическая физика, 2021, T. 40, № 9, стр. 57-63
Роль перекисного окисления липидов в оценке последствий воздействия химических токсикантов на биообъекты
Л. Н. Шишкина 1, *, М. В. Козлов 1, А. Ю. Повх 1, В. О. Швыдкий 1
1 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
* E-mail: shishkina@sky.chph.ras.ru
Поступила в редакцию 12.11.2020
После доработки 23.12.2020
Принята к публикации 20.01.2021
Аннотация
Изучено воздействие химических токсикантов разных групп (поверхностно-активное вещество, ацетон, тиофосфат натрия, отходы целлюлозно-бумажного производства) на состояние процессов перекисного окисления липидов (ПОЛ) в модельной системе (спонтанное низкотемпературное окисление лецитина в полярной среде) и на организм лабораторных мышей. Анализ состояния окислительных процессов в модельной системе и в печени мышей показал, что в системах разной сложности химические токсиканты оказывают воздействие на состояние липидного компонента мембран в зависимости от начальной интенсивность ПОЛ. Воздействие токсикантов на биообъекты вызывает нарушения регуляции ПОЛ независимо от их природы и способа поступления в организм и является основной причиной их токсичности.
Рост антропогенной нагрузки на биоту вызывает необходимость детального изучения механизма ее воздействия на различные системы, чтобы адекватно оценить последствия влияния неблагоприятных экологических факторов разной природы на биологические объекты. Однако прогнозирование последствий действия таких факторов затруднено прежде всего из-за отсутствия выраженных эффектов на уровне организма при повреждающих воздействиях токсикантов в фоновых концентрациях. Способность химических токсикантов перемещаться на значительные расстояния от очагов загрязнения обусловливает необходимость анализа механизма их совместного действия в малых дозах на биологические объекты разной степени сложности. Оценка последствий воздействия неблагоприятных экологических факторов на организм и первичный отбор наиболее перспективных соединений, способных минимизировать эти последствия, требуют разработки модельных систем и поиска адекватных информативных тестов [1].
Важность свободнорадикальных реакций, протекающих в разных компартментах клетки, в регуляции клеточного метаболизма в норме в настоящее время является общепризнанной [2–5]. Перекисное окисление липидов (ПОЛ) в эволюционном плане является одной из наиболее ранних регуляторных систем защиты организма от действия повреждающих факторов [6]. На основании этого предложена физико-химическая система регуляции ПОЛ, поддерживающая его стационарность в норме, в качестве основы экологического мониторинга [7].
Интенсификация ПОЛ активными формами кислорода, т.е. свободными гидроксильными и кислородсодержащими радикалами и органическими и неорганическими пероксидами, рассматривается как основная причина развития окислительного стресса в организме [8]. Последний играет важную роль медиатора поражения липидов, белков и ДНК [9, 10]. Предполагается, что способность химических токсикантов индуцировать окислительный стресс и влиять на регуляцию процессов ПОЛ при поступлении в организм обуславливает формирование биологических последствий их воздействия [11–14].
Цель данной работы заключалась в оценке состояния процессов ПОЛ в печени мышей при совместном действии химических токсикантов разных групп в малых дозах и изучении возможности использования спонтанного окисления лецитина для первичной оценки токсичности соединений.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве моделей химических токсикантов разной степени токсичности использованы следующие соединения: тиофосфат натрия, поверхностно-активное вещество (ПАВ) Твин-80, ацетон и черный щелок (отходы целлюлозно-бумажного производства). Субстратом окисления в модельной системе служил лецитин-стандарт (предприятие “БИОЛЕК”, Харьков, Украина), который использовали без дополнительной очистки после вскрытия ампулы и отгонки исходного 10%-ного водно-этанольного раствора.
Исходные растворы тиофосфата натрия готовили непосредственно перед экспериментом, используя реагент марки “ОСЧ” компании Sigma-Aldrich и трижды дистиллированную воду. При проведении экспериментов по спонтанному окислению лецитина проводили отгонку исходного растворителя и готовили раствор лецитина в дистиллированной воде в диапазоне концентраций от 27.1 до 30.2 мкг/мл (3.9 ⋅ 10–5–4.3 ⋅ 10–5 моль/л). Температура окисления равна 20 °С. За ходом окисления следили по образованию вторичных продуктов окисления, реагирующих с 2-тиобарбитуровой кислотой (ТБК-активные продукты (ТБК-АП)), содержание которых определяли на спектрофотометре ПЭ-5400ВИ (Россия) при длине волны 532 нм по методу, описанному в работе [15], и относили к 1 мг лецитина в пробе.
Спектрофотометрические измерения растворов тиофосфата натрия, лецитина и их смеси проводили в кварцевых кюветах толщиной 1 см с использованием спектрофотометра “Shimadzu UV-1700 PharmaSpec” (Япония). Полученные дифференциальные УФ-спектры подвергали математической обработке по методу Гаусса в программе Excel solver путем минимизации суммы квадратов разности между экспериментальным и расчетным спектрами, соблюдая следующие условия: совпадение контура исходного спектра с расчетным после аппроксимации на уровне 1 ⋅ 10–3–1 ⋅ 10–5. Количество функций Гаусса при аппроксимации зависело от вида спектра.
Раствор Твина-80 (Ferak Berlin, Германия) с концентрацией 0.3% в 10%-ном водном ацетоне марки “ОСЧ” готовили непосредственно перед экспериментом и вводили мышам линии Balb/c (самцы массой 16–20 г) внутрибрюшинно по 0.2 мл на каждые 20 г массы мыши. Забой опытных животных (пять особей) осуществляли спустя 1 мес после начала эксперимента одновременно с контрольной группой (пять особей), т.е. с группой интактных мышей линии Balb/c из той же партии, не подвергавшихся воздействию.
Влияние присутствия в питьевой воде производственного токсиканта (черного щелока) на состав фосфолипидов (ФЛ) печени животных изучали на мышах SHK (самки) массой 19.5–24.5 г. Сорок особей были разделены на четыре группы. Мышам групп I, II и III ежедневно вместо питьевой (водопроводной) воды давали свежеприготовленный раствор черного щелока в концентрациях 0.005%, 0.015% и 0.05% соответственно. Мыши группы IV из той же партии получали водопроводную воду и служили контролем. Забой опытных и контрольных мышей декапитацией проводили одновременно спустя 32 сут после начала эксперимента.
В экспериментах с животными печень сразу после забоя с 9 до 10 ч утра (чтобы исключить суточные колебания параметров) помещали в бюксы, охлаждаемые льдом. Содержание ТБК-АП в гомогенате печени относили к 1 мг белка в пробе, анализ которого осуществляли по методу [16].
Липиды из печени мышей и 10%-ного водно-этанольного раствора лецитина выделяли по методу Блая и Дайера в модификации Кейтса [17]. Качественный и количественный состав ФЛ лецитина и печени мышей определяли методом тонкослойной хроматографии, используя силикагель типа G или H компании Sigma-Aldrich (США), стеклянные пластинки размером 9 × 12 см, а в качестве подвижной фазы – смесь растворителей хлороформ – метанол – ледяная уксусная кислота – дистиллированная вода в соотношениях 12.5 : 7.5 : 2 : 1. Проявление хроматограмм осуществляли в парах йода. Для каждой пробы анализировали не менее четырех-пяти хроматографических дорожек.
Количественный анализ фракций ФЛ по образованию фосфорно-молибденового комплекса в присутствии аскорбиновой кислоты был проведен с использованием спектрофотометра Du-50 фирмы “Beckman” (США) при длине волны 810 нм, фотометра КФК-3 при 800 нм или спектрофотометра ПЭ-5400ВИ (группа компаний “ЭКРОС”, Россия) при 815 нм. Методические подробности анализа состава липидов представлены в работе [18].
Помимо количественного содержания отдельных фракций ФЛ, оценивали также обобщенные показатели состава липидов: доля ФЛ (%) в составе общих липидов; отношение основных фракций ФЛ в клетках млекопитающих фосфатидилхолин/фосфатидилэтаноламин (ФХ/ФЭ) и отношение сумм долей (в %) более легкоокисляемых и более трудноокисляемых фракций ФЛ (∑ЛОФЛ/∑ТОФЛ). Последнее отношение вычисляли по следующей формуле: ∑ЛОФЛ/∑ТОФЛ = (ФИ + ФС + ФЭ + + КЛ + ФК)/(ЛФХ + СМ + ФХ), где ФИ – фосфатидилинозит, ФС – фосфатидилсерин, КЛ – кардиолипин, ФК – фосфатидная кислота, ЛФХ – лизоформы фосфолипидов, СМ – сфингомиелин (в препаратах лецитина, выделенного из растительного объекта, это сфинголипиды).
Все исследованные показатели в экспериментах на животных определяли для каждой особи индивидуально. Содержание ТБК-активных продуктов в гомогенатах печени и растворах липидов, как и концентрацию белка в пробах, определяли как среднее значение из трех независимых измерений для каждой точки. Экспериментальные данные обрабатывали стандартными статистическими методами, используя программный продукт MS Excel и пакет компьютерных программ KINS [19]. Для оценки результатов статистического анализа использовали стандартные параметры: R – коэффициент корреляции, b – коэффициент линейной регрессии, p – уровень достоверности различий, который оценивали по t-критерию Стьюдента. В приведенных ниже табл. 1–4 данные представлены в виде средних арифметических значений с указанием их средних квадратичных ошибок (M ± m).
Таблица 1.
Содержание ТБК-АП продуктов в печени мышей в группах возрастного контроля и спустя месяц после воздействий
| Варианты экспериментов | [ТБК-АП], нмоль/мг белка |
|---|---|
| Мыши линии Balb/c, возрастной контроль | 0.115 ± 0.010 (n = 5) |
| Мыши линии Balb/c, 30 сут после введения 0.3%-ного раствора Твин-80 в 10%-ном водном растворе ацетона | 0.0985 ± 0.0125 (n = 5) |
| Мыши SHK, возрастной контроль | 0.080 ± 0.008 (n = 10) |
| Мыши SHK, 32 сут после начала опыта, [Черный щелок] = 0.005%, группа I | 0.078 ± 0.014 (n = 10) |
| Мыши SHK, 32 сут после начала опыта, [Черный щелок] = 0.015%, группа II | 0.109 ± 0.015 (n = 10) |
| Мыши SHK, 32 сут после начала опыта, [Черный щелок] = 0.05%, группа III | 0.076 ± 0.010 (n = 10) |
Таблица 2.
Коэффициенты корреляции (R) и линейной регрессии (b) взаимосвязи между соотношением сумм более легкоокисляемых и более трудноокисляемых фракций фосфолипидов (∑ЛОФЛ/∑ТОФЛ) и отношением фосфатидилхолин/фосфатидилэтаноламин (ФХ/ФЭ) в группах возрастного контроля и спустя месяц после воздействий
| Варианты экспериментов | R | b |
|---|---|---|
| Мыши линии Balb/c, возрастной контроль | −0.87 ± 0.11 (n = 5) | 0.324 ± 0.075 |
| Мыши линии Balb/c, 30 сут после введения 0.3%-ного раствора Твин-80 в 10%-ном водном растворе ацетона | −0.998 ± 0.002 (n = 5) | 0.864 ± 0.025 |
| Мыши SHK, возрастной контроль | −0.92 ± 0.06 (n = 10) | 0.433 ± 0.063 |
| Мыши SHK, 32 сут после начала опыта, [Черный щелок] = 0.005%, группа I | −0.25 (n = 10) | |
| Мыши SHK, 32 сут после начала опыта, [Черный щелок] = 0.015%, группа II | −0.95 ± 0.04 (n = 10) | 0.127 ± 0.015 |
| Мыши SHK, 32 сут после начала опыта, [Черный щелок] = 0.05%, группа III | −0.70 ± 0.21 (n = 10) | 0.201 ± 0.073 |
Таблица 3.
Состав фосфолипидов (ФЛ) использованных в работе партий лецитина
| ФЛ | Содержание (P, %) | |||
|---|---|---|---|---|
| партия 1 | партия 2 | партия 3 | партия 4 | |
| Лизоформы фосфолипидов | 1.80 ± 0.38 | 3.26 ± 0.29 | 2.49 ± 0.13 | 3.66 ± 0.04 |
| Сфинголипиды | 4.44 ± 0.55 | 2.44 ± 0.12 | 2.66 ± 0.16 | 4.47 ± 0.36 |
| Фосфатидилхолин | 85.60 ± 1.35 | 87.25 ± 1.05 | 83.65 ± 0.65 | 80.90 ± 0.85 |
| Фосфатидилинозит + фосфатидилсерин | 1.90 ± 0.14 | 1.91 ± 0.47 | 1.79 ±0.36 | 4.36 ± 0.07 |
| Фосфатидилэтаноламин | 3.41 ± 0.40 | 3.57 ± 0.63 | 6.28 ± 0.57 | 3.90 ± 0.36 |
| Кардиолипин + фосфатидная кислота | 2.78 ± 0.33 | 1.57 ± 0.12 | 3.15 ± 0.34 | 2.72 ± 0.06 |
Таблица 4.
Обобщенные показатели состава липидов разных партий лецитина
| Номер партии | Доля фосфолипидов в составе общих липидов, % | ∑ЛОФЛ/∑ТОФЛ |
|---|---|---|
| 1 | 40.0 ± 3.8 (n = 8) |
0.088 ± 0.005 (n = 5) |
| 2 | 47.1 ± 3.0 (n = 8) |
0.076 ± 0.006 (n = 5) |
| 3 | 58.9 ± 4.1 (n = 7) |
0.126 ± 0.007 (n = 5) |
| 4 | 64.1 ± 2.7 (n = 9) |
0.123 ± 0.003 (n = 5) |
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Первый этап работы заключался в оценке состояния процессов ПОЛ в печени мышей разных линий при поступлении в их организм химических соединений разной степени токсичности. Выбор печени в качестве объекта исследования обусловлен тем, что именно она является одним из основных органов не только биосинтеза и деградации ФЛ, но и биотрансформации поступающих в организм ксенобиотиков. Концентрация Твина-80, используемого в медицинской практике в качестве солюбилизатора, была в 36 раз ниже его предельно рекомендуемой дозы при нейропсихофармакологических исследованиях [20]. Концентрация ацетона была в 100 раз ниже ПДК. Концентрация черного щелока в питьевой воде мышей соответствовала диапазону его содержания в стоках целлюлозно-бумажных производств [11, 21].
Печень лабораторных животных характеризуется самой низкой интенсивностью процессов ПОЛ, которую в сложных биологических системах обычно оценивают по содержанию ТБК-АП в гомогенате ткани, а липиды печени обладают наиболее высоким уровнем антиокислительной активности [22]. Последствия повреждающих воздействий на организм зависят от исходных величин параметров физико-химической системы регуляции ПОЛ в тканях. Это обусловило необходимость определения содержания ТБК-АП в печени интактных мышей линии Balb/c (самцы) и SHK (самки), с которыми проводили эксперименты (табл. 1). Как следует из представленных данных, интенсивность процессов ПОЛ в печени мышей линии Balb/c достоверно выше, чем аналогичный показатель в группе контрольных мышей SHK (p < 0.05). Это соответствует представлениям о более высокой чувствительности мышей линии Balb/c к повреждающим воздействиям по сравнению с беспородными мышами SHK. В печени мышей из опытных групп во всех вариантах экспериментов содержание ТБК-АП достоверно не отличается от аналогичной величины у мышей соответствующих групп контроля (табл. 1) вследствие роста в ряде случаев вариабельности показателя у особей после воздействий.
Однако отсутствие достоверных различий величин среднегрупповых показателей интенсивности ПОЛ не может рассматриваться как нормализация регуляции окислительных процессов в печени опытных животных. Во-первых, чувствительность и способность к нормализации разных показателей системы регуляции ПОЛ неодинакова. Действительно, способность липидов печени мышей линии Balb/c к окислению спустя 1 мес после введения Твина-80 и ацетона, т.е. величина отношения ∑ЛОФЛ/∑ТОФЛ [18], достоверно (p < < 0.05) ниже, чем в группе контрольных животных: 0.842 ± 0.043 и 0.975 ± 0.034 соответственно [23]. Во-вторых, повреждающие воздействия вызывают нарушения регуляторных взаимосвязей между тесно скоординированными в норме показателями системы регуляции ПОЛ [13, 14, 23].
Ранее было выявлено, что в регуляции биохимических процессов в печени мышей важную роль играет взаимосвязь между способностью липидов к окислению и структурным состоянием ее мембранной системы, которое определяется отношением основных фракций ФЛ печени ФХ/ФЭ [13, 18, 23]. В липидах печени мышей контрольных групп в обоих вариантах экспериментов обнаружены обратные корреляционные взаимосвязи между данными параметрами, величина b для которой в печени мышей линии Balb/c несколько меньше, чем аналогичное значение у контрольной группы мышей SHK (табл. 2). У мышей опытных групп взаимосвязь между структурным состоянием мембранной системы печени и способностью ее липидов к окислению либо имеет достоверно отличную от соответствующей контрольной группы величину коэффициента b, либо отсутствует (табл. 2) независимо от способа поступления токсикантов в организм и степени их токсичности. Так, спустя месяц после внутрибрюшинного введения 0.3%-ного раствора Твина-80 в 10%-ном водном растворе ацетона коэффициент линейной регрессии взаимосвязи между отношениями ∑ЛОФЛ/ ∑ТОФЛ и ФХ/ФЭ у мышей опытной группы в 2.7 раза выше, чем у мышей контрольной группы. Это позволяет сделать вывод о более высокой чувствительности окисляемости липидов печени при воздействии на организм совместного действия ПАВ и ацетона в малых дозах по сравнению с вариабельностью структурного состояния липидного компонента печени у мышей опытной группы. Спустя 32 сут после начала эксперимента обратная корреляция между параметрами ∑ЛОФЛ/∑ТОФЛ и ФХ/ФЭ сохраняется только при наличии в питьевой воде черного щелока в концентрации 0.015%, несколько снижается при концентрации 0.05% и отсутствует при его концентрации 0.005% (табл. 2). Уменьшение коэффициента линейной регрессии данной корреляционной взаимосвязи в 3.4 и 2.15 раза при концентрации черного щелока 0.015% и 0.05%, соответственно, относительно величины в контроле (табл. 2) свидетельствует о большей чувствительности структурного состояния мембранной системы печени к воздействию щелока по сравнению со способностью липидов к окислению.
Однотипность функционирования физико-химической системы регуляции ПОЛ на разных уровнях организации биообъекта [24] позволяет предположить возможность использования различных модельных систем для изучения механизма формирования биологических последствий воздействия повреждающих факторов на организм. Так, в работе [7] было установлено, что масштаб и направленность влияния компонентов водной среды на интенсивность низкотемпературного спонтанного автоокисления лецитина также существенно зависят от степени его окисленности. Способность лецитина образовывать достаточно устойчивые наноразмерные агрегаты в полярной среде позволила рассматривать их в качестве модели биологических мембран и предложить спонтанное низкотемпературное автоокисление лецитина для оценки влияния компонентов среды на процессы ПОЛ в биологических объектах [7].
Важную роль в токсигенизации водной среды играют соединения восстановленной серы [11, 25]. В качестве модельного соединения для изучения его воздействия на интенсивность окислительных процессов был использован обладающий выраженными восстановительными свойствами тиофосфат натрия [26], а в качестве модели – модель низкотемпературного автоокисления лецитина. Поскольку препараты природных ФЛ разных партий различаются по количественному соотношению фракций и содержанию ФЛ в составе общих липидов [27], в табл. 3 и 4 представлены характеристики липидов использованных в работе четырех партий лецитина. Как видно из этих данных, партии лецитина 1 и 2 характеризуются более низкой способностью липидов к окислению, возможно, вследствие низкого содержания ФЛ в составе общих липидов лецитина и более высокой долей трудноокисляемых фракций в составе ФЛ по сравнению с аналогичными значениями параметров в липидах лецитина в партиях 3 и 4. Исходная интенсивность процессов ПОЛ в растворах лецитина также существенно различается у разных партий [7]. Это оказывает влияние на масштаб изменения содержания ТБК-АП после внесения в реакционную среду тиофосфата натрия в концентрации 3.9 ⋅ 10–5 моль/л уже в первые 15–30 мин реакции. Так, в экспериментах с партиями лецитина, характеризующимися более высоким исходным содержанием ТБК-АП (партии 1 и 3; партия 2 лецитина из работы [7]), в присутствии тиофосфата натрия относительное содержание ТБК-АП в смеси уменьшалось от 0.510 ± 0.008 (n = 4) до 0.75 ± 0.04 (n = 3). Однако в случае низкой исходной интенсивности ПОЛ ([ТБК-АП]0 = 1.43 ± 0.01, n = 3) внесение в реакционную среду тиофосфата натрия либо не оказывает влияния на интенсивность ПОЛ (партия 4), либо увеличивает скорость окисления лецитина на 40–50% (партия 2) в зависимости от количественного соотношения фракций ФЛ в препарате (табл. 3).
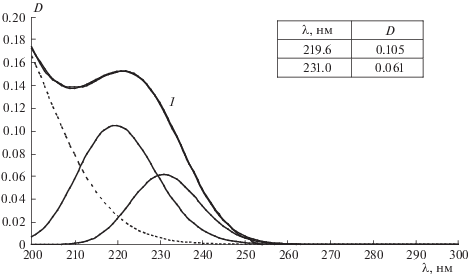
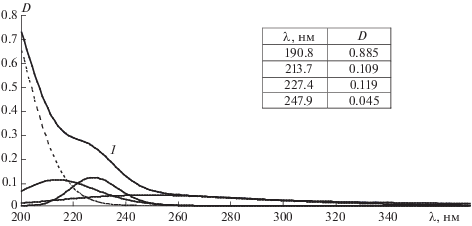
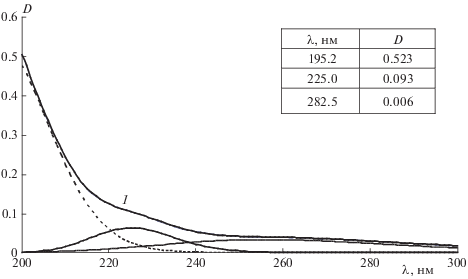
Важную роль в механизме окислительных процессов играет образование комплексов ФЛ с биологически активными веществами (БАВ). Для экспериментального выявления возможности образования комплекса тиофофосфата натрия с лецитином (партия 3) в работе проведена математическая обработка УФ-спектров лецитина, тифофосфата натрия и их смеси по методу Гаусса (рис. 1–3). Как и в неполярных средах [27], в водном растворе лецитина выявлены три полосы поглощения (рис. 1). Наиболее интенсивной является полоса поглощения в области 195 нм, обусловленная n → → σ*-переходами, характерными для сложных эфиров, и π → π*-переходами несопряженных двойных связей –CH=CH–. Полоса поглощения в области 225 нм обусловлена π → π*-переходами сопряженных двойных связей. Полоса поглощения в области 282.5 нм обусловлена как π → π*-переходами неподеленной электронной пары атома кислорода, сопряженной с двойной связью жирнокислотной цепи (–O–CH=CH–), так и n → π*-переходами, характерными для карбонильной группы –C=O. В водном растворе тиофосфата натрия (рис. 2) обнаружены две полосы поглощения. Как предположено в [26], они могут быть обусловлены наличием в растворе мономеров (219.6 нм) и димеров (231 нм) тиофосфата натрия. В УФ-спектрах смеси реагентов наблюдается как смещение максимумов полос поглощения и величины их интенсивности, так и появление дополнительной полосы поглощения при λ = 247.9 нм (рис. 3). Это свидетельствует об образовании комплекса тиофосфата натрия с лецитином, что влияет на интенсивность процессов ПОЛ в системе.
Рис. 1.
УФ-спектр лецитина в дистиллированной воде и его гауссианы. Концентрация лецитина – 4.3 ⋅ 10–5 моль/л; 1 – исходный и расчетный УФ-спектры.
ЗАКЛЮЧЕНИЕ
Таким образом, введение в организм животных малотоксичных химических агентов в низких концентрациях, наличие промышленных химических токсикантов в питьевой воде и присутствие соединения восстановленной серы в модельной липидсодержащей системе существенно влияют на регуляцию окислительных процессов в печени мышей и интенсивность окисления модельного субстрата. В системах разной сложности масштаб влияния зависит от исходного состояния процессов окисления и не зависит от природы токсиканта и способа его поступления в организм. Поскольку природа ФЛ играет существенную роль в процессе образования их комплексов с БАВ [27], то, возможно, именно способность химических токсикантов образовывать комплексы с ФЛ является определяющей причиной нарушения регуляции ПОЛ. Этому предположению соответствуют и полученные в работе результаты по влиянию тиофосфата натрия на интенсивность перекисного окисления лецитина в зависимости от его исходного уровня и количественного соотношения фракций в составе ФЛ лецитина. Ранее было показано, что изменение интенсивности окислительных процессов приводит к изменению баланса окислительно-восстановительных процессов в водной среде, играющих важную роль в формировании ее токсичных свойств [28].
Совокупность представленных данных и анализ литературных источников позволяют заключить, что нарушение регуляции процессов окисления при воздействии на биообъекты химических токсикантов является основной причиной их токсичности. Модель спонтанного низкотемпературного окисления лецитина в водной фазе и использование УФ-спектрометрии для оценки способности БАВ образовывать с ним комплексы могут использоваться в качестве тестов для первичной оценки токсичности соединений.
Работа выполнена в рамках госзадания Института биохимической физики им. Н.М. Эмануэля РАН № 44.4 (регистрационный номер 0084-2019-0014).
Список литературы
Штамм Е.В., Скурлатов Ю.И., Рощин А.В. и др. // Хим. физика. 2019. Т. 38. № 11. С. 16.
Бурлакова Е.Б., Храпова Н.Г. // Успехи химии. 1985. Т. 54. Вып. 9. С. 1540.
Membrane Lipid Oxidation / Ed. Pelfrey V. V. III. Boston: CRC Press, 1991.
Hensley K., Robinson K.A., Gabbita P. et al. // Free Radic. Biol. & Med. 2000. V. 28. № 10. P. 1456.
Chemical and Biochemical Kinetics New Horizons. V. 2. Biological Kinetics. Leden, Boston: VSP, 2005.
Меньщикова Е.Б., Зенков Н.К. // Успехи соврем. биологии. 1993. Т. 13. № 4. С. 442.
Шишкина Л.Н., Козлов М.В. Мазалецкая Л.И. и др. // Хим. физика. 2020. Т. 39. № 6. С. 52.
Oxidative Stress / Ed. Sies H. L.: Academic Press, 1985.
Valko M., Leibfritz D., Moncol J. et al. // Intern. J. Biochem. Cell. Biol. 2007. V. 39. P. 44.
Keshari A.K., Verma A.K., Kumar T., Srivastava R. // Intern. J. Sci. Technol. 2015. V. 3. № 7. P. 155.
Shtamm E.V., Frog B.N., Skurlatov Yu.I. et al. // Acta Hydroch. Hydrob. 2002 V. 30. № 5–6. P. 256.
Garmash S.A., Smirnova V.S., Karp O.E. et al. // J. Environ. Radioact. 2014. V. 127. P. 163.
Shishkina L.N., Kudyasheva A.G., Shevchenko O.G., Zagorskaya N.G. // Heavy Metals and other Pollutants in the Environments. Biological Aspects / Eds. Zaikov G.E., Weisfeld L.I., Lisitsin E.M., Bekuzarova S.A. Canada: Apple Academic Press, 2017. P. 363.
Скурлатов Ю.И., Штамм Е.В., Шишкина Л.Н. и др. // Хим. физика. 2020. Т. 39. № 2. С. 50.
Isakawa T., Matsushita S. // Lipids. 1980. V. 15. № 3. P. 137.
Itzhaki R., Gill D.M. // Anal. Biochem. 1964. V. 9. P. 401.
Кейтс М. Техника липидологии. М.: Мир, 1975.
Шишкина Л.Н., Кушнирева Е.В., Смотряева М.А. // Радиац. биология. Радиоэкология. 2004. Т. 44. № 3. С. 289.
Брин Э.Ф., Травин С.О. // Хим. физика. 1991. Т. 10. № 6. С. 830.
Varma R.K., Kaushal R., Junnarkal A.Y. et al. // Arzneimittelforshung. 1985. B. 35. № 3. S. 804.
Зайцева Н.И., Байкова И.С., Швыдкий В.О. и др. // Хим. физика. 2009. Т. 28. № 4. С. 15.
Шишкина Л.Н., Хрустова Н.В. // Биофизика. 2006. Т. 51. Вып. 2. С. 340.
Козлов М.В., Кушнирева Е.В., Урнышева В.В и др. // Биофизика. 2007. Т. 52. Вып. 4. С. 693.
Shishkina L.N., Klimovich M.A., Kozlov M.V. // Pharmaceutical and Medical Biotechnology. New Perspectives / Eds. Orlicki R., Cienciala C., Krylova L., Pielichowski J., Zaikov G.E. N.Y.: Nova Sci. Publi., 2013. P. 151.
Швыдкий В.О., Штамм Е.В., Скурлатов Ю.И. и др. // Хим. физика. 2017. Т. 36. № 8. С. 23.
Neumann H., Steinberg I.Z., Katchalski E. // J. Amer. Chem. Soc. 1965. V. 87. P. 3841.
Маракулина К.М., Крамор Р.В., Луканина Ю.К. и др. // ЖФХ. 2016. Т. 90. № 2. С. 182.
Швыдкий В.О., Повх А.Ю., Шишкина Л.Н. и др. // Хим. безопасность. 2019. Т. 3. № 1. С. 118.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика