Химическая физика, 2021, T. 40, № 9, стр. 72-79
Получение биосовместимых материалов на основе полимерных комплексов сукцинила хитозана с поли-N-винилпирролидоном или полиэтиленгликолем
М. В. Базунова 1, *, Р. А. Мустакимов 1, Е. И. Кулиш 1
1 Башкирский государственный университет
Уфа, Россия
* E-mail: mbazunova@mail.ru
Поступила в редакцию 04.02.2021
После доработки 09.04.2021
Принята к публикации 20.04.2021
Аннотация
Проведено изучение взаимодействия макромолекул компонентов полимерных комплексов на основе поли-N-винилпирролидона или полиэтиленгликоля с сукцинилом хитозана спектральным и реологическим методами. Спектроскопическими методами доказано наличие кооперативного взаимодействия между макромолекулами посредством водородных связей в изученных системах. Показано, что при варьировании мольного соотношения полимеров в комплексах изменяется степень структурированности растворов на их основе, что, в свою очередь, влияет на гелеобразующие и пленкообразующие свойства получаемых систем. Установлено, что пленочные материалы на основе индивидуальных полимеров характеризуются низкими значениями краевого угла смачивания. Это говорит о высокой гидрофильности этих материалов, а пленки на основе полимерных комплексов имеют меньшую гидрофильность поверхности. Следовательно, путем модификации поли-(N-винилпирролидона) или полиэтиленгликоля сукцинилом хитозана удалось придать материалам на их основе бóльшую лиофильность, что будет способствовать многоточечному взаимодействию с ними активных центров биомакромолекул организма.
ВВЕДЕНИЕ
В последнее время ведется активная работа в различных областях медицинского материаловедения, в том числе по разработке и созданию ряда новых полимерных биоматериалов и систем биомедицинского назначения: ранозаживляющих покрытий, систем направленной доставки лекарств, ферментов или генов, мукоадгезивных покрытий, основ мягких лекарственных средств, матриксов для тканевой инженерии и пр. [1–3]. При создании подобного рода материалов особый интерес вызывают полимерные комплексы (ПК) [4]. Интерес к изучению процесса формирования ПК связан с простотой их получения, уникальностью свойств таких систем и широким спектром их применения не только в медицине, но и в других областях (косметологии, лакокрасочной промышленности и др.).
Процесс образования ПК является обратимым и контролируется такими факторами, как природа исходных полимеров, их молекулярная масса, последовательность смешения компонентов, их соотношение и концентрация в смеси. Поэтому знание особенностей формирования ПК позволяет регулировать в широком диапазоне их физико-химические характеристики и оптимальные условия получения, что является основным преимуществом использования ПК по сравнению с индивидуальными полимерами [5]. Иными словами, подбор параметров при синтезе ПК позволяет реализовать ситуацию, когда на основе одних и тех же исходных полимеров могут быть получены материалы с совершенно различными свойствами.
При создании полимерных материалов биомедицинского назначения внимание исследователей привлекают водорастворимые физиологически-нейтральные или физиологически активные доступные синтетические полимеры, такие как поливиниловый спирт, поли-N-винилпирролидон (ПВП), полиэтиленгликоль (ПЭГ), полиакриламид и др. [6]. Так, ПВП обладает хорошей растворимостью в воде, высокой адсорбирующей способностью, склонностью к комплексообразованию и отсутствием токсичности [7]. Широко известны также комплексы поликарбоновых кислот с ПВП и полиакриламидом, которые подробно рассмотрены в работах [8, 9]. Установлено, что в результате взаимодействия макромолекул данных полимеров образуется поликомплекс одинакового состава за счет водородных связей между карбоксильными группами поликислоты и атомами кислорода ПВП или полиакриламида.
Также известно, что материалы на основе ПЭГ с различными молекулярными массами в настоящее время представляют собой универсальные диффузионные матрицы для контролируемой транс-дермальной доставки лекарств. Наиболее важным функциональным свойством такой матрицы является контроль скорости высвобождения лекарства, растворенного в матрице, которая определяется диффузионной подвижностью сегмента полимера и его адгезией к коже [10].
Однако у ПВП и ПЭГ имеются недостатки, ограничивающие их применение в медицинской практике, а именно, неудовлетворительные пленкообразующие и гелеобразующие свойства, что не позволяет напрямую сформировать из них полимерный материал. В присутствии воды ПВП и ПЭГ обладают преимущественно гидрофильными свойствами, что также затрудняет формирование стабильных материалов.
Данные недостатки могут быть устранены путем введения в системы на основе ПВП и ПЭГ полисахаридов, которые за счет своих структурно-механических характеристик и возможностей взаимодействия с амфифильным ПВП и ПЭГ могут повысить структурированность ПК. Несомненно, что полисахариды, содержащие в своем составе гидроксильные и простые эфирные группы, т.е. являющиеся протоноакцепторными соединениями, могут образовывать полимерные комплексы. К настоящему времени имеется достаточно обширный экспериментальный материал по взаимодействию полисахаридов с синтетическими полимерами [11–17].
Весьма интересными и перспективными в этом аспекте представляются полисахарид хитозан и его производные, например сукцинил хитозана (СХТЗ). Преимуществами СХТЗ при создании материалов медицинского назначения на основе ПК являются, с одной стороны, растворимость нейтральных средах, а с другой – биосовместимость с тканями организма, бактериостатичность и способность к биодеградации [18, 19].
Создание полимерных комплексов ПВП–СХТЗ и ПЭГ–СХТЗ также может позволить целенаправленно изменять плотность распределения ионогенных групп и, соответственно, гидрофильно-гидрофобный баланс поверхности биоматериалов на их основе, что приведет к образованию на поверхности материалов микрофрагментов, отличающихся полярностью, лиофильностью, упорядоченностью, что будет способствовать многоточечному взаимодействию с ней активных центров макромолекул организма и, соответственно, увеличению биосовместимости. Варьирование состава ПК обеспечит регулирование конформационно-надмолекулярного состояния макромолекул, что, несомненно, отразится на возможности управления сорбционными и транспортными свойствами пленочных материалов на их основе.
Таким образом, целями данной работы были изучение взаимодействия макромолекул компонентов полимерных комплексов на основе ПВП или ПЭГ с СХТЗ спектральным и реологическим методами и исследование гидрофильно-гидрофобного баланса пленочных материалов на их основе.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В данной работе были использованы следующие полимеры: 1) поли-N-винилпирролидон с молекулярной массой М = 58 кДа марки Plasdone K29/32 производства компании GAF (США); 2) натриевая соль сукцинила хитозана с М = 207 кДа (ТУ 9284-027-11734126-08) производства ЗАО “Биопрогресс” (г. Щелково); 3) полиэтиленгликоль марки НОРПЭГ-8000 производства OOO “ЗАВОД СИНТАНОЛОВ”. Получение полимерных комплексов проводили в водном растворе (растворитель – бидистиллированная вода) путем последовательного растворения навесок полимеров, предварительно очищенных от примесей и высушенных, при интенсивном перемешивании. Полимерные комплексы ПВП–СХТЗ и ПЭГ–СХТЗ готовили в различных мольных соотношениях исходных компонентов ПК, полученные путем добавления определенных объемов раствора СХТЗ к растворам ПВП или ПЭГ обозначены как ПК1, а ПК, полученные при добавлении определенных объемов растворов ПВП или ПЭГ к раствору СХТЗ, обозначены как ПК2.
Значения удельной вязкости (ηуд) растворов СХТЗ, ПЭГ, ПВП и систем ПВП–СХТЗ и ПЭГ–СХТЗ определяли с помощью вискозиметра Уббелоде при температуре (25 ± 1) °С. При этом состав реакционной смеси выражали через мольное соотношение z:
Пленочные полимерные материалы на основе свежеприготовленных растворов ПК получали методом полива на обезжиренные чашки Петри. Толщина пленочных образцов поддерживалась постоянной и равной 0.1 мм.
УФ-спектры полимерной системы СХТЗ–ПВП и ПВП исследовали на спектрофотометре UV-2600 компании Shimadzu (Япония) с двулучевой оптической системой в диапазоне длин волн 185–600 нм. ИК-спектры пропускания исходных полимеров и ПК в диапазоне 500–4000 см–1 исследовали с помощью инфракрасного фурье-спектрофотометра IRAffinity-1S компании Shimadzu (Япония) с использованием приставки для исследования нарушенного полного внутреннего отражения. Для подтверждения наличия взаимодействия макромолекул сравнивались спектры ПК с эталонными спектрами индивидуальных полимеров, взятых в различных мольных соотношениях. Так как результаты, полученные для соответствующих систем, во всем интервале соотношений согласуются, за эталонную систему брали ПК с мольным соотношением полимеров в смеси 1 : 1.
Реологические исследования растворов индивидуальных полимеров и ПК проводили на модульном динамическом реометре Haake Mars III компании Thermo Fisher (Германия) при температуре (25 ± 1) °С в режиме непрерывного сдвигового деформирования в диапазоне скоростей сдвига от 0.1 до 100 с–1 в осцилляционном и динамическом режимах. Использовали систему плоскость – конус с диаметром 60 мм и углом при вершине конуса 2°. Испытания в осцилляционном режиме выполнялись в области линейной вязкоупругости в диапазонах амплитуд 0.1–10 Па и частот осцилляции 0.1–10 Гц, что соответствует интервалу концентраций раствора СХТЗ 0.2–15.0 мас.%.
Гидрофильность поверхности полимерных пленок исследовали путем измерения краевого угла смачивания, образующегося между поверхностью материалов и каплей воды при температуре (20 ± 1)°С, с помощью цифровой камеры с функцией макросъемки, и дальнейшей обработки полученных фотографий в программе CorelDRAW X3 компании Corel Corporation (США).
Параметры, характеризующие свойства поверхности, а именно, свободную поверхностную энергию (γS) и свободную энергию межфазовой поверхности (γSL), рассчитывали по результатам измерения краевого угла смачивания пленочных образцов водой, используя уравнения Де Жена [20].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Отличительной особенностью межмолекулярного взаимодействия полимеров в ПК по сравнению с процессами, протекающими между низкомолекулярными веществами, является кооперативный характер связей, возникающих между макромолекулами. Макромолекулы неионогенных полимеров или полиэлектролитов с ионогенными группами в недиссоциированном состоянии (например, поликарбоновые кислоты при низких значениях рН) в водных растворах взаимодействуют главным образом за счет водородных связей. Образование ПК в данном случае не сопровождается выделением нерастворимого продукта и может быть подтверждено косвенным образом – путем сравнения физико-химических свойств индивидуальных полимеров и комплексов на их основе или с помощью спектроскопических методов анализа.
Известно, что одними из самых распространенных спектроскопических методов изучения межмолекулярных взаимодействий являются электронная и инфракрасная спектроскопии, позволяющие изучить строение веществ и подтвердить их структуру. Поэтому для доказательства взаимодействия ПВП или ПЭГ с СХТЗ в смесях ПВП–СХТЗ и ПЭГ–СХТЗ использовали ИК- и УФ-спектроскопию. Были изучены УФ-спектры поглощения растворов смесей полимеров ПВП и СХТЗ, взятых в различных мольных соотношениях (от 1 : 5 до 5 : 1), и спектры отдельных индивидуальных полимеров в диапазоне концентраций полимеров 0.1–1.0 мас.%.
Известно, что в структуре молекулы ПВП хромофором является карбонильная группа лактамного цикла – резонансного гибрида структур, в одной из которых азот обладает частичным положительным зарядом, а кислород частично отрицательно заряжен. Следовательно, ПВП должен эффективно взаимодействовать с нуклеофилами посредством водородных связей, которые влияют на энергию системы и распределение заряда.
В ходе исследования УФ-спектра ПВП и ПВП–СХТЗ было выявлено, что для системы ПВП–СХТЗ отмечаются гиперхромный эффект и батохромный сдвиг полосы поглощения (228 нм) по сравнению с ПВП (219 нм) [21]. Данный факт свидетельствует о перестройке электронной структуры вследствие кооперативного взаимодействия между макромолекулами ПВП и СХТЗ.
Можно ожидать, что особые межмолекулярные взаимодействия, в том числе посредством водородных связей, в полимерных комплексах должны более заметно отражаться в изменениях инфракрасных спектров, и это на самом деле так. В ИК-спектре ПВП важными характеристическими частотами являются 1650 см–1 (валентные колебания С=О) и 1286 см–1 (валентные колебания С–N). В спектре ПВП–СХТЗ (рис. 1) наблюдаются небольшие сдвиги характеристических полос поглощения в коротковолновую область (1645 и 1279 см–1), что может говорить о наличии взаимодействия посредством водородных связей.
Рис. 1.
ИК-спектры ПВП и ПЭГ концентрацией 1 мас.% и смесей ПВП–СХТЗ, ПЭГ–СХТЗ в мольном соотношении 1 : 1 (концентрации полимеров в смесях 1 мас.%).
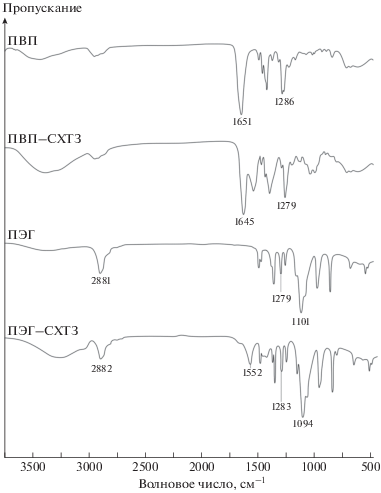
Для ПЭГ главные характеристические полосы проявляются в области, характерной для гидроксигрупп, при 3340 см–1, валентные колебания С–О–Н – в области 1101 см–1. Добавление СХТЗ к ПЭГ приводит к смещению характеристических полос поглощения в область меньших волновых чисел (3258 и 1094 см–1), что свидетельствует об образовании водородных связей между функциональными группами макромолекул (гидроксильными группами ПЭГ и карбоксильными группами СХТЗ). Это обусловлено тем, что при образовании водородной связи силовая постоянная связи О–Н уменьшается, а полоса может сдвигаться в область частот 3500–2500 см–1 [22]. Причем, чем прочнее возникающее взаимодействие, тем ниже частота колебаний. Таким образом, спектроскопические методы позволяют сделать вывод о наличии взаимодействия между СХТЗ и ПВП или ПЭГ.
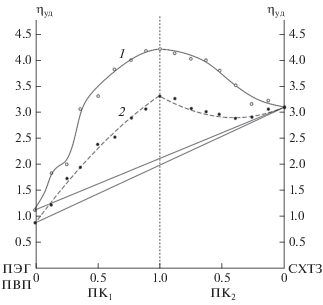
О формировании полимерных комплексов в системах ПВП–СХТЗ и ПЭГ–СХТЗ для ПК1 и ПК2 также свидетельствуют зависимости удельной вязкости от мольного соотношения компонентов, представленные на рис. 2. Видно, что значения удельной вязкости растворов ПК для обоих видов полимерных систем во всем интервале мольных соотношений лежат выше аддитивных величин, что может говорить об увеличении структурированности растворов комплексов за счет определенного конформационно-надмолекулярного состояния кооперативно связанных макромолекул. При этом порядок смешения растворов исходных полимеров не играет существенной роли в формировании комплекса. Очевидно, что с увеличением концентрации полимеров в системе значения удельной вязкости тоже будут выше аддитивных величин и имеют такую же зависимость от мольных соотношений.
Рис. 2.
Зависимости удельной вязкости от мольного соотношения компонентов в ПК1 и ПК2 для смесей СХТЗ–ПВП (2) и СХТЗ–ПЭГ (1) (концентрации полимеров в смесях – 1 мас.%).
Одним из способов создания материалов медицинского назначения с регулируемыми сорбционными, физико-химическими и структурно-механическими (в том числе геле-, волокно- и пленкообразующими) свойствами на основе водорастворимых полимеров является регулирование процессов агрегации макромолекул в исходных растворах [23, 24]. В случае растворов ПК управление процессами агрегации возможно не только за счет изменения концентрационного режима растворов (разбавленный, полуразбавленный и концентрированный), но и за счет изменения соотношения компонентов комплекса, влияющего на конформационно-надмолекулярное состояние кооперативно связанных макромолекул. В связи с вышесказанным, а также для дополнительного подтверждения наличия ощутимого взаимодействия между макромолекулами компонентов ПК были проведены реологические исследования.
На рис. 3 представлена зависимость наибольшей ньютоновской вязкости η от концентрации для растворов индивидуального СХТЗ и систем ПВП–СХТЗ и ПЭГ–СХТЗ в двойных логарифмических координатах. В соответствии с общепринятыми подходами [25–27] зависимости η от концентрации c исходных полимеров в растворе в двойных логарифмических координатах могут быть описаны степенной функцией: η ∼ сn. В области малых концентраций полимеров вязкость обычно пропорциональна концентрации в первой степени, что соответствует области разбавленных растворов неперекрывающихся клубков. По мере увеличения концентрации макромолекулы начинают взаимодействовать друг с другом, вызывая рост вязкости вследствие повышения сопротивления их движению. При последующем увеличении концентрации полимеров в растворе происходит формирование флуктуационной сетки зацеплений и переход в полуразбавленный режим. Данный факт сопровождается увеличением показателя степени n и появлением перегиба на кривой зависимости вязкости от концентрации в двойных логарифмических координатах, соответствующего образованию сетки.
Рис. 3.
Зависимость наибольшей ньютоновской вязкости η от концентрации СХТЗ для индивидуального СХТЗ (1) и систем ПВП–СХТЗ (2) и ПЭГ–СХТЗ (3) с мольным соотношением 1 : 1. Величины η определены при скорости сдвига, равной 0.1 с–1. Размерности исходных параметров: η – Па ⋅ с, концентрация – г/дл.
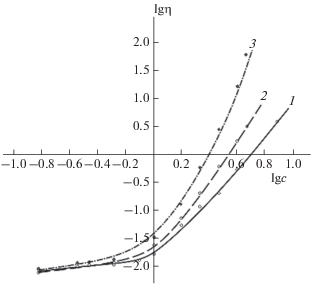
Действительно, как следует из данных, представленных на рис. 3, для раствора СХТЗ и систем ПВП–СХТЗ и ПЭГ–СХТЗ в области небольших концентраций полимера показатель степени n близок к единице, а при увеличении концентрации вязкость становится пропорциональной концентрации полимера с5. Таким образом, начало формирования сетки зацеплений соответствует растворам с концентрацией СХТЗ 1.2 мас.% в случае индивидуального СХТЗ и 0.9 и 1.0 мас.% в случае систем ПЭГ–СХТЗ и ПВП–СХТЗ соответственно. Более раннее формирование сетки зацеплений в случае растворов ПК можно объяснить наличием дополнительной пространственной структуры, узлы которой образованы взаимодействующими комплементарными полярными группами. Также необходимо отметить, что в области полуразбавленных растворов ПК характеризуются более высокими значениями наибольшей ньютоновской вязкости, чем раствор СХТЗ. Вязкость растворов ПВП и ПЭГ изменяется незначительно при увеличении концентрации и не может вносить ощутимый вклад в величину общей вязкости полимерных смесей.
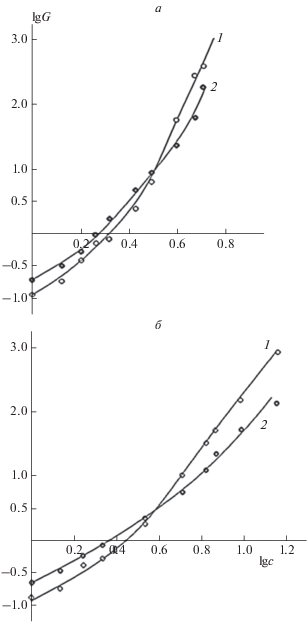
Известно, что о формировании пространственной структуры, т.е. переходе полимерной системы из состояния вязкоупругой жидкости в упруговязкое тело (гель), можно судить по характеру изменения зависимостей модулей накопления, G ', и потерь, G ". Ранее установлено, что для водного раствора СХТЗ переход из вязкоупругого состояния в гель происходит при его концентрации 4.0 мас.% [23, 24]. Из зависимостей на рис. 4 видно, что раствор полимерного комплекса ПЭГ–СХТЗ становится гелем при чуть меньшей концентрации СХТЗ (3.3 мас.%), для системы ПВП–СХТЗ концентрация, при которой происходит переход, равна 3.9 мас.%. Результат согласуется с данными зависимости η от концентрации (рис. 3), согласно которым растворы полимерного комплекса ПЭГ–СХТЗ имеют самую высокую вязкость. Наличие упорядоченных структур, возникающих в упруго-вязких системах, позволит формировать пленки, характеризующиеся более высоким модулем упругости [28].
Рис. 4.
Зависимость модуля упругости (накоплений) – кривая 1 и модуля вязкости (потерь) – кривая 2 от содержания СХТЗ в полимерных комплексах СХТЗ–ПЭГ (а) и СХТЗ–ПВП (б) с мольным соотношением 1 : 1. Частота осциллирующего напряжения – 1 Гц, амплитуда напряжения – 1 Па. Размерности исходных параметров: модуль упругости (накоплений) и модуль вязкости (потерь) – Па, концентрация – мас.%.
Гидрофильно-гидрофобный баланс поверхности материалов, предназначенных для биомедицинского использования, является значимым показателем, косвенно характеризующим биологическую совместимость и оказывающим влияние на адгезию и жизнеспособность клеток [29, 30]. Критерием оценки этого баланса служит величина краевого угла смачивания водой. В связи с этим для мониторинга изменения гидрофильности поверхности пленочных образцов на основе изученных ПК определяли краевой угол смачивания θ. Измерение этой величины позволило также вычислить такие важные характеристики поверхности, как величину сил сцепления, поверхностное натяжение и свободную энергию межфазовой поверхности.
Пленки на основе индивидуальных полимеров СХТЗ и ПВП, как и ожидалось, характеризуются низкими значениями краевого угла смачивания (табл. 1), что говорит о их высокой гидрофильности, а пленки на основе ПК СХТЗ с ПЭГ или ПВП имеют меньшую гидрофильность поверхности, причем для системы ПВП–СХТЗ краевой угол смачивания имеет максимальное значение. Данные факты, вероятно, связаны с уменьшением количества доступных полярных групп вследствие их экранирования и вовлечения во взаимодействие с полярными группами второго компонента. Результаты расчета показали, что наиболее низкие значения соотношения гидрофильность/гидрофобность поверхности имели образцы на основе ПК, а следовательно, они более биосовместимы с клетками живого организма [31].
Таблица 1.
Значения краевого угла смачивания водой для пленочных образцов исходных СХТЗ, ПВП и ПК на основе систем ПВП–СХТЗ, ПЭГ–СХТЗ
| Система | θ, град | γ, эрг/см2 | γSL, эрг/см2 | WSL, эрг/см2 |
|---|---|---|---|---|
| СХТЗ | 55 ± 2.1 | 43.1 | 3.9 | 112.0 |
| ПВП | 30 ± 0.4 | 54.2 | 2.1 | 121.1 |
| ПВП–СХТЗ (1 : 1) | 84 ± 3.8 | 28.3 | 9.7 | 89.4 |
| ПВП–СХТЗ (1 : 2) | 75 ± 3.1 | 30.3 | 8.1 | 94.5 |
| ПЭГ–СХТЗ (1 : 1) | 61 ± 2.8 | 38.1 | 5.6 | 106.4 |
| ПЭГ–СХТЗ (1 : 2) | 68 ± 2.9 | 35.7 | 6.2 | 101.6 |
Поверхностная энергия также является важной характеристикой, способной влиять на биосовместимость материалов [32]. Однако влияние на клетки гидрофильно-гидрофобного баланса поверхности, определяющее поверхностную энергию и другие показатели, не универсально: в одних случаях рост клеточных структур тканей организма увеличивается на гидрофильных поверхностях, в других – на гидрофобных. В ходе исследования пленочных материалов, полученных на основе индивидуальных полимеров и ПК на их основе, показано, что наиболее низкие значения поверхностного натяжения и сил сцепления характерны для пленок полимерного комплекса ПВП–СХТЗ, имеющих самую низкую гидрофильность (табл. 1).
Таким образом, варьирование состава изученных ПК позволяет целенаправленно изменять гидрофильно-гидрофобный баланс поверхности полимерных пленок на их основе.
ВЫВОДЫ
1. Спектроскопическими методами доказано наличие кооперативного взаимодействия между макромолекулами посредством водородных связей в системах ПВП–СХТЗ, ПЭГ–СХТЗ.
2. Посредством варьирования соотношения полимеров в системе можно изменять степень структурированности полимерных комплексов ПВП–СХТЗ и ПЭГ–СХТЗ, что, в свою очередь, позволяет влиять на поверхностные и объемные свойства получаемых материалов. Показано, что вязкость полимерных смесей ПВП–СХТЗ и ПЭГ–СХТЗ выше, чем у индивидуальных полимеров, что свидетельствует об увеличении структурированности этих систем. Так, раствор полимерного комплекса ПЭГ–СХТЗ становится упруго-вязкой системой (гелем) при чуть меньшей концентрации СХТЗ (3.3 мас.%), чем остальные изученные системы (4.0 мас.% для индивидуального СХТЗ и 3.9 мас.% для системы ПВП–СХТЗ).
3. Пленочные материалы на основе индивидуальных полимеров СХТЗ и ПВП характеризуются низкими значениями краевого угла смачивания, что говорит о их высокой гидрофильности, а пленки на основе полимерного комплекса СХТЗ с ПЭГ или ПВП имеют меньшую гидрофильность поверхности, причем для системы ПВП–СХТЗ краевой угол смачивания имеет максимальное значение (до 84°). Иными словами, путем модификации получилось снизить гидрофильность ПВП и ПЭГ и тем самым придать материалу бóльшую лиофильность, что будет способствовать многоточечному взаимодействию с ней активных центров биомакромолекул организма.
Работа подготовлена при поддержке грантом Российского фонда фундаментальных исследований № 20-33-90069/20.
Список литературы
Штильман М.И., Подкорытова А.В., Немцев С.В. и др. Технология полимеров медико-биологического назначения. Полимеры природного происхождения: уч. пос. М.: БИНОМ. Лаборатория знаний, 2015.
Lili Z., Mariusz S., Istvan T. // ACS Biomater. Sci. Eng. 2019. V. 5. № 10. P. 46.
Бадыкова Л.А., Мударисова Р.Х., Колесов С.В. // Хим. физика. 2020. Т. 39. № 1. С. 88; https://doi.org/10.31857/S0207401X20010033
Kumar V., Yang T., Yang Y. // Intern. J. Pharm. 1999. V. 188. № 2. P. 221.
Sohail K., Khan I.U., Shahzad Y. et al. // Braz. J. Pharm. Sci. 2014. № 50. P. 173.
Воробьева Е.В., Крутько Н.П. Полимерные комплексы в водных и солевых средах. Минск: Белорусская наука, 2010.
Штильман М.И. Полимеры медико-биологического назначения. М: ИКЦ “Академкнига”, 2006.
Shekeyeva K.K. // Вестн. Казахского Национ. мед. ун-та. 2019. № 1. С. 434.
Фрисс С.А. // Медицинская экспертиза и право. 2011. № 6. С. 9.
Краснюк И.И., Беляцкая А.В., Степанова О.И. и др. // Фармация. 2016. № 6. С. 10.
Feldstein M.M., Raigorodskii I.M., Iordanskii A.L. et al. // J. Control. Release. 1998. V. 52. № 1. P. 25.
Бочек А.М., Шевчук И.Л., Калюжная Л.М. // ЖПХ. 2010. Т. 83. № 4. С. 660.
Князева Т.Е., Мясникова И.Б., Медведева В.В. и др. // Высокомолекуляр. соединения. Б. 2006. Т. 48. № 5. С. 864.
Мун Г.А., Нуркеева Е.С., Хуторянский В.В. и др. // Высокомолекуляр. соединения. Б. 2001. Т. 43. № 3. С. 552.
Ian Freshney R. Culture of animal cells: A manual of basic technique. 5th ed. N.Y.: John Wiley & Sons, 2005.
Trufakina L.M., Kudeshova E.G. // J. Eng. Phys. Thermophys. 2003. V. 76. № 3. P. 56.
Труфакина Л.М. // ЖПХ. 2006. Т. 79. № 12. С. 2037.
Сливкин А.И., Лапенко В.Л., Арзамасцев А.П. и др. // Вестн. Воронежского ГУ. Сер.: Химия. Биология. Фармация. 2005. № 2. С. 74.
Bazunova M.V., Sharafutdinova L.A., Lazdin R.Y. et al. // Appl. Biochem. Microbiol. 2018. V. 54. № 5. P. 474; https://doi.org/10.1134/S0003683818050058
Де Жен П.Ж. // УФН. 1987. Т. 151. № 4. С. 623.
Сидельковская Ф.П. Химия N-винилпирролидона и его полимеров. М.: Наука, 1970.
Казицына Л.А., Куплетская Н.Б. Применение УФ-, ИК- и ЯМР-спектроскопии в органической химии. М.: Высш. шк., 1971.
Базунова М.В., Шуршина А.С., Чернова В.В. и др. // Хим. физика. 2016. Т. 35. № 12. С. 62; https://doi.org/10.7868/S0207401X16120049
Базунова М.В., Шуршина А.С., Лаздин Р.Ю. и др. // Хим. физика. 2020. Т. 39. № 7. С. 49; https://doi.org/10.31857/S0207401X20070031
Агеев Е.П., Вихорева Г.А., Матушкина Н.Н. и др. // Высокомолекуляр. соединения. А. 2000. Т. 42. № 2. С. 333.
Успенский С.А., Вихорева Г.А. Сонина А.Н. и др. // Хим. волокна. 2010. № 2. С. 11.
Виноградов Г.В., Малкин А.Я. Реология полимеров. М.: Химия, 1977.
Никифорова Г.Г., Васильев В.Г., Роговина Л.З. и др. // Высокомолекуляр. соединения. А. 2003. Т. 45. № 10. С. 1733.
Andrade J.D., Gregonis D.E., Smith L.M. Surface and interfacial aspects of biomedical polymers. V. 1. N.Y.: Plenum Press, 1985.
Богданова С.А., Эбель А.О., Слобожанинова М.В. и др. // Бутлеровские сообщ. 2002. Т. 2. № 9. С. 25.
Роговина С.З., Алексанян К.В., Владимиров Л.В. и др. // Хим. физика. 2019. Т. 38. № 9. С. 39; https://doi.org/10.1134/S0207401X19090097
Kennedy S.B., Washburn N.R., Simon C.G. et al. // Biomaterials. 2006. V. 27. № 20. P. 3820.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


