Журнал высшей нервной деятельности им. И.П. Павлова, 2023, T. 73, № 6, стр. 735-748
Вызванные потенциалы мозга человека на выключение звука в условиях пространственной маскировки
Е. А. Петропавловская 1, *, Л. Б. Шестопалова 1, Д. А. Саликова 1, В. В. Семенова 1
1 Федеральное государственное бюджетное учреждение науки Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: petropavlovskaiae@infran.ru
Поступила в редакцию 28.12.2022
После доработки 01.07.2023
Принята к публикации 03.07.2023
- EDN: IDMINQ
- DOI: 10.31857/S0044467723060072
Аннотация
Было исследовано влияние взаимного расположения звукового стимула и фонового маскера на компоненты вызванных потенциалов (ВП) мозга человека в ответ на выключение звука. Звуковые стимулы предъявлялись дихотически, положение звуковых образов задавалось при помощи межушных различий по интенсивности. Тестовый сигнал и маскер были расположены в одной точке пространства либо были разнесены на расчетное угловое расстояние 90 или 180 град. При совпадении положения сигнала и маскера выявлено значимое снижение амплитуды и увеличение латентности компонентов N1, P2 и N2 ответов на выключение. При удалении сигнала от маскера наблюдалось увеличение амплитуды почти до уровня ответа на сигнал в тишине и уменьшение латентности всех компонентов отклика, что, предположительно, свидетельствует об успешном выделении стимула из фона.
Большинство исследований слуховой системы анализируют свойства нейронных или суммарных ответов на включение звука и игнорируют ответы на их окончание. Это обусловлено рядом акустических, перцептивных и нейробиологических причин. Акустически окончания естественных звуков часто бывают более размытыми, чем начала, также они сильнее искажаются реверберацией, особенно в замкнутых пространствах (Traer, McDermott, 2016). Неудивительно, что, с точки зрения восприятия, окончания звуковых сигналов также менее заметны, чем их начала (Phillips et al., 2002). Тем не менее окончания звуков играют важную роль в восприятии речи и в анализе слуховых сцен, выступая в качестве одного из значимых признаков для перцептивной группировки (Szabo et al, 2016). С точки зрения физики и физиологии в момент включения начинается воздействие энергии внешнего источника на нейроны-рецепторы, которое ведет к изменениям мембранного потенциала и генерации потенциалов действия. В момент выключения воздействие энергии внешнего стимула на рецепторы прекращается, что, в свою очередь, требует принципиально иных механизмов генерации ответа на это событие. Предполагается, что ответы на начало и окончание звуковых стимулов являются нейронными репрезентациями изменений сигнала во времени (Kopp-Scheinpflug et al., 2011, 2018).
Ответы на выключение звука можно выделить в электрической активности мозга на всех уровнях слуховой системы, хотя они обычно менее выражены, чем ответы на включение (Abeles, Goldstein, 1972; He et al., 1997; Recanzone, 2000; Phillips et al., 2002). Основной темой большинства исследований ответов на выключение является их сходство и различие с ответами на начало стимула. Активно обсуждается, формируются ли эти два типа реакций за счет одних и тех же нейронных популяций и механизмов обработки информации, или за счет разных. Существующие данные об ответах на выключение в центральном слуховом пути предполагают, что они в основном генерируются в дорсальном кохлеарном и верхнем параоливарном ядрах (Recanzone, 2000; Phillips et al., 2002). В задних холмах и внутреннем коленчатом теле ответы на выключение звука могут быть как унаследованы от ствола головного мозга, так и сформированы заново, или иметь смешанное происхождение. В коре головного мозга ответы на выключение звука, по-видимому, наследуются из нижележащих структур (обзор Kopp-Scheinpflug et al., 2018). Исследования на животных показывают, что в коре меньше нейронов, отвечающих на выключение, чем на включение; при этом нейронам, отвечающим на выключение, менее свойственна тонотопическая организация. Тем самым подтверждается предположение о том, что за реакции на включение и выключение могут быть ответственны отчасти различные популяции нейронов с различными функциональными свойствами (Abeles, Goldstein, 1972; He et al., 1997; Recanzone, 2000; Phillips et al., 2002). С другой стороны, в коре есть некоторая доля нейронов, реагирующих как на включение, так и на выключение (Volkov, Galazjuk, 1991). Это соответствует представлениям о том, что связанные с началом и концом звучания слуховые вызванные потенциалы (ВП) имеют общие компоненты и (по крайней мере, частично) отражают одну и ту же базовую обработку информации (Qin et al., 2007). Было высказано предположение, что различным ответам соответствуют различные наборы синаптических входов (Scholl et al., 2010).
Механизмы генерации ответов на выключение звука особенно чувствительны к поддержанию равновесия между процессами возбуждения и торможения на клеточном уровне. С нарушениями этого равновесия связывают трудности с обнаружением пауз в звуковом сигнале (Schneider et al., 1994: Snell, Frisina, 2000) и различением речи в шуме (Gordon-Salant, Fitzgibbons, 1993), возникающие при старении и заболеваниях центральной нервной системы, даже когда пороги слуха нормальны. Интересно, что компоненты слуховых ВП на выключение шумовых и окончание речевых стимулов значительно слабее и более замедлены у пожилых людей, чем у молодых (Harris et al., 2012; Skoe et al., 2015). Хотя необходимо отметить, что связанные с началом звучания компоненты ВП также подвержены влиянию старения (Irsik et al., 2021).
На уровне суммарной электрической активности, регистрируемой со скальпа, выключение звука вызывает колебания электроэнцефалограммы (ЭЭГ), по форме и латентности сходные с теми, которые вызывает включение звука. Амплитуды ВП на включение и выключение сходным образом зависят от крутизны фронтов нарастания и спада стимула, а также от его длительности и от межстимульного интервала. При уменьшении длительности стимула до 1 с и менее, ВП на выключение уменьшается вплоть до полного исчезновения (Davis, Zerlin, 1966). Аналогично, при уменьшении межстимульного интервала до 1 секунды и менее, ВП на включение второго стимула оказывается угнетен (при условии, что первый стимул имел достаточную длительность для формирования ВП на выключение), из чего делается вывод, что эти два ответа не являются полностью независимыми, а их генераторы как минимум частично перекрываются (Hillyard, Picton, 1978). Записи МЭГ также свидетельствуют, что компоненты N1 и P2 ответов на начало и конец звучания происходят из перекрывающихся источников (Hari et al., 1987; Pantev et al., 1996; Yamashiro et al., 2011). С другой стороны, имеются данные о достоверно различном (хотя и близком) расположении генераторов магнитных ответов на включение и выключение (Noda et al., 1998).
Изменения ВП на окончание звука исследуют также в связи с привлечением внимания к длительности стимулов (Horváth, 2016) и с процессами обнаружения сигнала в шуме (Baltzell, Billings, 2014). Предположительно, выключение стимула может способствовать выделению сигнала на фоне маскера, выступая в качестве признака перцептивной группировки (Grose et al., 2009; Mlynarsky, McDermott, 2019). Психофизические исследования с речевыми стимулами свидетельствуют, что, помимо влияния соотношения сигнал/шум (signal-to-noise ratio, SNR), значимым признаком является также абсолютный уровень сигнала, даже в присутствии фонового шума (Dirks et al., 1982; Studebaker et al., 1999; Hornsby et al., 2005). В исследовании (Baltzell, Billings, 2014) было проведено сравнение зависимости слуховых ВП здоровых испытуемых в реакции на включение и выключение тонального стимула в тишине и на фоне длящегося шума, а также зависимость этих ВП от соотношения сигнал/шум. Ранее было показано, что увеличение уровня сигнала в тишине приводит к уменьшению латентности и увеличению амплитуды ВП на включение (Billings et al., 2007). На фоне маскера амплитуда и латентность ВП на включение зависели только от соотношения сигнал/шум, а зависимость от абсолютного уровня сигнала терялась. Вызванные потенциалы на выключение продемонстрировали те же зависимости от уровня сигнала в тишине и изменений SNR, как и ВП на включение, и в дополнение к ним – чувствительность к изменениям уровня сигнала в шуме. Это сходство может свидетельствовать о том, что выключение сигнала может быть использовано слуховой системой для выделения сигнала из шума, наряду с другими признаками (Billings et al., 2009).
В литературе, посвященной помехоустойчивости слуховой системы, широко обсуждается феномен бинаурального освобождения от маскировки, также известный как “эффект вечеринки” (cocktail-party effect), или пространственное освобождение от маскировки. Пороги обнаружения тестового сигнала на фоне маскера понижаются при разнесении в пространстве реальных источников звука (в условиях свободного звукового поля) или при введении в звуковые стимулы межушных различий по времени или интенсивности (в условиях дихотической стимуляции) (Litovsky, 2012). Обзор литературы о влиянии положения звуковых стимулов на ВП на включение приведен в статьях Шестопаловой и др. (2022, 2023). В присутствии маскера общей тенденцией является уменьшение амплитуды и увеличение латентности всех компонентов слуховых ВП. При введении межушных или реальных пространственных различий между сигналом и маскером наблюдается тенденция к увеличению амплитуды ВП и уменьшению латентности. Степень влияния маскировки и пространственных признаков на отдельные компоненты ответа варьирует в зависимости от характера стимулов (шумовые, тональные или речевые), направленности внимания и задания, которое выполнял испытуемый. При дихотическом предъявлении шумовых сигналов, пространственное положение которых задавалось посредством межушных различий по интенсивности, было показано, что при совпадении положения сигнала и маскера амплитуда компонентов N1 и P2 ответа на включение заметно снижалась, а латентность увеличивалась. При увеличении расчетного углового расстояния между ними до 90 градусов амплитуда этих компонентов росла, а латентность уменьшалась, что рассматривается как проявление пространственного освобождения от маскировки (Шестопалова и др., 2022). Влияние пространственных характеристик стимулов на ответы на выключение звука не исследовано.
Психофизические исследования локализации звуковых стимулов показывают, что при анализе пространственных признаков слуховой системе свойственна значительная инерционность. По разным данным, временное окно интеграции пространственной информации может составлять от 40 до 300 мс (Carlile, Leung, 2016; Семенова и др., 2022). При локализации движущихся стимулов инерционность проявляется в том числе в смещении воспринимаемого положения начальной точки траектории в направлении движения. При совпадении во времени начала движения с включением сигнала начальная часть траектории не воспринимается (Петропавловская и др., 2010). В то же время локализация конечных точек траекторий оказывается более надежной, так как после накопления необходимого количества информации об изменении положения стимула вступают в действие предсказательные механизмы, компенсирующие действие инерционности (Петропавловская и др., 2011). Исходя из этого можно предположить, что при достаточном времени звучания ВП на выключение звукового стимула могут оказаться чувствительны к его пространственным признакам и устойчивы к воздействию маскировки.
Настоящая публикация является частью комплексного исследования пространственной маскировки, включающего анализ ВП на три типа событий (начало звучания, начало движения звукового образа и конец звучания), а также поведенческие ответы. В данной работе проведен анализ ВП на выключение звуковых стимулов, полученных в тех же условиях и на тех же испытуемых, что и анализ ответов на включение звука в упомянутой выше работе Шестопаловой и др. (2022). Топография ответов на все три типа событий проанализирована в следующей работе (Шестопалова и др., 2023).
Таким образом, цели настоящего исследования состояли в следующем: 1) изучить влияние взаимного расположения звукового стимула и маскера на ВП, вызванные выключением звука; 2) определить, какие компоненты ВП в наибольшей степени отражают пространственное освобождение от маскировки.
МЕТОДИКА
Условия эксперимента и испытуемые. В экспериментах приняли участие 18 праворуких испытуемых (6 мужчин и 12 женщин) в возрасте от 18 до 45 лет (средний возраст 27.8 ± 1.4 лет), с нормальным слухом. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены Комиссией по этике ФГБУН Института физиологии им. И.П. Павлова РАН (Протокол № 22-02). Каждый участник исследования предоставил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования. Во время регистрации ЭЭГ испытуемые располагались в кресле внутри экранированной звукоизолированной камеры и во время звуковой стимуляции читали книгу по своему выбору. Звуковые сигналы предъявлялись испытуемым дихотическим способом. Дополнительные сведения о методике можно получить в предыдущих работах этого цикла (Шестопалова и др., 2022, 2023). Ниже приводятся сведения и детали, необходимые для понимания анализа реакций на выключение сигнала.
Все испытуемые до начала опытов проходили стандартную процедуру аудиометрии на частотах от 125 до 8000 Гц. Отклонения пороговых величин от нормального уровня слуха, а также разница между порогами, измеренными для правого и левого уха, не превышали 10 дБ. Полная программа эксперимента для каждого испытуемого распределялась на три дня с интервалом 1–2 нед. В начале каждого экспериментального дня у каждого испытуемого определяли пороги слышимости шумовых сигналов для правого и левого уха. Относительно этих индивидуальных порогов выставляли одинаковую интенсивность звука в правом и левом каналах и получали ответы испытуемого о воспринимаемом положении звукового образа. При необходимости проводилась коррекция интенсивности на одном из каналов таким образом, чтобы звуковой образ располагался ровно по средней линии головы. Далее интенсивность всех звуковых стимулов выставлялась относительно этих скорректированных значений.
Стимулы. Исходными сигналами служили два отрезка белого шума, синтезированные с частотой дискретизации 96 кГц и фильтрованные в полосе 200–10 000 Гц. Сигналы преобразовывались в аналоговую форму при помощи многоканальной аудиоплаты Gina24 (Echo Audio, США) и предъявлялись дихотически с помощью звукоизлучателей Etymotic ER-2 (Etymotic Research Inc., США).
Шумовые посылки, используемые в дальнейшем для создания тестового и маскирующего стимулов (сигнала и маскера соответственно), были синтезированы цифровым способом независимо из исходных сигналов, что обеспечивало отсутствие корреляции между сигналом и маскером. Пространственное положение всех стимулов задавалось величиной межушных различий по интенсивности (∆I) между бинаурально предъявляемыми сигналами. Межушные различия по интенсивности создавались одновременным увеличением интенсивности звука с одной стороны и уменьшением с другой на одинаковые величины, что позволяет при дихотическом предъявлении создать ощущение смещения звукового образа без изменения его громкости.
Длительность маскера составляла 9070 мс. Фронты длительностью 10 мс, сглаженные косинусоидальной функцией, были наложены в начале и в конце маскера, а также в начале и в конце каждого из тестовых сигналов. Здесь и далее длительность сигналов приводится без учета фронтов. В эксперименте использовались три типа маскеров, различавшихся только пространственным положением и условно обозначенных как левый, центральный и правый. Центральным маскером служил стимул с c ∆I = 0 дБ, вызывающий ощущение неподвижного звукового образа около средней линии головы. Левым и правым маскерами служили стимулы с ∆I = –10 и +10 дБ соответственно, вызывающие ощущение неподвижного звукового образа, расположенного вблизи левого или правого уха. Данное положение звукового образа соответствовало расчетному угловому смещению на ±90 град. Согласно литературным данным, полная латерализация звукового образа может наступать в диапазоне значений ∆I от 6 до 20 дБ (Dingle et al., 2012; Ozmeral et al., 2019). Следует подчеркнуть, что в данной работе воспринимаемые угловые расстояния не рассматриваются, поэтому угловые величины в градусах, приведенные здесь и далее, нужно рассматривать как категориальную меру.
Полная длительность тестового сигнала составляла 2000 мс. Каждый тестовый сигнал состоял из трех фрагментов, следующих друг за другом без паузы: 1) начального участка длительностью 1000 мс с постоянной величиной ∆I, равной 0 или ±10 дБ; 2) участка с линейным изменением ∆I (от 0 до ±10 дБ и от ±10 до 0 дБ, итого 4 вида сигналов) длительностью 200 или 400 мс; 3) конечного участка длительностью 800 или 600 мс соответственно, с постоянной конечной величиной ∆I, равной ±10 или 0 дБ. В представленной работе анализируются только вызванные реакции на выключение последнего фрагмента тестового сигнала; первые два фрагмента использовались для других задач. В дальнейшем изложении понятие “неподвижный тестовый сигнал/стимул” будет относиться именно к его конечному участку. На конечном участке сигнала постоянная величина ∆I принимала значения 0, +10 или –10 дБ в разных стимулах. Эти участки тестовых стимулов также вызывали ощущение неподвижного звукового образа, расположенного либо у средней линии головы, либо вблизи левого или правого уха.
Каждая проба в серии имела общую длительность 10 с и содержала трехкратное повторение тестового сигнала в тишине или на фоне одного из маскеров (центрального, у левого или у правого уха). Тестовые стимулы предъявлялись с интервалом 770 мс от конца одного стимула до начала следующего. В пробах с маскером начало первого тестового сигнала было отставлено от начала маскера на 770 мс, что позволяло отделить реакцию на включение сигнала от реакции на включение маскера. После третьего повторения тестового сигнала следовала пауза 760 мс, так что реакции на выключение сигнала и маскера были также разнесены во времени. При предъявлении тестовых стимулов в тишине (без маскера) интервалы между стимулами были точно такими же, как в условиях маскировки.
Интенсивность тестовых сигналов устанавливали на уровне 45 дБ над порогом слышимости каждого из ушей, интенсивность маскера – на уровне 50 дБ. Предъявление сигнала на фоне маскера приводило к увеличению общей интенсивности этого участка стимула на 6 дБ по сравнению с предъявлением только маскера. Таким образом, при одновременном дихотическом предъявлении общая интенсивность маскера и сигнала была около 56 дБ.
Процедура эксперимента. Левый, центральный и правый маскеры предъявлялись в разных сериях. Продолжительность одной серии составляла около 8 мин. Серии с каждым положением маскера предъявлялись каждому испытуемому по 4 раза и чередовались в случайном порядке в разные дни. Между сериями делались перерывы на отдых по 3–5 мин (или дольше по просьбе испытуемого). Тестовые сигналы в каждой экспериментальной серии могли предъявляться в тишине (4 типа стимула × 3 пробы × 3 повтора в пробе) или на фоне маскера (4 типа стимула × × 8 проб × 3 повтора в пробе) и тоже чередовались в случайном порядке. Таким образом, каждый тип стимула в тишине и на фоне каждого маскера предъявлялся каждому испытуемому по 96 раз. Угловое расстояние между тестовым сигналом и маскером определялось разницей величин ∆I между ними и в момент окончания стимула могло равняться 0, 90 или 180 град (следует напомнить, что приведенные угловые величины нужно рассматривать как категориальную меру).
Регистрация и обработка ЭЭГ. Регистрацию ЭЭГ осуществляли при помощи энцефалографа ActiveTwo (BIOSEMI, Голландия) и 32 хлорсеребряных электродов, расположенных в соответствии с международной системой 10–20, с заменой точек отведения PO3/PO4 на C5/C6. Дополнительные электроды располагали на мочках ушей, над правым глазом и под левым глазом, ближе к их внешнему краю. ЭЭГ оцифровывалась в полосе 0–102 Гц с частотой дискретизации 2048 Гц с последующим понижением до частоты 512 Гц и записывалась на жесткий диск компьютера. Дальнейшая обработка проводилась по окончании опыта. Непрерывную запись ЭЭГ разбивали на эпохи длительностью 10 000 мс. В среднем около 2% эпох содержали нестереотипные артефакты, их удаляли вручную при предварительном просмотре. В каждом отведении проводили коррекцию базовой линии относительно усредненного потенциала всех электродов, и фильтровали в диапазоне 0.5-45 Гц. Артефакты, связанные с движениями глаз, мышечной активностью и нарушениями контакта, удаляли при помощи метода независимых компонент (ICA) средствами EEGLab (Delorme et al., 2007). Затем ЭЭГ восстанавливали, в качестве референса принимали усредненный потенциал электродов на мочках ушей и проводили коррекцию базовой линии по предстимульному участку длительностью 930 мс перед началом маскера.
Для получения ВП ЭЭГ дополнительно фильтровали в полосе 2–30 Гц. Записи ЭЭГ в каждом из 32 каналов усредняли отдельно по всем типам стимулов для каждого испытуемого. В пределах каждой эпохи выделяли участки реакции на каждое из трех повторений тестового сигнала, содержавшие ответы на три типа слуховых событий – включение стимула, начало движения, выключение стимула. В данной работе приводятся результаты анализа только ВП на выключение. Для анализа эффектов пространственного положения маскера и сигнала индивидуальные записи ЭЭГ усредняли по группе 24 электродов (Fz, Cz, Fp1, AF3, F3, F7, FC1, FC5, C3, C5, T7, CP1, CP5, Fp2, AF4, F4, F8, FC2, FC6, C4, C6, T8, CP2 и CP6). Данная область интереса была выбрана по результатам визуального анализа топограмм ответов и с учетом предыдущих работ, в которых исследовались ВП на шумовые стимулы, различающиеся пространственными характеристиками (Шестопалова и др., 2022, 2023). Для получения гранд-усредненных потенциалов проводили усреднение по группе в целом (n = 18). В реакции на выключение тестового сигнала измеряли индивидуальные пиковые латентности и средние амплитуды компонентов N1, P2 и N2 в окне шириной 50 мс, центрированном на соответствующем пике гранд-усредненного потенциала. Точность автоматического определения латентности индивидуальных пиков контролировалась визуально, и в случае необходимости проводилась коррекция (от 3 до 18% случаев для разных компонентов и разных условий). Скорректированные величины не выходили за пределы удвоенной ширины окна.
Анализ данных. Измеренные величины подвергали предварительному 5-факторному дисперсионному анализу (repeated measures ANOVA, rmANOVA) с факторами Условие (в тишине, с маскером), Положение маскера в серии (левый, центральный, правый), Длительность участка движения (200, 400 мс), Направление движения стимула (слева к центру, справа к центру, от центра влево, от центра вправо), Положение стимула в эпохе (первый, второй, третий). По результатам дисперсионного анализа и попарных сравнений были выделены факторы, не влиявшие на амплитуду и латентность ответа на выключение, и проведено усреднение ВП между соответствующими условиями. В частности, были усреднены: 1) реакции на каждое из трех повторений тестового сигнала внутри эпохи; 2) реакции на сигналы, различавшиеся длительностью второго фрагмента (изменения ∆I в течение 200 или 400 мс); 3) реакции на одинаковые стимулы в тишине, предъявлявшиеся в качестве контроля в сериях с разным положением маскера; 4) ответы на стимулы, двигавшиеся справа и слева к центру, поскольку исследуемые в данной работе эффекты относились именно к последнему (конечному) фрагменту сигнала, и значимых различий в их характеристиках выявлено не было. В результате были получены выборки участков ЭЭГ, содержавших ВП на выключение сигнала в центре (394 ± 25 предъявлений), слева и справа (по 197 ± 12 повторений), при звучании в тишине либо на фоне левого, центрального или правого маскера. У полученных таким образом усредненных ВП снова измеряли индивидуальные пиковые латентности и средние амплитуды компонентов N1, P2 и N2 в окне шириной 50 мс, центрированном на соответствующем пике гранд-усредненного потенциала.
Измеренные величины подвергали 2-факторному дисперсионному анализу (repeated measures ANOVA, rmANOVA) с факторами Маскер (без маскера, левый, центральный, правый) и Сигнал (левый, центральный, правый). При отклонении данных от сферичности применяли поправку к степеням свободы Гринхауза–Гайссера. При проведении множественных сравнений применяли поправку Бонферрони. Все сравнения проводили с уровнем значимости p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
ВП на выключение тестового сигнала в условиях маскировки. Пример ВП на все три слуховых события (включение, начало изменения ∆I и выключение), имевших место в течение звукового стимула при его предъявлении в тишине, приведен на рис. 1. Вызванные потенциалы на выключение тестовых сигналов, предъявленных в тишине или при разных положениях маскера, приведены на рис. 2.
Рис. 1.
Пример ВП на включение (ВКЛ), начало движения (ДВИЖ) и выключение (ВЫКЛ) тестового сигнала, двигавшегося от центра вправо, предъявленного в тишине (тонкая черная линия) или на фоне центрального маскера (толстая серая линия). Стрелки около схемы головы соответствуют расчетной траектории движения тестового сигнала, а крестик – положению маскера. Стрелки над графиком показывают моменты наступления соответствующих слуховых событий. Fig. 1. An example of auditory event related potentials (ERPs) evoked by sound onset (ВКЛ), motion onset (ДВИЖ) and sound offset (ВЫКЛ). Test signal moving from the center to the right was presented in silence (thin black line) or against the background of the central masker (thick gray line). The arrows near the head scheme correspond to the calculated trajectory of the test signal, and the cross indicates the position of the masker. Arrows at the top show the moments of the corresponding auditory events.
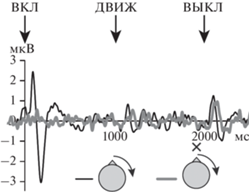
Рис. 2.
Вызванные потенциалы на выключение тестового сигнала, предъявленного в тишине или на фоне маскера разной локализации. Кружки около схемы головы демонстрируют положение тестового сигнала в момент выключения, а крестики – положение маскера. На всех графиках тонкая черная линия – сигнал без маскера, толстая черная линия – маскер у левого уха, пунктирная черная линия – маскер по центру головы, толстая серая линия – маскер у правого уха. Fig. 2. ERPs to the sound offset in silence or in the presence of a masker of different locations. The circles near the head scheme show the offset position of the test signal and the crosses show the position of the background masker. In all panels, thin black line corresponds to the signal presented in silence, thick black line – to the masker at the left ear, dotted black line – to the masker near the center, thick gray line – to the masker at the right ear.
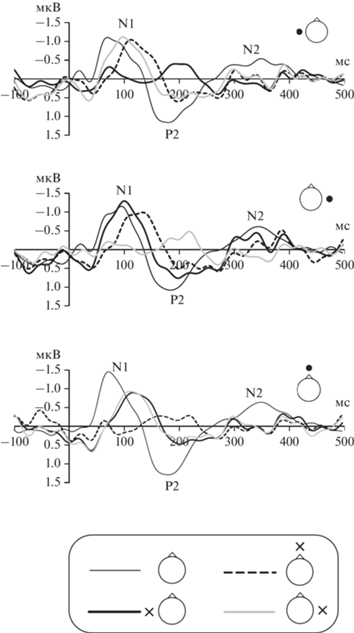
Дисперсионный анализ (rmANOVA) средних амплитуд компонентов N1, P2 и N2 (Маскер (без маскера, левый, центральный, правый) × Сигнал (левый, центральный, правый)) выявил для всех трех компонентов ВП высокую значимость главного эффекта Маскера (N1: F(2.06, 35.00) = 7.63, η2 = 0.31, p < 0.01; P2: F(2.09, 35.55) = 27.17, η2 = 0.62, p < 0.001; N2: F(2.00, 33.94) = 22.64, η2 = 0.57, p < 0.001). Для всех трех компонентов главный эффект Маскера связан с тем, что амплитуда компонентов при маскировке была меньше, чем в тишине. Главный эффект Сигнала был значимым только для амплитуды N2 (F(2.0, 34.00) = 4.67, η2 = 0.22, p < 0.05), при отсутствии значимого взаимодействия со вторым фактором (p > > 0.05). Согласно попарным сравнениям, этот эффект был связан с большей амплитудой N2 в реакции на правосторонний сигнал, чем на левосторонний (p < 0.05). Взаимодействие Маскер × Сигнал было значимо для амплитуд N1 и P2 (N1: F(3.55, 60.27) = 16.03, η2 = 0.49, p < 0.001; P2: F(3.10, 52.77) = 3.41, η2 = 0.17, p < 0.05). Результаты попарных сравнений rmANOVA показаны видом штриховки линий на рис. 3: сплошные линии указывают на достоверные различия (p < 0.05) в степени маскировки между соседними величинами угловых расстояний сигнала и маскера, а пунктирные отрезки соответствуют отсутствию достоверных различий (p > 0.05). Самое сильное подавление ВП наблюдалось в тех пространственных комбинациях, в которых межушные различия ∆I в маскере и сигнале совпадали, т.е. при нулевом угловом разнесении маскера и сигнала. Освобождение от маскировки проявлялось как рост амплитуды ВП при увеличении углового расстояния между маскером и сигналом от 0 до 90 град. Оно достигало уровня достоверности только для волны N1 (p < 0.05). Дальнейшее увеличение углового расстояния (с 90 до 180 град) не приводило к изменениям величины какого-либо из компонентов ВП (p > 0.05), за исключением амплитуды компонента N1 при ощущении сигнала справа. Попарные сравнения амплитуды компонента N1 ответов на сигналы в тишине и при разнесении с маскером на 90 и 180 градусов значимых различий не выявили (p > 0.05), то есть его амплитуда восстанавливалась до исходного уровня (под исходным уровнем мы имеем в виду ответ на тестовый сигнал в тишине). Однако амплитуда компонентов P2 и N2 в присутствии маскера все еще была достоверно ниже, чем в тишине (p < 0.05), при увеличении расчетного углового расстояния между сигналом и маскером до 90 град, и даже до 180 град, когда сигнал располагался слева, а маскер справа (в обратной комбинации различия были недостоверны).
Рис. 3.
Зависимость амплитуды и латентности компонентов ВП на выключение от углового расстояния между сигналом и маскером. В левой части рисунка приведены графики амплитуды исследуемых компонентов, в правой – латентности. Рядам соответствуют положения тестового сигнала слева, справа и по центру. Все сочетания взаимного расположения сигнала и маскера отложены по категориальной оси абсцисс в порядке возрастания углового расстояния: в тишине (без маскера), 0, 90, 180 град между сигналом и маскером. Черная линия соответствует показателям компонента N1, светло-серая – компонента P2, темно-серая – компонента N2. Пунктиром обозначены недостоверные различия (p > 0.05) между соседними значениями. Вертикальными черточками показана стандартная ошибка. Fig. 3. Effect of the signal-masker angular distance on the amplitude and latency of ERP components to the sound offset. Left column: the ERP amplitude. Right column: the ERP latency. The rows (top-down) correspond to the positions of the test signal on the left/right or at the center. All combinations of signal and masker are plotted along the categorical abscissa in ascending order of the angular distance: in silence (without masker), 0, 90, 180 deg between the signal and the masker. Black line, light gray line and dark gray line correspond to the N1, P2 and N2 components, respectively. The dashed line indicates non-significant differences (p > 0.05) between neighboring values. Vertical lines represent the standard errors.
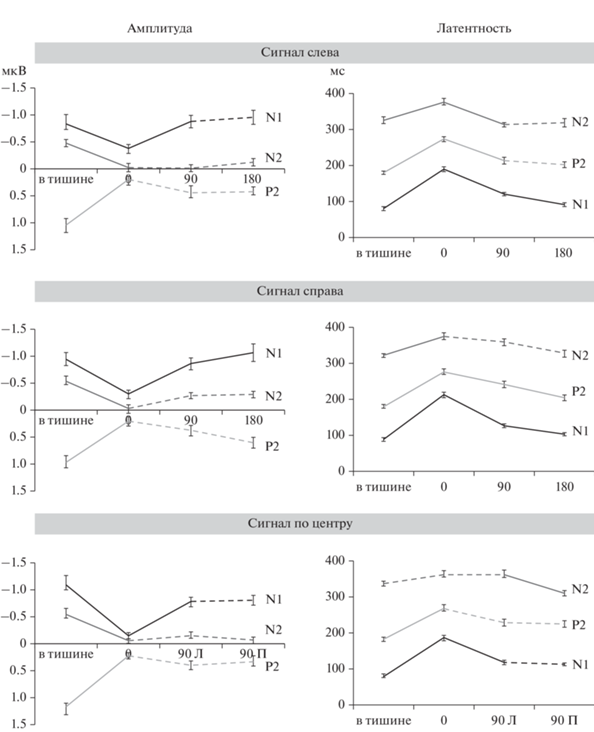
Аналогичный анализ пиковых латентностей N1, P2 и N2 выявил для всех трех компонентов высокую значимость главного эффекта Маскера (N1: F(2.12, 36.12) = 96.23, η2 = 0.85, p < 0.001; P2: F(2.20, 37.39) = 37.34, η2 = 0.69, p < 0.001; N2: F(2.13, 36.12) = 6.13, η2 = 0.27, p < 0.01). Главный эффект Сигнала был значимым только для латентности N1 (F(1.64, 27.86) = = 10.67, η2 = 0.39, p < 0.001). Взаимодействие Маскер*Сигнал было значимо для латентностей всех трех компонентов (N1: F(2.78, 47.33) = = 96.89, η2 = 0.85; P2: F(3.77, 64.13) = 22.22, η2 = 0.57; N2: F(4.24, 72.01) = 13.65, η2 = 0.45, p < 0.001 для всех). Согласно попарным сравнениям, эффект маскировки при совпадающем положении маскера и сигнала состоял в значимом росте латентностей для всех сигналов и для всех компонентов ВП (p < 0.05), кроме волны N2 в реакции на центральный сигнал (p > 0.05) (рис. 2 и 3). Освобождение от маскировки при разнесении сигнала и маскера на 90 град приводило к уменьшению латентности, наиболее выраженному для компонента N1. В отличие от амплитуд, латентности N1 и P2 продолжали сокращаться при дальнейшем увеличении углового расстояния с 90 до 180 град (p < 0.05, за исключением волны P2 в реакции на левосторонний сигнал).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На рис. 1 можно видеть, что в тишине ВП на выключение сигналов имели значительно меньшую амплитуду, чем ответы на включение, при сохранении латентности исследуемых компонентов. В работе Шестопаловой и др. (2022) приведены следующие величины компонентов ON-ответа в тишине, полученные в этом же эксперименте: амплитуда N1 в реакции на левый и правый сигнал –2.2 мкВ, а в реакции на центральный сигнал –1.9 мкВ; амплитуда P2 в реакции на все сигналы 2.7 мкВ. В настоящем эксперименте получены меньшие величины: амплитуда N1 в реакции на левый и правый сигнал –0.9 мкВ, а в реакции на центральный сигнал –1.1 мкВ; амплитуда P2 составила 1.0 и 1.2 мкВ соответственно. Различие в амплитуде ответов на включение и выключение сигнала в тишине – более чем двукратное. Такие различия характерны для амплитуды ВП на включение и выключение при одинаковом уровне звука, форме и длительности фронтов нарастания и спада, и временных интервалах между включением и выключением (Davis, Zerlin, 1966; Hillyard, Picton, 1978; Baltzell, Billings, 2014).
Как и в случае реакций на включение сигнала (Шестопалова и др., 2022), маскировка оказывала существенное влияние на амплитуду и латентность основных колебаний ВП. В условиях маскировки обнаружено значимое снижение амплитуды и увеличение латентности компонентов N1, P2 и N2 ответов на выключение сигнала при совпадении его положения с длящимся маскером. При разнесении в пространстве сигнала и маскера на расчетное угловое расстояние 90 град отмечен рост амплитуды и уменьшение латентности всех компонентов ВП на выключение, указывающие на пространственное освобождение от маскировки, однако восстановление амплитуды было достоверным только для компонента N1. Увеличение расчетного расстояния между сигналом и маскером до 180 градусов не вызывало значимого увеличения амплитуды ответов, но при этом значимо уменьшались пиковые латентности компонента N1 ответов на латерализованные сигналы (рис. 2 и 3). Описанные проявления освобождения от маскировки в ответах на окончание тестового сигнала в целом совпадают с изменениями ВП на его начало, полученных в тех же условиях и на тех же испытуемых (Шестопалова и др., 2022). Наличие пространственного освобождения от маскировки свидетельствует о том, что в генерации этих ответов участвуют нейронные популяции, обрабатывающие бинауральные различия. Сходство между воздействием маскировки на вызванные потенциалы на включение и выключение звука подтверждает предположение, что эти два события обрабатываются популяциями нейронов, которые частично совпадают.
Однако обнаружены и некоторые отличия между ответами на включение и выключение звуковых стимулов. В условиях маскировки при разнесении сигнала и маскера в пространстве амплитуда компонента N1 ответа на выключение восстанавливалась до исходного уровня, чего не наблюдалось в ответах на включение. Следовательно, при пространственном освобождении от маскировки реакция на выключение сигнала подавляется в меньшей степени, чем реакция на включение. Можно предположить, что восстановление амплитуды до исходного уровня соответствует лучшему обнаружению сигнала. С другой стороны, латентность N1 ВП на выключение сильно изменялась в условиях маскировки. При совпадении пространственных признаков сигнала и маскера увеличение пиковой латентности компонента N1 ответа на выключение могло достигать порядка 100 мс, тогда как аналогичная величина для ответов на включение составляла около 50 мс (Шестопалова и др., 2022). Возможно, механизм генерации ответа на выключение стимула в условиях маскировки задействует более сложные нейронные сети, что увеличивает время анализа сенсорной информации, но способствует выделению сигнала из шума.
В работе (Baltzell, Billings, 2014), где исследовалась зависимость ВП на выключение от интенсивности стимула и соотношения сигнал/шум, было показано, что волна N2 играет гораздо большую роль в величине ВП на выключение, чем ответах на включение. Авторы объясняют это большим вкладом тормозных нейронов в генерацию ответов на выключение, либо большей чувствительностью ответа на выключение к соотношению сигнал/шум. На этом основании мы могли бы предполагать, что компонент N2 будет наиболее устойчив к условиям маскировки. Однако в нашей работе волна N2 была подавлена почти до полного исчезновения. Возможным объяснением этого явления могут быть различия в применявшихся звуковых сигналах. В цитированной работе испытуемым предъявляли тональные сигналы на фоне шумового маскера, что могло приводить к непроизвольному переключению внимания и отражаться в амплитуде компонента N2. В нашем исследовании сигнал и маскер не различались по частотным характеристикам, и непроизвольного переключения внимания, вероятно, не происходило.
Интерпретация изменений ранних и поздних компонентов ВП в реакциях на пространственные стимулы может проводиться с привлечением двухступенчатой модели (Ducommun et al., 2002). Авторы сравнивали вызванные ответы на включение звуковых стимулов, отличающихся по положению и движущихся, и выделяли два временных периода обработки стимула: начальная фаза (0–250 мс) предположительно соответствовала накоплению информации и интеграции акустических признаков, а следующая фаза могла быть связана с распознаванием направления движения. Позднее эта концепция была использована для объяснения функциональных различий раннего и позднего компонентов ВП на начало движения (Getzmann, 2011). В нашей работе показано разное воздействие маскировки на амплитуду и латентность ранних и поздних компонентов ВП на выключение: волна N1 полностью восстанавливалась, а подавление компонентов P2 и N2 сохранялось даже при сильном разнесении сигнала и маскера в пространстве. Однако в момент выключения стимула поступление новой информации в слуховую систему прекращается, поэтому генерацию поздних компонентов ВП невозможно объяснить накоплением информации и анализом сложных признаков, следовательно, двухступенчатая модель в данном случае неприменима. Можно предположить, что активность, соответствующая поздним компонентам ВП, в значительной степени отражает сравнение последнего обнаруженного слухового события с кратковременным контекстом. Возможно, более сильное подавление поздних компонентов ответа в условиях одновременной маскировки связано с тем, что продолжающееся воздействие маскера с теми же частотными характеристиками затрудняет это сравнение.
Согласно анализу топографии ответов на разные слуховые события (Шестопалова и др., 2023), в тишине компонент N1 ответа на включение демонстрировал контралатеральное преобладание, а компонент P2 – правостороннее. Асимметрия усиливалась в присутствии маскера в противоположной сигналу половине акустического пространства, и уменьшалась, если положение сигнала и маскера совпадало. В то же время в цитированной работе не было обнаружено асимметрии распределения ответа по скальпу ни для каких компонентов ВП на выключение, ни в тишине, ни в условиях маскировки. Эти различия можно интерпретировать как свидетельство того, что популяции нейронов, отвечающие на включение и выключение, частично различаются. Предположительно, симметричное распределение ВП на выключение может быть результатом более активного межполушарного взаимодействия и синхронизации активности в слуховой коре обоих полушарий.
Возможно, механизм формирования ответа на выключение следует рассматривать в рамках концепции каскада взаимосвязанных электрических реакций, при котором одни нейронные популяции реагируют на активность других (Dexter, 2018; Muraskin et al., 2018). ВП на выключение может генерироваться широким нейронным ансамблем, реагирующим на прекращение активности отдельных пространственно-чувствительных популяций и обеспечивающим временную перцептивную группировку. Реакции этого ансамбля могут различаться величиной и латентностью (но не топографией) в зависимости от того, какая именно популяция была “выключена”. При выключении популяции, активность которой была сильно подавлена в условиях маскировки (при совпадении положения сигнала и маскера), реакция широкого ансамбля может быть слабой и достаточно поздней, и в результате наблюдается подавленный и запаздывающий ответ на выключение. При выключении популяции, сохранившей свою активность при маскировке, реакция широкого ансамбля окажется более быстрой и большей по величине. В отсутствие маскера после выключения сигнала наступает тишина, поэтому ответ на выключение оказывается максимальным.
ЗАКЛЮЧЕНИЕ
В присутствии длящегося неподвижного маскера амплитуда ВП на выключение была меньше, а их латентность увеличивалась по сравнению с ответами на выключение тех же сигналов в тишине. Этот эффект был наиболее выражен при совпадении положения тестового сигнала и маскера. При удалении сигнала от маскера на 90 градусов наблюдалось пространственное освобождение от маскировки, выразившееся в увеличении амплитуды и уменьшении латентности всех компонентов отклика. Амплитуда компонента N1 восстанавливалась до исходного уровня (амплитуды ответа на сигнал в тишине), что может свидетельствовать об успешном выделении стимула из фона. При этом амплитуда компонентов P2 и N2 не достигала исходного уровня. Дальнейшее увеличение расстояния между сигналом и маскером не вызывало достоверного увеличения амплитуды вызванных потенциалов на выключение.
Обнаруженные закономерности позволяют предположить, что выключение сигнала может играть значительную роль при выделении стимула из фона. Наличие пространственного освобождения от маскировки указывает на то, что механизм генерации ответов на выключение включает в себя нейронные сети, обрабатывающие пространственные признаки.
Список литературы
Петропавловская Е.А., Шестопалова Л.Б., Вайтулевич С.Ф. Проявления инерционности слуховой системы при локализации движущихся звуковых образов малой длительности. Физиология человека, 2010. 36 (4): 34–44.
Петропавловская Е.А., Шестопалова Л.Б., Вайтулевич С.Ф. Предсказательная способность слуховой системы при плавном движении и скачкообразном перемещении звуковых образов малой длительности. Журн. высш. нервн. деят. им. И.П. Павлова. 2011. 61 (3): 293–305.
Семенова В.В., Шестопалова Л.Б., Петропавловская Е.А., Саликова Д.А., Никитин Н.И. Латентность вызванного потенциала как показатель интегрирования акустической информации о движении звука. Физиология человека. 2022. 48 (4): 57–68.
Шестопалова Л.Б., Петропавловская Е.А., Саликова Д.А., Семенова В.В., Никитин Н.И. Слуховые вызванные потенциалы человека в условиях пространственной маскировки. Физиология человека. 2022. 48 (6): 32–43.
Шестопалова Л.Б., Петропавловская Е.А., Саликова Д.А., Семенова В.В. Влияние слуховой пространственной маскировки на межполушарную асимметрию вызванных ответов. Физиология человека. 2023. 49 (4): 16–29.
Abeles M., Goldstein Jr. M.H. Responses of single units in the primary auditory cortex of the cat to tones and to tone pairs. Brain Res. 1972. 42: 337–352.
Baltzell L.S., Billings C.J. Sensitivity of offset and onset cortical auditory evoked potentials to signals in noise. Clin. Neurophysiol. 2014. 125 (2): 370–380.
Billings C.J., Tremblay K.L., Souza P.E., Binns M.A. Effects of hearing aid amplification and stimulus intensity on cortical auditory evoked potentials. Audiol. Neurootol. 2007. 12: 234–246.
Billings C.J., Tremblay K.L., Stecker G.C., Tolin W.M. Human evoked cortical activity to signal-to-noise ratio and absolute signal level. Hear Res. 2009. 254: 15–24.
Carlile S., Leung J. The Perception of Auditory Motion. Trends. Hear. 2016. 20: 1–19.
Davis H., Zerlin S. Acoustic relations of the human vertex potential. J. Acoust. Soc. Am. 1966. 39: 109–116.
Delorme A., Sejnowski T., Makeig S. Enhanced detection of artifacts in EEG data using higher-order statistics and independent component analysis. Neuroimage. 2007. 34 (4): 1443–1449.
Dexter R.F.I. Auditory perceptual learning and changes in the conceptualization of auditory cortex. Hearing Research. 2018. 366: 3–16.
Dingle R.N., Hall S.E., Phillips D.P. The three-channel model of sound localization mechanisms: interaural level differences. J. Acoust. Soc. Am. 2012. 131 (5): 4023–4029.
Dirks D.D., Morgan D.E., Dubno J.R. A procedure for quantifying the effects of noise on speech recognition. J. Speech Hear Disord. 1982. 47: 114–123.
Ducommun C.Y., Murray M.M., Thut G., Bellmann A., Viaud-Delmon I., Clarke S., Michel C.M. Segregated Processing of Auditory Motion and Auditory Location: An ERP Mapping Study. NeuroImage. 2002. 16: 76–88.
Getzmann S. Auditory motion perception: onset position and motion direction are encoded in discrete processing stages. European J. Neuroscience. 2011. 33: 1339–1350.
Gordon-Salant S., Fitzgibbons P.J. Temporal factors and speech recognition performance in young and elderly listeners. J. Speech Hear. Res. 1993. 36 (6): 1276–1285.
Grose J.H., Buss E., Hall J.W. 3rd. Within- and across-channel factors in the multiband comodulation masking release paradigm. J. Acoust. Soc. Am. 2009. 125 (1): 282–293.
Hari R., Pelizzone M., Makela J.P., Hallstrom J., Leinonen L., Lounasmaa O. V. Neuromagnetic responses of the human auditory cortex to on- and offsets of noise bursts. Audiology. 1987. 26: 31–43.
Harris K.C., Wilson S., Eckert M.A., Dubno J.R. Human evoked cortical activity to silent gaps in noise: effects of age, attention, and cortical processing speed. Ear Hear. 2012. 33 (3): 330–339.
He J., Hashikawa T., Ojima H., Kinouchi Y. Temporal integration and duration tuning in the dorsal zone of cat auditory cortex. J. Neurosci. 1997. 17: 2615–2625.
Hillyard S.A., Picton T.W. On and off components in the auditory evoked potential. Percept. Psychophys. 1978. 24: 391–398.
Hornsby B.W.Y., Trine T.D., Ohde R.N. The effects of high presentation levels on consonant feature transmission. J. Acoust. Soc. Am. 2005. 118: 1719–29.
Horváth J. Attention-dependent sound offset-related brain potentials. Psychophysiology. 2016. 53: 663–677.
Irsik V.C., Almanaseer A., Johnsrude I.S., Herrmann B. Cortical Responses to the Amplitude Envelopes of Sounds Change with Age. J. Neurosci. 2021. 41 (23): 5045–5055.
Kopp-Scheinpflug C., Tozer A.J., Robinson S.W., Tempel B.L., Hennig M.H., Forsythe I.D. The sound of silence: ionic mechanisms encoding sound termination. Neuron. 2011. 71 (5): 911–925.
Kopp-Scheinpflug C., Sinclair J.L., Linden J.F. When Sound Stops: Offset Responses in the Auditory System. Trends Neurosci. 2018. 41 (10): 712–728.
Litovsky R.Y. Spatial release from masking. Acoust. Today. 2012. 8: 18.
Mlynarsky W., McDermott J.H. Ecological origins of perceptual grouping principles in the auditory system. PNAS. 2019. 116 (50): 25355–25364.
Muraskin J., Brown T.R., Walz J.M., Tu T., Conroy B., Goldman R.I., Sajda P. A multimodal encoding model applied to imaging decision-related neural cascades in the human brain. NeuroImage. 2018. 180 (A): 211–222.
Noda K., Tonoike M., Doi K., Koizuka I., Yamaguchi M., Seo R., Kubo T. Auditory evoked off-response: its source distribution is different from that of on-response. Neuroreport. 1998. 9: 2621–2625.
Ozmeral E.J., Eddins D.A., Eddins A.C. Electrophysiological responses to lateral shifts are not consistent with opponent-channel processing of interaural level differences. J. Neurophysiol. 2019. 122 (2): 737–748.
Pantev C., Eulitz C., Hampson S., Ross B., Roberts L.E. The auditory evoked ‘‘off’’ response: sources and comparison with the ‘‘on’’ and ‘‘sustained’’ responses. Ear & Hearing. 1996. 17: 255–265.
Phillips D.P., Hall S.E., Boehnke S.E. Central auditory onset responses, and temporal asymmetries in auditory perception. Hear. Res. 2002. 167: 192–205.
Qin L., Chimoto S., Sakai M., Wang J., Sato Y. Comparison between offset and onset responses of primary auditory cortex ON–OFF neurons in awake cats. J. Neurophysiol. 2007. 97: 3421–3431.
Recanzone G.H. Response profiles of auditory cortical neurons to tones and noise in behaving macaque monkeys. Hear. Res. 2000. 150: 104–118.
Schneider B.A., Pichora-Fuller M.K., Kowalchuk D., Lamb M. Gap detection and the precedence effect in young and old adults. J. Acoust. Soc. Am. 1994. 95(2): 980–991.
Scholl B. Gao X., Wehr M. Nonoverlapping sets of synapses drive on responses and off responses in auditory cortex. Neuron. 2010. 65: 412–421.
Skoe E., Krizman J., Anderson S., Kraus N. Stability and plasticity of auditory brainstem function across the lifespan. Cereb. Cortex. 2015. 25 (6): 1415–1426.
Snell K.B., Frisina D.R. Relationships among age-related differences in gap detection and word recognition. J. Acoust. Soc. Am. 2000. 107 (3): 1615–1626.
Studebaker G.A., Sherbecoe R.L., McDaniel D.M., Gwaltney C.A. Monosyllabic word recognition at higher-than-normal speech and noise levels. J. Acoust. Soc. Am. 1999. 105: 2431–2444.
Szabó B.T., Denham S.L., Winkler I. Computational Models of Auditory Scene Analysis: A Review. Front Neurosci. 2016. 10: Art. 524.
Traer J., McDermott J.H. Statistics of natural reverberation enable perceptual separation of sound and space. Proc. Natl. Acad. Sci. U. S. A. 2016. 113: 7856–7865.
Volkov I.O., Galazjuk A.V. Formation of spike response to sound tones in cat auditory cortex neurons: interaction of excitatory and inhibitory effects. Neuroscience. 1991. 43: 307–321.
Yamashiro K., Inui K., Otsuru N., Kakigi R. Change-related responses in the human auditory cortex: An MEG study. Psychophysiology. 2011. 48: 23–30.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


