Журнал высшей нервной деятельности им. И.П. Павлова, 2022, T. 72, № 5, стр. 690-696
Динамика альфа-ритма ЭЭГ как биомаркер обучения новым двигательным навыкам после операции по аутотрансплантации мышц у детей больных артрогрипозом
Е. Д. Благовещенский 1, *, О. Е. Агранович 2, М. М. Корякина 1, Д. О. Бредихин 1, А. Н. Шестакова 1
1 Центр нейроэкономики и когнитивных исследований, Институт когнитивной нейронауки,
Национальный исследовательский университет Высшая школа экономики
Москва, Россия
2 НИИ детской ортопедии им. Т. Турнера
Санкт-Петербург, Россия
* E-mail: eblagovechensky@hse.ru
Поступила в редакцию 15.03.2022
После доработки 15.04.2022
Принята к публикации 26.04.2022
- EDN: KXSDLK
- DOI: 10.31857/S0044467722050045
Аннотация
Обучение новым навыкам движения является критическим фактором при лечении определенных моторных заболеваний. Так, при лечении у детей с врожденной атрофей бицепса (артрогрипоз) применяется инновационная методика, связанная с аутотрансплантацией донорских мышц, которые начинают выполнять роль нефункционирующего бицепса. В этом случае после операции пациент сталкивается с уникальной ситуацией – имеется возможность выполнять паттерны движения, которые никогда не выполнялись до операции. Возможно, выполнение новых движений не всегда связанна только с эффектами хирургической операции, но и с необходимыми нейропластическими перестройками в центральной нервной системе. В данном исследовании были проанализированы изменения в наиболее выраженной нейродинамической составляющей активности мозга – α ритме – в контексте обучения новым двигательным паттернам у детей после вышеупомянутой операции. Обнаружено, что у некоторых пациентов существенный прогресс двигательных навыков коррелирует со скачкообразным увеличением мощности в альфа-диапазоне ЭЭГ. Это, возможно, указывает, что α ритм может быть также биомаркером и предиктором эффективности операции по аутотрансплантации мышц в случае лечения артрогрипоза.
ВВЕДЕНИЕ
Артрогрипоз является врожденным заболеванием, вызванным отмиранием групп мотонейронов в передних рогах спинного мозга. Таким образом, нарушается иннервирование определенных мышц, связанных с данными мотонейронами, что, в свою очередь, приводит к деградации соответствующих мышц (Morrey et al., 1981; Oishi et al., 2019). Это отражается в том, что ребенок рождается с некоторыми недоразвитыми или отсутствующими мышцами. Особо стоит отметить, что данное заболевание не является прогрессирующим. Как известно, некоторые мышцы не имеют дублеров (многие движения производятся сразу несколькими мышцами, поэтому отсутствие одной не служит критичным фактором для успешности выполнения движения), однако такая мышца, как бицепс, является уникальной для осуществления полноценного функционирования верхней конечности. Отсутствие бицепса приводит к тому, что пациент не может полноценно себя обслуживать в обычной жизни, несмотря на сохранность остальных мышц (Mikati, 2007). Для лечения данного заболевания используется операция по аутотрансплантации большой грудной, либо широчайшей мышцы спины на место бицепса. Таким образом, пересаженная мышца начинает выполнять не свойственные ей функции и должна действовать синергично в окружении других мышц (Agranovich et al., 2019; van Bosse et al., 2017). Изменение паттерна активности пересаженной мышцы требует существенных нейропластических изменений. В первую очередь, в коре головного мозга, так как было показано, что начальные изменения при выработке нового двигательного навыка отражаются именно на самом верхнем уровне моторного контроля – коре больших полушарий. Также в данном случае имеется интересный феномен: мозг не только должен научиться новому паттерну двигательной активности, а по сути, он должен освоить новую степень свободы – сгибание руки в локтевом суставе (Blagovechtchenski et al., 2019). На наш взгляд данная ситуация уникальна – мы сталкиваемся не с эффектами восстановления утраченных навыков (“реабилитация”), а обучению несколько по-другому использовать верхние конечности (“абилитация”).
К сожалению, в доступной литературе имеется крайне мало сообщений, касающихся изменений в головном мозге после трансплантации мышц, и обычно данные работы связаны с феноменом “реабилитации”. Так имеются данные о структурных перестройках после ампутации конечностей (Adkins et al., 2021). Например, было показано, что после ампутации или трансплантации конечностей (единичные случаи) наблюдаются перестройки в организации представительств первичной сенсорной и моторной коры. Данные перестройки связанны именно с латеральностью, так как происходят в контралатеральных представительствах конечностей, на которых происходили хирургические воздействия (Chen et al., 1998). Имеется большой пласт работ, связанных с перестройками в моторной коре вызванных операционными вмешательствами связанными с лечением инсульта или удалением опухолей (Traversa et al., 1997, 1998). Четко прослеживается изменение моторных карт, но оно мозаично: нельзя точно сказать, что в случае отсутствия той или иной мышцы (как при ампутации) или части моторной коры (в случае хирургического удаления) имеется прямая зависимость – активность мышцы/представительство в коре (Grefkes et al., 2013; Ward, 2003). Возможно, такая ситуация также связанна с погрешностью методов оценки функциональной активности (ТМС, фМРТ, МЭГ) (Maris et al., 2007; Rossini et al., 2015). Однако, хочется еще раз подчеркнуть, что все эти исследования связаны с тем, как происходит феномен реабилитации, то есть попытки мозга пациента восстановить утраченные функции.
В случае лечения артрогрипоза перед мозгом пациента возникает абсолютно другая проблема: как перестроить уже сложившуюся активность под выполнение абсолютно новых и ключевых задач – освоение новых степеней свободы верхних конечностей (Blago-vechtchenski et al., 2019)? Под степенью свободы мы подразумеваем новоприобретенную возможность сгибать руку в локтевом суставе.
В предыдущих работах нами было показано, что активность мозга у детей, больных артрогрипозом и здоровых существенно отличается в параметрах ЭЭГ (Blagoveschenskiy et al., 2018a). Так, основные отличия наблюдаются в области мощности большинства диапазонов (альфа, бета, тетта и гамма). Т.к. у большинства пациентов, исследуемых нами, имелась положительная динамика лечения артрогрипоза, мы предположили, что и динамика осцилляторной активности мозга тоже будет изменяться в сторону увеличения мощности ритмов. В данной статье мы представили результаты, где оценивается динамика альфа-ритма после проведения операции по пересадке мышц (большой грудной или широчайшей мышцы спины) на место бицепса. Также стоит подчеркнуть трудность логистики исследований: пациенты приезжают на повторные исследования только исходя из рекомендаций наблюдающих врачей, и обеспечить регулярные сессии записи ЭЭГ не представлялось возможным. В итоге из 64-х пациентов, находящихся под наблюдением за три года только у семи, мы смогли найти относительно регулярные записи ЭЭГ в соответствии с тестами. С учетом того, что такие исследования являются уникальными (см. обсуждение), на наш взгляд даже такая небольшая выборка может дать некоторое понимание картины происходящего и направления дальнейшего исследования вопроса.
С точки зрения обработки ЭЭГ были оценены такие параметры, как амплитуда α-ритма и его характеристика, отражающая нейродинамические свойства осцилляций, – длинновременные корреляции (ДВК). Последний параметр является косвенной оценкой лабильности осцилляторных процессов (Hardstone et al., 2012). Выбор α-ритма был обусловлен тем, что данный ритм имеет наиболее выраженную структуру в ЭЭГ человека, в том числе по соотношению сигнал/шум (Brinkman et al., 2014).
Цель статьи
В данной статье показаны относительно уникальные данные – изменение ЭЭГ у детей, которым произвели операцию по пересадке мышцы. Таким образом, у детей возникла новая степень свободы движения руки (возможность сгибать руку в локтевом суставе), и мы попытались оценить возможные маркеры того, как мозг адаптируется к такой новой ситуации.
МЕТОДИКА
Пациенты
Были проведены повторные записи ЭЭГ у 7 пациентов с артрогрипозом (2 мужского, 7 женского пола) в возрасте от 3 до 15 лет (средний возраст 8.1 года ±5.1 (стандартное отклонение)). Данные о пациентах приведены в табл. 1.
Таблица 1.
Данные пациентов на момент начала регистрации. Возраст приведен на момент проведения операции. Уровень поражения соотносится с сегментами спинного мозга Table 1. Patient data at the start of registration. Age is given at the time of surgery. The level of the lesion correlates with the spinal cord segments
| Пациент N | Возраст | Уровень поражения | Диагноз |
|---|---|---|---|
| 1 | 5 | С5-С6, L2-S1 | Артрогрипоз с поражением верхних и нижних конечностей. Верхний и нижний парапарез |
| 2 | 3 | C5-С7, L4-S1 | Артрогрипоз с поражением верхних и нижних конечностей. Верхний и нижний парапарез |
| 3 | 15 | С5-Th1, L5-S1 | Артрогрипоз с поражением верхних и нижних конечностей. Верхний и нижний тотальный вялый парапарез |
| 4 | 15 | C5-C7 | Артрогрипоз с поражением верхних и нижних конечностей. Верхний и нижний парапарез |
| 5 | 4 | С5-С7 | Артрогрипоз с поражением верхних конечностей. Верхний вялый парапарез с акцентом справа. Дизартрия стертая форма. |
| 6 | 10 | С6-C7 | Артрогрипоз с поражением верхних конечностей. Верхний вялый парапарез |
| 7 | 6 | C5-C7 | Артрогрипоз с поражением верхних конечностей. Верхний вялый парапарез |
Регистрация ЭЭГ проводилась после аутотрансплантации различных групп мышц в позицию двуглавой мышцы плеча.
Оценка тяжести заболевания и успешности реабилитации
Восстановление активного сгибания в локтевом суставе осуществлялись путем аутотрансплантации следующих вариантов мышечных лоскутов: большая грудная мышца (БГМ) у трех (N1, N4, N6) и широчайшая мышца спины (ШМС) у четырех пациентов. При клиническом исследовании пациентов оценивались следующие показатели: амплитуда движений в локтевом суставе (активные и пассивные), сила мышц сгибателей предплечья по 5-балльной шкале (модифицированная шкала Van Heest (Van Heest et al., 1998)).
Запись ЭЭГ
Регистрация ЭЭГ проводилась в шумоизолированном помещении, где находились пациент и сопровождающая персона (медицинский сотрудник или один из родителей). Для регистрации ЭЭГ использовался 21-канальный усилитель NVX-36 (производство МКС, Россия). Использовалась система регистрации 10–20%. В качестве референта использовался электрод Cz. Для дальнейшего анализа проводилось усреднение относительно среднего значения референта. Частота дискретизации составляла 500 Гц. Запись проводилась в течение 10–20 минут, непрерывно.
При регистрации ЭЭГ дети просматривали спокойные видеоролики (мультфильмы или видеоклипы). Просмотр видеороликов был обусловлен следующим фактором: на этапе разработки парадигмы записи выявлено, что большинство детей при 10-минутной записи без каких-либо задач либо начинают активно жаловаться на скуку, либо засыпают, что существенно влияет на интерпретацию результатов.
Перед непосредственным анализом запись ЭЭГ подверглась фильтрации и удалении артефактов. Фильтрация проводилась в полосе пропускания сигнала 1–45 Гц (двухсторонний фильтр Батерворта четвертого порядка). При помощи визуальной оценки были выявлены и удалены из анализа каналы и эпохи с высоким уровнем шума. Артефакты от моргания удалялись при помощи анализа независимых компонент пакетом FastICA (Hyvarinen, 1999).
Анализ данных проводился в α-диапазоне 8–12 Гц. Были проанализированы следующие параметры: средняя амплитуда ритма и ДВК. Для оценки амплитуды ритма измерялось среднее значение на основе огибающей сигнала после полосной частотной фильтрации (8–12 Гц). Огибающая кривая строилась на основе преобразования Гилберта.
С целью оценки ДВК использовался метод детрендированного флуктационного анализа с окнами 5–50 секунд. Данный метод является разновидностью автокорреляционного анализа, применимого к нестационарным процессам. Подробное описание данного анализа приводится у Хардстона и соавт. (Hardstone et al., 2012).
К сожалению, так как в наличии было всего 21 канал ЭЭГ, то анализ источников не представлялся возможным. Приведенные данные анализа являются усредненными значениями по всем регистрируемым каналам ЭЭГ. В дополнительных материалах имеется представление топограм для α- и θ-ритмов.
Регулярность записи ЭЭГ
Нами были выбраны пациенты (7 человек из 64 наблюдаемых нами пациентов), у которых регистрация ЭЭГ попадала в относительно определенные периоды/окна после операции, однако даже при таком подходе не удалось найти пациентов с одновременными записями во всех четырех интервалах. Мы обозначили следующие временные интервалы после операции: спустя две недели, спустя полгода (±1 месяц), спустя год (±2 месяца), спустя полтора года (±3 месяца). Данные временные интервалы отображаются далее, как интервалы 1, 2, 3 и 4.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
У семи пациентов были записаны повторные ЭЭГ и измерения силы мышцы, а также оценены навыки самообслуживания. У всех пациентов было обнаружено улучшение качества самообслуживания, а также силы пересаженной мышцы. На рис. 1 представлена типичная ЭЭГ запись (пациент N1).
Рис. 1.
Пример записи ЭЭГ у пациента N1 с 187 по 204 секунды записи. Fig. 1. Example of EEG recording of patient N1 from 187 to 204 seconds of recording.
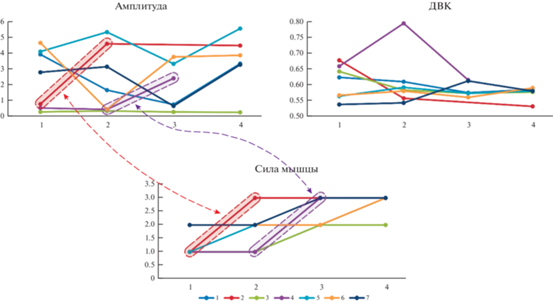
На рис. 2 представлены изменения в амплитуде и ДВК для всех семи пациентов. Следует отметить следующие особенности: наиболее сильные изменения в силе мышцы после аутотрансплантации на место бицепса соответствуют одним из максимальных изменений в амплитуде α-ритма (пациенты N2 и N4). Однако, в ДВК нельзя заметить такой тенденции. На рис. 2 отображены такие тенденции. Кроме того, наиболее серьезные изменения субъективной оценке улучшения самообслуживания также наблюдались именно у данных пациентов.
Рис. 2.
На панели сверху показаны панели изменений амплитуды (µВт) и ДВК (значение экспоненты (Hardstone et al., 2012)) в α-ритме. На панели снизу – изменения в силе мышцы (по модифицированной шкале Van Heest (Blagoveschenskiy et al., 2018a)). Цветовым кодом (от 1 до 7) показаны эффекты у 7-ми пациентов. Стрелками обозначены наиболее существенные изменения в амплитуде и соответствия этому изменению в силе мышц. Fig. 2. The panel above shows the panels of changes in amplitude (µW) and long-run correlations (exponent value (Hardstone et al., 2012)) in the alpha rhythm. The panel below shows changes in muscle strength (modified Van Heest scale (Blagoveschenskiy et al., 2018a)). The color code (1 to 7) shows the effects in 7 patients. Arrows indicate the most significant changes in amplitude and correspond to this change in muscle strength.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Особенности регистрации ЭЭГ у больных детей
Следует в первую очередь упомянуть особенности регистрации ЭЭГ у детей с моторными заболеваниями. С одной стороны, у таких детей двигательная активность несколько снижена (исходя из опыта авторов) по сравнению со здоровыми детьми. С другой стороны, поскольку использовалась практика повторной записи ЭЭГ, мы видели, что дети с каждым разом все спокойнее относятся к данной процедуре. Возможно, этот фактор может накладывать особенности на полученные результаты. Однако, нам не удалось найти в литературе оценки роли данного фактора.
Оценка динамики ЭЭГ
При оценке динамики ЭЭГ у детей следует учитывать сильную вариабельность в отличие от взрослых. Как указывалось выше, данная работа является продолжением предыдущего исследования, где нами было показано среднее уменьшение мощности α-ритма у детей с артрогрипозом по сравнению со здоровыми (Blagoveschenskiy et al., 2018b). Мы ожидали увеличение мощности альфа-осцилляции при успешных процессах абилитации. Как можно видеть из представленных данных, наиболее существенные изменения в мощности α-ритма произошли у пациентов, у которых наиболее выражены изменения в моторных навыках. Хотя стоит отметить, что у некоторых пациентов имеются и негативные сдвиги при небольшой позитивной динамике в моторике. К сожалению, невозможно провести статистический анализ на семи пациентах. Однако, наблюдение за вероятной связью резких изменений в ЭЭГ с резкими положительными изменениями в процессах абилитации, может, на наш взгляд, служить предметом для дальнейших исследований. Нейродинамическиий показатель, в качестве которого выступал ДВК, как мы и ожидали, сильно не изменился. Это согласуется с предыдущим исследованием (Blagoveschenskiy et al., 2018b), где у детей с артрогрипозом и здоровых детей ДВК не отличались.
К сожалению, не имелось возможности оценить разновидность α-ритма – μ-ритм, так как этот ритм завязан на конкретных источниках, расположенных в сенсомоторных областях коры. Для полноценного решения обратной задачи локализации μ-ритма 21 электрода недостаточно, а оценка активности над электродами C3 или С4 не может свидетельствовать о происхождении ритма из-за того, что мозг является объемным проводником. Топография α-ритма не показывает определенных паттернов (см. рис. 1 в дополнительных материалах).
Таким образом, крайне тяжело полноценно отслеживать динамику у детей в ЭЭГ после проведенных операций по логистическим причинам. Этот факт также находит отражение в доступной литературе: практически отсутствуют работы с лонгитюдной оценкой изменений в ЭЭГ у детей/взрослых после трансплантации мышц. Большинство работ связано с реабилитацией моторных навыков (например, запрос в базе pubmed (https://pubmed.ncbi.nlm.nih.gov/) “autotransplantation of muscles and EEG” дает четыре ссылки, которые не имеют никакого отношения к обсуждаемой теме). Имеются редкие работы, связанные только с некоторыми особенностями перестроек в коре головного мозга после аутотрансплантации конечностей или ампутациями (Chen et al., 1998; Vargas et al., 2009).
Хотелось бы подчеркнуть возможные перспективы дальнейших исследований. В научных исследованиях принято проводить «контроли» для любого исследования. Однако, на наш взгляд, в данном конкретном случае имеются существенные проблемы. Исследуемые пациенты сталкиваются с ситуацией, когда у них появляются новые степени свободы конечностей, и мы пытаемся оценить пластические перестройки, связанные с данным фактором. Очень тяжело представить, как можно сделать плацебо или контрольную группу для данного случая. Авторы будут благодарны за любые предложения и комментарии данной статьи, так как исследования активно продолжаются.
Список литературы
Adkins A.N., Dewald J.P.A., Garmirian L.P., Nelson C.M., Murray W.M. Serial sarcomere number is substantially decreased within the paretic biceps brachii in individuals with chronic hemiparetic stroke. Proc Natl Acad Sci. 2021. 118(26).
Agranovich O.E., Kochenova E.A., Oreshkov A.B., Trofimova S.I., Petrova E.V., Gabbasova E.L. Evaluation of unipolar transfer of the latissimus dorsi to flexor antebrachii in patients with arthrogryposis. Genij Ortop. 2019. 25(1): 42–48.
Blagoveschenskiy E.D., Agranovich O.E., Kononova E.L., Baindurashvili A.G., Nazarova M.A., Shestokova A.N. Characteristics of electrophysiological activity of the cerebral cortex in children with arthrogryposis. Neuromuscul Dis. 2018. 8(2): 25–32.
Blagovechtchenski E.D., Agranovich O.E., Kononova Y., Nazarova M., Nikulin V.V. Perspectives for the Use of Neurotechnologies in Conjunction With Muscle Autotransplantation in Children. Front Neurosci. 2019. 13:99.
Brinkman L., Stolk A., Dijkerman H.C., de Lange F.P., Toni I. Distinct Roles for Alpha- and Beta-Band Oscillations during Mental Simulation of Goal-Directed Actions. J Neurosci. 2014. 34(44): 14783–14792.
Chen R., Corwell B., Yaseen Z., Hallett M., Cohen L.G. Mechanisms of Cortical Reorganization in Lower-Limb Amputees. J Neurosci. 1998. 18(9): 3443–34450.
Grefkes C., Ward N.S. Cortical Reorganization After Stroke: How Much and How Functional? http://dx.doi.org/101177/1073858413491147. 2013. 20(1): 56–70.
Hardstone R., Poil S.S., Schiavone G., Jansen R., Nikulin V.V., Mansvelder H.D. Detrended Fluctuation Analysis: A Scale-Free View on Neuronal Oscillations. Front Physiol. 2012. 3: 450.
Maris E., Oostenveld R. Nonparametric statistical testing of {EEG}- and {MEG}-data. J Neurosci Methods. 2007. 164(1): 177–190.
Mikati M.A. Arthrogryposis, renal tubular acidosis and cholestasis syndrome: spectrum of the clinical manifestations. Clin Dysmorphol. 2007. 16(1): 71.
Morrey B.F., Askew L.J., Chao E.Y. A biomechanical study of normal functional elbow motion. J Bone Joint Surg Am. 1981. 63(6): 872–877.
Oishi S., Agranovich O., Zlotolow D., Wall L., Stutz C., Pajardi G. Treatment and outcomes of arthrogryposis in the upper extremity. Am J Med Genet Part C Semin Med Genet. 2019. 181(3): 363–371.
Rossini P.M., Burke D., Chen R., Cohen L.G., Daskalakis Z., Di Iorio R., Ziemann U. Non-invasive electrical and magnetic stimulation of the brain, spinal cord, roots and peripheral nerves: Basic principles and procedures for routine clinical and research application. An updated report from an I.F.C.N. Committee. Clin Neurophysiol. 2015. 126(6): 1071–1107.
Traversa R., Cicinelli P., Bassi A., Rossini P.M., Bernardi G. Mapping of motor cortical reorganization after stroke. A brain stimulation study with focal magnetic pulses. Stroke. 1997. 28(1): 110–117.
Traversa R., Cicinelli P., Pasqualetti P., Filippi M., Rossini P.M. Follow-up of interhemispheric differences of motor evoked potentials from the “affected” and “unaffected” hemispheres in human stroke. Brain Res. 1998. 803(1–2): 1–8.
Van Bosse H.J.P., Pontén E., Wada A., Agranovich O.E., Kowalczyk B., Lebel E., et al. Treatment of the Lower Extremity Contracture/Deformities. J Pediatr Orthop. 2017. 37: S16–23.
Van Heest A., Waters P.M., Simmons B.P. Surgical treatment of arthrogryposis of the elbow. J Hand Surg Am. 1998. 23(6): 1063–1070.
Vargas C.D., Aballéa A., Rodrigues É.C., Reilly K.T., Mercier C., Petruzzo P. Re-emergence of hand-muscle representations in human motor cortex after hand allograft. Proc Natl Acad Sci. 2009. 106(17): 7197–7202.
Ward L.M. Synchronous neural oscillations and cognitive processes. Trends Cogn Sci. 2003. 7(12): 553–559.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


