Журнал высшей нервной деятельности им. И.П. Павлова, 2022, T. 72, № 4, стр. 543-560
Влияние овариоэктомии на обучение крыс в норме и после раннего провоспалительного стресса
И. В. Павлова 1, *, М. И. Зайченко 1, Н. Д. Брошевицкая 1, В. В. Сидорина 1, А. В. Шаркова 1, Г. А. Григорьян 1
1 Федеральное государственное бюджетное учреждение науки
Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
* E-mail: pavlovfml@mail.ru
Поступила в редакцию 03.03.2022
После доработки 25.04.2022
Принята к публикации 26.04.2022
- EDN: ITXNZI
- DOI: 10.31857/S0044467722040086
Аннотация
Исследовали влияние овариоэктомии (ОЭ) самок, проведенной в возрасте 35 дней, на выработку и угашение реакции условнорефлекторного страха, а также на обучение в водном лабиринте Морриса у взрослых крыс. Поведение ОЭ самок сравнивали с поведением самцов и ложнооперированных самок. Сопоставляли влияние ОЭ у животных после раннего провоспалительного стресса (введение бактериального липополисахарида на 3-й и 5-й постнатальные дни, группа ЛПС) и у контрольной группы (введение физиологического раствора, группа ФИЗ). ОЭ затрудняла выработку реакции условнорефлекторного страха на звук в группе ЛПС, а также замедляла угашение страха как в группе ФИЗ, так и ЛПС по сравнению с ложнооперированными самками. При обучении в водном лабиринте Морриса ОЭ в группе ФИЗ улучшала обучение самок по сравнению с ложнооперированными самками, делая их такими же успешными в решении пространственной задачи, как самцы. Ранний провоспалительный стресс оказывал сходное влияние на самцов и ОЭ самок, ухудшая многие показатели обучения в лабиринте Морриса. ОЭ не повлияла на рабочую память в тесте с ежедневной сменой местоположения платформы. ОЭ по многим показателям устраняла половые различия в поведении самок по сравнению с самцами и делала их более подверженными влиянию провоспалительного стресса.
Как известно, женщины значительно чаще мужчин испытывают депрессию, тревожные расстройства, посттравматические стрессовые расстройства (Cover et al., 2014; McDermott et al., 2015; Григорьян, 2022). Предрасположенность к развитию данных заболеваний у женщин увеличивается при снижении уровня стероидных половых гормонов в постменопаузе или после операций по хирургическому удалению яичников при различных заболеваниях (Григорьян, 2022). Эти данные ставят вопрос о защитной роли женских половых гормонов в развитии тревожно-депрессивных расстройств и в процессах приобретения и угашения страха.
В экспериментах на животных широко используется операция по удалению яичников, овариоэктомия (ОЭ), которую применяют при изучении роли женских половых гормонов в поведении. Часто в литературе ОЭ рассматривают в качестве модели женской менопаузы, создаваемой на животных среднего возраста. Показано, что ОЭ может приводить к усилению тревожно-депрессивного поведения (Павлова и соавт., 2022; Григорьян, 2022; Khayum et al., 2020; Puga-Olguín et al., 2019). Данные о влиянии ОЭ на когнитивные способности и память в аверсивных задачах достаточно противоречивые, что может быть связано как с разными временными интервалами, в которые оцениваются последствия ОЭ, разными экспериментальными протоколами, а также и с неоднородным контролем, с которым сравниваются ОЭ самки, поскольку ложнооперированные и интактные самки имеют естественные колебания уровня эстрогена и прогестерона в зависимости от стадий эстрального цикла.
Наиболее хорошо изучено влияние ОЭ в таких аверсивных задачах, как выработка реакции условнорефлекторного страха и обучение в водном лабиринте Морриса поиску скрытой платформы. В ряде работ было показано, что в водном лабиринте Морриса после ОЭ у крыс нарушалась пространственная навигация и ухудшалось обучение по сравнению с ложнооперированными самками, о чем свидетельствовало увеличение проплываемой дистанции и латентного периода достижения платформы, а также уменьшение времени пребывания в целевом квадранте (Sarkaki et al., 2008; Monteiro et al., 2005; Feng et al., 2004). В других работах не было выявлено отклонений в процессе обучения в лабиринте Морриса у ОЭ крыс и мышей (Tao et al., 2020; Li et al., 2014; Simpkins et al., 1997), но имелся дефицит памяти в тесте с убранной платформой (Simpkins et al., 1997). В отдельных работах наблюдали улучшение обучения (Daniel et al., 1999). Рабочая память в тесте с ежедневной перестановкой местоположения платформы ухудшалась (Tao et al., 2020) либо не менялась (Monteiro et al., 2005). Зависимости результатов от линии животных не прослеживается.
В модели выработки классического павловского условного оборонительного рефлекса (fear conditioning) не было обнаружено различий по уровню замирания в ответ на контекст и сигнал у ОЭ самок по сравнению с ложнооперированными (ЛОЭ) самками (McDermott et al., 2015) или интактными самками на стадии эструса-проэструса (Kashefi, Rashidy-Pour, 2014). При выработке реакции страха в ответ на предъявление контекста в модели со стержнем, помещенным в камере, через который подавали ток в качестве безусловного стимула, видели нарушения в проявлении страха на сигнал после ОЭ (Gervais et al., 2014). У животных после ОЭ по сравнению с интактными самками на стадии проэструса (Parrish et al., 2019) или по сравнению с ложнооперированными самками (Gupta et al., 2001) было обнаружено ухудшение угашения условнорефлекторного страха. Другие авторы не наблюдали различий в угашении реакции страха в ответ на предъявление контекста (McDermott et al., 2015).
В других моделях оборонительных условных рефлексов ОЭ также могла приводить к когнитивным нарушениям. ОЭ вызывала ухудшение выработки реакции активного избегания (Simpkins et al., 1997). У самок после ОЭ ухудшались показатели условнорефлекторного избегания места, ОЭ крысы по сравнению с ложнооперированными и интактными самками больше времени стали проводить в негативном отсеке, ассоциируемом с болью, вызванной воздействием формалина (Li et al., 2014). Через 4 недели после ОЭ отмечалось ухудшение памяти при рефлексе пассивного избегания, мыши проводили больше времени в темном отсеке, в котором ранее получали удар током (Tao et al., 2020).
В литературе имеются сведения о совместном действии ОЭ и разных видов стрессов – хронического непредсказуемого стресса (Karisetty et al., 2017), хронического стресса обездвижения (Takuma et al., 2012), физического и психологического стресса (Khaleghi et al., 2021), однократного длительного стресса (Mirshekar et al., 2013). Совместное действие ОЭ и разных видов дополнительных стрессов существенно меняло реакции на одиночные воздействия. Совместное влияние раннего провоспалительного ЛПС стресса и ОЭ не изучено. В опытах на грызунах было показано, что ОЭ приводит к развитию нейровоспалительного процесса и активации иммунной системы подобно действию бактериального провоспалительного токсина, липополисахарида (ЛПС) (Ge et al., 2020; Wu et al., 2020; Wang et al., 2016; Azizi-Malekabadi et al., 2015; Григорьян, 2022; Iwasa et al., 2014). Ранее нами было показано, что ранний провоспалительный стресс оказывает большее влияние на самцов, чем самок как при выработке различных видов оборонительных рефлексов (Брошевицкая и соавт., 2020), так и при обучении поиску скрытой платформы в лабиринте Морриса (Зайченко и соавт., 2022). Меньшая чувствительность самок объяснялась защитной ролью женских половых гормонов, оказывающих противовоспалительное действие. Можно было предположить, что ОЭ сделает самок более подверженными влиянию раннего провоспалительного стресса.
Целью нашей работы было изучение влияния ОЭ на выработку и угашение реакции условнорефлекторного страха, а также на обучение поиску скрытой платформы в водном лабиринте Морриса у самок крыс в норме и после раннего провоспалительного стресса. В задачи работы входило: 1) исследование влияния ОЭ на выработку и угашение реакции условнорефлекторного страха у крыс в норме и после раннего провоспалительного стресса; 2) исследование влияния ОЭ на обучение поиску скрытой платформы в водном лабиринте Морриса и в тесте на рабочую память с ежедневной сменой местоположения платформы у крыс в норме и после раннего провоспалительного стресса.
МЕТОДИКА
Животные. Опыты проводили на 110 крысах Вистар (58 самцов и 52 самки) в возрасте от 3 до 5 мес. Крысята были выведены в виварии ИВНД и НФ от родителей, полученных из филиала “Столбовая” ФГБУН НЦБМТ ФМБА, Россия. В экспериментах соблюдали принципы гуманности, изложенные в директивах Европейского Сообщества (2010/63/ЕU) и положения ИВНД и НФ РАН о работе с экспериментальными животными.
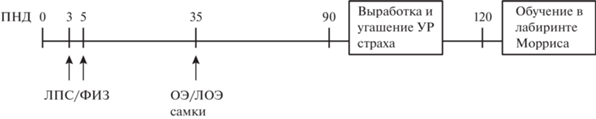
Ранний провоспалительный стресс. На рис. 1 представлена общая схема экспериментов. На 3-й и 5-й дни жизни у одной половины крысят из помета вызывали провоспалительный стресс путем введения бактериального липополисахарида (ЛПС) от Echerichia coli, серотип О26:В6 (Sigma) в дозе 50 мкг/кг в объеме 10 мкл/г (группа ЛПС, всего 50 крысят). Во время этой процедуры крысят разлучали с матерью на 15–20 мин., взвешивали на электронных весах с точностью до 0.01 г и им подкожно в холку вводили ЛПС с помощью инсулинового шприца. Этих крысят дополнительно метили с помощью подкожного введения у основания хвоста 10 мкл черной краски, которая используется для татуировок (фирма Dynamic Color, краска Triple Black Tattoo Ink). Другой половине крысят из помета в этом же возрасте подкожно вводили физиологический раствор в объеме 10 мкл/г (группа ФИЗ, контроль, всего 60 крысят). При разделении пометов старались уравнять в группах ЛПС и ФИЗ число самцов и самок. Разделение пометов делали с целью ослабить влияние генетического фактора и особенностей матери на результаты экспериментов. В возрасте 25 дней крысят отсаживали от матери.
Рис. 1.
Схема проведения экспериментов. ПНД – постнатальный день, ЛПС/ФИЗ – введение ЛПС или физиологического раствора, ОЭ/ЛОЭ – проведение операции овариоэктомии или ложной овариоэктомии.
Fig. 1. The scheme of experiments. PND – postnatal day, ЛПС/ФИЗ – administration of ЛПС or saline, OЭ /ЛОЭ – ovariectomy or sham ovariectomy.
Операция овариоэктомии. В возрасте 35 дней у 26 самок (13 из группы ЛПС, 13 из группы ФИЗ) проводили операцию двухсторонней ОЭ, у других 26 самок (13 из группы ЛПС, 13 из группы ФИЗ) операцию ЛОЭ (рис. 1). Операции проводили под изофлурановым ингаляционным наркозом (Аэрран). При ОЭ делали разрез длиной 2 см по белой линии в нижней части живота, рассекая кожу, мышцы и брюшину, идентифицировали маточные трубы и яичники, перевязывали трубы на расстоянии 1 см от яичников, коагулировали сосуды, подходящие к яичникам, затем удаляли верхнюю часть труб и яичники. С помощью шовного материала последовательно зашивали брюшину, жировую клетчатку и кожу. Шов на коже дополнительно смазывали клеем БФ-6. При операции ЛОЭ после идентификации маточных труб и яичников их соответственно не перевязывали и не удаляли. После операции крысам вводили антибиотик амоксициллин (0.3 мл) в/м и 2 мл глюкозы п/к в холку.
Группы животных. Были сформированы шесть экспериментальных групп животных: самцы группы ЛПС (n = 24), самцы группы ФИЗ (n = 34), самки группы ЛПС после ОЭ (ЛПС + ОЭ, n = 13), самки группы ЛПС после ЛОЭ (ЛПС + ЛОЭ, n = 13), самки группы ФИЗ после ОЭ (ФИЗ + ОЭ, n = 13), самки группы ФИЗ после ЛОЭ (ФИЗ + ЛОЭ, n = 13).
Выработка, тестирование и угашение классического условного оборонительного рефлекса (fear conditioning). Перед началом экспериментов крыс приручали (хэндлинг) по 15–20 мин в течение 3–4 дней. Для выработки классического павловского условного оборонительного рефлекса использовали камеру Startle and Fear Combined System производства PanLab Harvard apparatus (Испания, 2000). Эксперименты начинали у крыс в возрасте 3 мес. (рис. 1). При обучении после 120-секундного периода обследования камеры животным давали 3 сочетания звука (30 с, 80 дБ, 2000 Гц) и электрокожного болевого раздражения, наносимого через решетку пола (2 с, 0.8 мА, задержка 28 с от начала действия звука), межсигнальные интервалы составляли 40–50-секунд, после последнего сочетания следовал период последействия в 40 с. Через 24 ч после обучения проводили тестирование условнорефлекторного страха (тест 1). При тестировании животных помещали в тот же контекст на 120 с, после чего предъявляли звук в течение 120 с (80 дБ, 2000 Гц), далее следовал период последействия в 120 с. Далее в двух опытах с интервалом 1–2 дня проводили угашение реакции условнорефлекторного страха, при этом давали по 10 изолированных звуковых стимулов (30 с, 80 дБ, 2000 Гц) без электрокожных раздражений с 20-секундными межсигнальными интервалами. После процедуры угашения через 24 часа тестировали сохранность рефлекса (тест 2).
Во всех опытах поведение крыс анализировали до (реакции на контекст) и во время действия звука (на контекст и сигнальный раздражитель). Условнорефлекторный страх оценивали по времени замирания. Замирание – периоды неподвижности длительностью не менее 2 с, когда наблюдались только дыхательные движения животного. Замирание определяли по записи механограммы пола камеры с помощью амплитудного и временного порогов. Амплитудный порог зависел от массы тела крысы, коэффициента усиления и выставлялся таким образом, чтобы отсечь интервалы с активным движением животного. Обработка проводилась с помощью стандартной программы, прилагающейся к установке фирмы Panlab. Программа позволяла детектировать эпизоды замирания, определять их длительность и рассчитывать процент времени замирания от длительности каждого анализируемого интервала времени. Кроме того, для оценки уровня эмоционального напряжения у крыс подсчитывали число дефекаций и уринаций.
Обучение в водном лабиринте Морриса. В возрасте 4 месяцев крыс обучали находить скрытую под водой платформу в лабиринте Морриса. Лабиринт представлял собой круглый пластиковый бассейн черного цвета диаметром 150 см и высотой 60 см (Noldus Ltd), наполненный водой до уровня 30 см. В помещении вокруг бассейна располагались внелабиринтные ориентиры – изображения геометрических фигур. Лабиринт условно, с помощью двух пересекающихся через центр прямых, разделяли на 4 равных квадранта. Точки пересечения прямых со стенками бассейна служили в качестве мест погружения животных в воду (условно – север, юг, запад, восток). С помощью 2 окружностей, имеющих центр в центре бассейна, лабиринт условно делили на центральную (диаметр 40 см), среднюю (ширина 30 см) и периферическую (ширина 25 см) зоны. В середину одного из квадрантов (средняя зона) помещали круглую платформу (диаметром 10 см), сделанную из прозрачного оргстекла и незаметную под водой. Верхний край платформы был на 1.5–2.0 см ниже уровня воды. Во время опытов в комнате было слегка затемненное освещение (30–50 Лкc); температура воды в ходе опытов была 22–24 град. Обучение проводили в течение 9 дней по две пробы в день. Между первой и второй пробой время составляло 15–20 минут. Положение платформы в ходе обучения не менялось. Стартовые позиции, с которых крыс опускали в бассейн с водой, постоянно меняли, используя 4 основные точки погружения. Максимальное время одной пробы составляло 60 с. Если крыса не находила платформу за 60 с, ее сажали на нее, и оставляли на платформе в течение 20 с.
Для фиксирования траектории движения крыс использовали программу Etho Vision, а также видеорегистрацию. При обработке анализировали такие параметры, как латентный период (время) достижения платформы, проплываемую до платформы дистанцию, скорость плавания, отыскание платформы (доля попыток, завершившихся нахождением платформы, от общего числа попыток в этот день, выполненных крысами каждой группы). Для оценки стратегии поиска платформы рассчитывали процент времени пребывания или процент проплываемой дистанции в периферической зоне от общего времени пребывания в лабиринте или общей длины дистанции соответственно.
На 10-й день для проверки степени усвоения навыка у крыс проводили тест-пробу без платформы в бассейне. О степени обученности крыс судили по времени нахождения крыс в квадранте платформы и латентности достижения зоны, где при обучении располагалась платформа.
Тестирование рабочей памяти в лабиринте Морриса. После 9-дневного обучения и теста на 10 день приступали к оценке у крыс разных групп краткосрочной или рабочей памяти. В этом случае опыты проводили в течение 4 дней с ежедневным изменением местоположения платформы. В день давали 4 пробы. Продолжительность пробы составляла 60 с, интервал времени между пробами – 30 с. Вычисляли средние значения для каждого показателя для каждой пробы за четыре дня обучения. Оценивали латентность достижения платформы и проплываемую дистанцию.
Статистическая обработка данных. Для обработки результатов использовали стандартную программу STATISTICA 8.0. Распределение значений исследованных параметров было проверено на нормальность по критерию Колмогорова-Смирнова (Basic Statistics, раздел Descriptive Statistics). Если распределение значений анализируемого параметра соответствовало нормальному, то при сравнении групп крыс использовали дисперсионный анализ ANOVA, раздел One-way или factorial ANOVA. При post-hoc анализе применяли критерий Newman-Keuls test. Анализировали влияние факторов ГРУППА (ЛПС или ФИЗ) и ПОЛ (условно выделяли три группы животных: самцы, ОЭ самки и ЛОЭ самки), номер звукового стимула (1–10). Если распределение значений не соответствовало нормальному распределению, то в этом случае для сопоставления групп использовали Kruskal–Wallis ANOVA, с последующим сравнением групп с помощью Multiple Comparisons of mean ranks for all groups (Nonparametric Statistics). Для сопоставления двух групп использовали Mann– Whitney U-критерий. Различия считали статистически значимыми при р < 0.05, отмечали наличие тенденции при 0.05 ≤ р < 0.1. Данные на рисунках представлены в виде средних значений ± ошибки средних.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Влияние овариоэктомии на вес крыс. В три месяца вес крыс в группах самцов, ОЭ самок и ЛОЭ самок существенно различался, как в группе ФИЗ (Kruskal–Wallis критерий: H (2, n = = 54) = 37.7, p = 0.000), так и ЛПС (Kruskal–Wallis критерий: H (2, n = 50) = 36.7, p = = 0.000). В группе ФИЗ вес ОЭ самок (280.6 г) был больше (р < 0.05, Multiple comparison), чем вес ЛОЭ самок (222.8 г), но меньше, чем вес самцов (324.9 г). В группе ЛПС вес ОЭ самок также был больше (293.2 г), чем у ЛОЭ самок (229.2 г), но меньше, чем вес самцов (328.4 г). Прибавка веса у ОЭ самок по сравнению с ЛОЭ самками в ФИЗ группе составила 20.6%, в ЛПС группе – 21.8%. Различий по весу крыс одного пола в группах ФИЗ и ЛПС не было обнаружено (р > 0.05, Mann–Whitney U-критерий). Таким образом, операция ОЭ приводила к увеличению веса тела самок и уменьшению половых различий по весу с самцами.
Влияние овариоэктомии на выработку и проявление условнорефлекторного страха в Тесте 1. Изначально при действии первого звука уровень замирания был низкий и не отличался у самцов, ОЭ и ЛОЭ самок как в группе ФИЗ, так и ЛПС (рис. 2 (а)). После получения болевого стимула при действии второго звука в ЛПС группе возникали различия по времени замирания у крыс разного пола (фактор ПОЛ F2.47 = 6.08, p = 0.021), ОЭ самки замирали на меньшее время (р < 0.05), чем ЛОЭ самки (рис. 2 (а)). При действии третьего звука различий по времени замирания между крысами разного пола в ЛПС группе уже не наблюдалось. В ФИЗ группе различий по времени замирания при 2 и 3-м звуке также не наблюдалось. Таким образом, полученные данные свидетельствуют, что в ЛПС группе ОЭ самки испытывали некоторые трудности в процессе обучения.
Рис. 2.
Влияние овариоэктомии на выработку и проявление условнорефлекторного страха в Тесте 1. (а) – процент времени замирания при действии 1–3 звука при обучении. (б) – процент времени замирания в ответ на предъявление контекста в Тесте 1. (в) – процент времени замирания в ответ на звук в Тесте 1. ОЭ – овариоэктомированные самки, ЛОЭ – ложноовариоэктомированные самки. ФИЗ – группа крыс с введением физиологического раствора в раннем онтогенезе, ЛПС – группа крыс с введением ЛПС. n – число крыс в группе ФИЗ/ЛПС. * – статистически значимые различия (р < 0.05, One Way ANOVA, post-hoc анализ) между самцами и самками, # – тенденция (0.05 ≤ р < 0.1). + – различия (р < 0.05) между ОЭ и ЛОЭ самками.
Fig. 2. The effect of ovariectomy on the acquisition and expression of conditioned fear in Test 1. (a) – the percentage of freezing time during the action of 1–3 sounds during training. (б) – percentage of freezing time in response to the presentation of context in Test 1. (в) – percentage of freezing time in response to sound in Test 1. OЭ – ovariectomized females, ЛОЭ – sham-ovariectomized females. ФИЗ – a group of rats with the introduction of saline in early ontogenesis, ЛПС – a group of rats with the introduction of LPS. n – the number of rats in the ФИЗ/ЛПС group. * – statistically significant differences (p < 0.05, One Way ANOVA, post-hoc analysis) between males and females, # – trend (0.05 ≤ p < 0.1). + – differences (p < 0.05) between OЭ and ЛОЭ females.
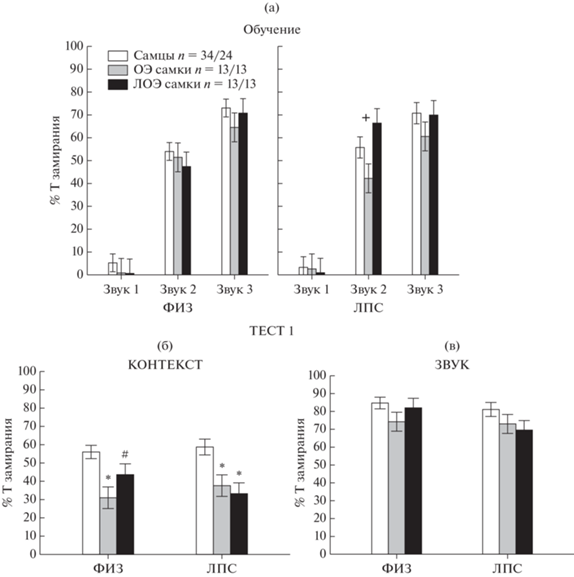
Тестирование через 24 часа показало, что время замирания при действии звука не различалось у самцов, ОЭ и ЛОЭ самок, как в группе ФИЗ, так и ЛПС (рис. 2 (в)). В ответ на контекст (рис. 2 (б)) различия между крысами разного пола проявлялись как в ФИЗ группе (фактор ПОЛ F2.57 = 6.78, p = 0.002), так и ЛПС группе (F2.47 = 7.71, p = 0.001). При этом в группе ЛПС и ФИЗ ОЭ и ЛОЭ самки замирали на меньшее время (post-hoc анализ), чем самцы (в группе ФИЗ – различия между ЛОЭ самками и самцами проявлялись на уровне тенденции), различий между группами ОЭ и ЛОЭ самок не было обнаружено. Таким образом, несмотря на некоторые трудности в процессе обучения, все крысы, как показал Тест 1, успешно выработали реакцию условнорефлекторного страха на звук, в ответ на контекст страх у самок ОЭ и ЛОЭ групп проявлялся в меньшей степени, чем у самцов.
Влияние овариоэктомии на угашение условнорефлекторного страха. При угашении реакции страха были обнаружены существенные различия по времени замирания на звуковые сигналы между самцами, ОЭ и ЛОЭ самками, как при первом сеансе угашения (фактор ПОЛ F2.1030 = 39.83, p = 0.000), так и во втором (F2.1040 = 51.39, p = 0.000) (рис. 3 (а), (в)). Взаимодействие факторов ПОЛ × ГРУППА проявлялось как в первом сеансе угашения (F2.1030 = 2.77, p = 0.049), так и во втором (F2.1040 = 8.65, p = 0.000). При этом самки ЛОЭ группы, судя по post-hoc анализу, во время 1 и 2 сеансов угашения замирали меньшее время, чем самцы и ОЭ самки, как в ФИЗ, так и ЛПС группах (рис. 3 (а),(в)). ОЭ самки в ФИЗ группе во время первого и второго сеансов угашения замирали на большее время (р < < 0.05), чем самцы. ОЭ самки в ЛПС группе во время первого сеанса замирали на такое же время, как самцы, во время второго – на меньшее время, чем самцы (р < 0.05) (рис. 3 (а), (в)). Фактор № звука оказывал существенное влияние на время замирания при первом (F9.1030 = 6.8, p = 0.000) и втором сеансе угашения (F9.1040 = = 2.5, p = 0.008), во втором сеансе наблюдалось взаимодействие факторов ПОЛ × № звука (F18.1040 = 2.31, p = 0.001). Анализ динамики угашения показал (рис. 3 (б), (г)), что во время первого сеанса угашения различия по времени замирания между крысами разного пола появлялись преимущественно в конце, после пятого применения звука, а во время второго сеанса могли наблюдаться все время, начиная со второго применения звука. Таким образом, ОЭ самки в процессе угашения реакции условнорефлекторного страха на звук испытывали существенные трудности по сравнению с ЛОЭ самками, и угашение у них проходило значительно медленнее. Данные о более быстром угашении рефлекса у ЛОЭ самок по сравнению с самцами соответствуют ранее полученным данным на неоперированных самках (Брошевицкая и соавт., 2020).
Рис. 3.
Влияние овариоэктомии на угашение условнорефлекторного страха. (а) – усредненный процент времени замирания в ответ на звуковые стимулы в первом сеансе угашения, (в) – во втором сеансе. (б) и (г) – процент времени замирания в зависимости от номера звукового стимула в первом и втором сеансах угашения соответственно. (д) – процент времени замирания в ответ на предъявление контекста в Тесте 2, (е) – в ответ на звук в Тесте 2. ОЭ – овариоэктомированные самки, ЛОЭ – ложноовариоэктомированные самки. ФИЗ – группа крыс с введением физиологического раствора в раннем онтогенезе, ЛПС – группа крыс с введением ЛПС. * – статистически значимые различия (р < 0.05, Factorial ANOVA, post-hoc анализ) между самцами и самками, # – тенденция (0.05 ≤ р < 0.1). + – различия между ОЭ и ЛОЭ самками, $ – различия внутри пола между ФИЗ и ЛПС группами (р < 0.05).
Fig. 3. The effect of ovariectomy on the extinction of conditioned fear. (a) – the average percentage of freezing time in response to sound stimuli in the first session of extinction, (в) – in the second session. (б) and (д) – the percentage of freezing time depending on the number of the sound stimulus in the first and second sessions of extinction, respectively. (д) – the percentage of freezing time in response to the presentation of the context in Test 2, (е) – in response to the sound in Test 2. OЭ – ovariectomized females, ЛОЭ – sham ovariectomized females. ФИЗ – a group of rats with the introduction of saline in early ontogenesis, ЛПС – a group of rats with the introduction of LPS. * – statistically significant differences (p < 0.05, Factorial ANOVA, post-hoc analysis) between males and females, # – trend (0.05 ≤ p < 0.1). + – differences between OЭ and ЛОЭ females, $ – differences within sex between ФИЗ and ЛПС groups (p < 0.05).
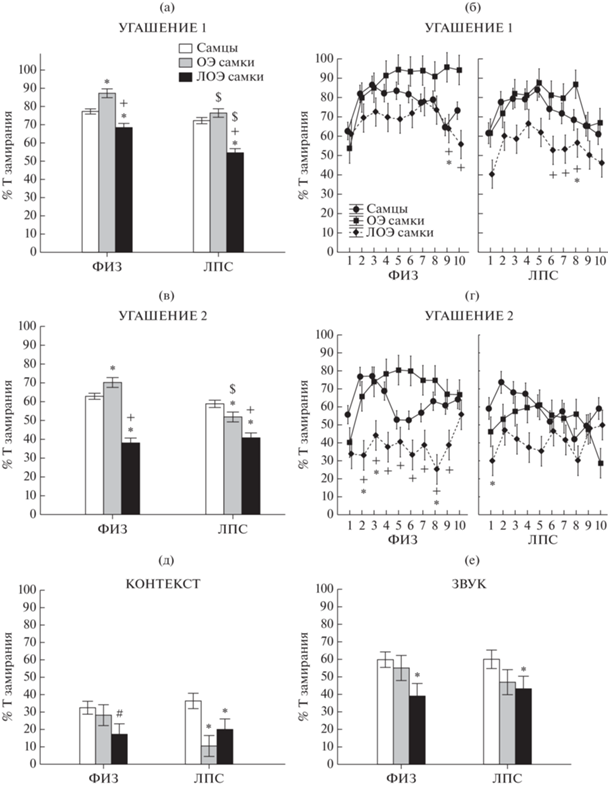
В процессе угашения наблюдались различия между крысами ФИЗ и ЛПС группы (фактор ГРУППА в первом сеансе F1.1030 = = 32.80, p = 0.000, во втором сеансе F1.1040 = = 11.43, p = 0.001). Так, при первом сеансе угашения ОЭ и ЛОЭ самки ЛПС группы замирали меньшее время, чем аналогичные животные ФИЗ группы (рис. 3 (а)), т.е. угашение у них было более успешным. При втором сеансе угашения ОЭ самки ЛПС группы также замирали меньшее время, чем аналогичные животные ФИЗ группы (рис. 3 (в)). Более быстрое угашение рефлекса у самок ЛПС группы по сравнению с ФИЗ группой отмечалось ранее (Брошевицкая и соавт., 2020).
В Тесте 2 через 24 часа после последнего сеанса угашения фактор ПОЛ оказывал влияние на время замирания в ответ на звук (F2.104 = = 4.86, p = 0.009) и на контекст (F2.104 = 6.88, p = 0.002), однако, судя по post-hoc анализу, различий между ОЭ и ЛОЭ самками во времени замирания уже не наблюдалось как в ответ на звук (рис. 3 (е)), так и на контекст (рис. 3 (д)). По сравнению с самцами ЛОЭ самки замирали меньше на контекст и на звук, в ФИЗ группе были менее выраженные различия (тенденция), чем в ЛПС группе. Время замирания у ОЭ самок не отличалось от замирания самцов в ответ на звук, в ответ на контекст в ЛПС группе было меньше, чем у самцов. Таким образом, в Тесте 2 различия по уровню замирания между ОЭ и ЛОЭ самками были не выражены в отличие от процесса угашения, значения по замиранию в ответ на звук у ОЭ самок занимали промежуточное положение между самцами и ЛОЭ самками.
Влияние овариоэктомии на обучение в водном лабиринте Морриса. Анализ графиков на рис. 4 (а)–(г) показал, что в начале обучения с 1 по 5 опыты проходило значительное изменение многих анализируемых параметров во всех группах, в конце (6–9 опыт) изменения были менее выраженными, т.е. наблюдался выход на плато. Наличие такой динамики позволило провести анализ по суммарным данным с 6 по 9 опыт (рис. 4 (д)–(з)). В конце обучения наблюдались различия между группами самцов, ОЭ и ЛОЭ самок, что видно как при анализе по отдельным дням (рис. 4 (а)–(г)), так и по суммарным данным (рис. 4 (д)–(з)). В табл. 1 приведены результаты сопоставления групп крыс, различающихся по полу, с 6 по 9 дни с помощью Kruskal–Wallis критерия.
Рис. 4.
Влияние овариоэктомии на обучение крыс в водном лабиринте Морриса. (а)–(г) – изменение различных показателей поведения в зависимости от дня обучения. (д)–(з) – усредненные показатели поведения крыс в конце обучения (6–9 день). По оси абсцисс на (а)–(г) – день обучения, группа крыс; на (д)–(з) – группа крыс. ОЭ – овариоэктомированные самки, ЛОЭ – ложноовариоэктомированные самки. ФИЗ – группа крыс с введением физиологического раствора в раннем онтогенезе, ЛПС – группа крыс с введением ЛПС. n – число крыс в группе ФИЗ/ЛПС. * – статистически значимые различия между самцами и самками, + – различия между ОЭ и ЛОЭ самками (р < 0.05 Kruskal–Wallis критерий, Multiple comparison of mean ranks for all groups). $ – различия внутри пола между ФИЗ и ЛПС группами (р < 0.05, Mann–Whitney U-критерий).
Fig. 4. The effect of ovariectomy on the training of rats in the Morris water maze. (а)–(г) – changes in various indicators of behavior depending on the day of training. (д)–(з) – average indicators of rat behavior at the end of training (6–9 days). On the abscissa axis on (а)–(г) – day of training, a group of rats; on (д)–(з) – a group of rats. OЭ – ovariectomized females, ЛОЭ – sham ovariectomized females. ФИЗ – a group of rats with the introduction of saline in early ontogenesis, ЛПС – a group of rats with the introduction of ЛПС. n – the number of rats in the ФИЗ/ЛПС group. * – statistically significant differences between males and females, + – differences between OЭ and ЛОЭ females (p < 0.05 Kruskal–Wallis test, Multiple comparison of mean ranks for all groups). $ – differences within gender between ФИЗ and ЛПС groups (p < 0.05, Mann–Whitney U test).
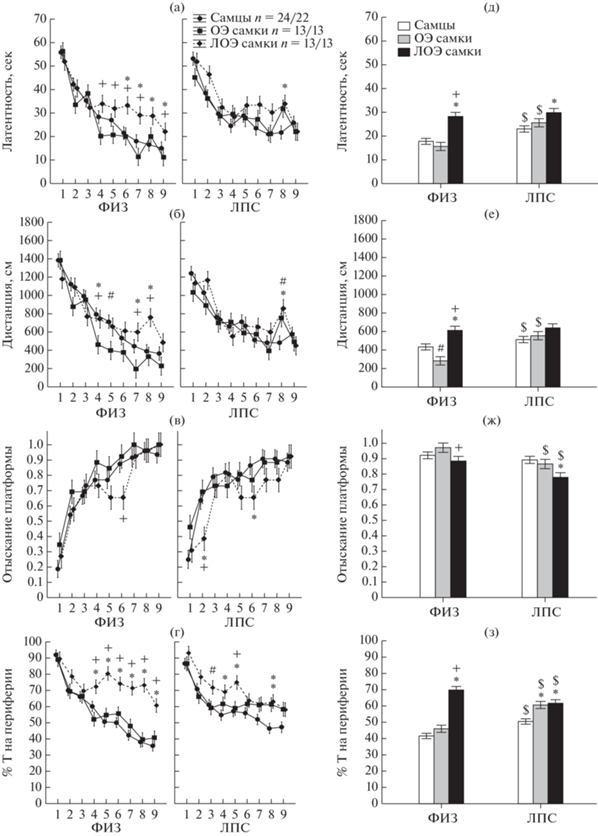
Таблица 1.
Сопоставление с помощью теста Kruskal–Wallis различных показателей поведения при поиске скрытой платформы в лабиринте Морриса у самцов, ОЭ и ЛОЭ самок в конце обучения (6–9 опыты) и при тестировании рабочей памяти Table 1. Comparison of various behavior indicators when searching for a hidden platform in the Morris maze in males, OЭ and ЛОЭ females at the end of training (6–9 days) and when testing working memory using the Kruskal–Wallis test
| Показатель поведения | Группа ФИЗ | Группа ЛПС | ||
|---|---|---|---|---|
| Обучение (6–9 день) | Латентность | H (2, n = 400) = 51.22, p= 0.000 | H (2, n = 384) = 10.94, p = 0.004 | |
| Дистанция | H (2, n = 400) = 47.40, p = 0.000 | – | ||
| % Т на периферии | H (2, n = 397) = 85.88, p = 0.000 | H (2, n = 382) = 20.99, p = 0.000 | ||
| Отыскание платформы | H (2, n = 400) = 5.65, p = 0.049 | H (2, n = 384) = 6.85, p = 0.033 | ||
| Скорость | H (2, n = 400) = 32.02, p = 0.000 | H (2, n = 384) = 10.21, p = 0.006 | ||
| Тестирование рабочей памяти | Дистанция | 1 попытка | H (2, n = 195) = 18.09, p = 0.000 | – |
| 2 попытка | H (2, n = 195) = 16.36, p = 0.000 | – | ||
| 3 попытка | H (2, n = 195) = 14.39, p = 0.002 | – | ||
| 4 попытка | H (2, n = 195) = 15.56, p = 0.000 | – | ||
| Латентность | 1 попытка | H (2, n = 195) = 14.01, p = 0.001 | – | |
| 2 попытка | H (2, n = 195) = 12.93, p = 0.002 | – | ||
| 3 попытка | H (2, n = 195) = 8.42, p = 0.015 | – | ||
| 4 попытка | H (2, n = 195) = 9.44, p = 0.009 | – | ||
В конце обучения в группе ФИЗ у ОЭ самок по сравнению с ЛОЭ самками была меньше латентность достижения платформы (рис. 4 (а), (д)), меньше проплываемая дистанция (рис. 4 (б), (е)), больше доля попыток с отысканием платформы (рис. 4 (в), (ж)), ниже процент времени плавания в периферической зоне лабиринта (рис. 4 (г), (з)). По всем этим параметрам ОЭ самки не отличались от самцов. В то же время ЛОЭ самки по сравнению с самцами достигали платформы с большей латентностью (рис. 4 (а), (д)), проплывали большую дистанцию (рис. 4 (б), (е)) и большее время проводили в периферической зоне лабиринта (рис. 4 (г), (з)), что соответствует ранее полученным данным о больших трудностях у самок по сравнению с самцами при решении пространственных задач (Зайченко и соавт., 2022). В ФИЗ группе скорость плавания у ОЭ и ЛОЭ самок была меньше, чем у самцов.
В ЛПС группе различия между самцами, ОЭ и ЛОЭ самками были менее выражены (табл. 1). Введение ЛПС в раннем онтогенезе оказало существенное влияние на поведение самцов и ОЭ самок. Ранее наблюдали ухудшение обучения у самцов, но не самок под влиянием раннего провоспалительного стресса (Зайченко и соавт., 2022). У самцов и ОЭ самок ЛПС группы по сравнению с ФИЗ группой была больше латентность достижения платформы (рис. 4 (д)), проплываемая дистанция (рис. 4 (е)) и время нахождения на периферии лабиринта (рис. 4 (з)), у ОЭ самок была меньше доля попыток с отысканием платформы (рис. 4 (ж)). Различия в поведении ОЭ и ЛОЭ самок в группе ЛПС не были обнаружены. Различия в поведении самцов и ЛОЭ самок хотя и сохранялись, но были менее выраженные, чем в группе ФИЗ. У ЛОЭ самок по сравнению с самцами была больше латентность (рис. 4 (д)), больше время нахождения на периферии лабиринта (рис. 4 (з)), меньше доля попыток с отысканием платформы (рис. 4 (ж)). Скорость плавания у ОЭ и ЛОЭ самок была ниже, чем у самцов в группе ЛПС.
Тестирование на десятый день с отсутствующей платформой показало (рис. 5 (а)), что в ФИЗ группе все животные проводили большой процент времени в целевом квадранте (32–40%), различий между группами разного пола не было обнаружено. В группе ЛПС наблюдались различия между крысами разного пола (F2.45 = 4.69, p = 0.014). ЛОЭ самки ЛПС группы проводили меньше времени в целевом квадранте, чем самцы (р < 0.05). У ОЭ самок в группе ЛПС было меньше время в целевом квадранте по сравнению с группой ФИЗ. Латентность достижения зоны (рис. 5 (б)), где при обучении располагалась платформа, различалась у крыс разного пола (фактор ПОЛ F2.84 = 12.50, p = 0.000). Кроме того, наблюдалось взаимодействие факторов ПОЛ × Группа (F2.84 = 3.54, p = 0.033). В ФИЗ группе у ЛОЭ самок латентность была больше, чем у самцов и ОЭ самок, что соответствует закономерностям, полученным на 6–9 день при обучении. В ЛПС группе у самцов латентность увеличивалась по сравнению самцами ФИЗ группы, различий между полами не наблюдалось.
Рис. 5.
Влияние овариоэктомии на показатели поведения в тесте на 10 день с убранной платформой (а), (б) и при тестировании на рабочую память в экспериментах с ежедневной сменой местоположения платформы (в), (г). По оси абсцисс на (а), (б) – группа крыс, на (в), (г) – номер попытки. По оси ординат на (в), (г) – показатель поведения на данной попытке, усредненный по четырем дням тестирования. ОЭ – овариоэктомированные самки, ЛОЭ – ложноовариоэктомированные самки. ФИЗ – группа крыс с введением физиологического раствора в раннем онтогенезе, ЛПС – группа крыс с введением ЛПС. * – статистически значимые различия между самцами и самками, + – различия между ОЭ и ЛОЭ самками, $ – различия внутри пола между ФИЗ и ЛПС группами (р < 0.05, на (а) и (б) – Factorial ANOVA, post-hoc анализ, на (в) и (г) – Kruskal-Wallis критерий, Multiple comparison of mean ranks for all groups, Mann–Whitney U-критерий).
Fig. 5. The effect of ovariectomy on behavior indicators in the test on day 10 with the platform removed (a), (б) and when testing for working memory in experiments with daily change of the platform location (в), (г). On the abscissa axis on (a), (б) – a group of rats, on (в), (г) – the number of attempts. On the ordinate axis by (в), (г) – an indicator of behavior on this attempt, averaged over four days of testing. OЭ – ovariectomized females, ЛОЭ – sham ovariectomized females. ФИЗ – a group of rats with the introduction of saline in early ontogenesis, ЛПС - a group of rats with the introduction of ЛПС. * – statistically significant differences between males and females, + – differences between ОЭ and ЛОЭ females, $ – differences within sex between ФИЗ and ЛПС groups (p < 0.05, on (a) and (б) Factorial ANOVA, post-hoc analysis, on (в) and (г) – Kruskal-Wallis test, Multiple comparison of mean ranks for all groups, Mann-Whitney U test).
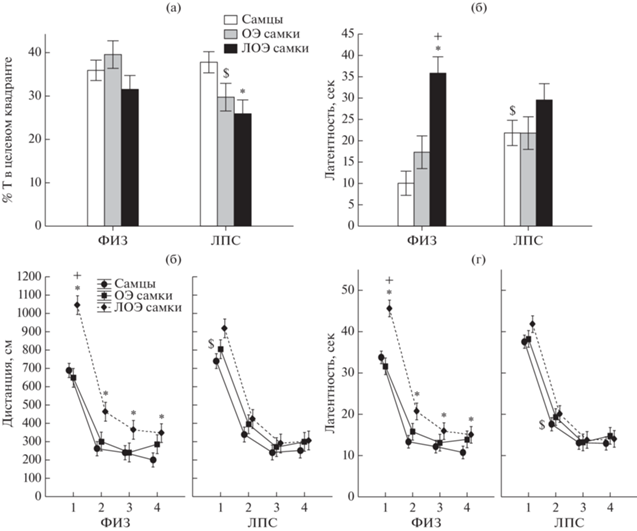
Таким образом, ОЭ в группе ФИЗ улучшала обучение самок, делая их такими же успешными в решении пространственной задачи, как самцы. Ранний провоспалительный стресс оказывал сходное влияние на самцов и ОЭ самок, ухудшая многие показатели обучения.
Влияние овариоэктомии на рабочую память в лабиринте Морриса. В тесте на рабочую память с ежедневной сменой местоположения платформы различия в проплываемой дистанции и латентности между крысами разного пола наблюдались только в ФИЗ группе (табл. 1). При этом у ЛОЭ крыс значения дистанции и латентности были больше, чем у самцов (рис. 5 (в), (г)) на протяжении всех проб. Значения данных показателей у ОЭ крыс не отличались от самцов. Между ОЭ и ЛОЭ самками различия наблюдались только при первых попытках, у ОЭ самок дистанция и латентность были меньше, чем у ЛОЭ самок. К четвертой попытке различия между ОЭ и ЛОЭ самками исчезали, все самки успешно находили платформу с небольшой латентностью. В ЛПС группе различий между крысами разного пола не наблюдалось, у всех животных к 4 попытке сокращались дистанция и латентность. О сохранной рабочей памяти, как известно, свидетельствует градиент падения показателей от предыдущей попытки к последующей, наиболее важен градиент при переходе от первой ко второй попытке. Поскольку градиенты не отличались у ОЭ и ЛОЭ самок, можно заключить, что ОЭ не повлияла на рабочую память. Большая латентность и дистанция у ЛОЭ самок на первых попытках может быть связана с преобладающей у них стратегией поиска платформы на периферии лабиринта.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В наших опытах ОЭ в возрасте 35 дней вызывала существенное увеличение массы тела крыс по сравнению с ЛОЭ животными. В три месяца вес ОЭ самок занимал промежуточное положение между весом самцов и ЛОЭ самок. Эти результаты полностью согласуются с данными литературы (Ge et al., 2020; Khayum et al., 2020), которые свидетельствуют о тормозном влиянии эстрогенов на прирост массы тела самок. Данные об изменении веса тела после ОЭ могут служить подтверждением успешности проведенной операции по удалению яичников.
ОЭ оказывала разное влияние на поведение крыс в двух экспериментальных задачах – при выработке и угашении условнорефлекторного страха и при обучении в водном лабиринте поиску скрытой платформы. При выработке условнорефлекторного страха на контекст и сигнал только в группе ЛПС наблюдались трудности в процессе обучения у ОЭ самок по сравнению с группой ЛОЭ, в тесте через 24 часа различия исчезали, что может свидетельствовать о сохранности процесса консолидации памяти. Полученные данные о сходном проявлении страха в тесте 1 у ОЭ и ЛОЭ самок согласуются с данными литературы об отсутствии различий по уровню замирания в ответ на контекст и сигнал у ОЭ самок по сравнению с ЛОЭ (McDermott et al., 2015) или интактными самками на стадии эструса-проэструса (Kashefi, Rashidy-Pour, 2014). В другой модели условнорефлекторного страха со стержнем, через который наносились электрокожные раздражения, можно было наблюдать множественные проявления страха, включающие в себя не только замирание, но и уменьшение времени нахождения около стержня и числа контактов с ним, закапывания стержня и др. (Gervais et al., 2014). При этом после обучения ОЭ самки показали меньшее проявление страха на сигнал, чем контрольные самки. В нашей работе при предъявлении контекста как ОЭ, так и ЛОЭ самки замирали меньше, чем самцы, что согласуется с ранее полученными данными о половых различиях в проявлении страха на контекст (Maren et al., 1994; Daviu et al., 2014; Colon et al., 2018). Время замирания при действии звука не отличалось у самцов и самок. Меньшее время замирания на контекст связано, по-видимому, с меньшим уровнем тревожности у самок, чем у самцов. Проведенный ранее корреляционный анализ обнаружил связь между уровнем тревожности и временем замирания на контекст после обучения (Павлова и соавт., 2015). ОЭ, осуществляемая в подростковом возрасте, не приводила к увеличению уровня тревожности в наших опытах (Павлова и соавт., 2022).
Наибольшее влияние ОЭ оказала на угашение условнорефлекторного страха. При этом время замирания в процессе угашения у самок ОЭ группы было больше, чем у ЛОЭ группы, самки ЛПС группы угашали быстрее, чем самки ФИЗ группы. Как было ранее показано, существуют половые различия в угашении страха, у самок угашение протекает гораздо быстрее, чем у самцов (Павлова и соавт., 2020; Daviu et al., 2014), хотя у самок возможно и самопроизвольное восстановление страха (Matsuda et al., 2015; Park et al., 2017). Наши данные о большем времени замирания у ОЭ самок по сравнению с ЛОЭ самками в процессе угашения подтверждают данные литературы о дефиците угашения страха у ОЭ крыс по сравнению с интактными самками на стадии проэструс (Parrish et al., 2019) или по сравнению с ложнооперированными самками (Gupta et al., 2001). Кроме того, известно, что введение ОЭ самкам эстрадиола облегчало угашение и способствовало консолидации памяти об угашении (Zeidan et al., 2011; Chang et al., 2009; Graham, Scott, 2018; Graham, Daher, 2016). Большую роль в эффектах эстрадиола на угашение страха играют бета-рецепторы эстрогена, но не альфа-рецепторы, что было показано с введением агонистов данных рецепторов (Chang et al., 2009). Угашению может способствовать не только эстроген, но и прогестерон, вырабатываемый в яичниках. Инъекция прогестерона перед угашением страха самкам во время стадии метэструса (низкий уровень эстрогена и прогестерона) способствовала консолидации памяти об угашении (Milad et al., 2009), впоследствии было показано, что эффект прогестерона на угашение сильно зависит от временных интервалов введения (Graham, Daher, 2016). Полученные нами данные о замедлении угашения условнорефлекторного страха у ОЭ самок могут, по-видимому, объяснить увеличение у женщин в постменопаузе числа посттравматических стрессовых расстройств, при которых наблюдаются существенные трудности с угашением страха.
Относительно механизма действия эстрадиола при ускорении угашения известно следующее. Большая роль отводится NMDA рецепторам глутамата, активация которых необходима для улучшения функциональной пластичности. Введение антагониста NMDA рецептора (МК801) блокировало ускорение угашения страха после системного введения эстрадиола у ОЭ крыс, а введение агониста (D-циклосерина) способствовало угашению страха у ОЭ крыс, подобно действию эстрадиола (Graham, Scott, 2018). Показано, что высокий эндогенный уровень эстрадиола или активация бета-рецепторов к эстрогену улучшает глутаматергическую передачу и синаптическую пластичность в инфралимбической области медиальной префронтальной коры, в структуре, имеющей большое значение для выработки и консолидации памяти об угашения страха (Galvin, Ninan, 2014). Согласно современным представлениям о механизмах угашения страха, проекции нейронов инфралимбической коры, оканчивающиеся на тормозных вставочных нейронах миндалины, способны подавлять активность в центральной миндалине и уменьшать, таким образом, проявления страха при угашении (Cover et al., 2014). О том, что эстрадиол способен менять активность вентромедиальной префронтальной коры, говорят и другие факты. Так, введение агониста бета-рецепторов эстрогена после выработки угашения способствовало консолидации памяти об угашении и увеличивало экспрессию c-Fos генов в вентромедиальной префронтальной коре и снижало экспрессию данных генов в миндалине (Zeidan et al., 2011). На женщинах с помощью магнитно-резонансного сканера было показано, что при высоком эндогенном уровне эстрадиола наблюдается активация префронтальной коры и высокая скорость угашения страха (Zeidan et al., 2011). Кроме того, эстроген способен оказывать влияние на активность нейронов латерального и базального ядра миндалины. Во время стадии проэструс, когда наблюдается наиболее высокий уровень эстрогена и наибольшая скорость угашения страха на сигнал, у нейронов латерального ядра наблюдался сдвиг возбудительно-тормозного баланса в сторону тормозных реакций (Blume et al., 2017).
ОЭ оказала значительное влияние на обучение крыс в водном лабиринте Морриса в наших опытах, причем влияние отличалось в группах ФИЗ и ЛПС. В лабиринте Морриса проявились половые различия в обучении у самцов и ЛОЭ самок из ФИЗ группы, что подтвердило данные, ранее полученные на самцах и интактных самках (Зайченко и соавт., 2022; Snihur et al., 2008). ЛОЭ самки из ФИЗ группы испытывали трудности при обучении, латентность достижения платформы и проплываемая дистанция у них были больше, чем у самцов, для них даже в конце обучения была более характерна стратегия поиска платформы около стенок лабиринта (тигмотаксис). ОЭ самки из ФИЗ группы отличались от ЛОЭ самок, и были также успешны как самцы, т.е. ОЭ облегчила обучение самок в ФИЗ группе. Как известно, доминирующий тигмотаксис больше проявляется у самок и характерен для эгоцентрической стратегии поиска платформы, которая основана на запоминании траектории движения и ориентации на внутрилабиринтные стимулы (Koss, Frick, 2017). Аллоцентрическая стратегия, более характерная для самцов, основана на ориентации по внешним стимулам, расположенным вне бассейна. Можно предположить, что большая успешность ОЭ самок по сравнению с ЛОЭ самками была связана с тем, что ОЭ самки поменяли стратегию поиска платформы, тигмотаксис у ОЭ самок был менее выражен, чем у ЛОЭ животных. Эти данные подчеркивают роль эстрогенов в выборе стратегии поиска платформы в водном лабиринте Морриса.
В литературе имеются противоречивые данные о влиянии ОЭ на пространственное обучение. Ранее после ОЭ либо не наблюдали изменений в обучении в лабиринте Морриса (Tao et al., 2020; Simpkins et al., 1997; Li et al., 2014), либо видели ухудшение обучения (Sarkaki et al., 2008; Montereiro et al., 2005; Feng et al., 2004) и дефицит пространственной памяти в тесте с убранной платформой (Simpkins et al., 1997), либо ухудшение рабочей памяти в тесте с ежедневной перестановкой платформы (Tao et al., 2020). В меньшем числе работ, как и в наших опытах, наблюдали более успешное обучение в лабиринте Морриса ОЭ самок по сравнению с интактными животными (Daniel et al., 1999; Chesler, Juraska, 2000). Подтверждают наши результаты о положительном влиянии ОЭ на пространственное обучение данные литературы о том, что введение эстрадиола ОЭ самкам приводит к ухудшению обучения в лабиринте Морриса (Snihur et al., 2008; Daniel, Lee, 2004). Ухудшение обучения в пространственной задаче наблюдали также при совместном введении эстрогена и прогестерона ОЭ самкам (Chesler, Juraska, 2000). Эстроген, как известно, оказывает в целом положительное влияние на функционирование гиппокампа, ключевой структуры для пространственного обучения. Эстрадиол влияет на пластичность нейронов и нейрогенез в гиппокампе, которые связаны с гиппокамп-зависимым обучением и памятью (Cover et al., 2014). Эстрадиол увеличивает плотность синапсов и шипиков в поле СА1 гиппокампа и увеличивает длительную потенциацию. Введение эстрогена приводит к увеличению числа возбудительных синапсов на дендритах пирамидных клеток поля СА1 гиппокампа и уменьшению объема глиальных клеток (Chesler, Juraska, 2000). При повышенном уровне эстрогена увеличивается индукция длительной потенциации в поле СА1 в ответ на стимуляцию коллатералей Шаффера. Негативное влияние эстрогенов на выполнение пространственной задачи в литературе связывают с влиянием гормонов на внегиппокампальные структуры, либо со слишком высокой синаптической активностью собственно гиппокампа (Chesler, Juraska, 2000; Daniel et al., 1999).
В группе ЛПС, судя по нашим данным, ухудшалось обучение в лабиринте Морриса не только у самцов, но и ОЭ самок. У этих крыс по сравнению с ФИЗ группой была больше латентность достижения платформы и дистанция, а также время плавания на периферии лабиринта. Ранее ухудшение обучения в лабиринте Морриса после раннего провоспалительного стресса наблюдали только у самцов, но не у интактных самок (Зайченко и соавт., 2022). Ухудшение гиппокамп-зависимого пространственного обучения и долгосрочной памяти в водном лабиринте Морриса у ЛПС группы может быть связано с нарушениями функции гиппокампа за счет развития нейровоспалительного процесса, который подавляет нейротрофическую функцию факторов роста (BDNF и других) и нейрогенез (Gulyaeva, 2019; Григорьян и др., 2014). Дефицит BDNF и ослабленный нейрогенез способствуют уменьшению числа клеток гиппокампа. При этом вызываются пластические перестройки в виде уменьшения шипикового аппарата, длины и ветвления дендритного дерева. Влияние ЛПС на пластические перестройки в гиппокампе может приводить к ухудшению обучения в лабиринте Морриса. На переживающих срезах гиппокампа в поле СА1 крыс 17–33-дневного возраста после неонатального введения ЛПС был обнаружен дефицит длительной потенциации, что авторы связывают с ослаблением афферентного притока к нейронам гиппокампа (Kudryashova et al., 2019). В другой работе у крыс самцов, получавших ЛПС, также происходило значительное уменьшение длительной потенциации гиппокампа (Zubareva et al., 2020). При этом авторы связывают эти изменения с разной экспрессией субъединиц АМPA- и NМDА-рецепторов.
ЛПС практически не ухудшал обучение у ЛОЭ самок, по-видимому, из-за того, что эстроген, выделяющийся из сохранных яичников, выполнял защитную роль при развитии нейровоспалительного процесса. Известно, что эстрогены способны оказывать противовоспалительное влияние, ускоряя протекание воспалительного процесса в сторону его деактивации, большая роль при этом отводится противовоспалительному IL-4 (Villa et al., 2015). Эстрогены также могут затормозить выработку провоспалительных цитокинов (Najjar et al., 2018).
Тестирование на рабочую память с ежедневной сменой местоположения платформы в нашей работе не выявило серьезных нарушений обучения у ОЭ самок по сравнению с ЛОЭ самками. Большая дистанция и латентность достижения платформы была характерна для ЛОЭ самок по сравнению с ОЭ самками на первых попытках, на последующих попытках различия исчезали. Возможно, к увеличению дистанции и латентности у ЛОЭ самок приводила доминирующая стратегия поиска платформы на периферии лабиринта.
Таким образом, проведенное исследование свидетельствует об уменьшении половых различий между самцами и ОЭ самками как при угашении условнорефлекторного страха, так и при обучении в пространственной задаче. Ранний провоспалительный стресс оказывал влияние сходным образом на самцов и ОЭ самок, что наиболее четко видно при обучении в лабиринте Морриса.
ВЫВОДЫ
1. ОЭ, проведенная в подростковом возрасте (35 дней), приводила к увеличению веса взрослых самок на 20.6–21.8% по сравнению с ЛОЭ самками.
2. ОЭ у крыс после раннего провоспалительного стресса затрудняла выработку условнорефлекторного страха на звук. Однако в тесте через 24 часа после обучения не наблюдалось различий в уровне замирания у ОЭ и ЛОЭ самок. У крыс ФИЗ группы обучение не менялось после ОЭ.
3. ОЭ замедляла угашение условнорефлекторного страха на звук по сравнению с ЛОЭ самками у крыс ЛПС и ФИЗ групп.
4. Контрольные самки ФИЗ группы после ОЭ успешнее обучались поиску скрытой платформы в лабиринте Морриса по сравнению с ЛОЭ самками, при этом у них было меньше время плавания на периферии лабиринта, меньше дистанция и латентный период нахождения платформы. У ОЭ самок в ФИЗ группе уменьшались половые различия с самцами в обучении. Ранний провоспалительный стресс оказывал существенное влияние на ОЭ самок и самцов, затрудняя обучение в лабиринте Морриса, что проявлялось в увеличении латентности, дистанции и времени плавания на периферии лабиринта.
5. Не было выявлено влияния ОЭ на рабочую память крыс в ФИЗ и ЛПС группах в тесте с ежедневной сменой местоположения платформы.
Список литературы
Брошевицкая Н.Д., Павлова И.В., Зайченко М.И., Онуфриев М.В., Моисеева Ю.В., Григорьян Г.А. Половые различия в оборонительном поведении взрослых крыс в ответ на ранний нейровоспалительный стресс. Журн. высш. нерв. деят. им. И.П.Павлова. 2020.70(2): 261–278.
Григорьян Г.А. Овариоэктомия как модель тревожно-депрессивных расстройств. Нейрохимия. 2022. 39(1): 1–14.
Григорьян Г.А., Дыгало Н.Н., Гехт А.Б., Степаничев М.Ю., Гуляева Н.В. Молекулярно-клеточные механизмы депрессии. Роль глюкокортикоидов, цитокинов, и нейротрофических факторов в генезе депрессивных расстройств. Успехи физ. наук. 2014. 44(2): 3–20.
Зайченко М.И., Шаркова А.В., Павлова И.В., Григорьян Г.А. Половые различия во влиянии раннего провоспалительного стресса на обучение и память взрослых крыс в водном лабиринте Морриса. Журн. высш. нервн. деят. им. И.П. Павлова. 2022. 72(2): 222–238.
Павлова И.В., Брошевицкая Н.Д., Онуфриев М.В., Моисеева Ю.В. Половые различия в тревожности и оборонительном поведении крыс Вистар. Журн. высш. нервн. деят. им. И.П.Павлова. 2020. 70(2): 243–258.
Павлова И.В., Брошевицкая Н.Д., Зайченко М.И., Григорьян Г.А. Влияние овариоэктомии на тревожно-депрессивное поведение самок крыс в норме и после раннего провоспалительного стресса. Журн. высш. нервн. деят. им. И.П. Павлова. 2022. 72(2): 277–292.
Павлова И.В., Рысакова М.П. Проявление тревожности крыс Вистар при выработке условнорефлекторного страха. Журн. высш. нервн. деят. им. И.П. Павлова. 2015. 65(6): 720–734.
Azizi-Malekabadi H., Hosseini M., Pourganji M., Zabihi H., Saeedjalali M., Anaeigoudari A. Deletion of ovarian hormones induces a sickness behavior in rats comparable to the effect of lipopolysaccharide. Neurol. Res. Int. 2015.627642.
Blume S.R., Freedberg M., Vantrease J.E., Chan R., Padival M., Record M.J., DeJoseph M.R., Urban J.H., Rosenkranz J.A. Sex- and estrus-dependent differences in rat basolateral amygdala. J. Neurosci. 2017. 37(44): 10567–10586.
Chang Y.J., Yang C.H., Liang Y.C., Yeh C.M., Huang C.C., Hsu K.S. Estrogen modulates sexually dimorphic contextual fear extinction in rats through estrogen receptor beta. Hippocampus. 2009. 19(11): 1142–1150.
Chesler E.J., Juraska J.M. Acute administration of estrogen and progesterone impairs the acquisition of the spatial morris water maze in ovariectomized rats. Horm. Behav. 2000. 38(4): 234–242.
Colon L., Odynocki N., Santarelli A., Poulos A.M. Sexual differentiation of contextual fear responses. Learn. Mem. 2018. 25(5): 230–240.
Cover K.K., Maeng L.Y., Lebrón-Milad K., Milad M.R. Mechanisms of estradiol in fear circuitry: implications for sex differences in psychopathology. Transl. Psychiatry. 2014. 4(8): e422.
Daniel J.M., Lee C.D. Estrogen replacement in ovariectomized rats affects strategy selection in the Morris water maze. Neurobiol. Learn Mem. 2004. 82(2): 142–149.
Daniel J.M., Roberts S.L., Dohanich G.P. Effects of ovarian hormones and environment on radial maze and water maze performance of female rats. Physiol. Behav. 1999. 66: 11–20.
Daviu N., Andero R., Armario A., Nadal R. Sex differences in the behavioral and hypothalamic-pituitary-adrenal response to contextual fear conditioning in rats. Horm. Behav. 2014. 66(5): 713–723.
Feng Z., Cheng Y., Zhang J. Long-term effects of melatonin or 17 beta-estradiol on improving spatial memory performance in cognitively impaired, ovariectomized adult rats. J. Pineal. Res. 2004. 37(3): 198–206.
Galvin C., Ninan I. Regulation of the mouse medial prefrontal cortical synapses by endogenous estradiol. Neuropsychopharmacology. 2014. 39: 2086–2094.
Ge F., Yang H., Lu W., Shi H., Chen Q., Luo Y., Liu L., Yan J. Ovariectomy induces microglial cell activation and inflammatory response in rat prefrontal cortices to accelerate the chronic unpredictable stress-mediated anxiety and depression. Biomed.Res. Int. 2020. 2020: 3609758.
Gervais N.J., Jacob S., Brake W.G., Mumby D.G. Modulatory effect of 17-β estradiol on performance of ovariectomized rats on the Shock-Probe test. Physiol. Behav. 2014. 131: 129–135.
Graham B.M., Daher M. Estradiol and progesterone have opposing roles in the regulation of fear extinction in female rats. Neuropsychopharmacology. 2016. 41(3): 774–780.
Graham B.M., Scott E. Effects of systemic estradiol on fear extinction in female rats are dependent on interactions between dose, estrous phase, and endogeneous estradiol levels. Horm. Behav. 2018. 97: 67–74.
Gulyaeva N.V. Functional neurochemistry of the ventral and dorsal hippocampus: stress, depression, dementia and remote hippocampal damage. Neurochem. Res. 2019. 44(6): 1306–1322.
Gupta R.R., Sen S., Diepenhorst L.L., Rudick C.N., Maren S. Estrogen modulates sexually dimorphic contextual fear conditioning and hippocampal long-term potentiation (LTP) in rats(1). Brain Res. 2001. 888(2): 356–365.
Iwasa T., Matsuzaki T., Tungalagsuvd A., Munkhzaya M., Kawami T., Kato T., Kuwahara A., Yasui T., Irahara M. Effects of ovariectomy on the inflammatory responses of female rats to the central injection of lipopolysaccharide. J. Neuroimmunol. 2014a. 277(1–2): 50–56.
Karisetty B.C., Maitra S., Wahul A.B., Musalamadugu A., Khandelwal N., Guntupalli S., Garikapati R., Jhansyrani T., Kumar A., Chakravarty S. Differential effect of chronic stress on mouse hippocampal memory and affective behavior: Role of major ovarian hormones. Behav. Brain Res. 2017. 318: 36–44.
Kashefi A., Rashidy-Pour A. Effects of corticosterone on contextual fear consolidation in intact and ovariectomized female rats. Neurobiol. Learn Mem. 2014. 114: 236–241.
Khaleghi M., Rajizadeh M.A., Bashiri H., Kohlmeier K.A., Mohammadi F., Khaksari M., Shabani M. Estrogen attenuates physical and psychological stress-induced cognitive impairments in ovariectomized rats. Brain Behav. 2021. 11(5): e02139.
Khayum M.A., Moraga-Amaro R., Buwalda B., Koole M., den Boer J.A., Dierckx R.A.J.O., Doorduin J., de Vries E.F. Ovariectomy-induced depressive-like behavior and brain glucose metabolism changes in female rats are not affected by chronic mild stress. J. Psychoneuroendocrinology. 2020. 115: 104610.
Koss W.A., Frick K.M. Sex differences in hippocampal function. Journal of Neuroscience Research. 2017. 95: 539–562.
Kudryashova I.V., Tishkina A.O., Gulyaeva N.V. Neonatal proinflammatory stress and deficit of induction of long-term potentiation in the hippocampus in rats: gender differences. Neurosci. Behav. Physiol. 2019. 49(9): 1118–1126.
Li L.H., Wang Z.C., Yu J., Zhang Y.Q. Ovariectomy results in variable changes in nociception, mood and depression in adult female rats. PLoS One. 2014. 9(4): e94312.
Maren S., De Oca B., Fanselow M.S. Sex differences in hippocampal long-term, potentiation (LTP) and Pavlovian fear conditioning in rats: positive correlation between LTP and contextual learning. Brain. Res. 1994. 661(1–2): 25–34.
Matsuda S., Matsuzawa D., Ishii D., Tomizawa H., Sutoh C., Shimizu E. Sex differences in fear extinction and involvements of extracellular signal-regulated kinase (ERK). Neurobiol. Learn Mem. 2015. 123: 117–124.
McDermott C.M., Liu D., Ade C., Schrader L.A. Estradiol replacement enhances fear memory formation, impairs extinction and reduces COMT expression levels in the hippocampus of ovariectomized female mice. Neurobiol. Learn Mem. 2015. 118: 167–177.
Milad M.R., Igoe S.A., Lebron-Milad K., Novales J.E., Estrous cycle phase and gonadal hormones influence conditioned fear extinction. Neuroscience. 2009. 164: 887–895.
Mirshekar M., Abrari K., Goudarzi I., Rashidy-Pour A. Systemic administrations of β-estradiol alleviate both conditioned and sensitized fear responses in an ovariectomized rat model of post-traumatic stress disorder. Neurobiol. Learn Mem. 2013. 102: 12–19.
Monteiro S.C., Matté C., Bavaresco C.S., Netto C.A., Wyse A.T.S. Vitamins E and C pretreatment prevents ovariectomy-induced memory deficits in water maze. Neurobiol. Learn Mem. 2005. 84(3): 192–199.
Najjar F., Ahmad M., Lagace D., Leenen F.H.H. Sex differences in depression-like behavior and neuroinflammation in rats post-MI: role of estrogens. Am.J.Physiol. Heart Circ. Physiol. 2018. 315(5): H1159–H1173.
Park C.H.J., Ganella D.E., Kim J.H. Juvenile female rats, but not male rats, show renewal, reinstatement, and spontaneous recovery following extinction of conditioned fear. Learn. Mem. 2017. 24(12): 630–636.
Parrish J.N., Bertholomey M.L., Pang H.W., Speth R.C., Torregrossa M.M. Estradiol modulation of the renin-angiotensin system and the regulation of fear extinction. Transl. Psychiatry. 2019. 9(1): 36.
Puga-Olguín A., Rodríguez-Landa J.F., Rovirosa-Hernández M.J., Germán-Ponciano L.J., Caba M., Meza E., Guillén-Ruiz G., Olmos-Vázquez O.J. Long-term ovariectomy increases anxiety- and despair-like behaviors associated with lower Fos immunoreactivity in the lateral septal nucleus in rats. Behav. Brain Res. 2019. 360: 185–195.
Sarkaki A., Amani R., Badavi M., Safahani M., Aligholi H. Effect of ovariectomy on reference memory version of Morris water maze in young adult rats. Iran. Biomed. J. 2008. 12(2): 123–128.
Simpkins J.W, Green P.S, Gridley K.E, Singh M, de Fiebre N.C, Rajakumar G. Role of estrogen replacement therapy in memory enhancement and the prevention of neuronal loss associated with Alzheimer’s disease. Am. J. Med. 1997. 103(3A): 19S–25S.
Snihur A.W.K., Hampson E., Cain D.P. Estradiol and corticosterone independently impair spatial navigation in the Morris water maze in adult female rats. Behav. Brain Res. 2008. 187(1): 56–66.
Takuma K., Mizoguchi H., Funatsu Y., Hoshina Y., Himeno Y., Fukuzaki E., Kitahara Y., Arai S., Ibi D., Kamei H., Matsuda T., Koike K., Inoue M., Nagai T., Yamada K. Combination of chronic stress and ovariectomy causes conditioned fear memory deficits and hippocampal cholinergic neuronal loss in mice. Neuroscience. 2012. 207: 261–273.
Takuma K., Mizoguchi H., Funatsu Y., Kitahara Y., Ibi D., Kamei H., Matsuda T., Koike K., Inoue M., Nagai T., Yamada K. Placental extract improves hippocampal neuronal loss and fear memory impairment resulting from chronic restraint stress in ovariectomized mice. J. Pharmacol. Sci. 2012. 120(2): 89–97.
Tao X., Yan M., Wang L., Zhou Y., Wang Z., Xia T., Liu X., Pan R., Chang Q. Effects of estrogen deprivation on memory and expression of related proteins in ovariectomized mice. Ann. Transl. Med.2020. 8(6): 356.
Villa A., Vegeto E., Poletti A., Maggi A. Estrogens, neuroinflammation, and neurodegeneration. Endocrin. Rev. 2016. 37(4): 372–402.
Wang Y., Xu Y., Sheng H., Ni X., Lu J. Exercise amelioration of depression-like behavior in OVX mice is associated with suppression of NLRP3 inflammasome activation in hippocampus. Behav. Brain Res. 2016. 307: 18–24.
Wu B., Song Q., Zhang Y., Wang C., Yang M., Zhang J., Han W., Jiang P. Antidepressant activity of ω-3 polyunsaturated fatty acids in ovariectomized rats: role of neuroinflammation and microglial polarization. Lipids Health Dis. 2020. 19(1): 4.
Zeidan M.A., Igoe S.A., Linnman C., Vitalo A., Levine J.B., Klibanski A., Goldstein J.M., Milad M.R. Estradiol modulates medial prefrontal cortex and amygdala activity during fear extinction in women and female rats. Biological Psychiatry. 2011. 70: 920–927.
Zubareva O.E., Postnikova T.Y., Grifluk A.V., Schwarz A.P., Smolensky I.V., Karepanov A.A., Vasilev D.S., Veniaminova E.A., Rotov A.Y., Kalemenev S.V., Zaitsev A.V. Exposure to bacterial lipopolysaccharide in early life affects the expression of ionotropic glutamate receptor genes and is accompanied by disturbances in long-term potentiation and cognitive functions in young rats. Brain Behav. Immun. 2020. 90: 3–15.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


