Журнал высшей нервной деятельности им. И.П. Павлова, 2022, T. 72, № 4, стр. 520-542
Изменения социальности и предпочтения социальной новизны у самок крыс в условиях пролонгированной социальной изоляции
С. Д. Ширенова 1, Н. Н. Хлебникова 1, Н. А. Крупина 1, *
1 Федеральное государственное бюджетное научное учреждение “Научно-исследовательский
институт общей патологии и патофизиологии”
Москва, Россия
* E-mail: krupina-na@yandex.ru
Поступила в редакцию 01.11.2021
После доработки 16.01.2022
Принята к публикации 26.04.2022
- EDN: PRERDC
- DOI: 10.31857/S0044467722040104
Аннотация
Хронический стресс социальной изоляции (СИ) может приводить к дистрессу с негативными последствиями как для человека, так и для животных. В число многочисленных нарушений, вызванных СИ, входят расстройства эмоционально-мотивационной сферы и когнитивных функций, изменение социального поведения. В настоящее время нет данных о том, каковы последствия СИ при значительном увеличении ее длительности. Несмотря на то, что показана большая чувствительность самок крыс к стрессу, исследований на них недостаточно. В настоящей работе мы оценили социальность (общительность) и предпочтение “социальной новизны” в трехкамерном социальном тесте у самок крыс Wistar в двух сериях исследований на разных сроках пролонгированной СИ, начинавшейся в подростковом возрасте и продолжавшейся до возраста 5.5 и 9.5 месяцев. После СИ длительностью 2 месяца у крыс выявлено повышение предпочтения социального объекта несоциальному (повышение социальности) одновременно с появлением признаков снижения предпочтения нового социального объекта уже знакомому социальному объекту (признаки снижения предпочтения “социальной новизны”). В тесте социального взаимодействия крысы также демонстрировали увеличение длительности социальных контактов, в том числе агрессивных; у них отмечено снижение исследовательских оценок риска (свешиваний с открытых рукавов) в тесте “Приподнятый крестообразный лабиринт” и снижение исследовательской активности. После СИ длительностью 8.5 месяцев у крыс выявлены признаки дефицита социальности и выраженное снижение предпочтения “социальной новизны”. Признаков повышенной агрессивности не обнаружено. Таким образом, влияние СИ на социальное поведение зависело от ее длительности и, как мы считаем, сопровождалось изменением стратегий преодоления.
Хронический стресс, сопровождающийся чрезмерной активацией автономной нервной системы и гипоталамо-гипофизарно-адреналовой оси, обеспечивающих функционирование механизмов аллостаза, ведет к аллостатической нагрузке, следствием которой может быть развитие нейропластических перестроек в мозге и формирование патофизиологической основы нарушений психики и поведения (McEwen, 2004; McEwen, Gianaros, 2011; Ieraci et al., 2016). Изменения поведения в ответ на стресс основаны на эмоциональной и когнитивной оценке ситуации, что позволяет субъекту выработать стратегию преодоления (копинг-стратегию) (Dantzer, 2016). Среди хронических стрессов разного происхождения для социально живущих видов, включая человека, особое место занимает психосоциальный стресс, вызванный снижением числа социальных контактов, – стресс социальной изоляции (СИ), который может приводить к психологическому дистрессу с негативными последствиями как для человека (Holt-Lunstad et al., 2010), так и для животных (Mumtaz et al., 2018). Развитие дистресса у человека в условиях вынужденной длительной СИ подтверждено наблюдениями в период пандемии COVID-19 (Gorenko et al., 2020; Mann, Walker, 2022; Karpenko, 2020). У крыс, которые относятся к социальным животным (Schweinfurth, 2020), СИ приводит к развитию многочисленных нарушений, к которым, помимо изменения состояния нейроэндокринной системы, системы нейротрофических факторов, нейрохимических, физиологических и анатомических показателей, относятся расстройства эмоционально-мотивационной сферы и когнитивных функций (Heidbreder et al., 2000; Fone, Porkness, 2008; Mumtaz et al., 2018; Arakawa, 2018).
Во многих работах обнаружен половой диморфизм в эмоционально-мотивационном поведении интактных крыс разных линий. Так, например, взрослые самки линий Sprague-Dawley и Wistar были менее тревожны по сравнению с самцами в тесте “Приподнятый крестообразный лабиринт” (ПКЛ), а двигательная/исследовательская активность у них была выше, чем у самцов (Павлова и соавт., 2020; Krupina et al., 2020; Scholl et al., 2019). Экспрессия тревожно-подобного поведения у крыс зависит от пола животного, что важно учитывать в трансляционных исследованиях. Половые различия в ответе на стресс ожидаемы и показаны в многочисленных исследованиях, особенно в случаях стрессирования животных в раннем периоде развития (Bale, Epperson, 2015; Oyola M.G., Handa, 2017; Bangasser et al., 2018; Heck, Handa, 2019). Однако большинство работ проводится на самцах, это смещение особенно заметно в нейробиологии и биомедицинских исследованиях (Beery, Zucker, 2011). Для восполнения пробела в изучении половых различий в реактивности мозга предлагается применять биопсихосоциальный подход (Hirnstein, Hausmann, 2021), акцентируя внимание на исследованиях с использованием самок (Couzin-Frankel, 2014). Такой подход позволит выявить механизмы, определяющие различную предрасположенность особей разного пола к развитию психоневрологических нарушений, этиологически связанных со стрессом (Bangasser et al., 2018; Heck, Handa, 2019).
Стресс СИ, начинающийся в раннем возрасте и продолжающийся от нескольких недель до 2–3 мес, как правило, хотя не всегда, провоцирует повышение уровня тревожности и двигательной активности у самцов крыс разных линий (цит. по обзору (Fone, Porkness, 2008); обзору (Lukkes et al., 2009); (Mumtaz et al., 2018; Begni et al., 2020)), и эти изменения рассматривают как составляющую адаптационного ответа, предполагающего усиление поведения избегания рисков в угрожающей среде (McEwen et al., 2012). Как показано в последние годы, СИ также может изменять уровень тревожности у самок, но данные противоречивы. Например, после краткой СИ в подростковом возрасте уровень тревожности у самок крыс Sprague-Dawley был выше, чем у самок, содержавшихся в группах, и не отличался от уровня тревожности у самцов (Leussis, Andersen, 2007), а комбинированный стресс хронической СИ в подростковом возрасте, отягощенный периодической социальной угрозой или ограничением свободы, у самок Wistar, в отличие от самцов, не повышал уровень тревожности в тесте ПКЛ, однако увеличивал двигательную и исследовательскую активность (Bourke, Neigh, 2011). Нарушения по другим показателям поведения, таким как депрессивно-подобное поведение, болевая чувствительность, обучение под влиянием СИ, были сильнее выражены у самок грызунов, чем у самцов (Bourke, Neigh, 2011; Hong et al., 2012; Beery, Kaufer, 2015). По совокупности наблюдений было высказано предположение, что для проявления нарушений в поведении, индуцированных СИ, у самок требуется больше времени, чем у самцов (Fone, Porkness, 2008), что определяет необходимость моделирования длительной СИ.
В наших исследованиях на модели СИ, начинавшейся у крыс в раннем возрасте и пролонгированной до 9 мес, мы также выявили более выраженные когнитивные нарушения у самок по сравнению с самцами по показателям пространственной памяти и ассоциативного обучения на поздних сроках изоляции (Krupina et al., 2020). Несмотря на то, что базовый уровень кортикостерона в сыворотке крови самцов и самок крыс после 9 мес СИ не отличался от контрольного, его значения были выше у самок, чем у самцов, и только у самок, находившихся в условиях СИ, относительный вес надпочечников был выше, чем у самок, которых содержали в группах. Этот факт прямо свидетельствовал о том, что пролонгированная до 9 мес СИ является сильным стрессирующим воздействием, ответ на которое сильно выражен у самок крыс.
К изменениям поведения, индуцированным экспериментальным хроническим стрессом СИ, относятся и изменения социального поведения (Mumtaz et al., 2018). У крыс развиваются нарушения социальности (общительности) и социальной памяти (Arakawa, 2018; Tanaka et al., 2019). В наших исследованиях показано, что двух-/трехмесячная СИ провоцирует усиление социальных контактов у самцов крыс Wistar (Крупина и соавт., 2015; Хлебникова и соавт., 2018). В работе (Ferdman et al., 2007) на крысах той же линии выявлено увеличение социальных контактов у самцов, но не у самок крыс после 10–11 недель СИ. Однако в настоящее время мало данных о влиянии длительной СИ на социальное взаимодействие крыс, особенно самок, в разных моделях, предполагающих прямой социальный контакт животных или оценку социального предпочтения. На разных стадиях онтогенеза социальное взаимодействие носит специфический для возраста характер (Einon, Morgan, 1977; Arakawa, 2003, 2018), вследствие этого эффекты СИ зависят от того, на какой стадии развития и на какой срок субъекта подвергали изоляции. По изменению социального поведения можно судить не только об эффектах стресса как такового, но и об адаптации к действию стресса в случае его многократного повторения (Agrawal et al., 2011).
Насколько нам известно, в настоящее время нет данных о том, как длительная СИ, начатая в подростковом возрасте и непрерывно продолжающаяся во взрослом возрасте, влияет на социальное поведение самок крыс на разных сроках изоляции. Целью данного исследования была оценка социальности и предпочтения “социальной новизны” параллельно с оценкой уровня тревожности и двигательной активности в разных тестах у самок крыс на разных сроках длительной социальной изоляции, начинавшейся в раннем постнатальном онтогенезе и продолжавшейся до 8.5 месяцев.
МЕТОДИКА
В работе использованы самки крыс популяции Wistar, рожденные и выращенные в питомнике ФГБНУ “НИИОПП” (система “Меркурий”, номер в реестре: RU 1487336). Начиная с рождения, и на протяжении всего исследования животных содержали в стандартных условиях вивария с естественной сменой освещенности и свободным доступом к воде и пище (ООО “Лабораторкорм”, Россия). Все процедуры и эксперименты на животных проводили в соответствии с “Правилами надлежащей лабораторной практики”, утвержденными приказом Министерства здравоохранения РФ № 199н от 01.04.2016, ГОСТ 33215-2014, 33216-2014 “Руководство по содержанию и уходу за лабораторными животными”, а также в соответствии с Директивой 2010/63/EU от 22 сентября 2010 г. о защите животных, используемых в научных целях. Исследования были выполнены под контролем Этического комитета ФГБНУ “НИИОПП”.
Моделирование социальной изоляции
Две серии многомесячных исследований проведены последовательно в течение двух лет по схожей схеме. Дизайн исследования представлен на рис. 1. Крысята были рождены в одно и то же время года: конец декабря–начало января, – таким образом, все последующие оценки поведения крыс на каждом сроке в обеих сериях получены в течение одного и того же сезона. День рождения крыс считали нулевым постнатальным днем (ПНД). В первый ПНД каждой самке для вскармливания оставляли по 5–7 крысят из разных пометов, чтобы уменьшить влияние генетического фактора и уровня материнской заботы на поведение потомства. Крысят отсаживали от матерей на 31-й ПНД в серии 1 и на 35–36-й ПНД в серии 2, что соответствовало подростковому возрасту (Lukkes et al., 2009; McCormick, Green, 2013). Различие в сроках отсаживания от матери было обусловлено некоторыми отличиями в наборе поведенческих тестов в двух сериях. У крыс в возрасте 1 мес проводили первичную оценку двигательной активности в тесте автоматизированного “Открытого поля” (описание теста приведено ниже) и с учетом веса животных формировали контрольные и опытные группы крыс таким образом, чтобы по данным показателям группы не различались: в серии 1 – Контроль К1 (n = 30) и социальная изоляция СИ1 (n = 31); в серии 2 – Контроль К2 (n = 31) и социальная изоляция СИ2 (n = 30). Начиная со дня отсаживания от матери, на протяжении всего эксперимента животных контрольных групп содержали по 4–5 особей в клетках, изготовленных из непрозрачного полипропилена, размером 57.0 × 37.0 × 19.0 см, животных опытных групп содержали поодиночке в клетках размером 36.5 × 20.5 × 14.0 см до достижения животными возраста 5.5 мес в серии 1 и 9.5 мес в серии 2. Крыс контрольных и опытных групп в обеих сериях на протяжении всего эксперимента содержали в одинаковых условиях, в одной и той же комнате вивария, в которой также находились клетки с самцами. Крысы, которых содержали поодиночке, имели возможность воспринимать обонятельные, слуховые и в меньшей степени визуальные сигналы от других крыс, но были полностью лишены тактильного взаимодействия, то есть возможности прямых социальных контактов. Кроме того, этих крыс по сравнению с групповыми животными содержали в клетках меньшей высоты, что могло в некоторой степени ограничивать их моторную активность. Режим СИ у крыс опытных групп нарушали при чистке клеток дважды в неделю и при плановом тестировании. В периоды тестирования один раз в неделю крыс всех групп взвешивали.
Рис. 1.
Дизайн эксперимента. (а) – серия 1, (б) – серия 2. Постнатальный день 0 (ПНД 0) – день рождения животных, аОП – тест автоматизированного “Открытого поля”, кОП – тест классического “Открытого поля”, ПКЛ – тест “Приподнятый Крестообразный Лабиринт”, ТКС – трехкамерный социальный тест, СВ – тест социального взаимодействия. День отсаживания крысят от матери совпадал со днем начала социальной изоляции у крыс опытной группы.
Fig. 1. Experiment design. (а) – series 1, (б) – series 2. Postnatal day 0 (ПНД 0) – animals’ birthday, aOП – automated open field test, кOП – classic open field test, ПКЛ – Elevated Plus Maze test, ТКС – three-chamber social test, СВ – social interaction test. The day the pups were weaned from the dams coincided with the day of the beginning of social isolation in the experimental group rats.
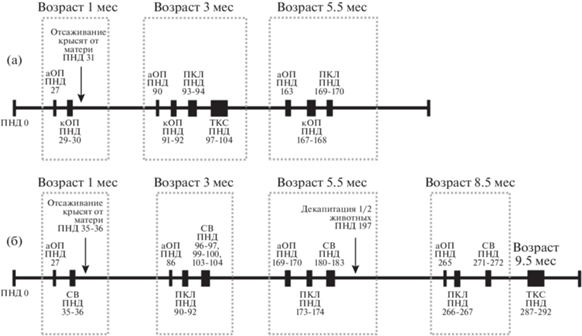
К окончанию экспериментов длительность СИ в серии 1 составила 4.5 мес, а в серии 2 – 8.5 мес.
В серии 2 по достижении животными возраста 6 мес, после окончания поведенческих исследований, половину крыс опытной и контрольной групп декапитировали с помощью гильотины и отбирали пробы структур мозга для последующего биохимического анализа (данные будут приведены в другой статье). Таким образом, на последнем этапе исследования поведения крыс в возрасте 9.5 мес в группе К2 оставалось 14 животных, а в группе СИ2 – 16 животных.
Оценка двигательной и исследовательской активности
Тест автоматизированного “Открытого поля”. В автоматизированном “открытом поле” (аОП) с прозрачными стенками (арена размером 48 × 48 × 21 см) в течение 10 мин при мягком комнатном освещении (17 люкс) оценивали горизонтальную (двигательную) и вертикальную (исследовательскую) активность крыс соответственно по пройденному пути в см и по числу стоек с помощью программного обеспечения системы Opto-Varimex (“Columbus Instruments”, США). После тестирования каждого животного в данном тесте и всех других (см. ниже) тестах экспериментальную камеру протирали 70%-м спиртом и высушивали с помощью полотенца.
В серии 1 двигательную активность в данном тесте оценивали у крыс в возрасте 1, 3 и 5.5 мес; в серии 2 – в возрасте 1, 3, 5.5 и 8.5 мес.
Оценка тревожно-подобного поведения
Тест классического “Открытого поля”. Известно, что снижение предпочтения центра ОП характеризует повышение тревожности у грызунов (Mohammad et al., 2016). Тестирование проводили в условиях классического “Открытого поля” (кОП, круглая белая арена диаметром 120 см, разделенная на 20 квадратов со стороной 20 см и окруженная непрозрачными стенками высотой 28 см) при ярком освещении (500–510 люкс в центре, 400–410 люкс на периферии ОП). Центром поля считали внутреннюю центральную круглую зону диаметром 28.3 см, краевой зоной считали наружную зону, прилежащую к стенке ОП, и составлявшую 20% от радиуса ОП, то есть 12 см. Общее время тестирования составляло 5 мин. Наряду с оценкой двигательной активности по числу пересеченных квадратов и исследовательской активности по числу вертикальных стоек оценивали латентный период захода в краевую зону ОП (с); время, проведенное в краевой зоне (с); время, проведенное в центре ОП за вычетом латентного периода выхода из центра после помещения крысы в ОП (далее – время в центре). Этим методом оценивали уровень тревожности у крыс в возрасте 1, 3 и 5.5 мес только в серии 1.
Тест “Приподнятый крестообразный лабиринт” (ПКЛ). Использовали стандартный подход для оценки тревожности в ПКЛ (Pellow et al., 1985) с применением современного протокола (Ari et al., 2019), оборудование и программное обеспечение видеосистемы “VideoMot2” (“TSE System”, Германия). Размеры и структура лабиринта, имеющего 2 открытых рукава (ОР) и 2 закрытых рукава (ЗР), подробно описаны в статье (Крупина и др., 2015). Освещенность над центральной зоной ПКЛ составляла 24 лк. Крысу помещали в центр лабиринта головой в сторону одного из ОР. Определяли длительность пребывания животного в ОР и ЗР и рассчитывали предпочтение ОР как отношение длительности пребывания крысы в ОР к суммарной длительности пребывания в рукавах ПКЛ; по величине общего пробега в ПКЛ (см) судили о двигательной активности животных; также оценивали среднюю скорость передвижения (см/с), число и длительность вертикальных стоек и свешиваний с ОР. Длительность тестирования составляла 5 мин.
В серии 1 уровень тревожности в ПКЛ оценивали у крыс в возрасте 3 и 5.5 мес; в серии 2 – в возрасте 3, 5.5 и 8.5 мес.
Оценка социального поведения
В работе применяли два типа тестов для оценки социального поведения крыс: (1) трехкамерный социальный тест (ТКС-тест), в котором оценивали социальность крыс, то есть выбор между незнакомым социальным объектом (конспецификом, находящимся в условиях ограничения двигательной активности) и несоциальным объектом, а также предпочтение “социальной новизны” – выбор между знакомым и незнакомым конспецификами; (2) тест социального взаимодействия (тест СВ), в котором оценивали социальные контакты крыс с конспецификом в условиях свободного поведения обоих.
Трехкамерный социальный тест. Для тестирования использовали аппарат, представлявший собой серый пластиковый ящик размером 120 × 80 см, разделенный двумя перегородками с дверцами на 3 равные части-камеры (40 × 40 × 80 см). За 24 ч до тестирования крыс опытных и контрольных групп для адаптации помещали по одной в пустой трехкамерный ящик, предоставляя животным возможность его исследовать в течение 5 минут. Интактных крыс того же пола и возраста, предназначавшихся для тестирования в качестве социальных объектов и не входивших в экспериментальные группы, за 24 ч до тестирования также адаптировали к обстановке, помещая их на 5 мин в клетку-цилиндр (диаметром 20 см и высотой 30 см). Стенки цилиндра были образованы металлическими прутьями. На следующий день во время эксперимента центральную камеру оставляли пустой, в две крайние камеры помещали клетки-цилиндры, в один из которых сажали крысу в качестве социального объекта (этих крыс на протяжении исследования содержали в другой комнате вивария), второй цилиндр оставляли пустым. Подопытную крысу помещали в центральную камеру на 1 мин для адаптации, затем дверцы открывали, и подопытная крыса могла исследовать все три камеры в течение 10 мин (Этап 1). По истечении 10 мин дверцы снова закрывали и возвращали подопытную крысу в центральную камеру. В это время во второй, ранее пустой цилиндр сажали вторую крысу (новый, незнакомый социальный объект). Затем дверцы открывали, и подопытная крыса могла исследовать все три камеры в течение 10 мин (Этап 2). На каждом этапе оценивали время, проведенное тестируемой крысой в каждой камере с объектами, и число заходов в эти камеры; время, проведенное крысой у каждого из объектов, и число подходов к объектам. Подходом к объекту считали приближение носа крысы к другой крысе, находившейся в цилиндре, или к пустому цилиндру, то есть активное изучение объекта на расстоянии не далее двух см от металлических прутьев цилиндров.
Социальность на Этапе 1 тестирования оценивали по предпочтению социальной камеры и социального объекта по формулам (McKibben et al., 2014):
(1) [(время, поведенное в камере с социальным объектом) – (время, проведенное в камере с пустым цилиндром)]/(суммарное время, проведенное в этих двух камерах) × × 100%;
(2) [(время, поведенное около социального объекта) – (время, проведенное около пустого цилиндра)]/(суммарное время, проведенное около двух объектов) × 100%.
Аналогично рассчитывали показатели “социальной новизны” на Этапе 2 тестирования: по предпочтению камеры с новым социальным объектом (незнакомой крысой) и самого нового социального объекта уже знакомому социальному объекту.
Трехкамерный социальный тест в серии 1 проводили у крыс в возрасте трех мес (длительность СИ у крыс опытной группы составляла 2 мес), в серии 2 – у крыс в возрасте 9.5 мес (длительность СИ у крыс опытной группы составляла 8.5 мес).
Тест социального взаимодействия. Социальное взаимодействие оценивали в незнакомой для крыс клетке из плексигласа (37.0 × × 57.0 × 19.0 см) в экспериментальной комнате при красном свете: освещенность над центром клетки составляла 7 лк. По методу Schneider, Przewłocki (2004) с небольшими модификациями сравнивали поведение пар крыс, которые формировали из животных либо опытной, либо контрольной группы, то есть единицей для сбора данных была пара крыс (Hermes et al., 2011; Campos et al., 2013). Подбор пар осуществляли таким образом, чтобы животные из одной группы на каждом сроке тестирования не встречались друг с другом ранее и различие в их весе не превышало 15%. Длительность тестирования составяла 15 мин. Оценивали длительность активных неагрессивных социальных контактов: вынюхивание, социальный груминг (вылизывание), залезание под или налезание на партнера, преследование, не заканчивавшееся проявлением агрессии, – и агрессивных контактов: преследование, переходящее в агрессивное взаимодействие, атаки/драки, укусы, агрессивный груминг (выкусывание, вызывающее вокализацию крысы-партнера) за время тестирования.
Этим методом оценивали социальное взаимодействие у крыс в возрасте 1, 3, 6 и 9 мес только в серии 2.
Статистическую обработку данных проводили по алгоритмам программы “STATISTICA For Windows 12.0” после предварительной проверки гипотезы о нормальном характере распределения по тестам Колмогорова – Смирнова и Лиллиефорса. Если гипотезу не отклоняли, применяли параметрические методы анализа, если гипотезу отклоняли – непараметрические методы. С учетом того, что в серии 2 на последнем этапе наблюдения (возраст крыс – 9.5 мес) в группах оставалось вдвое меньше крыс, чем на других этапах, а в серии 1 на заключительном этапе наблюдения по ряду причин также тестирование было проведено у меньшего числа крыс, чем на первом этапе наблюдения, для оценки динамики поведения животных в процессе эксперимента применяли параметрический Two Way ANOVA без повторных измерений. Оценивали влияние факторов “Содержание” (2 градации: изоляция, контроль в сериях 1 и 2) и “Возраст” [3 градации – 1, 3 и 5.5 мес в тесте аОП (2 градации – 3 и 5.5 мес в тесте ПКЛ) в серии 1; 4 градации – 1, 3, 5.5 и 8.5 мес в тесте аОП (3 градации – 3, 5.5 и 8.5 мес в тесте ПКЛ) в серии 2]. Post hoc анализ проводили с применением теста Ньюмана-Кеулса. Для сравнений данных двух независимых групп крыс использовали непараметрический двусторонний U-критерий Манна–Уитни для независимых переменных, для внутригрупповых сравнений на разных сроках обследования – непараметрический дисперсионный анализ Kruskal–Wallis ANOVA с последующим множественным сравнением средних рангов. В тесте социальных взаимодействий долю пар крыс, в которых хотя бы одно из животных демонстрировало агрессивное поведение, оценивали с помощью точного метода Фишера (ТМФ, двусторонний критерий). Принятый уровень значимости составлял 5%. При использовании параметрических критериев данные представлены в виде M ± ± S.E.M, при использовании непараметрических критериев – в виде медианы с первым и третьим квартилями.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Вес крыс
В серии 1 выявлено влияние только фактора “Возраст” на вес крыс: F(2, 161) = 1350.5; p < 0.001. По данным post hoc анализа с увеличением возраста крыс их вес нарастал (увеличение веса на каждом следующем сроке тестирования по сравнению с предыдущим сроком в опытной и контрольной группах было статистически значимым; p < 0.002) (рис. 2 (а)).
Рис. 2.
Вес, двигательная (горизонтальная) и исследовательская (вертикальная) активность у крыс, которых содержали в условиях социальной изоляции (СИ) (пунктир), в сравнении с контрольными крысами (К), которых содержали в группах (сплошная линия), в тесте автоматизированного “открытого поля” в двух сериях исследований. По вертикальной оси: (а) (серия 1), (г) (серия 2) – вес, г; (б) (серия 1), (д) (серия 2) – путь, пройденный за 10 мин наблюдения, см; (в) (серия 1), (е) (серия 2) – число стоек за 10 мин наблюдения. По горизонтальной оси – возраст крыс. # – p < 0.05 по сравнению со значением у крыс той же группы в возрасте 1 мес; + – p < 0.05 по сравнению со значением у крыс той же группы в возрасте 3 мес; * – p < 0.05 по сравнению с контрольной группой крыс в том же возрасте (двухфакторный анализ с повторными измерениями, post hoc тест Ньюмана-Кеулса).
Fig. 2. Weight, locomotor (horizontal) activity and exploratory behavior (vertical activity) in the rats kept under social isolation (СИ) (dotted line), compared with the control rats (K) kept in groups (solid line), in automated Open Field test in two experimental series. Vertical axis: (а) (series 1), (г) (series 2) – weight, g; (б) (series 1), (д) (series 2) – distance travelled for 10 min observation, cm; (в) (series 1), (е) (series 2) – number of rearing postures for 10 min observation. Horizontal axis – age of the rats. # – p < 0.05 compared with the rats of the same group at the age of 1 month; + – p < 0.05 compared with the rats of the same group at the age of 3 months; * – p < 0.05 compared with the control group of the same age (Two-Way Repeated Measures ANOVA followed by post hoc Newman-Keuls test).
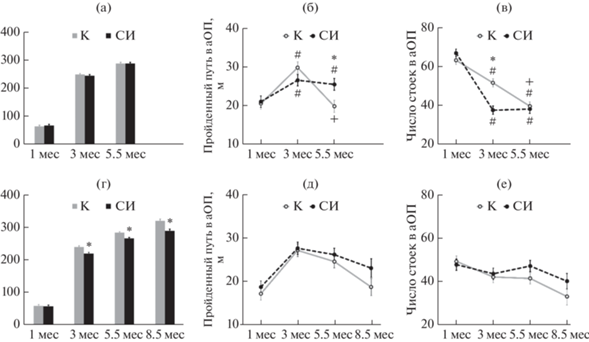
В серии 2 на вес крыс оказывали влияние оба фактора – “Возраст” (F(1, 204) = 38.548; p < 0.001) и “Содержание” (F(3, 204) = = 1662.205; p < 0.001), факторы взаимодействовали: F(3, 204) = 4.388; p = 0.005. Так же как в серии 1, увеличение веса на каждом следующем сроке тестирования по сравнению с предыдущим сроком в опытной и контрольной группах было статистически значимым (p < 0.001), однако начиная с возраста 3 мес, вес крыс, находившихся в условиях СИ, был меньше веса контрольных крыс (рис. 2 (г)), то есть СИ приводила к снижению веса животных.
Двигательная и исследовательская активность
Тест автоматизированного “Открытого поля”. Серия 1. Two Way ANOVA выявил влияние фактора “Возраст” на уровень двигательной активности крыс в сумме за 10 мин тестирования: F(2, 170) = 13.183; p < 0.001; post hoc анализ по тесту Ньюмана-Кеулса показал, что в возрасте 3 мес двигательная активность крыс была выше, чем в возрасте 1 мес, и превышала величину показателя у животных в возрасте 5.5 мес (в обоих случаях p < < 0.001). Фактор “Содержание” влияния не оказывал, однако было обнаружено взаимодействие факторов “Возраст” и “Содержание”: F(2, 170) = 4.297; p = 0.015. В возрасте 5.5 мес величина двигательной активности крыс, находившихся на изолированном содержании, по-прежнему статистически значимо превышала величину показателя в данной группе крыс в возрасте 1 мес и была больше, чем у крыс контрольной группы. У крыс группы К1 в возрасте 5.5 мес двигательная активность снижалась до исходных значений в возрасте 1 мес (рис. 2 (б)).
Обнаружено влияние факторов “Содержание” и “Возраст” на вертикальную активность самок крыс: соответственно F(1, 170) = = 5.012; p = 0.026 и F(2, 170) = 83.087; p < 0.001. Вертикальная исследовательская активность была ниже у самок, подвергнутых СИ, по сравнению с групповыми животными, и с возрастом снижалась независимо от условий содержания. Обнаружено взаимодействие факторов “Возраст” и “Содержание”: F(2, 170) = 9.183; p < 0.001. У крыс группы СИ1 в возрасте 3 мес (после двух мес изоляции) снижение числа стоек по сравнению со значением показателя до СИ в возрасте 1 мес было сильнее, чем в группе К1, что приводило к статистически значимому различию между группами СИ1 и К1 в возрасте 3 мес (рис. 2 (в)).
Серия 2. Two Way ANOVA выявил статистически значимое влияние фактора “Возраст” на уровень двигательной активности крыс: F(3, 204) = 16.914; p < 0.001; post hoc анализ показал, что в возрасте 3 и 5.5 мес двигательная активность была выше, чем в возрасте 1 мес, и превышала величину показателя у крыс в возрасте 8.5 мес (во всех случаях p < 0.001) (рис. 2 (д)). Влияние фактора “Содержание” не достигло уровня статистической значимости: F(1, 204) = 3.041; p = 0.083. Взаимодействие факторов не выявлено.
Two Way ANOVA выявил влияние фактора “Возраст” на вертикальную исследовательскую активность крыс: F(3, 203) = 4.771; p = = 0.003. В возрасте 8.5 мес она была ниже, чем в возрасте 1, 3 и 5.5 мес: соответственно p < < 0.001, p = 0.042, p = 0.030 (рис. 2 (е)). Влияние фактора “Содержание” и взаимодействие факторов “Возраст” и “Содержание” не обнаружены.
Таким образом, в обеих сериях в тесте аОП выявлено влияние возраста на уровень двигательной и исследовательской активности крыс. Условия содержания не оказывали прямого влияния на величину двигательной активности, но могли изменять уровень двигательной и исследовательской активности крыс в зависимости от возраста.
Тревожно-подобное поведение
Оценка уровня тревожности в классическом “Открытом поле”. Серия 1. Ни на одном из сроков тестирования не было обнаружено различий между крысами опытной и контрольной групп по показателям локомоторной и исследовательской активности (во всех сравнениях p > 0.05).
Показатели уровня тревожности в кОП у крыс, находившихся на изолированном содержании и в группах, приведены в таблице 1.
Таблица 1.
Показатели тревожно-подобного поведения в классическом тесте “Открытого поля” в серии 1 у крыс, находившихся в социальной изоляции (СИ), в сравнении с крысами, содержавшимися в группах (К). В обозначениях групп указан номер серии Table 1. Anxiety-like behavior indices in the classic Open Field test in rats kept in social isolation (single-housed rats) (СИ) compared with rats kept in groups (group-housed rats) (К) in two series. The number in group abbreviations refers to the number of the series
| Показатели поведения | Возраст 1 мес | Возраст 3 мес | Возраст 5.5 мес | |||
|---|---|---|---|---|---|---|
| К1 (n = 31) |
СИ1 (n = 30) |
К1 (n = 29) |
СИ1 (n = 30) |
К1 (n = 27) |
СИ1 (n = 30) |
|
| Время, проведенное в центре ОП (с) | 0.0 (0.0; 0.0) |
0.0 (0.0; 0.0) |
6.0● (0.0; 11.0) |
3.0● (0.0; 7.0) |
0.0• (0.0; 9.0) |
0.0 (0.0; 4.0) |
| Время, проведенное в краевой зоне ОП (с) | 290.5 (287.0; 294.0) | 292.0 (290.0; 296.0) | 266.0● (247.0; 275.0) | 276.0● (259.0; 286.0) | 280.0● (261.0; 289.0) | 288.0*● (279.0; 295.0) |
| Латентный период захода в краевую зону (с) | 6.0 (4.0; 8.0) |
4.0 (3.0; 6.0) |
10.0● (6.0; 12.0) |
10.0● (6.0; 15.0) |
8.0 (5.0; 14.0) |
5.0 * (4.0; 8.0) |
Примечание. Данные представлены в виде медианы с первым и третьим квартилями. * – p < 0.05 по сравнению с соответствующей по возрасту группой К1 (U-критерий Манна–Уитни); • – p < 0.05 по сравнению со значением у крыс той же группы в возрасте 1 мес (Kruskal–Wallis ANOVA с последующим множественным сравнением средних рангов); n – число крыс в группе.
Статистически значимые межгрупповые различия в величине показателей выявлены только в возрасте 5.5 мес: крысы, содержавшиеся в условиях СИ, проводили больше времени в краевой зоне ОП и быстрее заходили в краевую зону.
Внутригрупповые сравнения выявили сходные по характеру изменения в опытной и контрольной группах крыс: по сравнению с возрастом 1 мес в возрасте 3 мес латентный период захода в краевую зону ОП был увеличен [СИ1: [H (2, N = 87) = 22.830, p < 0.001; К1: H (2, N = 90) = 8.571; p = 0.014], как и время в центре ОП [СИ1: H (2, N = 87) = 12.393, p = 0.002; К1: H (2, N = 90) = 21.759; p = < < 0.001]. Время пребывания в краевой зоне у крыс обеих групп в возрасте 3 мес, напротив, было меньше, чем в возрасте 1 мес [СИ1: H (2, N = 87) = 33.058, p < 0.001; К1: H (2, N = = 90) = 28.913, p < 0.001].
Таким образом, в данном тесте по одному из основных показателей, характеризующих уровень тревожности, – времени пребывания в центральной зоне ОП – крысы группы СИ1 в возрасте 3 мес не отличались от крыс группы К1, однако в возрасте 5.5 мес у крыс, находившихся в условиях СИ, были отмечены признаки большего, чем в контроле, избегания открытого пространства.
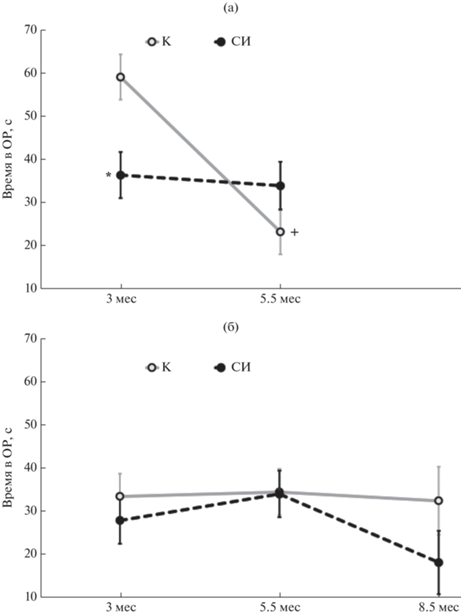
Тест “Приподнятый крестообразный лабиринт” (ПКЛ). Серия 1. Two Way ANOVA выявил влияние фактора “Возраст” на длительность пребывания крыс в ОР [F(1, 112) = = 12.894; p < 0.001] и взаимодействие факторов “Возраст” и “Содержание” [F(1, 112) = = 9.797; p = 0.002] (рис. 3 (а)). По сравнению с возрастом 3 мес длительность пребывания в ОР у крыс в возрасте 5.5. мес уменьшалась: снижение было выражено только у крыс контрольной группы. В возрасте 3 мес крысы группы СИ1 проводили меньше времени в ОР по сравнению с группой К1.
Рис. 3.
Длительность пребывания в открытых рукавах у крыс, которых содержали в условиях социальной изоляции (СИ) (пунктир), в сравнении с контрольными крысами (К), которых содержали в группах (сплошная линия), в тесте “Приподнятый крестообразный лабиринт” в двух сериях исследований. (а) (серия 1), (б) (серия 2): по вертикальной оси – время, с; по горизонтальной оси – возраст крыс. * – p < 0.05 по сравнению с контрольной группой крыс в возрасте 3 мес; + – p < 0.05 по сравнению со значением у крыс той же группы в возрасте 3 мес (двухфакторный анализ с повторными измерениями, post hoc тест Ньюмана-Кеулса).
Fig. 3. Time spent in the open arms in the rats kept under social isolation (СИ) (dotted line) compared with the control rats kept in groups (К) (solid line), in the Elevated Plus Maze test in 2 experimental series. (а) (series 1), (б) (series 2): vertical axis – time, s; horizontal axis – age of the rats. * – p < 0.05 compared with the control group of the rats at the age of 3 months; + – p < 0.05 compared with the rats of the same group at the age of 3 months (Two-Way Repeated Measures ANOVA followed by post hoc Newman-Keuls test).
Фактор “Возраст” оказывал влияние на предпочтение ОР в ПКЛ [Two Way ANOVA, F(1, 112) = 9.774; p = 0.002], факторы “Возраст” и “Содержание” взаимодействовали [F(1, 112) = 8.574; p = 0.004]. Снижение предпочтения ОР с возрастом обнаружено только у крыс, содержавшихся в группах, тогда как у крыс, содержавшихся в условиях СИ, предпочтение ОР оставалось на низком уровне на обоих сроках тестирования; в возрасте 3 мес предпочтение ОР у крыс, содержавшихся в изоляции, было ниже, чем у крыс контрольной группы. Результаты свидетельствуют о том, что в серии 1 у крыс в возрасте 3 мес после двух мес СИ показатели тревожности были выше, чем у крыс контрольной группы.
В серии 1 не было обнаружено влияние факторов “Возраст” и “Содержание” на общий пробег и среднюю скорость перемещения крыс в ПКЛ, факторы не взаимодействовали (во всех случаях p > 0.05).
Межгрупповой анализ по тесту Манна– Уитни показал, что у крыс в группе СИ1 по сравнению с группой К1 в возрасте 3 мес было снижено число свешиваний и длительность свешиваний с ОР ПКЛ (табл. 2).
Таблица 2.
Показатели тревожно-подобного поведения в тесте “Приподнятый крестообразный лабиринт” у крыс, находившихся в социальной изоляции (СИ), в сравнении с крысами, содержавшимися в группах (К), в двух сериях. В обозначениях групп указан номер серии Table 2. Anxiety-like behavior indices in the Elevated Plus Maze test in rats kept in social isolation (single-housed rats) (СИ) compared with rats kept in groups (group-housed rats) (К) in two series. The number in group abbreviations refers to the number of the series
| Показатели поведения | Число стоек | Длительность стоек, с | Число свешиваний ОР | Длительность свешиваний, с ОР |
|---|---|---|---|---|
| Возраст 3 мес | Серия 1 | |||
| К1 | 11.0 (8.0; 14.0) |
29.4 (16.0; 36.4) |
10.0 (5.0; 14.0) |
15.4 (6.8; 23.1) |
| СИ1 | 11.0 (8.0; 13.0) |
24.5 (19.2; 41.1) |
6.0 * (3.0; 9.0) |
7.5 * (2.7; 11.5) |
| Возраст 5.5 мес | Серия 1 | |||
| К1 | 10.0 (7.0; 14.0) |
31.7 (19.8; 28.7) |
1.5•• (0.0; 6.0) |
1.5•• (0.0; 8.2) |
| СИ1 | 8.0 (6.0; 11.0) |
29.2 (22.1; 37.6) |
3.0 (0.0; 7.0) |
4.8 (0.0; 14.9) |
| Возраст 3 мес | Серия 2 | |||
| К2 | 13.0 (10.0; 17.0) |
27.5 (20.0; 34.5) |
5.0 (2.0; 10.0) |
5.6 (1.8; 13.9) |
| СИ2 | 10.0* (8.0; 14.0) |
16.5 # (13.6; 33.7) |
3.0 * (0.0; 6.0) |
3.4* (0.0; 6.4) |
| Возраст 5.5 мес | Серия 2 | |||
| К2 | 9.0• (7.0; 13.0) |
27.9 (17.8; 40.5) |
3.5 (2.0; 6.0) |
5.7 (1.8; 8.7) |
| СИ2 | 9.5 (7.0; 14.0) |
27.7 (18.4; 32.9) |
3.5 (0.0; 7.0) |
5.4 (0.0; 16.9) |
| Возраст 8.5 мес | Серия 2 | |||
| К2 | 8.0• (5.0; 11.0) |
30.8 (19.8; 46.7) |
3.0 (0.0; 6.0) |
11.4 (3.0; 17.8) |
| СИ2 | 8.0 (5.0; 10.5) |
24.8 (15.3; 32.2) |
1.5 (0.0; 3.5) |
1.6 (0.0; 10.9) |
Примечание. Данные представлены в виде медианы с первым и третьим квартилями. * – p < 0.05; # – p < 0.08 по сравнению с соответствующей по возрасту контрольной группой (U-критерий Манна–Уитни); •• – p < 0.001; • – p < 0.05 по сравнению со значением у крыс той же группы в возрасте 3 мес (Kruskal–Wallis ANOVA с последующим множественным сравнением средних рангов). Серия 1, возраст 3 мес: СИ1, n = 29; К1, n = 30; возраст 5.5 мес: СИ1, n = 27; К1, n = 30. Серия 2, возраст 3 мес: СИ2, n = 30; К2, n = 31; возраст 5.5 мес: СИ2, n = 30; К2, n = 30; возраст 8.5 мес: СИ2, n = 16; К2, n = 14, где n – число крыс в группах.
Kruskal–Wallis ANOVA только в группе К1 выявил снижение с возрастом числа свешиваний с ОР [H (1, N = 60) = 24.405; p < 0.001] и их длительности [H (1, N = 60) = 18.618; p < < 0.001].
Серия 2. Факторы “Возраст” и “Содержание” не оказывали влияния на длительность пребывания крыс в ОР (рис. 3 (б)), а также на предпочтение ОР; взаимодействия факторов не обнаружено (во всех случаях p > 0.05).
Также не обнаружено влияние этих факторов на общий пробег и среднюю скорость перемещения крыс в ПКЛ, взаимодействия факторов не выявлено (во всех случаях p > 0.05).
Межгрупповой анализ по тесту Манна–Уитни показал, что у крыс в группе СИ2 в возрасте 3 мес число стоек, число свешиваний и длительность свешиваний в ПКЛ были меньше, чем в группе К2 (см. табл. 2).
Только в группе К2 обнаружено снижение с возрастом числа стоек в ПКЛ [H (2, N = = 75) =14.488; p < 0.001]: в возрасте крыс 5 и 8.5 мес оно было снижено по сравнению с возрастом 3 мес.
Таким образом, в тесте ПКЛ в обеих сериях по показателям активности крыс в ОР условия содержания не оказывали прямого влияния на уровень тревожности, но могли его изменять у контрольных крыс в зависимости от возраста. В обеих сериях у крыс после двух мес СИ были снижены число и длительность исследовательских оценок риска (свешиваний). Однако СИ длительностью до 7.5 мес не изменяла вертикальную исследовательскую активность крыс. Ни возраст, ни условия содержания не оказывали влияния на двигательную активность животных.
Социальное поведение
Трехкамерный социальный тест. Серия 1. В данной серии на Этапе 1 после 2 мес СИ у крыс было увеличено время в камере с социальным объектом (крысой) и время, проведенное около социального объекта; время около пустого цилиндра было снижено по сравнению с контрольным значением (рис. 4). Увеличение предпочтения камеры с социальным объектом камере с несоциальным объектом у крыс группы СИ1 по сравнению с крысами группы К1 не достигло уровня статистической значимости, а предпочтение социального объекта несоциальному было статистически значимым (табл. 3).
Рис. 4.
Показатели поведения в трехкамерном социальном тесте (серия 1) у крыс, которых в течение 2 мес содержали в условиях социальной изоляции (СИ), в сравнении с контрольными крысами, которых содержали в группах (К). В обозначениях групп указан номер серии. По горизонтальной оси: “Крыса” – камера с социальным объектом; “Пустой цилиндр” – камера с несоциальным объектом; “Знакомая крыса” – камера с крысой, с которой был контакт на Этапе 1; “Незнакомая крыса” – камера с новой крысой. Число животных в группах на Этапе 1: в группе К1 n = 28, в группе СИ1 n = 26; на Этапе 2: в группе К1 n = 24; в группе СИ1 n = 26. Серые прямоугольники – уровень медианы, значение медианы указано цифрами рядом с ними. * – p < 0.05 – по сравнению с группой К1 по соответствующему показателю в той же камере (непарный непараметрический критерий Манна–Уитни).
Fig. 4. The behavior of rats kept under social isolation (СИ) for 2 months, compared with control rats kept in groups (К), in a three-chamber social test (series 1). The number in group abbreviations refers to the number of the series. Horizontal axis: Крыса – chamber with social object; Пустой цилиндр – chamber with non-social object; Знакомая крыса – chamber with the rat contacted at Stage 1; Незнакомая крыса – chamber with a new rat. Number of animals for Stage 1: К1 n = 28, СИ1 n = 26; Stage 2: К1 n = 24, СИ1 n = 26. The grey rectangles indicate the median; the median value is also stated as a number next to the rectangles. * – p < 0.05 compared with К1 group in the same chamber (unpaired nonparametric Mann–Whitney test).
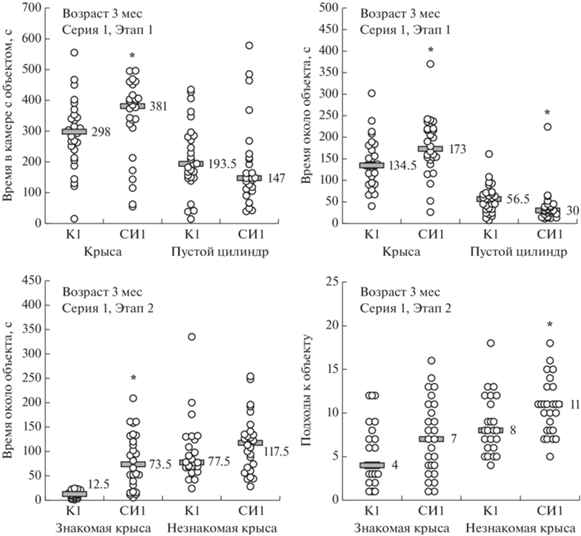
Таблица 3.
Показатели социальности и “социальной новизны” в трехкамерном социальном тесте у крыс, находившихся в социальной изоляции (СИ), в сравнении с крысами, содержавшимися в группах (К), в двух сериях исследований. В обозначениях групп указан номер серии Table 3. Sociability and social novelty preference indices in the three-chamber social test in rats kept in social isolation (single-housed rats) (СИ) compared with rats kept in groups (group-housed rats) (К) in two series. The number in group abbreviations refers to the number of the series
| Показатели | Возраст 3 мес Серия 1 |
Возраст 9.5 мес Серия 2 |
||
|---|---|---|---|---|
| К1 | СИ1 | К2 | СИ2 | |
| Этап 1 Предпочтение камеры с социальным объектом (крыса), % |
23.0 (–7.0; 38.9) (n = 28) |
45.9 # (17.7; 62.8) (n = 26) |
56.3 (–0.3; 70.2) (n = 11) |
38.0 (–6.1; 62.5) (n = 12) |
| Этап 1 Предпочтение социального объекта (крыса), % |
45.3 (12.5; 67.1) (n = 28) |
73.1 * (55.1; 80.0) (n = 26) |
59.2 (31.3; 68.8) (n = 11) |
38.3 (0.9; 60.2) (n = 12) |
| Этап 2 Предпочтение камеры с новым социальным объектом (незнакомая крыса), % |
28.7 (–15.0; 56.0) (n = 24) |
12.0 (–23.7; 61.3) (n = 26) |
24.5 (–14.2; 74.1) (n = 8) |
-31.0 * (–59.0; –18.4) (n = 12) |
| Этап 2 Предпочтение нового социального объекта (незнакомая крыса), % |
51.5 (–16.7; 82.6) (n = 24) |
25.5 # (–17.5; 66.7) (n = 26) |
54.9 (–11.7; 80.9) (n = 8) |
–18.1 * (–37.9; 38.3) (n = 12) |
На Этапе 2 у крыс в группе СИ1 по сравнению с контрольными животными было увеличено время около знакомой крысы наряду с увеличением числа подходов к незнакомой крысе (см. рис. 4). Не выявлено статистически значимого изменения предпочтения камеры с незнакомой крысой камере со знакомой крысой, но обнаружена выраженная тенденция к снижению предпочтения самого нового социального объекта уже знакомому социальному объекту (см. табл. 3).
Серия 2. На Этапе 1 в данной серии у крыс, находившихся в социальной изоляции в течение 8.5 мес, по сравнению с крысами контрольной группы число заходов в камеру с социальным объектом – крысой – было снижено, так же как и время, проведенное около крысы (рис. 5). Однако снижение предпочтения камеры с социальным объектом камере с несоциальным объектом или социального объекта несоциальному не было статистически значимым (см. табл. 3).
Рис. 5.
Показатели поведения в трехкамерном социальном тесте (серия 2) у крыс, которых в течение 8.5 мес содержали в условиях социальной изоляции (СИ), в сравнении с контрольными крысами, которых содержали в группах (К). В обозначениях групп указан номер серии. По горизонтальной оси: “Крыса” – камера с социальным объектом; “Пустой цилиндр” – камера с несоциальным объектом; “Знакомая крыса” – камера с крысой, с которой был контакт на Этапе 1; “Незнакомая крыса” – камера с новой крысой. Число животных в группах на Этапе 1: в группе К2 n = 11, в группе СИ2 n = 12; на Этапе 2: в группе К2 n = 8; в группе СИ2 n = 12. Серые прямоугольники – уровень медианы, значение медианы указано цифрами рядом с ними. * – p < 0.05; # – p = 0.051 – по сравнению с группой К2 по соответствующему показателю в той же камере (непарный непараметрический критерий Манна–Уитни).
Fig. 5. The behavior of rats kept under social isolation (СИ) for 8.5 months, compared with control rats kept in groups (К), in a three-chamber social test (series 2). The number in group abbreviations refers to the number of the series. Horizontal axis: Крыса – chamber with social object; Пустой цилиндр – chamber with non-social object; Знакомая крыса – chamber with the rat contacted at Stage 1; Незнакомая крыса – chamber with unfamiliar rat. Number of animals for Stage 1: К2 n = 11, СИ2 n = 12; Stage 2: К2 n = 8, СИ2 n = 12. The grey rectangles indicate the median; the median value is also stated as a number next to the rectangles. * – p < 0.05 compared with К2 group in the same chamber (unpaired nonparametric Mann–Whitney test).
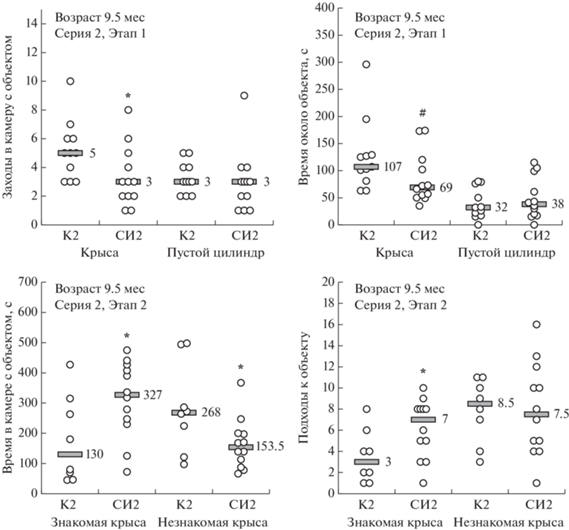
На Этапе 2 крысы из группы СИ2 по сравнению с крысами из группы К2 проводили больше времени в камере со знакомой крысой и меньше – в камере с незнакомой крысой (новым социальным объектом). Число подходов к знакомой крысе у животных, находившихся в изоляции, также было увеличено по сравнению с контролем (см. рис. 5). У крыс в группе СИ2 отмечена тенденция к увеличению времени подходов к знакомой крысе по сравнению с величиной показателя у крыс контрольной группы: соответственно 63.0 (16.0; 122.0) с и 33.0 (9.0; 42.5) с, p = 0.069, тест Манна–Уитни. После 8.5 мес СИ предпочтение камеры с незнакомой крысой камере со знакомой крысой и предпочтение нового социального объекта уже знакомому социальному объекту у крыс было снижено по сравнению с показателями у животных контрольной группы (см. табл. 3).
Таким образом, по результатам тестирования крыс в ТКС-тесте последствия СИ разной длительности в отношении социальности и предпочтения “социальной новизны” у крыс были различны. После двух мес СИ предпочтение социального объекта несоциальному у крыс было значительно выше контрольного уровня (более чем на 60%, см. табл. 3; Этап 1). После 8.5 мес изоляции социальность крыс опытной группы по этому показателю не отличалась от социальности животных контрольной группы, но просматривалось некоторое снижение величины показателя (примерно на 35%, см. табл. 3). После двух мес СИ у крыс удалось выявить только тенденцию к снижению предпочтения “социальной новизны”, а после 8.5 мес изоляции снижение предпочтения “социальной новизны” было сильно выраженным.
Тест социального взаимодействия. Серия 2. Межгрупповое сравнение не выявило различий в длительности неагрессивного и агрессивного взаимодействия у крыс опытной и контрольной групп в возрасте 1 мес. Однако возрасте 3 мес длительность как неагрессивных, так и агрессивных социальных контактов у крыс группы СИ2 превышала величину показателей у крыс группы К2 (рис. 6), то есть двухмесячная СИ приводила к усилению социального взаимодействия крыс независимо от его характера.
Рис. 6.
Длительность социальных контактов в тесте социального взаимодействия (серия 2) у крыс, которых содержали в условиях социальной изоляции (СИ), в сравнении с крысами контрольной группы, которых содержали в группах (К). В обозначениях групп указан номер серии. По вертикальной оси: длительность контактов, с. В возрасте крыс 1, 3 и 6 мес число пар во всех группах n = 15; в возрасте 9 мес в группе К2 n = 7, в группе СИ2 n = 8. Серые прямоугольники – уровень медианы, значение медианы указано цифрами рядом с ними. ** – p < 0.001; * – p < 0.05 – по сравнению с группой К2 по соответствующему показателю на том же сроке наблюдения (непарный непараметрический критерий Манна–Уитни).
Fig. 6. Time spent in social contacts in the rats kept under social isolation (СИ) compared with the control rats kept in groups (К) in the social interaction test (series 2). The number in group abbreviations refers to the number of the series. Vertical axis: time spent in social contact, s.; the number of pairs n = 15 in all groups of rats of 1, 3, and 6 months of age; n = 7 for the К2 group and n = 8 for the СИ2 group for the rats of 9 months of age. The grey rectangles indicate the median; the median value is also stated as a number next to the rectangles. ** – p < 0.001; * – p < 0.05 compared with the К2 group of the same age (unpaired nonparametric Mann–Whitney test).
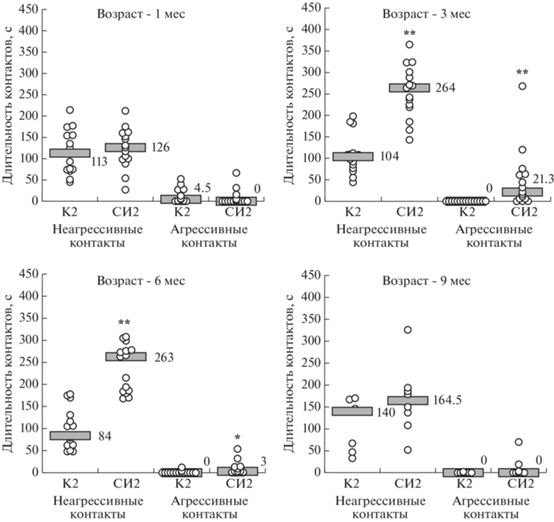
В возрасте 6 мес после 5 мес СИ у крыс сохранялись признаки повышенного социального взаимодействия по сравнению с крысами контрольной группы. В возрасте 9 мес статистически значимых различий между крысами групп СИ2 и К2 по длительности как неагрессивного, так и агрессивного социального взаимодействия не обнаружено.
Внутригрупповой непараметрический анализ Kruskal-Wallis ANOVA не выявил изменений в длительности неагрессивного социального взаимодействия у крыс контрольной группы в динамике наблюдения (p > 0.05). Агрессивное взаимодействие у взрослых крыс, находившихся на групповом содержании, снижалось практически до полного отсутствия в возрасте 3 мес по сравнению с возрастом 1 мес и далее не повышалось [H (3, N = 52) = 20.753; p < 0.001; по результатам post hoc анализа p < < 0.02].
У крыс в группе СИ2 в возрасте 3 и 6 мес по сравнению с возрастом 1 мес длительность неагрессивных социальных контактов была статистически значимо повышена [H (3, N = = 53) = 27.039, p < 0.001; по результатам post hoc анализа в обоих случаях p < 0.001]. У крыс в возрасте 9 мес после 8 мес СИ отмечена тенденция к сохранению повышенной длительности неагрессивных социальных контактов по сравнению с возрастом 1 мес (post hoc анализ: p = 0.096). Длительность агрессивных контактов у крыс в группе СИ2 только в возрасте 3 мес превышала величину показателей в возрасте 1 мес [H (3, N = 53) = 10.703, p = = 0.013; по результатам post hoc анализа p = = 0.020].
Относительное число пар, в которых крысы демонстрировали агрессивное поведение, было выше в группе СИ2 в возрасте 3 и 6 мес (ТМФ соответственно: p < 0.001 и p = 0.004).
Таким образом, СИ длительностью, как минимум, до 5 мес, сопровождалась усилением социального взаимодействия как неагрессивного, так и агрессивного характера. После 8 мес СИ социальное взаимодействие у крыс опытной и контрольной групп не различалось.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В двух сериях настоящего исследовании получены экспериментальные свидетельства того, что длительность СИ влияет на социальное поведение самок крыс. Факт увеличения предпочтения социального объекта у самок крыс в серии 1 в ТКС-тесте после двух месяцев СИ, то есть факт увеличения социальности крыс в возрасте 3 мес, хорошо согласуется с увеличением длительности социальных контактов у крыс в тесте СВ на данном сроке СИ в серии 2 (см. рис. 6). В тесте СВ в серии 2 отсутствие различий в длительности неагрессивных социальных контактов после 8 мес СИ у крыс опытных групп по сравнению с контрольными крысами также хорошо согласуется с отсутствием у них статистически значимых различий в социальности в ТКС-тесте после 8.5 мес СИ. Таким образом, при двухмесячной СИ социальное предпочтение у самок крыс усиливается, а при более длительной СИ – 8 мес и более – снижается до контрольных значений, и, по нашим данным, даже появляются признаки дефицита социальности.
Выявленное у крыс в возрасте 3 мес увеличение социального взаимодействия и социального предпочтения после двухмесячной СИ нельзя объяснить увеличением двигательной активности животных, так как в обеих сериях двигательная активность самок, находившихся в изоляции, на данном сроке тестирования не отличалась от двигательной активности самок контрольной группы. Вертикальная исследовательская активность крыс после двух мес СИ была даже ниже исследовательской активности животных контрольной группы (в серии 1 – в тесте аОП, в серии 2 – в тесте ПКЛ).
Надо особо отметить, что у самок крыс Wistar контрольных групп показатели поведения с возрастом также изменялись: у них выявлено снижение с возрастом двигательной и исследовательской активности в тесте аОП (серии 1 и 2) и возрастание уровня тревожности в тесте ПКЛ (серия 1). Сходная возрастная динамика двигательной, исследовательской активности и, в меньшей степени, тревожности, прослежена для самцов и самок крыс разных линий и популяций, в том числе Wistar, на протяжении всей жизни животных (Altun et al., 2007; Rykova et al., 2011). Несмотря на принципиальную схожесть динамики двигательной и исследовательской активности у крыс контрольных групп двух серий исследований, хорошо видны и некоторые различия между сериями (рис. 2 и 3). Как сказано выше, измерения одних и тех же показателей в этих сериях были проведены в одни и те же сезоны (и, как правило, в одни и те же месяцы) года в течение двух последовательных лет. С учетом этого мы полагаем, что выявленные различия могут быть обусловлены в первую очередь вариабельностью поведения в аутбредной популяции крыс Wistar, на представителях которой проведено настоящее исследование, а не влиянием иных факторов – суточных/сезонных световых ритмов и др. В пользу такого предположения свидетельствуют, например, данные, полученные Степаничевым и соавт. (2016). В этой работе крысы-самцы гетерогенной аутбредной популяции Wistar, которые исходно были разделены по уровню ориентировочно-исследовательского поведения в тесте “Открытого поля”, демонстрировали разный ответ на хроническое комбинированное стрессорное воздействие по показателям тревожно-депрессивного поведения.
Возможно, гетерогенность популяции Wistar привела к различиям в динамике веса крыс опытных групп в двух сериях исследований: в серии 2 крысы опытной группы весили меньше животных контрольной группы, начиная с двух мес СИ и до конца наблюдения. Многочисленные оценки веса крыс в условиях менее длительной, чем в настоящем исследовании, СИ показали, что изменения в поведении не сопровождаются устойчивым изменением веса животных, данные противоречивы (цит. по Fone, Porkess, 2008; Beery, Kauffer, 2015). В наших предыдущих работах на самцах крыс Wistar мы не выявили изменения веса животных после 2 и 3 мес СИ (Крупина и соавт., 2015; Хлебникова и соавт., 2018). Однако после 9 мес СИ у самцов, но не у самок крыс обнаружено снижение веса по сравнению с весом контрольных животных (Krupina et al., 2020). В работе (Carnevali et al., 2020) было показано, что взрослые самки линии Wild-type Croningen, подвергнутые 6-недельной СИ, набирали вес медленнее, чем самки контрольной группы. Напротив, самки крыс Sprague-Dawley после трех недель СИ, начинавшейся в подростковом возрасте (Jahng et al., 2012), и после двух мес СИ, начинавшейся сразу после отсаживания от матери (Hermes et al., 2011), весили больше, чем крысы контрольной группы. В одной из ранних работ по СИ крыс инбредной линии Wistar было показано снижение веса и у самцов, и у самок после 13 недель СИ (Hatch et al., 1965). По-видимому, влияние СИ на вес животных зависит от линии (или популяции) крыс, времени начала СИ, еe длительности и, в случае аутбредных линий, от гетерогенности выборок. В настоящей работе крысы опытных групп в обеих сериях демонстрировали усиление общительности в возрасте 3 мес после двух мес СИ независимо от того, было ли у них различие в весе с крысами контрольной групп. Снижение веса, связанное с потерей мышечной массы, начинает оказывать влияние на поведение старых крыс, достигших двухлетнего возраста (Altun et al., 2007).
Можно ли связать увеличение социальности в ТКС-тесте и длительности социальных контактов в тесте СВ с изменением уровня тревожности у крыс после двух мес СИ? В серии 1 в тесте ПКЛ крысы после 2 мес СИ проводили в ОР меньше времени, чем крысы контрольной группы (см. рис. 3 (а)), что можно рассматривать как признак более высокого уровня тревожности. Поскольку в данном тесте оценку уровня тревожности у крыс в возрасте 1 мес (до начала СИ) не проводили, нельзя исключить, что крысы опытной и контрольной групп могли различаться по уровню тревожности исходно. Однако в тесте кОП крысы опытной и контрольной групп по исходному уровню тревожности в возрасте 1 мес не различались (см. табл. 1). Известно, что результаты оценки уровня тревожности крыс в разных тестах могут различаться по ряду причин, в первую очередь, из-за разного анксиогенного контекста (O’Leary et al., 2013; Mohammad et al., 2016). Тем не менее мы считаем, что предположение об исходном различии по уровню тревожности в ПКЛ можно не рассматривать. Однако нельзя исключить, что либо в возрасте 3 мес уровень тревожности у крыс контрольной группы по сравнению с исходным значением снизился, либо в этом возрасте после двух мес СИ уровень тревожности у крыс опытной группы повысился. В серии 2 признаков повышения тревожности у крыс группы СИ в тесте ПКЛ не было обнаружено. В наших предыдущих работах на самцах популяции Wistar, подвергнутых двухмесячной СИ, также были получены противоречивые данные: уровень тревожности в тесте ПКЛ после 2 мес СИ мог быть повышен (Хлебникова и соавт., 2018) или не изменялся (Крупина и соавт., 2015). Эти оценки не противоречат оценкам других авторов по изменению уровня тревожности у крыс в условиях СИ. После 7 недель СИ Yildirim et al. (2012) не выявили изменений в уровне тревожности как у самцов, так и у самок крыс Wistar в тесте ПКЛ. Отсутствие изменений тревожности в этом тесте после 26-дневной СИ показано в работе (Joshi et al., 2017) на самцах и самках крыс Long Evans, тогда как в работе (Hellemans et al., 2004), напротив, обнаружено повышение тревожности у самцов крыс той же линии после 7 недель СИ. По совокупности этих противоречивых данных мы считаем, что высказанное нами ранее предположение о том, что изменение уровня тревожности в тесте ПКЛ у крыс-самцов в условиях СИ нельзя рассматривать в качестве устойчивой характеристики нарушения поведения (Хлебникова и соавт., 2018), что, по-видимому, можно распространить и на самок крыс Wistar. Таким образом, повышение у них общительности после двух мес СИ в двух тестах для оценки социального поведения происходило без очевидной связи с уровнем тревожности. Схожую картину мы наблюдали ранее у самцов: у них в тесте СВ длительность социальных контактов после двух мес СИ была повышена по сравнению с контрольными значениями показателей независимо от того, изменялся ли уровень тревожности (Крупина и соавт., 2015; Хлебникова и соавт., 2018).
Однако после 4.5 мес СИ были обнаружены признаки изменения поведения животных в краевой зоне ОП. Эту зону принято считать зоной тигмотаксиса. Показано, что препараты бензодиазепинового ряда облегчают выход в центр ОП из зоны тигмотаксиса, причем этот эффект связывают со снижением под их влиянием стресс-индуцированного торможения исследовательской активности в опасной незнакомой обстановке, но не с анксиолитическим действием как таковым (Prut, Belzung, 2003). Увеличение тигмотаксиса в стрессогенной обстановке незнакомого ОП было выявлено у крыс Long–Evans независимо от пола после 26 дней СИ (Joshi et al., 2017). Исходя из этих представлений, можно предположить, что в настоящем исследовании СИ, приводя к более быстрому заходу крыс в краевую зону ОП и увеличению времени пребывания в ней, то есть усиливая тигмотаксис, фактически усиливает стресс-индуцированное торможение исследовательской активности у животных в опасной обстановке. Вероятно, СИ повышает у самок чувствительность к стрессу. Это предположение хорошо согласуется с ранее полученными в наших исследованиях данными о большой уязвимости самок крыс к пролонгированному стрессу СИ, что было подтверждено, в том числе, увеличенным временем пребывания социально изолированных крыс в краевой зоне водного лабиринта Морриса – зоне тигмотаксиса (Krupina et al., 2020).
В обеих сериях в тесте ПКЛ мы также отметили снижение числа и общей длительности свешиваний с ОР лабиринта у крыс после двух мес СИ по сравнению с крысами контрольных групп. Интерпретация снижения выраженности свешиваний в ПКЛ неоднозначна (Ennaceur, 2014). Это снижение можно расценивать как показатель уменьшения исследовательских оценок риска (De Jesús-Burgos et al., 2012) и в этом случае говорить о снижении в обеих сериях исследовательской активности у крыс, содержавшихся в изоляции в течение двух мес. Можно рассматривать уменьшение числа свешиваний с ОР и как свидетельство повышения уровня тревожности у крыс, поскольку число свешиваний прямо коррелирует с исследованием ОР лабиринта (O’Leary, Gunn, Brown, 2013). Данные настоящей работы поддерживают такую интерпретацию, так как в серии 1 у крыс контрольной группы снижение предпочтения ОР (рост уровня тревожности) в возрасте от 3 до 5.5 мес сопровождалось снижением числа и длительности свешиваний; у трехмесячных крыс, которых содержали в изоляции, меньшая по сравнению с контрольным значением длительность пребывания в ОР сочеталась с меньшей выраженностью свешиваний (см. рис. 3 (а) и табл. 2). Однако заслуживает внимания то, что в серии 2 не было обнаружено снижения длительности пребывания крыс в ОР, тогда как показатели свешивания были ниже контрольных значений. Известно, что увеличение выходов в ОР у грызунов под влиянием ряда анксиолитиков может сопровождаться как увеличением, так и снижением либо даже отсутствием изменения частоты свешиваний (цит. по обзору Ennaceur, 2014). По совокупности данных мы допускаем, что свешивания с ОР в ПКЛ могут быть дополнительной характеристикой поведения крыс в экспериментальных условиях конфликта мотиваций, но в настоящее время трудно однозначно ответить на вопрос, о чем свидетельствует изменение этих показателей – о нарушении исследовательского поведения или об изменении уровня тревожности.
Выявленное в обеих сериях после двухмесячной СИ стремление самок крыс к повышению социальных контактов, в том числе агрессивных (в серии 2), можно рассматривать как демонстрацию дезадаптивного, неадекватного социального взаимодействия, индуцированного социальной депривацией, то есть как проявление дистресса. Но можно взглянуть на проблему иначе. Само социальное взаимодействие играет важную роль в более эффективном преодолении действия стресса СИ, перенесенного в подростковом возрасте, развивается адаптивный социальный фенотип, полезный в ситуациях, которые требуют социальной принадлежности для выживания социальных видов животных (Rivera-Irizarry et al., 2020). Усиление социального взаимодействия, вызванного неблагоприятными социальными условиями, включая стресс СИ, способствует смягчению действия этого стресса, преодолению его эффектов и развитию стрессоустойчивости, то есть способствует так называемой “социальной буферизации” (Beery, Kaufer, 2015). “Социальная буферизация”, в свою очередь, способствует снижению уровня стресс-индуцированной тревоги (Smith, Wang, 2014). С этих позиций можно предположить, что увеличение общительности самок крыс после двух мес СИ – это стратегия преодоления на данном сроке изоляции. Полученные в нашей работе данные не согласуются с данными Tanaka et al. (2019), которые выявили снижение социального предпочтения у самок крыс Long-Evans, находившихся в условиях СИ в течение примерно двух мес сразу после отсаживания от матери. Однако, как сказано выше (Arakawa, 2003), эффект влияния СИ на поведение крыс, связанное с тревожностью, зависит от того, в каком периоде развития животных была начата изоляция. В работе (Tanaka et al., 2019) СИ начинали на 21-й постнатальный день, сразу после отсаживания крысят от матери, то есть в предподростковом периоде, тогда как в настоящем исследовании крысят помещали в условия СИ уже в подростковом возрасте. Также нельзя исключить, что несогласование данных настоящей работы и работы (Tanaka et al., 2019) связано с использованием разных линий крыс (соответственно Wistar и Long-Evans), так как показано, что линия крыс оказывает влияние на последствия стрессирования (Faraday, 2002; Martis et al., 2018).
Отметим, что снижение предпочтения “социальной новизны” у крыс после 8.5 мес СИ по сравнению с показателями у контрольных животных не сопровождалось изменениями двигательной или исследовательской активности либо изменениями уровня тревожности в ПКЛ. В наших предыдущих работах также не было обнаружено отличий от контроля у самок крыс в возрасте 8.5 мес после 7.5 мес СИ по уровню двигательной активности (Krupina et al., 2020) и тревожности (Ширенова и соавт., 2021). Таким образом, выявленные на поздних сроках СИ нарушения предпочтения “социальной новизны” у крыс нельзя связать с изменением этих показателей.
Оценку предпочтения “социальной новизны” можно отнести к когнитивным функциям, характеризующим социальное узнавание (social recognition), поэтому на основании нарушения предпочтения “социальной новизны” можно предполагать развитие нарушений процессов обработки социальной информации и социальной памяти (Seillier, Giuffrida, 2016). Полученные в настоящем исследовании данные свидетельствует о возможном прогрессивном ухудшении социальной памяти у крыс, если срок СИ увеличивается.
Результаты настоящего исследования не противоречат интересной гипотезе, рассмотренной в работе (Matisz et al., 2021), суть которой заключается в том, что хронический стресс переключает поведение крыс с исследования окружающей среды на эксплуатацию известных ресурсов для удовлетворения текущих и неизвестных будущих потребностей, избегая множества возможных угроз. На взрослых самцах крыс Long-Evans авторы показали, что после хронического пятинедельного мягкого непредсказуемого стресса, включавшего в число стрессирующих воздействий СИ (дважды в неделю – на всю ночь, один раз в неделю – на сутки), у животных повышалась чувствительность к угрожающему контексту (в присутствии запаха хищника они пробегали большую дистанцию с большей скоростью, чем контрольные крысы в тесте ОП), снижалось исследовательское и “потребительское”/пищедобывательное поведение (consummatory behavior) (они меньше исследовали и меньше лизали кормушки в задаче конкурентного выбора). Сдвиг в поведении от исследования к эксплуатации известных ресурсов, по мнению авторов, дает стрессированным животным преимущество в приспособлении к окружающей среде, и его можно считать адаптивным, так как исследование требует времени и энергии и связано с повышенным риском по сравнению с использованием знакомого варианта. В настоящей работе на модели хронического стресса СИ мы не оценивали “потребительское” поведение самок крыс как таковое, однако оценивали исследовательское поведение, поведение избегания рисков и моторную активность. Снижение исследовательской активности по сравнению с контрольными значениями было выявлено у крыс в обеих сериях после двухмесячной СИ. Признаки усиления поведения избегания рисков в тесте классического ОП (быстрый уход из центра в краевую зону и большее время, проведенное в этой зоне, см. табл. 1) были обнаружены в серии 1 у крыс в возрасте 5.5 мес после 4.5 мес изоляции, что совпадало по времени с увеличением моторной активности животных в автоматизированном ОП (см. рис. 2 (б)). Усиленный моторный ответ, по мнению авторов гипотезы (Matisz et al., 2021), может быть следствием неспособности задействовать пассивные стратегии преодоления при сенситизации к угрозам или усиления поиска избегания, то есть отражать повышенное возбуждение (arousal). В рамках гипотезы о смещении поведения под влиянием хронического стресса от исследования к эксплуатации известных ресурсов снижение предпочтения нового социального объекта, вплоть до полного отсутствия такого предпочтения, можно рассмотреть как снижение мотивации к исследованию нового. Таким образом, снижение предпочтения “социальной новизны” может отражать не только нарушения социальной памяти, но и изменение характера мотивационной деятельности.
Выявленное в настоящем исследовании изменение показателей социальности и ухудшение предпочтения “социальной новизны” у крыс после СИ длительностью 8.5 мес по сравнению с СИ длительностью 2 мес, по-видимому, сопровождается сменой стратегий преодоления. В соответствии с моделью аллостатических состояний, предложенной Куприяновым и Ждановым (2014), можно предположить, что происходит переход аллостатической нагрузки на иной, более высокий уровень.
ВЫВОДЫ
1. В двух сериях исследований выявлена схожая возрастная динамика веса самок крыс Wistar, которых содержали в группах или в условиях СИ, начинавшейся в подростковом периоде в возрасте 1 мес и непрерывно продолжавшейся до возраста 5.5 или 9.5 мес. С возрастом вес крыс опытной и контрольной групп нарастал. Однако в одной из серий обнаружено, что начиная с двух мес изоляции вес крыс был меньше, чем у контрольных животных, которых содержали в группах.
2. В обеих сериях в тесте автоматизированного “Открытого поля” выявлена схожая динамика двигательной активности у крыс, которых содержали в группах или в условиях СИ. Величина двигательной активности у взрослых крыс была выше, чем у подростков, и начиная с 5.5 мес снижалась. Вертикальная исследовательская активность в обеих сериях независимо от условий содержания с возрастом снижалась. Однако в одной из серий изменения показателей в группах зависели от возраста: у крыс, которых содержали в условиях СИ, в возрасте 3 мес исследовательская активность была ниже, а двигательная активность в возрасте 5.5 мес – выше, чем у животных, которых содержали в группах.
3. В обеих сериях в тесте “Приподнятый крестообразный лабиринт” условия содержания не оказывали прямого влияния на уровень тревожности крыс по показателям активности в открытых рукавах. Однако в одной из серий показатели тревожности у крыс после двух мес. СИ были выше, чем у крыс контрольной группы. В этой серии у контрольных крыс в возрасте 5.5 мес тревожность была выше, чем в возрасте 3 мес. В обеих сериях после двух мес СИ у крыс была снижена выраженность исследовательских оценок риска (свешиваний). Ни возраст, ни условия содержания не оказывали влияния на двигательную активность животных.
4. В тесте классического “Открытого поля” уровень тревожности у крыс подросткового и взрослого возраста, которых содержали в условиях СИ или в группах, в возрасте 1 и 3 мес не различался, но после 4.5 мес СИ крысы проявляли признаки избегания открытого пространства, проводя больше времени на периферии “Открытого поля”.
5. В тесте социального взаимодействия выявлено увеличение длительности социальных контактов неагрессивного и агрессивного характера у крыс после 2 и 5 мес СИ. После 8 мес СИ характер социального взаимодействия крыс опытной и контрольной групп не различался.
6. Длительность СИ оказывала влияние на социальность и предпочтение “социальной новизны” у крыс. В трехкамерном социальном тесте после двух мес СИ у крыс предпочтение социального объекта несоциальному объекту было выше, чем у крыс контрольной группы, при этом у животных были выявлены признаки снижения предпочтения нового социального объекта ранее знакомому социальному объекту. После 8.5 мес СИ у крыс предпочтение социального объекта несоциальному не отличалось от показателей в контрольной группе, однако предпочтение “социальной новизны” было снижено.
Список литературы
Крупина Н.А., Хлебникова Н.Н., Орлова И.Н. Ранняя социальная изоляция увеличивает агрессивность и нарушает кратковременное привыкание у крыс. Патол. физиол. эксперим. тер. 2015. 59(4): 4–15.
Куприянов Р.В., Жданов Р.И. Стресс и аллостаз: проблемы, перспективы и взаимосвязь. Журн. высш. нерв. деят. им. И.П. Павлова. 2014. 64(1): 21–31.
Павлова И.В., Брошевицкая Н.Д., Онуфриев М.В., Моисеева Ю.В. Половые различия в тревожно-депрессивном и оборонительном поведении крыс Вистар. Журн. высш. нервн. деят. им. И.П. Павлова. 2020. 70(2): 243–258.
Степаничев М.Ю., Тишкина А.О., Новикова М.Р., Левшина И.П., Пискунов А.К., Лазарева Н.А., Гуляева Н.В. Эффекты хронического комбинированного стресса: изменения поведения крыс с разной реакцией на новизну. Журн. высш. нервн. деят. им. И.П. Павлова. 2016. 66(5): 611–625.
Хлебникова Н.Н., Медведева Ю.С., Крупина Н.А. Ранняя социальная изоляция, вызывающая эмоционально-мотивационные нарушения у крыс, сопровождается дефицитом кратковременного привыкания, но не влияет на пространственную память. Журн. высш. нервн. деят. им. И.П. Павлова. 2018. 68(5): 647–662.
Ширенова С.Д., Хлебникова Н.Н., Крупина Н.А. Тревожно-депрессивный профиль самцов и самок крыс, подвергнутых длительной социальной изоляции. В кн.: Нейронаука для медицины и психологии. Москва: ООО “МАКС Пресс”, 2021. XVII Международный Междисциплинарный Конгресс. Судак, Крым, Россия, 4–10 июня 2021 г. С. 438–439.
Agrawal A., Jaggi A.S., Singh N. Pharmacological investigations on adaptation in rats subjected to cold water immersion stress. Physiol. Behav. 2011. 103(3–4): 321–329.
Altun M., Bergman E., Edström E., Johnson H., Ulfhake B. Behavioral impairments of the aging rat. Physiol. Behav. 2007. 92(5): 911–923.
Arakawa H. Ethological approach to social isolation effects in behavioral studies of laboratory rodents. Behav. Brain Res. 2018. 341: 98–108.
Arakawa H. The effects of isolation rearing on open-field behavior in male rats depends on developmental stages. Development. Psychobiol. 2003. 43(1): 11–19.
Ari C., D’Agostino D.P., Diamond D.M., Kindy M., Park C., Kovács Z. Elevated plus maze test combined with video tracking software to investigate the anxiolytic effect of exogenous ketogenic supplements. J. Vis. Exp. 2019. 143: e58396, https://doi.org/10.3791/58396
Bale T.L., Epperson C.N. Sex differences and stress across the lifespan. Nat. Neurosci. 2015. 18(10): 1413–1420.
Bangasser D.A., Eck S.R., Telenson A.M., Salvatore M. Sex differences in stress regulation of arousal and cognition. Physiol. Behav. 2018. 187: 42–50.
Beery A.K., Kaufer D. Stress, social behavior, and resilience: Insights from rodents. Neurobiol. Stress. 2015. 1: 116–127.
Beery A.K., Zucker I. Sex bias in neuroscience and biomedical research. Neurosci. Biobehav. Rev. 2011. 35: 565e572.
Begni V., Sanson A., Pfeiffer N., Brandwein C., Inta D., Talbot S.R., Riva1 M.A., Gass P., Mallien A.S. Social isolation in rats: Effects on animal welfare and molecular markers for neuroplasticity. PLoS ONE. 2020. 15(10): e0240439.
Bourke C.H., Neigh G.N. Behavioral effects of chronic adolescent stress are sustained and sexually dimorphic. Horm. Behav. 2011. 60(1): 112–120.
Campos A.C., Fogaca M.V., Aguiar D.C., Guimaraes F.S. Animal models of anxiety disorders and stress. Revista Brasileira de Psiquiatria. 2013. 35(suppl 2): S101–S111.
Carnevali L., Statello R., Vacondio F., Ferlenghi F., Spadoni G., Rivara S., Mor M., Sgoifo A. Antidepressant-like effects of pharmacological inhibition of FAAH activity in socially isolated female rats. Eur. Neuropsychopharmacol. 2020. 32: 77–87.
Couzin-Frankel J. National Institutes of Health. Needed: more females in animal and cell studies. Science. 2014. 344(6185): 679.
Dantzer R. Behavior: Overview. In: Stress: Concepts, Cognition, Emotion, and Behavior. 1st Edition. Handbook of Stress. Vol. 1. Editor: George Fink. Elsevier, Academic Press, 2016. Ch. 6. P. 57–63. ISBN: 978-0-12-800951-2.
De Jesús-Burgos M., Torres-Llenza V., Pérez-Acevedo N.L. Activation of amygdalar metabotropic glutamate receptors modulates anxiety, and risk assessment behaviors in ovariectomized estradiol-treated female rats. Pharmacol. Biochem. Behav. 2012. 101(3): 369–378.
Einon D.F., Morgan M.J. A critical period for social isolation in the rat. Developmental Psychobiology. 1977. 10(2): 123–132.
Ennaceur A. Tests of unconditioned anxiety – Pitfalls and disappointments. Physiol. Behav. 2014. 135: 55–71.
Faraday M.M. Rat sex and strain differences in responses to stress. Physiol. Behav. 2002. 75(4): 507–522.
Ferdman N., Murmu R., Bock J., Braun K., Leshem M. Weaning age, social isolation, and gender, interact to determine adult explorative and social behavior, and dendritic and spine morphology in prefrontal cortex of rats. Behav. Brain Res. 2007. 180(2): 174–182.
Fone K.C., Porkness M.V. Behavioural and neurochemical effects of post-weaning social isolation in rodents-relevance to developmental neuropsychiatric disorders. Neurosci. Biobehav. Rev. 2008. 32(6): 1087–1102.
Gorenko J.A., Moran C., Flynn M., Dobson K., Konnert C. Social Isolation and Psychological Distress Among Older Adults Related to COVID-19: A Narrative Review of Remotely-Delivered Interventions and Recommendations. J. Applied Gerontol. 2020. 40(1): 3–13.
Hatch A.M., Wiberg G.S., Zawidzka Z., Cann M., Airth J.M., Grice H.C. Isolation syndrome in the rat. Toxicol. Appl. Pharmacol. 1965. 7(5): 737–745.
Heck A.L., Handa R.J. Sex differences in the hypothalamic–pituitary–adrenal axis’ response to stress: an important role for gonadal hormones. Neuropsychopharmacology. 2019. 44(1): 45–58.
Heidbreder C.A., Weiss I.C., Domeney A.M., Pryce C., Homberg J., Hedou G., Feldon J., Moran M.C., Nelson P. Behavioral, neurochemical and endocrinological characterization of the early social isolation syndrome. Neurosci. 2000. 100(4): 749–768.
Hellemans K.G., Benge L.C., Olmstead M.C. Adolescent enrichment partially reverses the social isolation syndrome. Brain Res. Dev. Brain Res. 2004. 150(2): 103–115.
Hermes G., Li N., Duman C., Duman R. Post-weaning chronic social isolation produces profound behavioral dysregulation with decreases in prefrontal cortex synaptic-associated protein expression in female rats. Physiol. Behav. 2011. 104(2): 354–359.
Hirnstein M., Hausmann, M. Sex/gender differences in the brain are not trivial—A commentary on Eliot et al. 2021. Neurosci. Biobehav. Rev. 2021.130: 408–409.
Holt-Lunstad J., Smith T.B., Layton B. Social relationships and mortality risk: A meta-analytic review. PLOS Med. 2010. 7(7): 1–20.
Hong S., Flashner B., Chiu M., Hoeve E.V., Luz S., Bhatnagar S. Social isolation in adolescence alters behaviors in the forced swim and sucrose preference tests in female but not in male rats. Physiol. Behav. 2012. 105(2): 269–275.
Ieraci A., Mallei A., Popoli M. Social isolation stress induces anxious-depressive- like behavior and alterations of neuroplasticity-related genes in adult male mice. Neural. Plas. 2016. 2016: 6212983.
Jahng J.W., Yoo S.B., Ryu V., Lee J.-H. Hyperphagia and depression-like behavior by adolescence social isolation in female rats. Int. J. Dev. Neurosci. 2012. 30(1), 47–53.
Joshi N., Leslie R.A., Perrot T.S. Analyzing the experiences of adolescent control rats: Effects of the absence of physical or social stimulation on anxiety-like behaviour are dependent on the test. Physiol. Behav. 2017. 179: 30–41.
Karpenko O., Syunyakov T.S., Kulygina M.A., Pavlichenko A.V., Chetkina A.S., Andrushchenko A.V. Impact of COVID-19 pandemic on anxiety, depression and distress – online survey results amid the pandemic in Russia. Consortium Psychiatricum. 2020.1(1): 8–20.
Krupina N.A., Shirenova S.D., Khlebnikova N.N. Prolonged social isolation, started early in life, impairs cognitive abilities in rats depending on sex. Brain Sci. 2020. 10(11): 799.
Leussis M.P., Andersen S.L. Is adolescence a sensitive period for depression? Behavioral and neuroanatomical findings from a social stress model. Synapse. 2007. 62(1): 22–30.
Lukkes J.L., Watt M.J., Lowry C.A., Forster G.L. Consequences of post-weaning social isolation on anxiety behavior and related neural circuits in rodents. Front. Behav. Neurosci. 2009. 3: 18.
Mann L.M., Walker B.R. The role of equanimity in mediating the relationship between psychological distress and social isolation during COVID-19. J. Affect. Disord. 2022. 296: 370–379. Epub 2021 Oct 2.https://doi.org/10.1016/j.jad.2021.09.087
Martis L.-S., Krog S., Tran T.P., Bouzinova E., Christiansen S.L., Møller A., Holmes M.C., Wiborg O. The effect of rat strain and stress exposure on performance in touchscreen tasks. Physiol. Behav. 2018. 184: 83–90.
Matisz C.E., Badenhorst C.A., Gruber A.J. Chronic unpredictable stress shifts rat behavior from exploration to exploitation. Stress. 2021. 24(5): 635–644.
McCormick C.M., Green M.R. From the stressed adolescent to the anxious and depressed adult: Investigations in rodent models. Neurosci. 2013. 249: 242–257.
McEwen B.S. Protection and damage from acute and chronic stress: allostasis and allostatic overload and relevance to the pathophysiology of psychiatric disorders. Ann. N. Y. Acad. Sci. 2004. 1032(1): 1–7.
McEwen B.S., Eiland L., Hunter R.G., Miller M.M. Stress and anxiety: Structural plasticity and epigenetic regulation as a consequence of stress. Neuropharmacology. 2012. 62(1): 3–12.
McEwen B.S., Gianaros P. J. Stress- and Allostasis-Induced Brain Plasticity. Annu. Rev. Med. 2011. 62(1): 431–445.
McKibben C.E., Reynolds G.P., Jenkins T.A. Analysis of sociability and preference for social novelty in the acute and subchronic phencyclidine rat. J. Psychopharmacol. 2014. 28(10): 955–963.
Mohammad F., Ho J., Woo J.H., Lim C.L., Poon D.J.J., Lamba B., Claridge-Chang A. (2016). Concordance and incongruence in preclinical anxiety models: Systematic review and meta-analyses. Neurosci. Biobehav. Rev. 2016. 68: 504–529.
Mumtaz F., Khan M.I., Zubair M., Dehpour A.R. Neurobiology and consequences of social isolation stress in animal model – A comprehensive review. Biomed. Pharmacother. 2018. 105: 1205–1222.
O’Leary T.P., Gunn R.K., Brown R.E. What Are We Measuring When We Test Strain Differences in Anxiety in Mice? Behav. Genet. 2013. 43: 34–50.
Oyola M.G., Handa R.J. Hypothalamic–pituitary–adrenal and hypothalamic–pituitary–gonadal axes: Sex differences in regulation of stress responsivity. Stress. 2017. 20(5): 476–494.
Pellow S., Chopin P., File S.E., Briley M. Validation of open:closed arm entries in an elevated plus-maze as a measure of anxiety in the rat. J. Neurosci. Methods. 1985. 14(3): 149–167.
Prut L., Belzung C. The open field as a paradigm to measure the effects of drugs on anxiety-like behaviors: a review. Eur. J. Pharmacol. 2003. 463(1–3): 3–33.
Rivera-Irizarry J.K., Skelly M.J., Pleil K.E. Social isolation stress in adolescence, but not adulthood, produces hypersocial behavior in adult male and female C57BL/6J mice. Front. Behav. Neurosci. 2020. 14: 129. https://doi.org/10.3389/fnbeh.2020.00129
Rykova V.I., Leberfarb E.Yu., Stefanova N.A., Shevelev O.B., Dymshits G.M., Kolosova N.G. Brain proteoglycans in postnatal development and during behavior decline in senescence-accelerated OXYS rats. . Adv. Gerontol. 2011. 24(2): 234–243.
Schneider T., Przewłocki R. Behavioral alterations in rats prenatally exposed to valproic acid: animal model of autism. Neuropsychopharmacol. 2004. 30(1): 80–89.
Scholl J.L., Afzal A., Fox L.C., Watt M.J., Forster G.L. Sex differences in anxiety-like behaviors in rats. Physiol. Behav. 2019. 211: 112670.
Schweinfurth M.K. The social life of Norway rats (Rattus norvegicus). Elife. 2020. Apr 9; 9: e54020.
Seillier A., Giuffrida A. Disruption of social cognition in the sub-chronic PCP rat model of schizophrenia: Possible involvement of the endocannabinoid system. Europ. Neuropsychopharmacol. 2016. 26(2): 298–309.
Smith A.S., Wang Z. Hypothalamic oxytocin mediates social buffering of the stress response. Biol. Psychiatry. 2014. 76(4): 281–288.
Tanaka K., Osako Y., Takahashi K., Hidaka C., Tomita K., Yuri K. Effects of post-weaning social isolation on social behaviors and oxytocinergic activity in male and female rats. Heliyon. 2019. 5(5): e01646.
Yildirim E., Erol K., Ulupinar E. Effects of sertraline on behavioral alterations caused by environmental enrichment and social isolation. Pharmacol. Biochem. Behav. 2012. 101(2): 278–287.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


