Журнал высшей нервной деятельности им. И.П. Павлова, 2022, T. 72, № 4, стр. 561-575
Влияние фрагмента АКТГ15-18 и его аналога АКТГ15-18PRO-GLY-PRO на последствия острого стрессогенного воздействия
Д. М. Манченко 1, Н. Ю. Глазова 2, Е. А. Себенцова 2, Л. А. Андреева 2, О. В. Долотов 1, 2, А. А. Каменский 1, Н. Ф. Мясоедов 2, Н. Г. Левицкая 1, *
1 Московский государственный университет им. М.В. Ломоносова, биологический факультет
Москва, Россия
2 Институт молекулярной генетики Национального исследовательского центра “Курчатовский институт”
Москва, Россия
* E-mail: nglevitskaya@gmail.com
Поступила в редакцию 29.11.2021
После доработки 21.01.2022
Принята к публикации 26.04.2022
- EDN: QFPBOO
- DOI: 10.31857/S0044467722040074
Аннотация
Тетрапептид KKRR, соответствующий последовательности АКТГ15-18, является самым коротким фрагментом, который с высоким сродством связывается с рецептором АКТГ, не активирует этот рецептор и препятствует связыванию с ним молекулы целого гормона, следовательно, проявляет свойства антагониста рецептора АКТГ. Целью работы было изучение влияния пептида АКТГ15-18 (KKRR) и его аналога АКТГ15-18PGP на поведение крыс Wistar в норме и после острого стресса, вызванного неизбегаемым электроболевым раздражением. Было показано, что исследованные пептиды не влияют на уровень тревожности белых крыс в норме. Предварительное введение АКТГ15-18 (250 мкг/кг) и его аналога АКТГ15-18PGP (50 и 250 мкг/кг) приводит к снижению тревожности и уменьшению выброса кортикостерона у крыс, перенесших однократное электроболевое раздражение. Выраженность и длительность антистрессорных эффектов препарата АКТГ15-18PGP значительно превышает выраженность и длительность эффектов его природного прототипа.
ВВЕДЕНИЕ
Стрессогенное воздействие вызывает в организме человека и животных каскад нейрохимических реакций, приводящих, в частности, к повышению толерантности к боли и изменению поведения. В ответ на действие стрессора повышается уровень гормонов гипоталамо-гипофизарно-адреналовой (ГГА) оси, происходит активация различных нейротрансмиттерных систем мозга. В развитие стрессорного ответа вовлечены опиоидная, серотонинергическая, дофаминергическая, ГАМК-ергическая и другие системы (O’Connor et al., 2000). ГГА-ось является важнейшим звеном в реализации реакции организма на стрессор. В ответ на воздействие клетки гипоталамуса выделяют кортикотропин-рилизинг-гормон, который стимулирует секрецию адренокортикотропного гормона (АКТГ) гипофизом. АКТГ воздействует на кору надпочечников, что приводит к быстрому увеличению продукции кортикостероидов (Розен, 1994). Выброс в кровь кортикостероидов индуцирует генерализованную реакцию, способствующую приспособлению организма к изменениям окружающей среды. Однако очень интенсивная и/или продолжительная стрессорная реакция может стать патогенетической основой для различных заболеваний (депрессия, тревожность и посттравматические стрессовые расстройства) (Schwabe, 2017; Floriou-Servou et al., 2021). У животных, перенесших стрессирующее воздействие, наблюдается снижение исследовательской активности, увеличение уровня тревожности и страха (Pijlman, Van Ree, 2002).
АКТГ является единственным пептидом, обладающим выраженной кортикотропной активностью (Raffin-Sanson et al., 2003). По своей структуре и происхождению АКТГ относится к семейству меланокортинов (MC), которое также включает в себя меланоцитстимулирующие гормоны (α-, β- и γ-МСГ). MC образуются из общего белка предшественника – проопиомеланокортина (Gantz, Fong, 2003; Yang, Harmon, 2020). Молекулы MC филогенетически очень древние и характеризуются высокой степенью консервативности (Catania, Lipton, 1993; Costa et al., 2005). В настоящее время выделено 5 типов рецепторов MC: MC1R – MC5R. Все MCR являются семидоменными трансмембранными рецепторами, сопряженными с G-белками (Starowicz, Przewlocka, 2003; Fridmanis et al., 2017). Все эндогенные MC содержат в своей структуре общую последовательность – фармакофор HFRW, соответствующий фрагменту АКТГ6-9, который необходим для связывания с MCR (Starowicz, Przewlocka, 2003; Davis et al., 2019). Все эндогенные MC способны связываться со всеми меланокортиновыми рецепторами за исключением меланокортинового рецептора 2-го типа (MC2R). Единственным известным эндогенным лигандом MC2R является молекула АКТГ (Catania et al., 2004; Yang, Harmon, 2020). MC2R представлены на мембранах клеток коры надпочечников в виде гексамерного комплекса, состоящего из двух молекул рецептора и четырех молекул адапторных белков MRAP (melanocortin receptor-associated protein), которые обеспечивают транспорт MC2R к мембране клетки и проведение сигнала от АКТГ (Gallo-Payet et al., 2017; Ghaddhab et al., 2017; Clark, Chan, 2019). Связывание АКТГ с МС2R стимулирует аденилатциклазу, которая вызывает увеличение продукции cAMP в клетке, что приводит к активации протеинкиназы А, которая индуцирует экспрессию ферментов, участвующих в биосинтезе стероидов (Catania et al., 2004; Gallo-Payet et al., 2017).
Как и для всех MCR, для активации MC2R необходимо присутствие в структуре пептида формакофора HFRW (смысловой последовательности). Эта последовательность имеется как в АКТГ, так и во всех МСГ. Тем не менее для MC2R высокоспецифичным лигандом является только АКТГ, но не МСГ, что предполагает наличие в молекуле АКТГ другого, специфичного только для MC2R, участка связывания. Исследования показали, что MC, в которых отсутствует последовательность KKRR (АКТГ15-18), лишены кортикотропной активности (Fridman et al., 2017). Замена в молекуле АКТГ1-24 одной из четырех аминокислот в последовательности KKRR на аланин приводила к резкому падению кортикотропной активности гормона (Costa et al., 2005). Последовательность KKRR была определена как адресная, необходимая для специфического связывания АКТГ с MC2R (Ghaddhab et al., 2017; Gallo-Payet et al., 2017). Активация MC2R требует взаимодействия между двумя фармакофорами гормона (HFRW и KKRR) и соответствующими им местами связывания на рецепторе (Ghaddhab et al., 2017; Davis et al., 2019; Yang, Harmon, 2020). Сайт связывания фармакофора HFRW формируется трансмембранными доменами TM2, TM3 и TM6, а фармакофора KKRR – TM4/5 и внеклеточной петлей EC2 (Davis et al., 2019). Предполагается, что внеклеточная часть MC2R может образовывать структуру, закрывающую сайт связывания фармакофора HFRW. Взаимодействия с белком MRAP и фармакофором KKRR вызывают конформационные изменения рецептора, приводящие к открытию этого сайта (Fridman et al., 2017). Таким образом, для активации MC2R необходимы обе последовательности: связывание адресной последовательности KKRR с рецептором позволяет смысловой последовательности HFRW взаимодействовать с MC2R и активировать его (Gallo-Payet et al., 2017).
Исследования показали, что тетрапептид KKRR (АКТГ15-18) является самым коротким фрагментом, который с высоким сродством связывается с MC2R, препятствует связыванию целой молекулы гормона с рецептором и не стимулирует продукцию cAMP, т.е. является антагонистом MC2R (Kovalitskaya et al., 2007; Ковалицкая и др., 2008). Эксперименты in vivo показали, что введение пептида KKRR за сутки до стрессогенного воздействия предотвращает стресс-вызванное возрастание уровня кортикостерона у крыс (Садовников и др., 2009). Однако исследования влияния этого пептида на поведение животных не проводились. Существенным недостатком природных MC является малая продолжительность их действия. Ранее было показано, что присоединение последовательности, обогащенной пролином, к природным пептидам, обладающим нейротропной активностью, приводит к увеличению выраженности действия и пролонгации их эффектов (Ашмарин и др., 1997; Kolomin et al., 2011). Это позволило предположить, что присоединение последовательности Pro-Gly-Pro к природному фрагменту АКТГ15-18 приведет к увеличению выраженности его эффектов.
Целью представленной работы было изучение эффектов пептида АКТГ15-18 (KKRR) и его аналога АКТГ15-18PGP. Исследовалось влияние этих пептидов на уровень тревожности крыс в норме, а также на изменения поведения, болевой чувствительности и содержания кортикостерона в сыворотке крови крыс, перенесших острое стрессогенное воздействие (неизбегаемое электроболевое раздражение).
МЕТОДИКА
Работа выполнена на крысах Wistar массой 200–250 г. Животных содержали в стандартных условиях вивария с соблюдением 12-часового светового режима (искусственное освещение с 9–00 до 21–00) и со свободным доступом к воде и пище. Исследование проведено с соблюдением биоэтических норм обращения с экспериментальными животными в соответствии с требованиями Директивы 2010/63/EU Европейского Парламента от 22.09.2010 г.
В работе были использованы пептиды KKRR (АКТГ15-18) и KKRRPGP (АКТГ15-18PGP), синтезированные в Институте молекулярной генетики Национального исследовательского центра “Курчатовский институт”. Пептиды вводили внутрибрюшинно в водном растворе из расчета 1 мл/кг массы тела, АКТГ15-18 – в дозе 250 мкг/кг, АКТГ15-18PGP – в дозах 50 и 250 мкг/кг. Контрольным животным вводили эквивалентный объем дистиллированной воды в соответствующие сроки.
Было проведено 5 независимых серий экспериментов. В первой серии исследовали влияние пептидов на показатели поведения крыс в норме. Было использовано 4 группы крыс (12 крыс в каждой группе): группа “Контроль” (животные получали инъекции растворителя в соответствующее время); группа “АКТГ15-18–250”, группа “АКТГ15-18PGP–50” и группа “АКТГ15-18PGP–250” (крысы получали инъекции соответствующего пептида в указанной дозе). Через 60 мин после введения препаратов изучали поведение животных в тесте ПКЛ, а через 24 часа после инъекции – в тесте “О-образный лабиринт”.
В остальных сериях экспериментов (2–5) изучали влияние пептидов на последствия острого стресса. В каждой серии было использовано по 5 групп крыс: группа “Контроль” (животные получали инъекции растворителя в соответствующее время и не подвергались стрессогенному воздействию), группа “Стресс” (крысы получали инъекции растворителя в соответствующее время и подвергались неизбегаемому электроболевому раздражению), группа “АКТГ15-18–250 + Стресс”, группа “АКТГ15-18PGP–50 + Стресс” и группа “АКТГ15-18PGP–250 + Стресс” (крысы получали инъекции соответствующего пептида в указанной дозе и подвергались неизбегаемому электроболевому раздражению).
Во второй и третьей сериях экспериментов оценивали влияние пептидов на изменения поведения, вызванные стрессогенным воздействием. Препараты вводили за 30 мин или за 20 часов до начала стрессогенного воздействия соответственно. Через 30 мин после окончания действия стрессора оценивали поведение крыс в тесте ПКЛ, а через 24 ч – в тесте “О-образный лабиринт”. В каждой группе в каждой серии было по 14 крыс. В четвертой серии экспериментов изучали влияние пептидов на стресс-вызванное изменение болевой чувствительности. Пептиды вводили за 30 мин до начала действия стрессора. В каждой группе было по 10 крыс. В пятой серии экспериментов оценивали влияние пептидов на содержание кортикостерона в сыворотке крови. Пептиды вводили за 20 ч до стресса. В каждой группе было по 7–8 крыс.
Модель острого стрессогенного воздействия. В качестве стрессогенного воздействия использовали неизбегаемое электроболевое раздражение. Крыс индивидуально помещали в экспериментальную камеру с решетчатым полом, соединенным с электростимулятором ЭСЛ-1. Электрическое раздражение наносили в течение 10 мин (10 сек тока с интервалом 20 сек) при частоте 200 Гц и длительности импульса 0.5 мсек. Напряжение варьировалось от 60 до 100 В в зависимости от появления вокализации. Крысы контрольной группы оставались в домашней клетке.
Для оценки уровня тревожности крыс использовали тесты “Приподнятый крестообразный лабиринт” и “О-образный лабиринт”.
Тест “Приподнятый крестообразный лабиринт” (ПКЛ). Экспериментальная камера лабиринта (НПК “Открытая Наука”, Россия) состоит из четырех расходящихся из центра рукавов (длина рукавов – 50 см, ширина – 15 см, высота стенок – 30 см). Два противоположных рукава закрыты с 3 сторон стенками и затемнены (10 лк); два других открыты и ярко освещены (450 лк). Лабиринт устанавливали на высоте 80 сантиметров от пола. Крысу помещали в центр лабиринта и в течение 5 минут визуально регистрировали время нахождения в открытых и закрытых рукавах лабиринта, количество заходов в открытые и закрытые рукава, суммарное число заходов в рукава лабиринта, число стоек и свешиваний с открытых рукавов.
Тест “О-образный лабиринт”. Лабиринт (НПК “Открытая Наука”, Россия) представляет собой замкнутый круговой коридор шириной 10 см и диаметром 105 см, размещенный на высоте 70 см от пола. Лабиринт разделен на 4 равных сектора, 2 противоположных сектора закрыты с боков стенками (высота 28 см), а два других открыты. Тестирование проводилось при равномерном неярком освещении (50 лк). В начале тестирования крысу помещали в закрытый сектор, далее в течение 5 мин визуально регистрировали латентный период выхода из закрытого сектора, время, проведенное в открытых секторах, число заходов в открытый сектор, число свешиваний и стоек.
Тест “Сдавливание задней лапы”. Величину болевого порога крыс до и после стресса измеряли в тесте “Сдавливание задней лапы”, в котором болевым раздражителем служит равномерно нарастающее давление на заднюю конечность. Измерение проводилось с помощью анальгезиметра фирмы “Ugo Basile” (Италия). Уровень болевой чувствительности определяли по величине давления на конечность в момент отдергивания лапы. Давление измерялось в условных единицах прибора, одна условная единица соответствует увеличению нагрузки на 20 г/см2. Максимальная нагрузка на конечность составляла 25 условных единиц. До введения препаратов проводили три измерения исходной болевой чувствительности. При анализе результатов для вычисления фоновой болевой чувствительности исходные значения усредняли. После окончания стрессогенного воздействия проводили 4 измерения болевой чувствительности с интервалом 15 мин. При статистической обработке данных для каждого животного при каждом измерении вычисляли изменение болевой чувствительности относительно фоновых значений.
Измерение уровня кортикостерона в сыворотке крови. Пробу крови брали из боковой хвостовой вены животных в объеме около 100 мкл. Для предотвращения образования тромбов в игле перед забором крови шприц промывали раствором цитрата натрия. Пробы крови выдерживали 20 мин при 37°С, затем 60 мин при 4°С. Далее пробы центрифугировали 10 мин при 5000 оборотах и отбирали сыворотку. В дальнейшем в образцах сыворотки определяли уровень кортикостерона с помощью набора для определения кортикостерона в биологических жидкостях (Corticosterone EIA Kit, Catalog № ADI-900-097, Enzo). Уровень кортикостерона измеряли за 30 мин до (базовый уровень) и через 10 и 45 мин после окончания стрессогенного воздействия. При статистической обработке данных для каждого животного при каждом измерении вычисляли изменение уровней кортикостерона относительно исходного уровня.
Статистическая обработка данных. Обработка результатов производилась с помощью пакета статистических программ “Statistica-10”. Для каждой выборки проводили оценку нормальности распределения с помощью критерия Шапиро–Уилка. Если распределение выборок соответствовало нормальному, для оценки результатов использовали метод дисперсионного анализа (ANOVA). При сравнении базового уровня кортикостерона применяли однофакторный ANOVA для фактора ГРУППА, при оценке изменений болевого порога и изменений уровня кортикостерона – ANOVA для повторных измерений для факторов ГРУППА и ВРЕМЯ ИЗМЕРЕНИЯ. В случае достоверного влияния выбранных факторов или их взаимодействия проводили post hoc анализ с использованием критерия Фишера (Fisher LSD test). В случае ненормального распределения отличия между группами оценивали с помощью критерия Краскела–Уоллеса, с последующим применением U-критерия Манна – Уитни (оценка поведения крыс в тестах ПКЛ и “О-образный лабиринт”). Данные на рисунках представлены в виде среднего ± стандартная ошибка среднего для нормально распределенных данных или в виде медианы и интерквартильного размаха с минимумом и максимумом значений при ненормальном распределении данных в выборках. Отличия считали достоверными при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Влияние пептидов АКТГ15-18 и АКТГ15-18PGP на поведение животных в норме
В первой серии опытов для оценки влияния пептидов на уровень тревожности и исследовательскую активность крыс через 60 мин после введения препаратов изучалось поведение животных в тесте ПКЛ, а через 24 часа после инъекции – в тесте “О-образный лабиринт”. Нами не было выявлено значимого влияния фактора ГРУППА для параметров поведения животных в данных тестах (критерий Краскела–Уоллеса–H < 4.8; p > > 0.15; табл. 1).
Таблица 1.
Влияние АКТГ15-18 и АКТГ15-18PGP на уровень тревожности крыс Table 1. Effects of ACTH15-18 and ACTH15-18PGP on the anxiety level in rats
| Группа/Показатель | Контроль | АКТГ15-18 250 мкг/кг |
АКТГ15-18PGP 50 мкг/кг |
АКТГ15-18PGP 250 мкг/кг |
H (3, N = 48); (p) |
|---|---|---|---|---|---|
| Тест “Приподнятый крестообразный лабиринт” (через 1 ч после введения) | |||||
| Время в открытых рукавах | 15.0 (1.0; 41.0) |
11.5 (7.5; 45.0) |
27.5 (8.0; 39.5) |
14.5 (0.0; 39.5) |
1.52 (0.68) |
| Время в закрытых рукавах | 251.5 (198.5; 264.5) |
248.0 (201.0; 267.0) |
229.5 (198.0; 257.5) |
250.5 (233.5; 293.0) |
0.52 (0.91) |
| Заходы в открытые рукава | 1.0 (0.5; 3.0) |
1.0 (1.0; 2.5) |
2.0 (1.0; 2.5) |
1.0 (0.0; 3.0) |
0.42 (0.94) |
| Заходы суммарные | 8.0 (5.0; 10.0) |
6.0 (3.5; 8.0) |
7.5 (4.5; 10.0) |
5.0 (2.0; 9.0) |
2.80 (0.42) |
| Свешивания | 2.0 (1.0; 4.0) |
4.5 (2.0; 6.0) |
2.5 (1.0; 2.5) |
2.5 (0.0; 5.5) |
2.19 (0.50) |
| Стойки | 9.0 (7.5; 12.0) |
8.0 (6.5; 10.5) |
10.0 (9.5; 13.0) |
11.0 (9.5; 12.0) |
4.97 (0.17) |
| Тест “О-образный лабиринт” (через 24 ч после введения) | |||||
| ЛП захода | 57.5 (16; 300) |
81.5 (33.5; 210) |
57.5 (20.0; 274) |
52.0 (15.0; 162) |
0.55 (0.91) |
| Время в открытых секторах | 15.0 (0.0; 64.5) |
14.5 (7.5; 31.0) |
13.5 (2.0; 51.0) |
24.5 (6.0; 42.0) |
0.22 (0.97) |
| Заходы в открытые сектора | 1.5 (0.0; 6.0) |
1.0 (1.0; 3.0) |
1.0 (0.5; 6.0) |
2.0 (1.0; 4.0) |
0.30 (0.96) |
| Свешивания | 1.0 (0.0; 3.5) |
1.0 (0.0; 2.0) |
2.0 (0.5; 3.5) |
1.0 (0.0; 3.5) |
1.90 (0.60) |
| Стойки | 7.0 (5.0; 10.5) |
7.0 (5.0; 10.0) |
10.0 (6.5; 12.0) |
8.0 (5.5; 11.0) |
1.48 (0.69) |
Влияние пептидов АКТГ15-18 и АКТГ15-18PGP на стресс-вызванные изменения поведения
Во второй и третьей сериях экспериментов нами исследовалось влияние АКТГ15-18 и АКТГ15-18PGP на изменения поведения животных, вызванные стрессогенным воздействием.
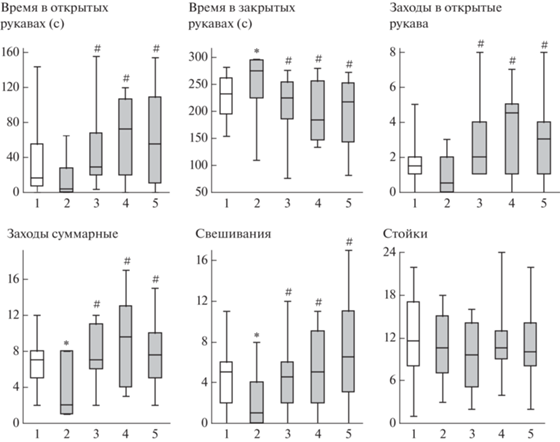
Во второй серии опытов пептиды вводили за 30 мин до начала стрессогенного воздействия. Через 30 мин после стресса изучали поведение крыс в тесте ПКЛ. Применение критерия Краскела–Уоллиса выявило статистически значимые отличия между группами по таким показателям, как время, проведенное в открытых и закрытых рукавах, число заходов в открытые рукава, суммарное число заходов в рукава и число свешиваний с открытых рукавов лабиринта (H(4, N = 70) > > 10.0; p < 0.04). Не было отмечено значимых различий между группами по числу стоек (H = 1.3; p = 0.86). Дальнейший анализ показал, что в группе “Стресс” время, проведенное в закрытых рукавах, было статистически значимо больше, а суммарное число заходов в рукава лабиринта и число свешиваний с открытых рукавов лабиринта было значимо меньше, чем в группе “Контроль” (p < 0.05) (рис. 1). Во всех группах крыс, получавших инъекции пептидов до стрессогенного воздействия, значимых отличий от группы “Контроль” отмечено не было (p > 0.10). В группах “АКТГ15-18–250 + Стресс”, “АКТГ15-18PGP–50 + Стресс” и “АКТГ15-18PGP–250 + Стресс” время, проведенное в закрытых рукавах, было статистически значимо меньше, а время в открытых рукавах, число заходов в открытые рукава, суммарное число заходов в рукава и число свешиваний – значимо больше, чем в группе “Стресс” (p < 0.01) (рис. 1). Значимых различий между группами “АКТГ15-18–250 + Стресс”, “АКТГ15-18PGP–50 + + Стресс” “АКТГ15-18PGP–250 + Стресс” зарегистрировано не было (p > 0.30).
Рис. 1.
Влияние АКТГ15-18 и АКТГ15-18PGP на стресс-вызванные изменения поведения крыс в тесте “Приподнятый крестообразный лабиринт” через 30 мин после окончания электроболевого раздражения. Группы крыс: 1 – Контроль; 2 – Стресс; 3 – Стресс + АКТГ15-18 (250 мкг/кг); 4 – Стресс + АКТГ15-18PGP (50 мкг/кг); 5 – Стресс + АКТГ15-18PGP (250 мкг/кг). Пептиды вводили за 30 мин до стресса. В каждой группе по 14 крыс. Данные представлены в виде медианы, интерквартильного размаха и минимального и максимального значений. Статистически значимые отличия от контроля отмечены * (p < 0.05), от группы Стресс – # (p < 0.05).
Fig. 1. Effects of ACTH15-18 and ACTH15-18PGP on stress-induced behavioral alterations in elevated plus maze 30 min after acute foot shock. Groups of rats: 1 – Control; 2 – Stress; 3 – Stress + ACTH15-18 (250 µg/kg); 4 – Stress + + ACTH15-18PGP (50 µg/kg); 5 – Stress + ACTH15-18PGP (250 µg/kg). The peptides were administrated 30 min before stress. n = 14 rats/group. The data are shown as median and interquartile range with minimum and maximum values. Significant differences vs Control marked * (p < 0.05); differences vs Stress – # (p < 0.05).
Через 24 часа после стрессогенного воздействия крыс тестировали в О-образном лабиринте. Критерий Краскела–Уоллиса выявил статистически значимые различия между группами по таким показателям, как время, проведенное в открытых секторах, число заходов в открытые сектора и число свешиваний (H(4, N = 70) > 19.0; p < 0.001), а также изменение латентного периода (ЛП) захода в открытый сектор на уровне тенденции (H = 8.93; p = 0.063). По числу стоек значимых различий между группами отмечено не было (H = 2.4; p = 0.67). В группе “Стресс” время в открытых секторах и число заходов в открытые сектора было статистически значимо меньше (p < 0.025), а ЛП захода в открытый сектор и число свешиваний были снижены на уровне тенденции (p < 0.065) по сравнению с группой “Контроль” (рис. 2). Во всех группах крыс, получавших инъекции пептидов до стрессогенного воздействия, время, проведенное в открытых секторах, число заходов в открытые сектора и число свешиваний было статистически значимо больше, чем в группе “Стресс” (p < 0.02). В группах животных, получавших инъекцию пептида АКТГ15-18PGP в обеих дозах, время, проведенное в открытых секторах, число заходов в открытые сектора и свешиваний статистически значимо превышало соответствующие значения в группе “Контроль” (p < 0.04). Кроме того, число свешиваний в этих группах было значимо больше, чем в группе “АКТГ15-18–250 + + Стресс” (p < 0.05).
Рис. 2.
Влияние АКТГ15-18 и АКТГ15-18PGP на стресс-вызванные изменения поведения крыс в тесте “О-образный лабиринт” через 24 часа после окончания электроболевого раздражения. Группы крыс: 1 – Контроль; 2 – Стресс; 3 – Стресс + АКТГ15-18 (250 мкг/кг); 4 – Стресс + АКТГ15-18PGP (50 мкг/кг); 5 – Стресс + + АКТГ15-18PGP (250 мкг/кг). Пептиды вводили за 30 мин до стресса. В каждой группе по 14 крыс. Данные представлены в виде медианы, интерквартильного размаха и минимального и максимального значений. Статистически значимые отличия от контроля отмечены * (p < 0.05), от группы Стресс – # (p < 0.05), от группы Стресс + АКТГ15-18 – & (p < 0.05).
Fig. 2. Effects of ACTH15-18 and ACTH15-18PGP on stress-induced behavioral alterations in O-maze test 24 h after acute foot shock. Groups of rats: 1 – Control; 2 – Stress; 3 – Stress + ACTH15-18 (250 µg/kg); 4 – Stress + + ACTH15-18PGP (50 µg/kg); 5 – Stress + ACTH15-18PGP (250 µg/kg). The peptides were administrated 30 min before stress. n = 14 rats/group. The data are shown as median and interquartile range with minimum and maximum values. Significant differences vs Control marked * (p < 0.05); differences vs Stress – # (p < 0.05); differences vs Stress + ACTH15-18 – & (p < 0.05).
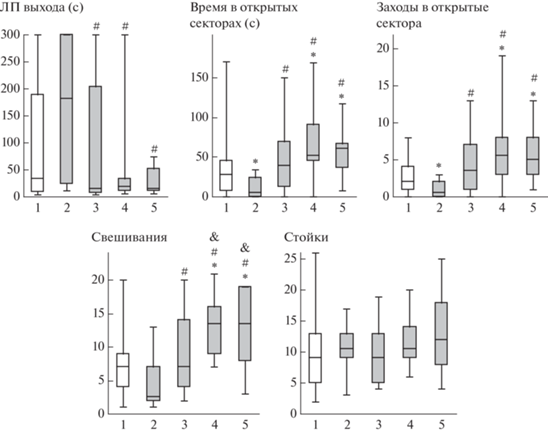
Таким образом, использованное стрессогенное воздействие приводило к увеличению уровня тревожности животных как через 30 мин, так и через 24 часа после окончания стресса. Введение пептидов АКТГ15-18 или АКТГ15-18PGP за 30 мин до стресса снижало стресс-вызванную тревожность у крыс в тестах ПКЛ и “О-образный лабиринт”. Кроме того, в группах крыс, получавших инъекции АКТГ15-18PGP в обеих дозах, через сутки после стресса уровень тревожности был снижен относительно группы “Контроль”. Следовательно, при введении за 30 мин до стресса исследуемые пептиды нормализовали уровень тревожности у крыс, перенесших стресс.
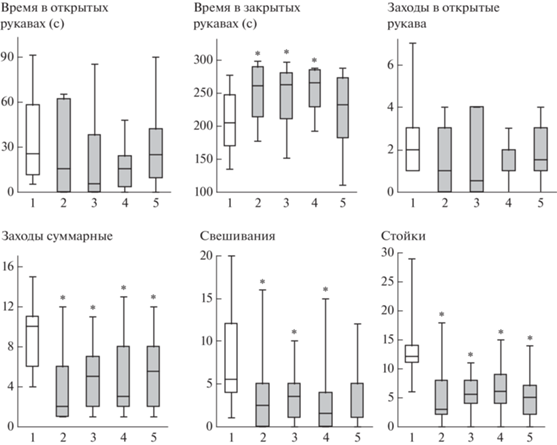
В третьей серии экспериментов для оценки длительности действия АКТГ15-18 и АКТГ15-18PGP изучали эффекты пептидов при введении за 20 часов до стресса. Через 30 мин после окончания стрессогенного воздействия оценивали уровень тревожности животных в тесте ПКЛ. Использование критерия Краскела–Уоллиса показало статистически значимые различия между группами по таким показателям, как время, проведенное в закрытых рукавах, суммарное число заходов в рукава, число стоек и свешиваний (H(4, N = = 70) > 10.2; p < 0.04). По времени в открытых рукавах и числу заходов в открытые рукава значимых отличий отмечено не было (H < < 6.4; p > 0.17). В группе “Стресс” время в закрытых рукавах было статистически значимо больше, а суммарное число заходов в рукава, число стоек и свешиваний значимо меньше, чем в группе “Контроль” (p < 0.03) (рис. 3). Введение пептидов АКТГ15-18 (250 мкг/кг) и АКТГ15-18PGP (50 мкг/кг) не оказывало влияния на эффекты стресса. В группе крыс, получавших АКТГ15-18PGP в дозе 250 мкг/кг, отмечалось статистически значимое снижение суммарного числа заходов в рукава и числа стоек по сравнению с группой “Контроль” (p < 0.02), остальные показатели в этой группе значимо от контроля не отличались (p > > 0.10). Значимых различий показателей поведения между группами крыс, подвергавшихся стрессогенному воздействию, не наблюдалось (p > 0.10).
Рис. 3.
Влияние АКТГ15-18 и АКТГ15-18PGP на стресс-вызванные изменения поведения крыс в тесте ПКЛ через 30 мин после окончания электроболевого раздражения. Группы крыс: 1 – Контроль; 2 – Стресс; 3 – Стресс + АКТГ15-18 (250 мкг/кг); 4 – Стресс + АКТГ15-18PGP (50 мкг/кг); 5 – Стресс + АКТГ15-18PGP (250 мкг/кг). Пептиды вводили за 20 ч до стресса. В каждой группе по 14 крыс. Данные представлены в виде медианы, интерквартильного размаха и минимального и максимального значений. Статистически значимые отличия от контроля отмечены * (p < 0.05).
Fig. 3. Effects of ACTH15-18 and ACTH15-18PGP on stress-induced behavioral alterations in elevated plus maze 30 min after acute foot shock. Groups of rats: 1 – Control; 2 – Stress; 3 – Stress + ACTH15-18 (250 µg/kg); 4 – Stress + + ACTH15-18PGP (50 µg/kg); 5 – Stress + ACTH15-18PGP (250 µg/kg). The peptides were administrated 20 h before stress. n = 14 rats/group. The data are shown as median and interquartile range with minimum and maximum values. Significant differences vs Control marked * (p < 0.05).
Через 24 часа после стресса оценивали поведение крыс в тесте “О-образный лабиринт”. Применение критерия Краскела–Уоллиса выявило значимые различия между группами по таким показателям, как ЛП захода в открытый сектор, время в открытых секторах и число заходов в открытые сектора (H(4, N = 65) > 17.2; p < 0.002). Различий по числу стоек и свешиваний отмечено не было (H < 5.0; p > 0.29). Дальнейший анализ не выявил значимых отличий показателей поведения крыс группы “Стресс” от контрольных животных (p > 0.12) (рис. 4). Параметры поведения крыс, получавших до стресса инъекцию АКТГ15-18, не отличались от соответствующих значений в группах “Контроль” и “Стресс” (p > 0.16). В группе “АКТГ15-18PGP–50 + + Стресс” время, проведенное в открытых секторах, было статистически значимо больше (p = 0.04), а число заходов в открытые сектора было увеличено на уровне тенденции (p = 0.09) по сравнению с группой “Контроль”. В группе “АКТГ15-18PGP–250 + + Стресс” ЛП захода в открытый сектор был статистически значимо меньше, а число заходов в открытые сектора значимо больше, чем в группе “Контроль” (p < 0.04). Кроме того, в группах крыс, которым вводили АКТГ15-18PGP в обеих дозах, отмечалось статистически значимое снижение ЛП захода в открытый сектор, а также увеличение времени в открытых секторах и числа заходов в открытые сектора по сравнению с группами “Стресс” и “АКТГ15-18–250 + Стресс” (p < 0.01).
Рис. 4.
Влияние АКТГ15-18 и АКТГ15-18PGP на стресс-вызванные изменения поведения крыс в тесте “О-образный лабиринт” через 24 часа после окончания электроболевого раздражения. Группы крыс: 1 – Контроль; 2 – Стресс; 3 – Стресс + АКТГ15-18 (250 мкг/кг); 4 – Стресс + АКТГ15-18PGP (50 мкг/кг); 5 – Стресс + + АКТГ15-18PGP (250 мкг/кг). Пептиды вводили за 20 ч до стресса. В каждой группе по 14 крыс. Данные представлены в виде медианы, интерквартильного размаха и минимального и максимального значений. Статистически значимые отличия от контроля отмечены * (p < 0.05), от группы Стресс – # (p < 0.05), от группы Стресс + АКТГ15-18 – & (p < 0.05).
Fig. 4. Effects of ACTH15-18 and ACTH15-18PGP on stress-induced behavioral alterations in O-maze test 24 h after acute foot shock. Groups of rats: 1 – Control; 2 – Stress; 3 – Stress + ACTH15-18 (250 µg/kg); 4 – Stress + + ACTH15-18PGP (50 µg/kg); 5 – Stress + ACTH15-18PGP (250 µg/kg). The peptides were administrated 20 h before stress. n = 14 rats/group. The data are shown as median and interquartile range with minimum and maximum values. Significant differences vs Control marked * (p < 0.05); differences vs Stress – # (p < 0.05); differences vs Stress + ACTH15-18 – & (p < 0.05).
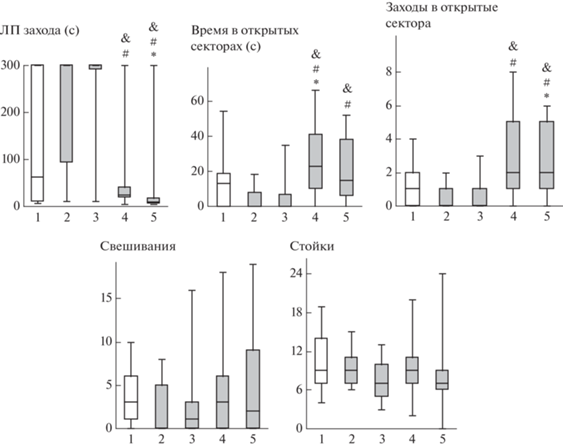
Таким образом, в данной серии экспериментов нами было зарегистрировано увеличение уровня тревожности крыс через 30 мин после стрессогенного воздействия. Кроме того, в группе крыс, перенесших стресс, отмечалось снижение исследовательской активности, о чем свидетельствует уменьшение числа стоек и суммарного числа заходов в рукава относительно показателей контрольной группы. Введение исследуемых пептидов за 20 часов до стресса не оказывало влияния на поведение крыс через 30 мин после воздействия. В этой серии экспериментов нами не было зарегистрировано отставленных изменений поведения у крыс группы “Стресс”, хотя показатели поведения в группах “Стресс” и “АКТГ15-18–250 + Стресс” были несколько ниже контрольных значений. У крыс группы “Контроль” в тесте “О-образный лабиринт” наблюдался довольно высокий уровень тревожности. Можно предположить, что на таком фоне эффекты стрессогенного воздействия были менее выражены. Введение пептида АКТГ15-18 за 20 часов до стресса не оказывало влияния на поведение крыс в тесте “О-образный лабиринт”. В группах животных, которым вводили АКТГ15-18PGP в обеих дозах, отмечалось снижение уровня тревожности как относительно группы “Контроль”, так и по сравнению с группой “Стресс”. Следовательно, при введении за 20 часов до стресса пептид АКТГ15-18PGP проявляет анксиолитическую активность.
Влияние пептидов АКТГ15-18 и АКТГ15-18PGP на стресс-вызванные изменения болевой чувствительности
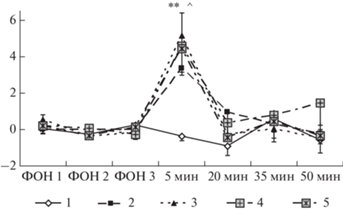
В четвертой серии экспериментов изучали влияние пептидов на изменение болевой чувствительности, вызванное стрессогенным воздействием. Пептиды вводили за 30 мин до начала воздействия, величину болевого порога измеряли через 5, 20, 35 и 50 мин после окончания электроболевого раздражения. Применение ANOVA для повторных измерений выявило статистически значимое влияние факторов ГРУППА (F4.45 = 2.75, p = 0.039) и ВРЕМЯ ИЗМЕРЕНИЯ (F6.270 = 21.01, p < < 0.00001), а также значимое взаимодействие этих факторов (F24.270 = 2.11, p < 0.002). Дальнейший анализ показал статистически значимое повышение болевого порога во всех группах крыс, перенесших стресс, как относительно фоновых значений (p < 0.001), так и по сравнению с группой “Контроль” (p < < 0.01) через 5 мин после окончания стресса (рис. 5). Таким образом, у крыс, перенесших электроболевое раздражение, отмечается стресс-вызванная анальгезия. Введение исследуемых пептидов не влияло на изменение болевой чувствительности, вызванное стрессом.
Рис. 5.
Влияние АКТГ15-18 и АКТГ15-18PGP на стресс-вызванные изменения болевой чувствительности крыс в тесте отдергивания задней лапы. По оси абсцисс – время после окончания стресса (мин), по оси ординат – изменение болевого порога относительно фоновых значений (условные единицы прибора). Группы крыс: 1 – Контроль; 2 – Стресс; 3 – Стресс + АКТГ15-18 (250 мкг/кг); 4 – Стресс + АКТГ15-18PGP (50 мкг/кг); 5 – Стресс + АКТГ15-18PGP (250 мкг/кг). Пептиды вводили за 30 мин до стресса. В каждой группе по 10 крыс. Данные представлены в виде среднего ± стандартная ошибка среднего. Статистически значимые отличия от контроля отмечены ** (p < 0.01), от фоновых значений – ^ (p < 0.001).
Fig. 5. Effects of ACTH15-18 and ACTH15-18PGP on stress-induced analgesia in the paw-withdrawal test. The X-axis – the time after stress termination (min), the Y-axis – changes in pain threshold relatively the baseline values (conventional units). Groups of rats: 1 – Control; 2 – Stress; 3 – Stress + ACTH15-18 (250 µg/kg); 4 – Stress + ACTH15-18PGP (50 µg/kg); 5 – Stress + ACTH15-18PGP (250 µg/kg). The peptides were administrated 30 min before stress. n = = 10 rats / group. The data are shown as mean ± standard error of means. Significant differences vs Control marked ** (p < 0.01), differences vs baseline value – ^ (p < 0.001).
Влияние пептидов АКТГ15-18 и АКТГ15-18PGP на стресс-вызванные изменения уровня кортикостерона в крови
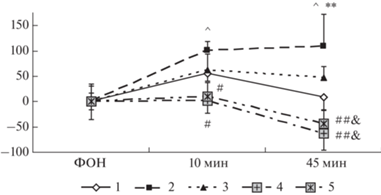
При изучении влияния исследуемых пептидов на базовый уровень кортикостерона и изменения содержания кортикостерона, вызванные стрессогенным воздействием, препараты вводили за 20 ч до стресса. Измерения уровня кортикостерона в сыворотке крови крыс проводили за 30 мин до начала и через 10 и 45 мин после окончания стрессогенного воздействия. Оценка базового уровня кортикостерона в сыворотке крови крыс не выявила значимого влияния фактора ГРУППА на этот показатель (F4.32 = 1.10, p = 0.37). Применение ANOVA для повторных измерений продемонстрировало статистически значимое влияние факторов ГРУППА (F4,32 = 4.49, p = 0.005) и ВРЕМЯ ИЗМЕРЕНИЯ (F2.64 = = 4.50, p = 0.042), взаимодействия факторов отмечено не было (F4.32 = 0.68, p = 0.64). В группе “Контроль” не было отмечено значимого изменения содержания кортикостерона относительно фоновых значений (p > > 0.10) (рис. 6). У крыс группы “Стресс” через 10 и 45 мин после окончания воздействия наблюдалось статистически значимое увеличение содержания кортикостерона относительно исходного уровня (p < 0.005), кроме того, через 45 мин содержание кортикостерона у этих животных было значимо выше, чем в группе “Контроль” (p = 0.01). В группе “АКТГ15-18–250 + Стресс” содержание кортикостерона через 10 мин после стресса превышало фоновые значения на уровне тенденции (p = 0.07), при этом значимых отличий уровня гормона у крыс этой группы от контроля и группы «Стресс» отмечено не было (p > 0.18). В группах животных, получавших инъекции АКТГ15-18PGP в обеих дозах, содержание кортикостерона после стресса не отличалось от фоновых значений (p > 0.10). Также не было зарегистрировано значимых отличий между этими группами и группой “Контроль” (p > 0.12). При этом уровень кортикостерона в группах крыс, которым вводили АКТГ15-18PGP в обеих дозах, был статистически значимо ниже, чем в группе “Стресс” через 10 (p < 0.04) и 45 мин (p < 0.001) после стресса. Следовательно, использованное электроболевое воздействие вызывает увеличение содержания кортикостерона в сыворотке крови. Введение тетрапептида АКТГ15-18 за 20 часов до стресса незначительно ослабляло стресс-вызванный выброс кортикостерона. Инъекции АКТГ15-18PGP в обеих дозах приводили к снижению до контрольных значений содержания кортикостерона в крови крыс, перенесших электроболевое раздражение. Кроме того, уровни кортикостерона в группе крыс, получавших инъекции АКТГ15-18PGP, через 45 мин после стресса были статистически значимо ниже, чем в группе животных, которым вводили АКТГ15-18.
Рис. 6.
Влияние АКТГ15-18 и АКТГ15-18PGP на стресс-вызванные изменения содержания кортикостерона в сыворотке крови крыс. По оси абсцисс – время после окончания стресса (мин), по оси ординат – изменение уровней кортикостерона относительно фоновых значений (нг/мл). Группы крыс: 1 – Контроль; 2 – Стресс; 3 – Стресс + АКТГ15-18 (250 мкг/кг); 4 – Стресс + АКТГ15-18PGP (50 мкг/кг); 5 – Стресс + АКТГ15-18PGP (250 мкг/кг). Пептиды вводили за 20 ч до стресса. В каждой группе по 7–8 крыс. Данные представлены в виде среднего ± стандартная ошибка среднего. Статистически значимые отличия от контроля отмечены ** (p < 0.01), от группы стресс – # (p < 0.05) и ## (p < 0.01), от группы Стресс + АКТГ15-18 – & (p < 0.05), от фоновых значений – ^ (p < 0.001).
Fig. 6. Effects of ACTH15-18 and ACTH15-18PGP on stress-induced changes in serum corticosterone levels. The X‑axis – the time after stress termination (min), the Y-axis – changes in corticosterone levels relatively the baseline values (ng/mL). Groups of rats: 1 – Control; 2 – Stress; 3 – Stress + ACTH15-18 (250 µg/kg); 4 – Stress + ACTH15-18PGP (50 µg/kg); 5 – Stress + ACTH15-18PGP (250 µg/kg). The peptides were administrated 20 h before stress. n = 7–8 rats/group. The data are shown as mean ± standard error of means. Significant differences vs Control marked ** (p < < 0.01); differences vs Stress – # (p < 0.05) and ## (p < 0.01); differences vs Stress + ACTH15-18 – & (p < 0.05); differences vs baseline value – ^ (p < 0.001).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В данной работе проведено исследование влияния фрагмента АКТГ15-18 (тетрапептида KKRR) и его нового аналога АКТГ15-18PGP на поведение крыс в норме, а также на стресс-вызванные изменения поведения, болевой чувствительности и уровня кортикостерона у белых крыс. Проведенные эксперименты показали, что введение АКТГ15-18 в дозе 250 мкг/кг или АКТГ15-18PGP в дозах 50 и 250 мкг/кг не приводит к изменению параметров поведения крыс в тесте ПКЛ через 1 час и тесте “О-образный лабиринт” через 24 часа после внутрибрюшинного введения. Следовательно, как природный фрагмент, так и его аналог в исследованных дозах не влияют на уровень тревожности животных в норме.
Многочисленные исследования показали, что острые стрессогенные воздействия различной природы могут вызывать у животных снижение исследовательской активности и увеличение тревожности (Pijlman, Van Ree, 2002; Zhang et al., 2019). Использованное нами электроболевое раздражение также приводило к увеличению уровня тревожности животных в тесте ПКЛ через 30 мин после окончания стресса и в тесте “О-образный лабиринт” через 24 часа после стресса. Пептиды АКТГ4-10 и АКТГ15-18PGP в исследуемых дозах при введении за 30 мин до стрессогенного воздействия оказывали антистрессорное действие – ослабляли как острые, так и отставленные изменения поведения животных, вызванные электроболевым раздражением. При этом введение АКТГ15-18PGP не только ослабляло стресс-вызванные изменения поведения, но и снижало уровень тревожности крыс, перенесших стресс, относительно контрольных значений. То есть АКТГ15-18PGP оказывал антистрессорное и анксиолитическое действие.
При введении за 20 часов до электроболевого раздражения исследуемые пептиды не влияли на поведение крыс в ПКЛ через 30 мин после стресса – во всех группах крыс, перенесших стресс, отмечался повышенный уровень тревожности. Однако следует отметить, что у крыс, получавших АКТГ15-18PGP в дозе 250 мкг/кг, увеличение тревожности было менее выражено – время, проведенное в закрытых рукавах, и число свешиваний не отличались от контрольных значений. При оценке отставленных изменений поведения в О-образном лабиринте в этой серии не было выявлено статистически значимых эффектов стресса. Введение пептида АКТГ15-18 за 20 ч до стресса не оказывало влияния на поведение крыс в тесте “О-образный лабиринт”. Крысы, получавшие инъекции АКТГ15-18PGP в обеих дозах, демонстрировали сниженный уровень тревожности по сравнению с другими экспериментальными группами. Следовательно, при введении за 20 ч до стресса пептид АКТГ15-18 не влияет на стресс-вызванные изменения поведения, а его аналог АКТГ15-18PGP оказывает анксиолитическое действие.
Хорошо известно, что острое стрессорное воздействие приводит к снижению реакции организма на болевые стимулы, развивается стресс-вызванная анальгезия (СВА). При действии стрессора активируются нисходящие тормозные пути, которые модулируют передачу болевой информации (Uchiyama et al., 2022). В развитии СВА участвуют различные нейромедиаторы, такие как опиоиды, эндоканнабиноиды, серотонин, дофамин, гистамин, ГАМК, глютамат и др. Специфические системы нейромедиаторов, опосредующие СВА, определяются характером, продолжительностью и интенсивностью стрессора (Butler, Finn, 2009; Atwal et al., 2020). В данном исследовании оценка болевой чувствительности животных показала, что использованное электроболевое раздражение приводит к повышению болевого порога у крыс через 5 мин после окончания стрессогенного воздействия. Введение исследуемых пептидов не приводило к достоверному изменению выраженности стресс-вызванной анальгезии у крыс.
Наши эксперименты также показали, что введение АКТГ15-18 и АКТГ15-18PGP за 20 ч до стресса, вызванного электроболевым раздражением, ослабляет стресс-вызванный выброс кортикостерона. При этом эффекты гептапептида были более выражены, чем эффекты АКТГ15-18. Известно, что как увеличение уровня кортикостерона, вызванное стрессогенным воздействием, так и введение экзогенного кортикостерона приводят к возрастанию тревожности животных (Kutiyanawalla et al., 2011; Frahm et al., 2020). Вероятно, зарегистрированные нами анксиолитические эффекты АКТГ15-18 и его аналога связаны с подавлением выброса кортикостерона под действием острого стресса.
Согласно данным литературы, синтетический пептид KKRR, соответствующий фрагменту АКТГ15-18, проявляет свойства антагониста MC2R (Ковалицкая и др., 2008). Также было показано, что введение этого тетрапептида за сутки до стрессогенного воздействия предотвращает возрастание уровня кортикостерона в надпочечниках и плазме крови крыс, вызванное холодовым и тепловым шоком (Садовников и др., 2009). В наших экспериментах введение АКТГ1-24 и его аналога АКТГ15-18PGP приводило к снижению выброса кортикостерона, вызванного электроболевым раздражением. Данные литературы и полученные нами результаты позволяют рассматривать эти пептиды как вероятные антагонисты MC-рецепторов второго типа, опосредующих влияние АКТГ на надпочечники. Можно предположить, что зарегистрированные нами антистрессорные эффекты АКТГ15-18 и его синтетического аналога АКТГ15-18PGP связаны с влиянием этих пептидов на функционирование гипоталамо-гипофизарно-адреналовой оси.
ВЫВОДЫ
1. Тетрапептид АКТГ15-18 (KKRR) и его аналог АКТГ15-18PGP при однократном внутрибрюшинном введении снижают стресс-вызванную тревожность крыс в тестах “Приподнятый крестообразный лабиринт” и “О-образный лабиринт”.
2. Введение АКТГ15-18 и АКТГ15-18PGP перед стрессогенным воздействием не влияет на стресс-вызванную анальгезию.
3. Введение АКТГ15-18 и АКТГ15-18PGP за 20 ч до электроболевого раздражения приводит к снижению стресс-вызванного выброса кортикостерона.
4. Выраженность и длительность антистрессорных эффектов АКТГ15-18PGP значительно превышают выраженность и длительность эффектов его природного прототипа.
Список литературы
Ашмарин И.П., Незавибатько В.Н., Мясоедов Н.Ф., Каменский А.А., Гривенников И.А., Пономарева-Степная М.А., Андреева Л.А., Каплан А.Я., Кошелев В.Б., Рясина Т.В. Ноотропный аналог адренокортикотропина 4-10-Семакс (15-летний опыт разработки и изучения). Журн. высш. нервн. деят. им. И.П.Павлова. 1997. 47(3): 420–430.
Ковалицкая Ю.А., Колобов А.А., Кампе-Немм Е.А., Золотарев Ю.А., Юровский В.В., Садовников В.Б., Липкин В.М., Наволоцкая Е.В. Синтетический пептид KKRR, соответсвующий фрагменту 15–18 адренокортикотропного гормона человека, является его антагонистом. Журн. Биоорг. химия. 2008. 34(1): 29–35.
Розен В.Б. Основы эндокринологии. М.: Изд-во МГУ, 1994.
Садовников В.Б., Сажин А.И., Золотарев Ю.А., Наволоцкая Е.В. Стресс-протекторное действие синтетического пептида KKRR, соответствующего фрагменту 15–18 адренокортикотропного гормона человека. Журн. Биоорг. химия. 2009. 35(1): 25–29.
Atwal N., Winters B.L., Vaughan C.W. Endogenous cannabinoid modulation of restraint stress-induced analgesia in thermal nociception. J. Neurochem. 2020. 152(1): 92–102.
Butler R.K., Finn D.P. Stress-induced analgesia. Prog. Neurobiol. 2009. 88(3): 184–202.
Catania A., Lipton J.M. α-Melanocyte stimulating hormone in the modulation of host reactions. Endocrine Reviews. 1993. 14(5): 564–576
Catania A., Gatti S., Colombo G., Lipton J.M. Targeting melanocortin receptors as a novel strategy to control inflammation. Pharmacol. Rev. 2004. 56(1): 1–29
Clark A.J.L., Chan L. Stability and turnover of the ACTH receptor complex. Front. Endocrinol. (Lausanne). 2019. 10: 491.
Davis P.E., Wilkinson E.C., Dores R.M. Identifying Common Features in the Activation of Melanocortin-2 Receptors: Studies on the Xenopus tropicalis Melanocortin-2 Receptor. International Journal of Molecular Sciences. 2019. 20(17): 4166.
Floriou-Servou A., von Ziegler L., Waag R., Schläppi C., Germain P.L., Bohacek J. The acute stress response in the multiomic era. Biol Psychiatry. 2021. 89(12): 1116–1126.
Frahm K.A., Williams A.A., Wood A.N., Ewing M.C., Mattila P.E., Chuan B.W., Guo L., Shah F.A., O’Donnell C.P., Lu R., DeFranco D.B. Loss of CREBRF reduces anxiety-like behaviors and circulating glucocorticoids in male and female mice. Endocrinology. 2020. 161(11): bqaa163.
Fridmanis D., Roga A., Klovins J. ACTH receptor (MC2R) specificity: what do we know about underlying molecular mechanisms? Front. Endocrinol. (Lausanne). 2017. 8: 13.
Gallo-Payet N., Martinez A., Lacroix A. Editorial: ACTH Action in the Adrenal Cortex: From Molecular Biology to Pathophysiology. Front Endocrinol (Lausanne). 2017. 8: 101.
Gantz I., Fong T.M. The melanocortin system. Am. J. Physiol. Endocrinol. Metab. 2003. 284: E468–E474.
Ghaddhab C., Vuissoz J.M., Deladoëy J. From Bioinactive ACTH to ACTH Antagonist: The Clinical Perspective. Front. Endocrinol. 2017. 8: 17.
Kolomin T., Shadrina M., Andreeva L., Slominsky P., Limborska S., Myasoedov N. Expression of inflammation-related genes in mouse spleen under tuftsin analog Selank. Regul. Pept. 2011. 170(1–3): 18–23.
Kovalitskaya Y.A., Zolotarev Y.A., Kolobov A.A., Sadovnikov V.B., Yurovsky V.V., Navolotskaya E.V. Interaction of ACTH synthetic fragments with rat adrenal cortex membranes. J. Pept. Sci. 2007. 13(8): 513–518.
Kutiyanawalla A., Terry A.V. Jr., Pillai A. Cysteamine attenuates the decreases in TrkB protein levels and the anxiety/depression-like behaviors in mice induced by corticosterone treatment. PLoS One. 2011. 6(10): e26153.
O’Connor T.M., O’Halloran D.J., Shanahan F. The stress response and the hypothalamic-pituitary-adrenal axis: from molecule to melancholia. Q.J.M. 2000. 93(6): 323–333.
Pijlman F.T., van Ree J.M. Physical but not emotional stress induces a delay in behavioural coping responses in rats. Behav. Brain Res. 2002. 136(2): 365–373.
Raffin-Sanson M.L., de Keyzer Y., Bertagna X. Proopiomelanocortin, a polypeptide precursor with multiple functions: From physiology to pathological conditions. Eur J Endocrinol. 2003. 149: 79–90.
Schwabe L., Memory under stress: from single systems to network changes. Eur J Neurosci. 2017. 45(4): 478–489.
Starowicz K., Przewlocka B. The role of melanocortins and their receptors in inflammatory processes, nerve regeneration and nociception. Life Sci. 2003. 73(7): 823–847.
Uchiyama S., Yoshihara K., Kawanabe R., Hatada I., Koga K., Tsuda M. Stress-induced antinociception to noxious heat requires α1A-adrenaline receptors of spinal inhibitory neurons in mice. Mol. Brain. 2022. 15(1): 6.
Yang Y., Harmon C.M. Molecular determinants of ACTH receptor for ligand selectivity. Mol Cell Endocrinol. 2020. 503: 110688
Zhang W.J., Cao W.Y., Huang Y.Q., Cui Y.H., Tu B.X., Wang L.F., Zou G.J., Liu Y., Hu Z.L., Hu R., Li C.Q., Xing X.W., Li F. The Role of miR-150 in stress-induced anxiety-like behavior in mice. Neurotox. Res. 2019. 35(1): 160–172.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


