Журнал высшей нервной деятельности им. И.П. Павлова, 2022, T. 72, № 3, стр. 360-369
Скорость обработки гиппокампом контекстуальной информации связана с ее конгруэнтностью ранее сформированным схемам
А. Н. Воробьева 1, 2, *, Т. Феделе 2, Э. Ф. Павоне 3, Й. Зарнтайн 4, Л. Имбах 5, М. Феурра 1, 2
1 Центр нейроэкономики и когнитивных исследований, Институт когнитивных нейронаук,
Национальный исследовательский университет “Высшая школа экономики”
Москва, Россия
2 Национальный исследовательский университет “Высшая школа экономики”
Москва, Россия
3 Braintrends Ltd.
Рим, Италия
4 Университетский госпиталь Цюриха
Цюрих, Швейцария
5 Цюрихский университет
Цюрих, Швейцария
* E-mail: alicianunez.v@gmail.com
Поступила в редакцию 16.07.2021
После доработки 17.12.2021
Принята к публикации 20.12.2021
- EDN: JSUFFQ
- DOI: 10.31857/S0044467722030108
Аннотация
Одним из важнейших механизмов, обеспечивающих гибкую регуляцию поведения, является способность сличать и интегрировать имеющуюся у субъекта информацию о мире с информацией, постоянно поступающей извне. В настоящей работе мы с помощью стереоэлектроэнцефалографии регистрировали гиппокампальный локальный полевой потенциал у испытуемых, выполнявших задачу на оценку конгруэнтности пар стимулов “предмет–контекст”. Мы показали, что гиппокамп вовлечен в обработку информации о конгруэнтности предмета контексту. Обработка информации, конгруэнтной cформированному ранее семантическому знанию, сопровождается более ранней активацией гиппокампа по сравнению с обработкой информации, требующей установления новых ассоциативных связей.
ВВЕДЕНИЕ
Семантическое знание, представленное различными структурами, такими как схемы, закономерности, образы, сценарии типичных ситуаций и др. (Ghosh, Gilboa, 2014; Gilboa, Marlatte, 2017), формируется путем обобщения множества эпизодов. С другой стороны, эпизодическая память как конструктивный процесс опирается на семантические структуры, играющие роль опор для кодирования информации, консолидации и целенаправленного припоминания (Anderson, 2018; Bartlett, Burt, 1933; Fernández, Morris, 2018; Пиаже, 2003). Согласно теории, предложенной van Kesteren, конгруэнтность входящей информации сформированному ранее семантическому знанию способствует ее обработке; это выражается в более эффективном запоминании, консолидации и воспроизведении информации (Frank et al., 2018; van Kesteren et al., 2012). В свою очередь, реактивация может изменять нейронные корреляты эпизодических воспоминаний, при этом сами воспоминания становятся более схематичными и стереотипными (van der Linden et al., 2017; Nadel et al., 2007). Таким образом, системы семантической и эпизодической памяти находятся в постоянном реципрокном динамическом взаимодействии.
Современные теории организации памяти, в противовес теории множественных систем, основываются на представлениях об ассоциативном научении в том смысле, что декларативная память вообще связана с установлением взаимосвязей между репрезентациями (Morris, 2006). В последнее время идут споры о механизмах формирования ассоциаций. Известно, что гиппокамп связан с памятью вообще и формированием ассоциаций в частности (Eichenbaum, 2017; Tonegawa et al., 2018; Ивашкина и др., 2020). С другой стороны, есть многочисленные свидетельства того, что формирование простых конъюнкций не требует участия гиппокампа, как у человека, так и у животных. Действительно, еще Корсаковым, а впоследствии и Milner было замечено, что пациенты с поражениями гиппокампа способны формировать простые ассоциации (Milner et al., 1968; Корсаков, 1998). Morris, основываясь на многочисленных исследованиях на животных моделях, высказывает предположение, что участие гиппокампа необходимо при взаимодействии с ситуациями “предсказуемой неоднозначности”, то есть случаев, когда один и тот же стимул стабильно имеет различные значения в зависимости от контекста, причем его участие не ограничивается процессами научения, но включает в себя также модуляцию процессов внимания, регуляции поведения и стратегического поиска информации в памяти (Morris, 2006).
Однако результаты, полученные на животных моделях, не позволяют делать выводы об устройстве памяти человека в связи с ее специфическими особенностями. Различия в организации памяти человека и животных связаны с особенностями их эволюционного развития (Murray et al., 2018) и обнаруживаются как на физиологическом (Mohan et al., 2015; Molnár et al., 2008; Strange et al., 2014), так и на психологическом уровнях: для эпизодической памяти человека, в отличие от квазиэпизодической памяти животных, характерны языковая организация (Леонтьев, 2003) и автопоэзис (Tulving, 1972). Основные источники данных о функциях гиппокампа у человека – нейропсихологические исследования гиппокампальных поражений и нейровизуализационные исследования – имеют ряд ограничений. Метод СЭЭГ имеет миллиметровое пространственное и миллисекундное временное разрешение в отличие от таких распространенных методов нейровизуализации, как электро/магнитоэнцефалография (ЭЭГ/МЭГ) и функциональная магнитно-резонансная томография (фМРТ), имеющих ограниченное пространственное либо временное разрешение соответственно. В отличие от фМРТ, фиксирующей гемодинамические изменения в мозге, вызванные нейронной активностью, метод СЭЭГ регистрирует непосредственные изменения самой этой активности (Buzsáki et al., 2012). В свою очередь, по сравнению со скальповой ЭЭГ и МЭГ, СЭЭГ обладает более высоким соотношением сигнала и шума и позволяет с высокой точностью локализовать источники регистрируемой активности. Таким образом, СЭЭГ частично снимает ограничения неинвазивных методов, позволяя получать высокоточные данные о пространственно-временной динамике нейронной активности. В последнее время существенный вклад в понимание этих функций вносят исследования, выполненные с помощью метода стереотаксической электроэнцефалографии (СЭЭГ) (Parvizi, Kastner, 2018; Youngerman et al., 2019). Данный метод предполагает участие пациентов с имплантированными стереотаксическими электродами в рамках терапии или предоперационного обследования по поводу различных неврологических заболеваний. Этот метод позволяет регистрировать активность глубинных структур мозга (таких как гиппокамп, миндалевидное тело, прилежащее ядро и др.) с высоким временным и пространственным разрешением, недоступным при помощи других методов.
Наcтоящее исследование нацелено на уточнение особенностей такой важной функции гиппокампа человека, как установление взаимоотношений между репрезентациями объектов (процесс, связанный с обработкой воспринимаемых здесь и сейчас стимулов) на основе их контекстуальной близости (то есть основанной на ранее сформированных знаниях). Мы предположили, что гиппокампальный вызванный ответ (ВО) при обработке существующих, знакомых человеку ассоциаций, будет отличаться от случаев, когда ассоциацию требуется установить впервые.
МЕТОДИКА
Участники исследования
В исследовании приняли участие 6 немецкоязычных пациентов (5 женщин, средний возраст – 31 год, все правши), проходящих суточный инвазивный СЭЭГ-мониторинг. Исследование проводилось до хирургического вмешательства по поводу фармакорезистентной эпилепсии, в результате которой в ряде случаев производится резекция гиппокампа. СЭЭГ-мониторинг и сбор данных осуществлялись в Университетском госпитале Цюриха, Швейцария. В ходе предоперационного СЭЭГ-мониторинга пациенты получали леветирацетам, ламотриджин, бриварацетам и лакосамид в дозировках, определенных лечащим врачом. Все пациенты проходили детальное до- и послеоперационное нейропсихологическое обследование, включавшее в том числе оценку общих когнитивных способностей (IQ), внимания и когнитивного контроля (тестов Go/NoGo и Струпа), а также памяти (тесты вербального (VLMT) и зрительного (RDVLT) научения) и речевой продукции. Для участия в исследовании были отобраны только те пациенты, чей уровень по всем измеренным нейропсихологическим показателям был средним или выше среднего.
Регистрация СЭЭГ осуществлялась при помощи записывающей системы ATLAS (Neuralynx, www.neuralynx.com) с частотой дискретизации 4 кГц и встроенным полосовым фильтром 0.5–1000 Гц с использованием СЭЭГ-электродов AD-Tech (AD-Tech, www.adtechmedical.com) диаметром 1.3 мм. На каждом электроде были расположены 8 записывающих контактов длиной 1.6 мм. Расположение электродов определялось путем сопоставления предоперационного МРТ-изображения с постоперационным КТ-изображением и вручную размечалось хирургом в нативном пространстве МРТ-изображения пациента (iPlan Stereotaxy 3.0, Brainlab, Germany). Для настоящего исследования были отобраны только электроды, находящиеся в гиппокампе (всего 25 контактов, расположенных на 13 электродах, см. рис. 1 (а) и 1 (б)). Пример расположения стереотаксического электрода показан на рис. 1 (в). Все пациенты имели нормальное или скорректированное зрение и подписали информированное согласие на участие в исследовании, протокол которого был одобрен локальным этическим комитетом (номер протокола PB 2016-02055).
Рис. 1.
(а) Контакты, вошедшие в анализ (n = 25) в левом и правом полушариях, нанесенные на шаблон MNI, в проекции на сагиттальный срез мозга. (б) Количество электродов и контактов, вошедших в анализ. (в) Пример расположения стереотаксического электрода на корональном срезе мозга. На рисунке показано постоперационное КТ-изображение мозга пациента, совмещенное с предоперационным МРТ-изображением. Контакты, расположенные в гиппокампе, обведены кружком. (г) Дизайн поведенческой задачи.
Fig. 1. (а) Contacts selected for the analysis (n = 25) in the left and right hemispheres, mapped onto the MNI template, projected on the sagittal view. (б) Number of electrodes and contacts per patient selected for the analysis. (в) An example of a stereoEEG electrode position on the coronal brain view. The figure shows post-operative CT image co-registered to the pre-operative MRI image. Contacts localized in the hippocampus are marked with circle. (г) Behavioral task design.
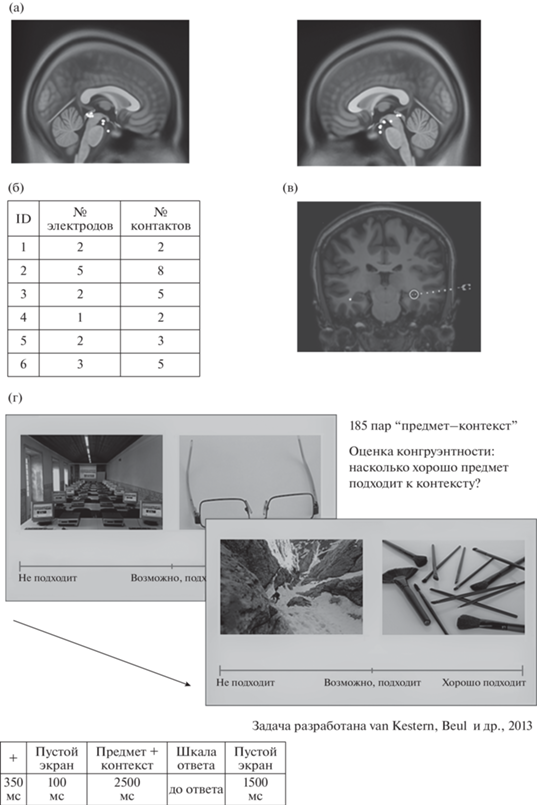
Дизайн и процедура исследования
В исследовании использовалась видоизмененная экспериментальная модель, спланированная и использованная в исследовании van Kesteren и соавт. (2013), которые также любезно предоставили набор стимулов для эксперимента. Набор состоял из 185 пар картинок (“предмет–контекст”). Каждая пара картинок была уникальной, то есть предъявлялась испытуемому только один раз. Пары были составлены таким образом, что 10% из них были “конгруэнтными” (например, “книга–библиотека”), 80% – “средней конгруэнтности” (например, “беруши–гостиная”) и 10% – “неконгруэнтными” (например, “мяч–лаборатория”).
Участники получали инструкцию оценить набор пар “предмет–контекст” по степени их “конгруэнтности”: “насколько хорошо этот предмет подходит к контексту; насколько вероятно увидеть такой предмет в таком контексте в реальной жизни”? В ходе каждой пробы испытуемому предъявлялись фиксационный крест на 350 мс, затем пустой экран в течение 100 мс. После этого одновременно предъявлялась пара картинок (“предмет–контекст”) на 2500 мс. Затем после предъявления пустого экрана в течение еще 100 мс предъявлялась зрительная аналоговая шкала, по которой испытуемые при помощи компьютерной мыши должны были отметить конгруэнтность каждой пары от “совсем не подходит” до “очень хорошо подходит”. Затем снова предъявлялся пустой экран в течение 1500 мс, после чего начиналась следующая проба. Зрительная аналоговая шкала представляла собой 100-балльную шкалу, зрительно воспринимавшуюся как непрерывная. Таким образом, испытуемый оценивал конгруэнтность каждой пары по 100-балльной шкале. Далее все пары стимулов были распределены по трем группам, согласно ответам испытуемых: “Неконгруэнтные” (с оценкой от 0 до 33 баллов), “Средние” (от 34 до 66 баллов) и “Конгруэнтные” (67–100 баллов). Предъявление стимулов и регистрация ответов испытуемых осуществлялась с помощью программы E-Prime 2.0.10.147 (Psychology Software Tools, Pittsburgh, PA). Дизайн поведенческой задачи показан на рис. 1 (г).
Обработка данных
Статистическая обработка поведенческих и СЭЭГ-данных выполнялась в среде программирования MatLab (версия R2017b) c использованием оригинальных скриптов и специализированных тулбоксов, находящихся в открытом доступе. Для проверки гипотезы о том, что 3 группы стимулов (“Конгруэнтные”, “Средние” и “Неконгруэнтные”) не различаются значимо по их количеству, использовался однофакторный дисперсионный анализ с фактором “Конгруэнтность”. Предварительная обработка СЭЭГ выполнялась с помощью тулбокса Brainstorm, версия 21-Jun-2021 (Tadel et al., 2011) (http://neuroimage.usc.edu/brainstorm). Частота дискретизации исходного сигнала была понижена до 200 Гц с помощью алгоритма каскадного ресэмплинга (resample-cascade). При записи общий референтный электрод располагался в белом веществе головного мозга. При последующем анализе в качестве референтного использовался общий усредненный потенциал от всех отведений. Далее СЭЭГ-данные проверялись визуально на наличие эпилептических разрядов и других артефактов, вызванных электростатическими разрядами, наводкой от медицинского или другого оборудования, а также движениями пациента (например, при смене позы или положения головы), при которых нарушался контакт электродов с входной коробкой электроэнцефалографа. Пробы и каналы, содержащие артефакты, были исключены из дальнейшего анализа, в окончательный анализ вошли 25 каналов и 73% проб. Затем запись была разбита на привязанные к стимулу эпохи от –2000 до 3000 мс с момента предъявления стимула. Пробы, записанные с каждого отведения каждого пациента, были объединены и включены в дальнейший анализ как принадлежащие одному “псевдопациенту”.
Дальнейший анализ СЭЭГ-данных выполняли в тулбоксе FieldTrip (Oostenveld et al., 2011; http://fieldtriptoolbox.org). Значения амплитуд локального полевого потенциала в пробах, соответствующих каждому экспериментальному условию, скорректировали на среднюю величину предстимульной активности (от –1500 до –100 мс) и усреднили в диапазоне от 0 до 2000 мс от предъявления стимула. Для расчета ВО использовали абсолютные значения амплитуд, так как при объединении данных от нескольких испытуемых невозможно установить положение источника сигнала по отношению к каждому из контактов. Выбор временного окна в 2000 мс был сделан, чтобы зарегистрировать как ранние, так и поздние гиппокампальные компоненты ВО, описанные в предыдущих исследованиях (Staresina et al., 2012). Для попарных сравнений между экспериментальными условиями использовали t-критерий Стьюдента для независимых выборок. Для выявления значимых различий между экспериментальными условиями применялся метод Монте-Карло с 500 пермутациями. Уровень значимости для всех тестов составлял p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Поведенческие результаты
Однофакторный дисперсионный анализ с фактором “Конгруэнтность” не выявил значимых различий в количестве стимулов, отнесенных испытуемыми к каждой из трех категорий: F (2, 15) = 0.87, p > 0.05. Однофакторный дисперсионный анализ с фактором “Конгруэнтность” не выявил значимых различий в количестве стимулов, вошедших в анализ после препроцессинга, в каждой из трех категорий: F (2, 15) = 1.43, p > 0.05. Количество проб в каждой категории, полученное после совмещения данных всех испытуемых, а также количество проб, вошедших в анализ после препроцессинга, показаны на рис. 2 (а).
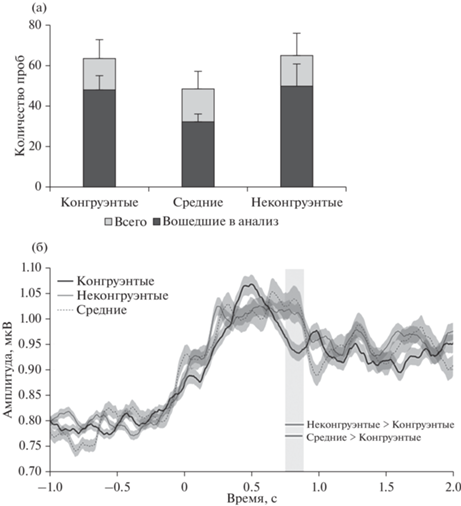
Рис. 2.
(а) Среднее количество стимулов в трех группах по степени конгруэнтности, согласно ответам испытуемых. Планки погрешностей обозначают стандартную ошибку среднего (SEM). (б) Усредненные абсолютные значения амплитуд локального полевого потенциала для каждой группы стимулов. Сигнал сглажен с временным окном 100 мс. Затененные области вокруг кривых показывают стандартную ошибку среднего (SEM). Горизонтальные полосы под графиком показывают временные промежутки, в которых абсолютное значение амплитуды для “конгруэнтных” стимулов было значимо (р < 0.05) ниже амплитуды для “неконгруэнтных” и “средних” стимулов. На графике уровень предстимульной активности не равен нулю, так как используются усредненные абсолютные значения амплитуды.
Fig. 2. (а) Mean number of stimuli in each of three congruency bins, according to the patients’ responses. Error bars depict standard error of mean (SEM). (б) Mean rectified local field potential (LFP) in each congruency bin. The signal is smoothed with 100 ms time window. Shaded areas depict standard error of mean (SEM). Colored bars under the plot show time windows where the LFP amplitude for the congruent items was significantly lower than the one for incongruent and medium items. Note that pre-stimulus activity on the plot is above zero, since the signal was rectified.
Вызванные ответы
Непараметрический пермутационный тест показал наличие значимых различий между абсолютными величинами амплитуд вызванного ответа при восприятии “Конгруэнтных” стимулов по сравнению со “Средними” и “Неконгруэнтными’ между 750 и 900 мс после предъявления стимулов, причем амплитуда сигнала в двух последних экспериментальных условиях (“Неконгруэнтные” и “Средние”) была значимо выше, чем в первом (“Конгруэнтные”). Формы сигнала и стандартные ошибки среднего для каждого экспериментального условия, а также временные интервалы, в которых обнаружены значимые различия между условиями, показаны на рис. 2 (б). При этом легко видеть, что пик вызванного ответа (около 500 мс) при обработке “конгруэнтных” пар “предмет–контекст” достигает максимального значения на 150 мс раньше, чем при обработке “средних” и “неконгруэнтных” пар. Таким образом, поздние компоненты ВО имеют сходную форму, но различаются своей латентностью.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящей работе изучалась вызванная активность гиппокампа при обработке стимулов (пар “предмет–контекст”) разной степени конгруэнтности. Исследование проводилось с помощью метода СЭЭГ, позволяющего получать уникальные данные о гиппокампальной активности человека с высоким пространственным и временным разрешением. Насколько нам известно, в настоящем исследовании были впервые получены прямые электрофизиологические данные, свидетельствующие о вовлечении человеческого гиппокампа в обработку информации о конгруэнтности объекта контексту.
Ключевая роль гиппокампа в формировании ассоциативной памяти показана в многочисленных исследованиях как на животных моделях, так и на людях (Eichenbaum, 2017; Торопова и др., 2018). Считается, что повышение амплитуды вызванного ответа связано с локальной синхронизацией нейронной активности и отражает вовлеченность источника данной активности в изучаемый сенсорный или когнитивный процесс (Köster et al., 2018; Luo, Guan, 2018; Xia, Hu, 2019). Поздние компоненты вызванного ответа для “конгруэнтных” пар “предмет–контекст” имеют значимо более низкую амплитуду, чем для “средних” и “неконгруэнтных” пар, в диапазоне от 750 до 900 мс.
Многочисленные исследования показывают, что когнитивная обработка информации начинается по меньшей мере уже после 300 мс (Cohen et al., 2007; Sutton et al., 1965; Yaple et al., 2018), хотя источники и механизмы возникновения этого компонента могут различаться (Li et al., 2019; Polich, 2007). Таким образом, время манифестации этих компонентов соответствует срокам сознательной обработки информации.
В одном из первых исследований ЭЭГ-коррелятов обработки конгруэнтности информации было показано, что поздние компоненты ВО связаны с восприятием физически или семантически отклоняющейся информации, что, предположительно, отражает процесс ее повторной обработки (Kutas, Hillyard, 1980). Более современные исследования также указывают, что поздние негативные компоненты ВО связаны с обработкой и интеграцией сложной информации (Morett et al., 2020). Так, в исследовании Bermúdez-Margaretto и соавт. было показано, что амплитуда компонента N400 снижается в ходе повторных предъявлений псевдослов, ассоциированных с определенным значением (Bermúdez-Margaretto et al., 2018). Выраженность поздних позитивных компонентов также связана с повторным предъявлением уже знакомых стимулов в отличие от новых стимулов (Van Strien et al., 2005). Таким образом, можно сделать вывод о том, что “конгруэнтные” пары обрабатываются гиппокампом в ускоренном режиме, тогда как стимулы, предъявленные с непривычным контекстом и требующие установления новой ассоциативной связи, требуют и более длительного времени для обработки. Предположительно, эта обработка отражается в появлении устойчивой активности в диапазоне от 300 до 600 мс для “средних” и “неконгруэнтных” пар стимулов.
В исследовании van Kesteren и соавт. (2013) было показано, что обработка “конгруэнтных” пар стимулов сопровождается повышением BOLD-активности в медиальной префронтальной коре, тогда как активность гиппокампа связана с обработкой “неконгруэнтных” стимулов. Предполагается, что в то время как гиппокамп “вслепую” связывает признаки между собой, медиальная префронтальная кора, а также левая нижняя лобная и угловая извилины посредством нисходящего воздействия могут ускорять процесс формирования ассоциативных связей в гиппокампе, если они укладываются в уже существующие структуры семантического знания, такие как схемы (Davis et al., 2020; van der Linden et al., 2017; Vogel et al., 2018). Наконец, последующее устойчивое позднее (в диапазоне от 1000 мс до конца эпохи) отклонение сигнала, предположительно, связано с кодированием информации в эпизодическую память.
Эпизодическая система человека и квазиэпизодическая система животных включают память о вещах, которые имели место в конкретном, то есть достаточно сложном контексте (времени и пространстве) (Buzsáki, Llinás, 2017; Stark et al., 2018). Функция гиппокампа тесно связана с контекстуальной памятью, в частности с памятью на пространственный и временной контекст (Buzsáki, Tingley, 2018; Lisman et al., 2017). Примечательно, что пространственная навигация и формирование пространственной эпизодической памяти обеспечивается активностью различных участков гиппокампа (Miller et al., 2018; Strange et al., 2014). В связи с этим можно предположить, что гиппокамп вовлечен в формирование поля значений и оперирование системой сложных ассоциаций, связанных с той или иной репрезентацией. При этом сами репрезентации могут храниться в областях коры, прилежащих к гиппокампу (парагиппокампальной (Staresina et al., 2012), энторинальной (Staresina et al., 2019), периринальной (Staresina et al., 2013)). Таким образом обеспечивается распознавание информации, даже если она появляется в ситуации, отличной от той, где была встречена впервые. Предполагается, что роль гиппокампа в данном процессе – быстрое разделение сходных паттернов для повышения эффективности их последующей обработки корой головного мозга (O’Reilly, Rudy, 2001).
К ограничениям настоящего исследования относятся невысокий размер выборки, ее клинический статус и отсутствие анализа активности других областей мозга. Низкий размер выборки связан с ограниченным доступом к пациентам с имплантированными стереотаксическими электродами, а также низкой пропускной способностью хирургических центров (Youngerman et al., 2019). При этом сигнал, который регистрируют интракраниальные электроды, обладает гораздо более высоким соотношением сигнала к шуму, чем скальповая ЭЭГ, что делает возможным проведение исследований на меньших выборках. Исследования, проведенные на выборках аналогичного размера, позволяют получать достоверные данные, верифицируемые при помощи других методов нейровизуализации, что подтверждается публикациями в ведущих международных научных изданиях (Axmacher et al., 2010; Axmacher et al., 2009; Cohen et al., 2007; Staresina et al., 2012; Staresina et al., 2013). Клинический статус испытуемых, в свою очередь, накладывает ряд ограничений на возможности интерпретации и экстраполяции данных. Однако, как указано выше, полученные нами результаты соотносятся с результатами других исследований, выполненных с применением методов нейровизуализации на человеке и инвазивных методов на животных моделях. Кроме того, интерпретацию вызванных ответов затрудняет отсутствие информации о полярности сигнала, поэтому при интерпретации этих данных приходится полагаться на латентность и различие в амплитуде компонентов ВО.
Наконец, еще одним из ограничений метода СЭЭГ является неполнота пространственного охвата мозга (Parvizi, Kastner, 2018). Это связано с установкой электродов в соответствии со схемой имплантации, определенной врачами в клинических целях. Одним из потенциальных направлений дальнейшей работы является проведение подобного исследования на выборке пациентов с более обширными схемами имплантации, что позволило бы не только оценить вовлеченность других областей мозга (в первую очередь прилежащих к гиппокампу участков медиальной височной коры, а также префронтальной и теменной коры), но и оценить временную динамику этой вовлеченности и функциональную связность между областями интереса. В тех же целях возможно проведение исследования с совместным использованием СЭЭГ и скальповой ЭЭГ. Кроме того, такое исследование позволило бы сравнить результаты скальповой ЭЭГ, полученные на пациентах, с аналогичными данными здоровых испытуемых.
ВЫВОДЫ
1. Прямая регистрация электрофизиологической активности гиппокампа человека указывает на вовлеченность гиппокампа в когнитивную обработку сложной контекстуальной информации, как конгруэнтной, так и неконгруэнтной ранее сформированному семантическому знанию.
2. Обработка информации, конгруэнтной cформированному ранее семантическому знанию, сопровождается более ранней активацией гиппокампа по сравнению с обработкой информации, требующей установления новых ассоциативных связей.
Список литературы
Ивашкина О.И., Торопова К.А., Рощина М.А., Анохин К.В. Формирование и извлечение ассоциативной памяти на комплексный сигнал у мышей: специфическое участие нейронов области CA1 гиппокампа. Журнал высшей нервной деятельности им. И. П. Павлова. 2020. 70 (3): 326–340.
Корсаков С.С. Медико-психологическое исследование одной формы болезни памяти. Психология памяти. Хрестоматия. Под ред. Гиппенрейтер Ю. Б., Романова В. Я. М.: ЧеРо, 1998. С. 62–75.
Леонтьев А. Н. Развитие памяти: экспериментальное исследование развития высших психологических функций. Становление психологии деятельности: Ранние работы. Под ред. Леонтьева А.А., Леонтьева Д.А., Соколовой Е.Е. М.: Смысл, 2003. С. 27–199.
Пиаже Ж. Психология интеллекта. СПб.: Питер, 2003 г. 78 с.
Торопова К.А., Трошев Д.В., Ивашкина О.И., Анохин К.В. Активация экспрессии c-fos в ретросплениальной коре, но не гиппокампе, сопровождает формирование ассоциации между обстановкой и безусловным стимулом и ее последующее извлечение у мышей. Журнал высшей нервной деятельности им. И.П. Павлова. 2018. 68 (6): 759–774.
Anderson R.C. Role of the Reader’s Schema in Comprehension, Learning, and Memory. Theoretical Models and Processes of Literacy. Ed. Alvermann D.E., Unrau N.J., Ruddell R.B. New York: Routledge, 2018. 136–145 pp.
Axmacher N., Cohen M.X., Fell J., Haupt S., Dümpelmann M., Elger C.E., Schlaepfer T.E., Lenartz D., Sturm V., Ranganath C. Intracranial EEG Correlates of Expectancy and Memory Formation in the Human Hippocampus and Nucleus Accumbens. Neuron. 2010. 65 (4): 541–549.
Axmacher N., Elger C.E., Fell J. Working memory-related hippocampal deactivation interferes with long-term memory formation. J. Neurosci. 2009. 29 (4): 1052–1060.
Bartlett F.C., Burt C. Remembering: a study in experimental and social psychology. Br. J. Educ. Psychol. 1933. 3 (2): 187–192.
Bermúdez-Margaretto B., Beltrán D., Cuetos F., Domínguez A. Brain signatures of new (pseudo-) words: Visual repetition in associative and non-associative contexts. Front. Hum. Neurosci. 2018. 12: 354.
Buzsáki G., Anastassiou C.A., Koch C. The origin of extracellular fields and currents-EEG, ECoG, LFP and spikes. Nat. Rev. Neurosci. 2012. 13 (6): 407–420.
Buzsáki G., Llinás R. Space and time in the brain. Science. 2017. 358 (6362): 482–485.
Buzsáki G., Tingley D. Space and Time: The Hippocampus as a Sequence Generator. Trends Cogn. Sci. 2018. 22 (10): 853–869.
Cohen M.X., Elger C.E., Ranganath C. Reward expectation modulates feedback-related negativity and EEG spectra. Neuroimage. 2007. 35 (2): 968–978.
Davis C.P., Altmann G.T.M., Yee E. Situational systematicity: A role for schema in understanding the differences between abstract and concrete concepts. Cogn. Neuropsychol. 2020. 37 (1–2): 142–153.
Eichenbaum H. Memory: Organization and Control. Annu. Rev. Psychol. 2017. 68 (1): 19–45.
Fernández G., Morris R.G.M. Memory, Novelty and Prior Knowledge. Trends Neurosci. 2018. 41 (10): 654–659.
Frank D., Montaldi D., Wittmann B., Talmi D. Beneficial and detrimental effects of schema incongruence on memory for contextual events. Learn. Mem. 2018. 25 (8): 352–360.
Ghosh V.E., Gilboa A. What is a memory schema? A historical perspective on current neuroscience literature. Neuropsychologia. 2014. 53 (1): 104–114.
Gilboa A., Marlatte H. Neurobiology of Schemas and Schema-Mediated Memory. Trends Cogn. Sci. 2017. 21 (8): 618–631.
Köster M., Finger H., Graetz S., Kater M., Gruber T. Theta-gamma coupling binds visual perceptual features in an associative memory task. Sci. Rep. 2018. 8 (1): 1–9.
Kutas M., Hillyard S.A. Reading between the lines: Event-related brain potentials during natural sentence processing. Brain Lang. 1980. 11 (2): 354–373.
Li F., Yi C., Jiang Y., Liao Y., Si Y., Dai J., Yao D., Zhang Y., Xu P. Different Contexts in the Oddball Paradigm Induce Distinct Brain Networks in Generating the P300. Front. Hum. Neurosci. 2019. 12 (January): 1–10.
Lisman J., Buzsáki G., Eichenbaum H., Nadel L., Ranganath C., Redish A.D. Viewpoints: How the hippocampus contributes to memory, navigation and cognition. Nat. Neurosci. 2017. 20 (11): 1434–1447.
Luo W., Guan J.-S. Do Brain Oscillations Orchestrate Memory? Brain Sci. Adv. 2018. 4 (1): 16–33.
Miller J., Watrous A. J., Tsitsiklis M., Lee S.A., Sheth S.A., Schevon C.A., Smith E.H., Sperling M.R., Sharan A., Asadi-Pooya A.A., Worrell G.A., Meisenhelter S., Inman C.S., Davis K.A., Lega B., Wanda P.A., Das S.R., Stein J.M., Gorniak R., Jacobs, J. Lateralized hippocampal oscillations underlie distinct aspects of human spatial memory and navigation. Nat. Commun. 2018. 9 (1): 2423.
Milner B., Corkin S., Teuber H.-L. Further analysis of the hippocampal amnesic syndrome: 14-year follow-up study of HM. Neuropsychologia. 1968. 6 (3): 215–234.
Mohan H., Verhoog M.B., Doreswamy K.K., Eyal G., Aardse R., Lodder B.N., Goriounova N.A., Asamoah B., Brakspear A.B.C.B., Groot C., van der Sluis S., Testa-Silva G., Obermayer J., Boudewijns Z.S.R.M., Narayanan R.T., Baayen J.C., Segev I., Mansvelder H.D., de Kock C.P. Dendritic and Axonal Architecture of Individual Pyramidal Neurons across Layers of Adult Human Neocortex. Cereb. Cortex. 2015. 25 (12): 4839–4853.
Molnár G., Oláh S., Komlósi G., Füle M., Szabadics J., Varga C., Barzó P., Tamás G. Complex events initiated by individual spikes in the human cerebral cortex. PLoS Biol. 2008. 6 (9): 1842–1849.
Morett L.M., Landi N., Irwin J., McPartland J.C. N400 amplitude, latency, and variability reflect temporal integration of beat gesture and pitch accent during language processing. Brain Res. 2020. 1747 (August): 147059.
Morris R.G.M. Theories of hippocampal function. The Hippocampus Book. Ed. Andersen P., Morris R., Amaral D., Bliss T., O’Keefe J. Oxford, UK: Oxford University Press, 2006. 581–713 pp.
Murray E.A., Wise S.P., Graham K.S. Representational specializations of the hippocampus in phylogenetic perspective. Neurosci. Lett. 2018. 680: 4–12.
Nadel L., Campbell J., Ryan L. Autobiographical Memory Retrieval and Hippocampal Activation as a Function of Repetition and the Passage of Time. Neural Plast. 2007. 2007: 1–14.
O’Reilly R.C., Rudy J.W. Conjunctive representations in learning and memory: Principles of cortical and hippocampal function. Psychol. Rev. 2001. 108 (2): 311–345.
Oostenveld R., Fries P., Maris E., Schoffelen J.-M. FieldTrip: Open Source Software for Advanced Analysis of MEG, EEG, and Invasive Electrophysiological Data. Comput. Intell. Neurosci. 2011. 2011: 1–9.
Parvizi J., Kastner S. Promises and limitations of human intracranial electroencephalography. Nat. Neurosci. 2018. 21 (4): 474–483.
Polich J. Updating P300: an integrative theory of P3a and P3b. Clin. Neurophysiol. 2007. 118 (10): 2128–2148.
Staresina B.P., Fell J., Lam A.T.A. Do, Axmacher N., Henson R.N. Memory signals are temporally dissociated in and across human hippocampus and perirhinal cortex. Nat. Neurosci. 2012. 15 (8): 1167–1173.
Staresina B.P., Fell J., Dunn J.C., Axmacher N., Henson R.N. Using state-trace analysis to dissociate the functions of the human hippocampus and perirhinal cortex in recognition memory. Proc. Natl. Acad. Sci. 2013. 110 (8): 3119–3124.
Staresina B.P., Reber T.P., Niediek J., Boström J., Elger C.E., Mormann F. Recollection in the human hippocampal-entorhinal cell circuitry. Nat. Commun. 2019. 10 (1): 1503.
Stark S.M., Reagh Z.M., Yassa M.A., Stark C.E.L. What’s in a context? Cautions, limitations, and potential paths forward. Neurosci. Lett. 2018. 680: 77–87.
Strange B.A., Witter M.P., Lein E.S., Moser E.I. Functional organization of the hippocampal longitudinal axis. Nat. Rev. Neurosci. 2014. 15 (10): 655–669.
Sutton S., Braren M., Zubin J., John E.R. Evoked-Potential Correlates of Stimulus Uncertainty. Science (80-.) . 1965. 150 (3700): 1187–1188.
Tadel F., Baillet S., Mosher J.C., Pantazis D., Leahy R.M. Brainstorm: A user-friendly application for MEG/EEG analysis. Comput. Intell. Neurosci. 2011. 2011: 1–13.
Tonegawa S., Morrissey M.D., Kitamura T. The role of engram cells in the systems consolidation of memory. Nat. Rev. Neurosci. 2018. 19 (8): 485–498.
Tulving E. Episodic and semantic memory. Organization of memory. Ed. Tulving E., Donaldson W. NY: Academic Press, 1972. 381–403 pp.
van der Linden M., Berkers R.M.W.J., Morris R.G.M., Fernández G. Angular Gyrus Involvement at Encoding and Retrieval Is Associated with Durable But Less Specific Memories. J. Neurosci. 2017. 37 (39): 9474–9485.
van Kesteren M.T.R., Ruiter D.J., Fernández G., Henson R.N. How schema and novelty augment memory formation. Trends Neurosci. 2012. 35 (4): 211–219.
van Kesteren M.T.R., Beul S.F., Takashima A., Henson R.N., Ruiter D.J., Fernández G. Differential roles for medial prefrontal and medial temporal cortices in schema-dependent encoding: From congruent to incongruent. Neuropsychologia. 2013. 51 (12): 2352–2359.
Van Strien J.W., Hagenbeek R.E., Stam C.J., Rombouts S.A.R.B., Barkhof F. Changes in brain electrical activity during extended continuous word recognition. Neuroimage. 2005. 26 (3): 952–959.
Vogel S., Kluen L.M., Fernández G., Schwabe L. Stress leads to aberrant hippocampal involvement when processing schema-related information. Learn. Mem. 2018. 25 (1): 21–30.
Xia X., Hu L. EEG: Neural Basis and Measurement. EEG Signal Processing and Feature Extraction.Singapore: Springer Singapore, 2019. 7–21 pp.
Yaple Z., Shestakova A., Klucharev V. Feedback-related negativity reflects omission of monetary gains: Evidence from ERP gambling study. Neurosci. Lett. 2018. 686 (July): 145–149.
Youngerman B.E., Khan F.A., McKhann G.M. Stereoelectroencephalography in epilepsy, cognitive neurophysiology, and psychiatric disease: safety, efficacy, and place in therapy. Neuropsychiatr. Dis. Treat. 2019. 15: 1701–1716.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


