Журнал высшей нервной деятельности им. И.П. Павлова, 2022, T. 72, № 3, стр. 387-404
Мозговая организация рабочей памяти при отсроченном копировании ломаной линии: анализ потенциалов, связанных с императивным сигналом
А. В. Курганский 1, 2, *, Д. И. Ломакин 1, А. А. Корнеев 1, 3, Р. И. Мачинская 1
1 Институт возрастной физиологии, Российская академия образования
Москва, Россия
2 Российская академия народного хозяйства и государственной службы
Москва, Россия
3 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: akurg@yandex.ru
Поступила в редакцию 27.09.2021
После доработки 10.12.2021
Принята к публикации 20.12.2021
- EDN: DDRYOS
- DOI: 10.31857/S0044467722030066
Аннотация
Группа взрослых испытуемых решала задачу на рабочую память (РП), предполагающую отсроченное копирование (рисование) ломаной линии, заданной либо статически в виде рисунка, либо динамически — путем показа курсора, движущегося вдоль невидимого контура этой линии. Исследовалось совместное влияние режима предъявления траектории (статического и динамического) и длительности удержания репрезентации в РП (величины задержки императивного стимула) на потенциалы (ССП), связанные с подачей звукового сигнала. Анализировались 5 длиннолатентных корковых компонентов ССП: N100, P200, P250, P300 и N400. Показано, что амплитуда N100 статистически значимо больше при статическом предъявлении ломаной, чем при динамическом, но не зависит от длительности задержки. Амплитуда остальных компонентов, напротив, зависела от величины задержки, но не зависела от режима предъявления, при этом она была выше при более длительной задержке. Обсуждается возможность, что (1) более высокие значения амплитуды N100 при статическом предъявлении ломаной линии, чем при динамическом, обусловлены дополнительным вовлечением нисходящего контроля на относительно ранних стадиях извлечения информации из РП и/или тем, что (2) в сохранении репрезентации ломаной линии в РП участвуют разные зрительные сенсорно-специфические зоны в зависимости от режима предъявления, а в их активации в ответ на императивный звуковой сигнал принимают участие различные группы нейронов слуховой коры. Предполагается, что зависимость амплитуды компонентов P200, P250, P300 и N400 от времени удержания репрезентации ломаной в РП связана с преобразованием этой репрезентации от сенсорно-специфического к абстрактному формату, а также с подготовкой к последующему двигательному воспроизведению.
ВВЕДЕНИЕ
Концепция рабочей памяти (РП) является одной из центральных в нейрокогнитивной науке, и мозговые процессы, лежащие в ее основе, составляют предмет устойчивого интереса исследователей.
Способ хранения информации в РП – формат сохраняемых в ней кодов – зависит от сенсорной модальности входной информации: в популярной модели РП, предложенной почти полвека назад Бэддели и Хитчем (Baddeley, Hitch, 1974; Baddeley, 2012), для зрительно-пространственной и фонологической информации предусмотрены два раздельных специализированных хранилища (visuospatial sketchpad и phonological loop). Роль РП не ограничивается сохранением и преобразованием сенсорной информации. РП способна сохранять также моторную информацию (Jaroslawska et al., 2018) и более абстрактную информацию о серийном порядке – порядке элементов разной природы в их последовательности (Baddeley, 2012; Hurlstone et al., 2014). Даже в пределах одной сенсорной модальности характер сохраняемой в РП информации и мозговые процессы, отвечающие за ее кодирование и последующее использование, зависят от способа предъявления этой информации, от задачи и от того, как эта информация будет использована в дальнейшем (Alain et al., 2009; Yang et al., 2015; Absatova, Kurgansky, 2016).
Экспериментальные и теоретические работы последних лет указывают на то, что РП является подвижной динамической системой, в которой параллельно существующие и конкурирующие репрезентации эволюционируют во времени (Корнеев и др., 2016а; Chota, Van der Stigchel, 2020).
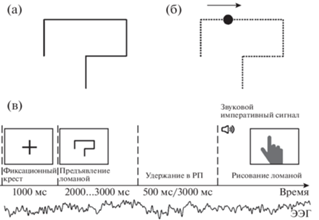
В наших предыдущих работах мы исследовали динамику сохраняемой в РП репрезентации последовательности движений, заданной статическим или динамическим зрительным образцом (Корнеев, Курганский, 2013, 2014а, 2014б; Корнеев и др., 2016а). Мы анализировали характеристики двигательного воспроизведения траектории (рисования ломаной линии), заданной в зрительной модальности либо статически в виде рисунка, либо динамически – движением по этой траектории (невидимой испытуемому) небольшого пятна (рис. 1). Для изучения процесса преобразования информации в РП – “динамики РП” – нами была использована парадигма задержанного воспроизведения траектории в ответ на предъявление императивного сигнала (ИС). Идея состояла в том, что с помощью ИС можно прозондировать характер сохраняемой в РП репрезентации и процессы ее преобразования в двигательный ответ, систематически варьируя момент предъявления ИС относительно момента окончания целевого стимула – величину задержки Td. Поскольку при разных значениях Td императивный сигнал задается одним и тем же стимулом и требует одного и того же двигательного ответа, любые систематические различия в характеристиках двигательного ответа, которые могут быть обнаружены при разных длительностях задержки Td, должны быть отнесены на счет изменений в формате сохраняемой в РП информации и/или процессов преобразования этой информации в двигательные команды. Выполненные в рамках этой парадигмы исследования показали, что латентный период двигательного ответа (воспроизведения ломаной линии в виде рисунка), характерная длительность движения и длительность остановки в вершинах ломаной, вообще говоря, различны при статическом и динамическом предъявлении ломаной. Оказалось, что такое различие в величине латентного времени максимально непосредственно после предъявления ломаной, убывает по мере увеличения задержки императивного сигнала и исчезает при Td более 3 сек.
Рис. 1.
Режимы предъявления стимулов и последовательность событий в одной экспериментальной пробе. (а) Типичная ломаная линия, предъявленная обычным образом в виде рисунка (статический режим предъявления, ST). (б) Эта же линия, заданная движением круглого пятна вдоль ее пяти сегментов (динамический режим предъявления, DN). (в) Последовательность событий в пробе: предъявление фиксационного крестика (1000 мс), предъявление ломаной линии (2000, 2500 или 3000 мс для ломаной, состоящей из 4, 5 или 6 сегментов), удержание следа ломаной (500 или 3000 мс), предъявление звукового императивного сигнала и двигательное воспроизведение запомненной ломаной (рисование кончиком указательного пальца) на сенсорном эране компьютера. В течение всей пробы регистрируется многоканальная ЭЭГ, схематически показанная в виде одного одноканального сигнала ниже оси времени.
Fig. 1. Stimuli presentation modes and the sequence of events in an experimental trial. (а) A typical broken line presented in a usual way as a line drawing; (б) the same broken line presented via showing a small spot moving along invisible segments of this line; (в) the sequence of events in a single trial comprise of (i) showing a fixation cross for 1000 ms, (ii) presenting broken line (2000, 2500 or 3000 ms for a broken line, containing 4, 5 or 6 segments, respectively), (iii) retention of the representation of the broken line in working memory (500 or 3000 ms), (iv) presentation of the auditory go signal, and (v) reproducing the retained broken line by drawing it with the index finger on the touchscreen surface. The multichannel EEG is recorded along entire trial. It is shown schematically as a single EEG trace below the time axis.
Отмеченные выше психометрические данные указывают на потенциальное различие в мозговых процессах, протекающих в РП на этапах занесения, удержания и извлечения информации при различных режимах предъявления траектории и различных величинах задержки. Для выявления характера этих процессов психометрических методов недостаточно; необходимо непосредственное исследование активности мозга. Первый шаг в этом направлении был предпринят в работе (Корнеев и др., 2016б). В этой работе анализировалось влияние времени задержки на корковые связанные с событием потенциалы (ССП), возникающие в ответ на императивный звуковой сигнал, в ситуации удержания в РП зрительной информации, предъявляемой в статическом режиме. Было показано, что потенциалы, связанные с императивным стимулом, существенно зависят от времени удержания в РП внутренней репрезентации ломаной линии. Анализ корковых источников ССП показал, что наблюдаемым на скальпе изменениям потенциала соответствуют выраженные и статистически значимые изменения реакции корковых источников как минимум в трех кластерах вокселов: с увеличением задержки наблюдается возрастание степени вовлечения правой орбитальной коры и билатерально-симметричное возрастание активности связанных с моторной системой дорсальных прецентральных и постцентральных корковых областей.
Цель настоящей работы состояла в том, чтобы сделать следующий шаг и исследовать совместное влияние режима предъявления траектории (статического и динамического) и длительности удержания репрезентации в РП (величины задержки императивного стимула) на вызванную биоэлектрическую активность мозга.
МЕТОДИКА
В эксперименте приняли участие 33 взрослых праворуких по самоотчету испытуемых (20 женщин и 13 мужчин) в возрасте от 21 года до 55 лет (32.2 ± 7.9 лет). Все испытуемые дали информированное согласие на участие в эксперименте. Протокол эксперимента был одобрен этической комиссией ФБГНУ “Институт возрастной физиологии Российской академии образования”.
Каждому испытуемому предлагалось запомнить и потом нарисовать последовательность вертикально и горизонтально ориентированных отрезков прямой, составляющих незамкнутую ломаную линию (рис. 1). Длина ломаной варьировала от 4 до 6 элементов. Испытуемого просили начинать воспроизведение запомненной ломаной в ответ на императивный сигнал. Императивный сигнал представлял собой короткую тональную посылку частотой 440 Гц и длительностью 100 мс. Использовались два значения (500 и 3000 мс) задержки начала императивного сигнала относительно момента окончания последнего стимула последовательности.
Ломаная линия – шаблон траектории будущего движения – предъявлялась испытуемому в двух режимах – статическом (ST) и динамическом (DN). В статическом режиме ломаная линия предъявлялась на фиксированное время (T = 2000 мс) вся целиком (рис. 1 (а)). В динамическом режиме по невидимому для испытуемого контуру ломаной линии двигалась точка (рис. 1 (б)) по закону, имитирующему движение кончика карандаша, которым рисует такую линию человек (Корнеев, Курганский, 2013). Время движения по каждому отрезку ломаной составляло 500 мс, что соответствует комфортно быстрому рисованию отрезка прямой человеком.
Эксперимент состоял из двух блоков проб (48 проб в каждом), различающихся режимом предъявления ломаной линии (статический или динамический). В каждом блоке в половине проб императивный сигнал был задержан на 500 мс, а в оставшейся половине – на 3000 мс. При этом в пределах одного блока пробы с длительной и короткой задержкой были перемешаны в квазислучайном порядке. Временное расписание событий в пределах пробы показано на рис. 1 (в).
Эксперимент проводился в полностью автоматическом режиме на компьютере Lenovo Yoga с сенсорным экраном, работающем под управлением операционной системы Kubuntu. Ход эксперимента контролировала управляющая программа (скрипт), реализованная в вычислительной среде Octave с использованием библиотеки функций psychtoolbox 3 (www.psychtoolbox.org). Управляющий скрипт определял временное расписание предъявления стимулов, регистрировал прикосновения к сенсорному экрану и перемещения вдоль него пальца испытуемого; кроме того, он также управлял компьютерным электроэнцефалографом – включал и выключал запись ЭЭГ.
Во время проведения эксперимента испытуемый сидел в кресле в затемненной камере и смотрел на экран, расположенный на таком расстоянии от испытуемого, чтобы было удобно касаться пальцем экрана и рисовать на нем ломаные линии (40–45 см). При этом до начала двигательного ответа испытуемый удерживал указательный палец в определенной позиции (home position) – касался небольшого прямоугольника на сенсорном экране.
ЭЭГ высокой плотности записывалась при помощи компьютерного электроэнцефалографа (Electrical Geodesics, Inc.) в полосе частот 0.1–70 Гц (частота оцифровки 250 Гц) от 129 электродов, расположенных в узлах сетчатого шлема HydroCel GSN (HCGSN), один из которых (вертексный электрод) использовался в качестве референтного. Запись ЭЭГ не была непрерывной, и созданные программой NetStation файлы данных содержали отдельные записи ЭЭГ для каждой пробы.
Для дальнейшего анализа в вычислительной среде Octave индивидуальные записи ЭЭГ извлекались из файлов и преобразовывались к формату (*.mat). При оценке ССП из отдельных записей ЭЭГ извлекались отрезки, привязанные по времени к началу императивного сигнала (короткого звука). Отрезки, содержащие артефакты, удалялись целиком в автоматическом режиме на основе порогового критерия: отрезок считался артефактным, если после удаления постоянной составляющей, сетевой наводки 50 Гц и последующей фильтрации в полосе частот 0.5–50 Гц амплитуда сигнала превышала 50 мкВ.
Для того чтобы вычислить индивидуальные ССП, для каждого испытуемого из ЭЭГ каждой пробы отдельно для каждого режима предъявления (ST, DN) и двух значений задержки (500, 3000 мс) были выбраны безартефактные отрезки длительностью 660 мс, из которых 160 мс составлял предстимульный период. В качестве референтного сигнала для отобранных отрезков использовалась полусумма сигналов от сенсоров, расположенных над левым и правым мастоидами.
Индивидуальные ССП вычислялись не для исходных отведений шлема HCGSN, а для 20 псевдоотведений, соответствующих 8 парам латерально-симметричных отведений (Fp1/2, F3/4, F7/8, C3/4, P3/4, T3/4, P5/6, O1/O2) и четырем сагиттальным отведениям (Fz, Cz, Pz, Oz) схемы 10 –20. Сигналы 20 псевдоотведений формировались следующим образом. На шлеме HCGSN были выбраны 20 электродов, соответствующих указанным 20 отведениям схемы 10 –20, и для каждого такого электрода выбирались 4 или 5 его ближайших соседей (выбор 4 или 5 соседних каналов определялся соображениями симметрии и компактности – выбранные электроды должны были располагаться на равном расстоянии от центрального). К безартефактным отрезкам ЭЭГ, принадлежащим каждой такой группе каналов (центральному каналу и его 4 или 5 соседям), применялся метод главных компонент, и первая главная компонента (компонента с наибольшей дисперсией) рассматривалась в качестве сигнала, характеризующего скоррелированную активность всей группы каналов. Полученный сигнал масштабировался таким образом, чтобы его средняя квадратичная амплитуда совпадала с таковой для всей группы исходных каналов. Таким образом, в результате описанной процедуры исходная 128-канальная ЭЭГ была заменена на 20 псевдоотведений схемы 10 –20, сигналы которых характеризовали ЭЭГ 20 групп реальных отведений на шлеме HCGSN.
Полученные данные анализировались с помощью дисперсионного анализа, выполненного по схеме с повторными измерениями (rmANOVA). Отдельно анализировались значения ССП для 8 пар симметрично расположенных латеральных псевдоотведений (Fp1/2, F3/4, F7/8, C3/4, P3/4, T3/4, P5/6, O1/O2) и четырех сагиттальных псевдоотведений (Fz, Cz, Pz, Oz).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
В результате анализа ССП, полученных для всех сочетаний уровней факторов РЕЖИМ и ЗАДЕРЖКА, были выделены 5 компонентов (N100, P200, P250, P300, N400), показанные на рис. 2 для наиболее наглядного случая – статического предъявления ломаной при длительной задержке императивного сигнала (3000 мс). Соответствующие распределения потенциала по скальпу для каждого из этих компонентов показаны на рис. 3.
Рис. 2.
Усредненный по испытуемым ССП в ответ на императивный звуковой сигнал при статическом предъявлении ломаной и длительном (3000 мс) периоде удержания ее репрезентации в РП. Потенциалы для 20 псевдоотведений наложены друг на друга, и анализируемые в работе компоненты отмечены стрелками N100, P200, P250, P300 и N400. Вдоль оси абсцисс отложена латентность (в мс); вдоль оси ординат – амплитуда в мкВ.
Fig. 2. Shown is the mean over all participants ERP related to imperative auditory signal. This ERP is computed for the static presentation mode and the long (3000 ms) retention period. Potentials for all 20 pseudo electrodes are overlapped; the ERP components of interest are labeled N100, P200, P250, P300, N400 and marked with arrows. The horizontal axis corresponds to latency (ms); the vertical axis corresponds to amplitude (uV).
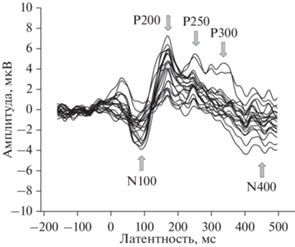
Рис. 3.
Распределение по скальпу потенциала компонентов N100, P200, P250, P300 и N400, показанных на рис. 2. Красный цвет соответствует позитивности, а синий – негативности.
Fig. 3. Scalp distribution of event-related potential for N100, P200, P250, P300, and N400 components shown in Fig. 2. Red color corresponds to positivity and blue color corresponds to negativity.

В отношении компонента P300 возникли опасения, что значительный вклад в него могут вносить электроокулографические (ЭОГ) артефакты (мы благодарны анонимному рецензенту, указавшему на это обстоятельство). Использованный нами жесткий амплитудный критерий (<50 мкВ) включения отрезков ЭЭГ в дальнейшую обработку позволил исключить влияние высокоамплитудных электроокулографических, но не низкоамплитудных ЭОГ-артефактов. Сопоставление ССП со связанными с событием ЭОГ (синхронной суммой отрезков ЭОГ-каналов, входящих в исходную 128-канальную запись ЭЭГ) при длительной задержке императивного сигнала (3000 мс) показало, что в случае статического предъявления ломаной, действительно, пик ССП с латентностью около 300 мс (см. рис. 2) может быть полностью или частично объяснен вкладом электроокулограммы. Однако это не справедливо в ситуации с динамическим предъявлением ломаной, где отчетливо выраженный P300 на ССП не имеет аналога в ЭОГ-каналах. Таким образом, нет сомнений в наличии P300 мозговой природы.
Для дальнейшей статистической обработки для каждого выделенного компонента была оценена его средняя амплитуда (амплитуда измерялась относительно нулевой линии) в 16-миллисекундном временном интервале от его пиковой латентности минус 8 мс до пиковой латентности плюс 8 мс.
Полученные для 8 пар симметрично расположенных латеральных псевдоотведений значения ССП были подвергнуты дисперсионному анализу (rmANOVA) с внутрииндивидуальными факторами: РЕЖИМ (статический; динамический), ЗАДЕРЖКА (короткая, 500 мс; длинная, 3000 мс), КОМПОНЕНТ (N100, P200, P250, P300, N400), ПОЛУШАРИЕ (левое, правое), ОТВЕДЕНИЕ (Fp, F, Fi, C, P, Ta, Tp, O). Описательная статистика для амплитуд выделенных компонентов ССП в билатерально-симметричных и сагиттальных отведениях в различных экспериментальных условиях представлена в таблице 1.
Таблица 1.
Описательная статистика компонентов ССП для двух режимов предъявления ломаной линии и двух значений задержки Table 1. Descriptive statistics of amplitudes of the ERP components for two presentation modes and two delays
| ССП | Отведения | Режим предъявления траектории | |||
|---|---|---|---|---|---|
| статический | динамический | ||||
| 500 мс Mean, Std.Error |
3000 мс Mean, Std.Error |
500 мс Mean, Std.Error |
3000 мс Mean, Std.Error |
||
| N100 | Fp | –3.802, 1.483 | –1.115, 1.353 | –0.64, 0.980 | –0.405, 1.244 |
| F | –5.523, 1.512 | –3.651, 1.502 | –1.853, 0.924 | –2.079, 1.050 | |
| Fi | –2.649, 0.954 | –0.463, 0.834 | –0.975, 0.687 | –1.148, 0.757 | |
| C | –5.265, 1.302 | –3.267, 1.059 | –1.775, 0.820 | –1.306, 0.767 | |
| P | –3.270, 0.899 | –1.387, 0.571 | –1.228, 0.617 | –0.578, 0.501 | |
| Ta | –2.240, 0.649 | –1.247, 0.681 | –1.801, 0.467 | –0.722, 0.461 | |
| Tp | –1.842, 0.614 | –0.614, 0.301 | –0.967, 0.397 | –0.479, 0.297 | |
| O | –1.758, 0.692 | –0.515, 0.413 | –0.885, 0.489 | –0.824, 0.378 | |
| Fz | –5.644, 1.590 | –3.461, 1.633 | –0.953, 1.029 | –1.975, 1.038 | |
| Cz | –6.126, 1.533 | –3.802, 1.158 | –1.818, 1.009 | –1.692, 0.935 | |
| Pz | –3.601, 1.100 | –1.756, 0.595 | –1.236, 0.815 | –0.931, 0.592 | |
| Oz | –1.721, 0.700 | –0.767, 0.493 | –0.913, 0.515 | –0.759, 0.429 | |
| P200 | Fp | 0.090, 1.290 | 2.994, 1.371 | 0.525, 1.504 | 3.265, 1.500 |
| F | 2.054, 0.993 | 3.923, 1.442 | 1.174. 1.383 | 3.772, 1.269 | |
| Fi | –0.105, 0.799 | 2.169, 1.037 | –0.483, 1.070 | 1.012, 0.830 | |
| C | 2.476, 0.745 | 4.368, 0.983 | 1.623, 0.976 | 4.106, 0.783 | |
| P | 1.290, 0.590 | 3.309, 0.587 | 0.882, 0.638 | 3.144, 0.523 | |
| Ta | 0.706, 0.439 | 2.437, 0.601 | –0.460, 0.600 | 1.514, 0.466 | |
| Tp | –0.087, 0.454 | 1.506, 0.379 | –0.026, 0.564 | 1.173, 0.416 | |
| O | 0.012, 0.540 | 1.279, 0.506 | 0.027, 0.687 | 1.315, 0.523 | |
| Fz | 2.136, 1.058 | 4.642, 1.773 | 2.350, 1.383 | 4.192, 1.379 | |
| Cz | 3.545, 0.960 | 5.369, 1.228 | 2.689, 1.245 | 5.530, 1.125 | |
| Pz | 1.463, 0.759 | 3.579, 0.761 | 1.665, 0.905 | 3.437, 0.721 | |
| Oz | –0.302, 0.634 | 1.222, 0.527 | 0.293, 0.761 | 1.513, 0.609 | |
| P250 | Fp | –2.921, 1.463 | 3.841, 1.586 | –1.432, 1.193 | 1.209, 1.395 |
| F | –0.957, 0.978 | 2.828, 1.284 | –0.843, 1.119 | 1.326, 1.242 | |
| Fi | –1.552, 0.762 | 2.821, 1.002 | –1.294, 0.856 | 0.360, 0.734 | |
| C | –0.036, 0.555 | 2.084, 0.712 | –0.037, 0.820 | 1.734, 0.819 | |
| P | 0.347, 0.370 | 2.442, 0.431 | 0.126, 0.554 | 1.644, 0.569 | |
| Ta | –0.637, 0.421 | 2.119, 0.463 | –0.395, 0.661 | 1.264, 0.497 | |
| Tp | –0.166, 0.444 | 1.377, 0.229 | –0.274, 0.455 | 0.543, 0.499 | |
| O | 0.201, 0.542 | 1.340, 0.453 | –1.03, 0.589 | 0.151, 0.675 | |
| Fz | –1.361, 1.201 | 3.224, 1.581 | –0.649, 1.262 | 1.151, 1.207 | |
| Cz | 0.190, 0.590 | 2.227, 0.890 | 0.183, 0.996 | 2.019, 0.991 | |
| Pz | 0.524, 0.455 | 2.630, 0.645 | –0.224, 0.741 | 1.410, 0.753 | |
| Oz | 0.139, 0.602 | 1.219, 0.548 | –0.904, 0.670 | 0.222, 0.739 | |
| P300 | Fp | –3.301, 1.408 | 2.250, 1.34 | –1.055, 1.280 | 3.573, 1.046 |
| F | –1.169, 0.975 | 1.063, 1.138 | –1.025, 1.028 | 1.822, 0.958 | |
| Fi | –2.108, 0.928 | 2.030, 0.917 | –0.958, 0.835 | 1.799, 0.715 | |
| C | –0.298, 0.575 | –0.485, 0.697 | –1.104, 0.657 | 0.382, 0.700 | |
| P | 0.324, 0.461 | 0.062, 0.525 | –1.102, 0.592 | 0.631, 0.569 | |
| Ta | –0.875, 0.441 | 0.384, 0.562 | –1.091, 0.634 | 0.878, 0.418 | |
| Tp | –0.006, 0.466 | –0.198, 0.469 | –0.816, 0.488 | 0.050, 0.444 | |
| O | 0.385, 0.567 | –0.369, 0.710 | –1.128, 0.719 | 0.014, 0.610 | |
| Fz | –1.383, 1.098 | 1.025, 1.298 | –0.546, 1.116 | 1.734, 0.940 | |
| Cz | –0.245, 0.708 | –1.593, 0.818 | –1.379, 0.786 | –0.247, 0.830 | |
| Pz | 0.742, 0.616 | –0.373, 0.687 | –1.438, 0.806 | 0.037, 0.741 | |
| Oz | 0.799, 0.682 | –0.546, 0.845 | –1.154, 0.807 | 0.033, 0.586 | |
| N400 | Fp | –5.044, 1.460 | –0.443, 1.500 | –1.237, 1.152 | 1.670, 1.090 |
| F | –3.878, 1.143 | –1.850, 1.203 | –1.435, 1.028 | –0.593, 0.709 | |
| Fi | –2.834, 0.949 | 0.702, 0.758 | –0.884, 0.739 | 0.423, 0.570 | |
| C | –2.835, 0.784 | –3.058, 0.897 | –2.431, 0.730 | –1.746, 0.506 | |
| P | –1.443, 0.536 | –1.653, 0.709 | –2.094, 0.509 | –0.820, 0.500 | |
| Ta | –1.856, 0.552 | –0.745, 0.455 | –1.452, 0.554 | –0.437, 0.300 | |
| Tp | –0.653, 0.531 | –0.946, 0.501 | –1.457, 0.429 | –0.507, 0.463 | |
| O | –0.499, 0.578 | –0.856, 0.792 | –1.908, 0.639 | –0.543, 0.758 | |
| Fz | –4.179, 1.232 | –1.711, 1.365 | –0.650, 1.546 | –0.650, 1.546 | |
| Cz | –3.265, 0.748 | –4.346, 1.137 | –2.617, 0.925 | –2.617, 0.925 | |
| Pz | –1.478, 0.683 | –2.342, 0.928 | –2.637, 0.680 | –2.637, 0.680 | |
| Oz | 0.384, 0.854 | –0.926, 0.813 | –2.030, 0.748 | –2.030, 0.748 | |
Примечание: для каждого компонента ССП даны средние по парам симметричных латеральных отведений (Fp, F, Fi, C, P, O, Ta, Tp) значения амплитуды и индивидуальные значения амплитуды в сагиттальных отведениях (Fz, Cz, Pz, Oz). Note: For each ERP component shown are mean over pairs of symmetrical lateral electrodes (Fp, F, Fi, C, P, O, Ta, Tp) amplitudes and individual amplitude values for sagittal electrodes (Fz, Cz, Pz, Oz).
Из двух интересующих нас основных эффектов значимым оказалось влияние фактора ЗАДЕРЖКА (F(1, 20) = 11.466; p = 0.003; $\eta _{p}^{2}$ = 0.364), но не фактора РЕЖИМ (p = = 0.472). Однако оказались значимыми взаимодействия с этим фактором: двойное взаимодействие РЕЖИМ × КОМПОНЕНТ (F(4, 17) = 4.337; p = 0.013; $\eta _{p}^{2}$ = 0.505) и тройное взаимодействие РЕЖИМ × ЗАДЕРЖКА × × КОМПОНЕНТ (F(4, 17) = 3.043; p = 0.046; $\eta _{p}^{2}$ = 0.417). Фактор ЗАДЕРЖКА также оказался участником двух значимых двойных взаимодействий: ЗАДЕРЖКА × ОТВЕДЕНИЕ (F(4, 17) = 4.713; p = 0.007; $\eta _{p}^{2}$ = 0.702) и ЗАДЕРЖКА × ПОЛУШАРИЕ (F(1, 20) = = 4.93; p = 0.038; $\eta _{p}^{2}$ = 0.198).
Полученные для сагиттальных отведений амплитуды компонентов ССП также были подвергнуты дисперсионному анализу с факторами РЕЖИМ (статический; динамический), ЗАДЕРЖКА (короткая, 500 мс; длинная, 3000 мс), КОМПОНЕНТ (N100, P200, P250, P300, N400), ОТВЕДЕНИЕ (Fz, Cz, Pz, Oz). Был обнаружен значимый эффект фактора ЗАДЕРЖКА (F(1, 20) = 4.604, p = 0.044, $\eta _{p}^{2}$ = 0.187), значимое двойное взаимодействие РЕЖИМ × КОМПОНЕНТ (F(4, 17) = = 3.477, p = 0.030, $\eta _{p}^{2}$ = 0.450) и два тройных взаимодействия РЕЖИМ х ЗАДЕРЖКА × × КОМПОНЕНТ (F(4, 17) = 3.071, p = 0.045, $\eta _{p}^{2}$ = 0.420) и ЗАДЕРЖКА × КОМПОНЕНТ × × ОТВЕДЕНИЕ (F(12, 9) = 8.406, p = 0.002, $\eta _{p}^{2}$ = 0.918).
Наличие значимых взаимодействий с участием фактора КОМПОНЕНТ позволяет перейти к анализу влияния остальных факторов на каждый из компонентов по отдельности.
Компонент N100
Дисперсионный анализ амплитуды компонента N100 для 8 пар билатерально-симметричных отведений с факторами РЕЖИМ, ЗАДЕРЖКА, ПОЛУШАРИЕ и ОТВЕДЕНИЕ выявил значимое влияние фактора РЕЖИМ (F(1, 20) = 7.516, p = 0.012, $\eta _{p}^{2}$ = 0.276) и значимое взаимодействие РЕЖИМ × ОТВЕДЕНИЕ (F(7, 14) = 5.103, p = 0.005,$\eta _{p}^{2}$ = 0.718).
Дисперсионный анализ компонента N100 для 4 сагиттальных отведений с факторами РЕЖИМ, ЗАДЕРЖКА и ОТВЕДЕНИЕ выявил значимое влияние фактора РЕЖИМ (F(1, 20) = 12.075, p = 0.002, $\eta _{p}^{2}$ = 0.376) и значимое взаимодействие РЕЖИМ х ОТВЕДЕНИЕ (F(7, 14) = 4.538, p = 0.015, $\eta _{p}^{2}$ = 0.431).
Наличие значимых взаимодействий с фактором ОТВЕДЕНИЕ позволяет провести дисперсионный анализ амплитуды компонента N100 отдельно в каждой из 8 пар симметричных отведений, используя факторы РЕЖИМ, ЗАДЕРЖКА и ПОЛУШАРИЕ, и в каждом из 4 сагиттальных отведений, используя факторы РЕЖИМ и ЗАДЕРЖКА.
Для 8 статистических тестов, относящихся к билатерально-симметричным отведениям, использовалась поправка Бонферрони, и значимыми считались эффекты с p < 0.05/8 = = 0.0062. Значимым оказался единственный эффект – влияние фактора РЕЖИМ в центральных отведениях С3 и С4 (F(1, 20) = = 14.334, p = 0.001, $\eta _{p}^{2}$ = 0.417). При этом в статическом режиме амплитуда N100 была больше, чем в динамическом.
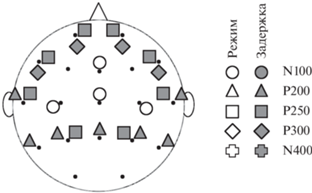
Для 4 статистических тестов, относящихся к сагиттальным отведениям, использование поправки Бонферрони приводило к критерию значимости p < 0.05/4 = 0.0125. Значимым оказалось влияние фактора РЕЖИМ в отведениях Fz (F(1, 20) = 10.388, p = 0.004, $\eta _{p}^{2}$ = 0.342) и Cz (F(1, 20) = 14.855, p = 0.001, $\eta _{p}^{2}$ = 0.426). При этом в обоих случаях амплитуда компонента была больше при статическом предъявлении. Симметричные и сагиттальные отведения, для которых были выявлены значимые различия амплитуд N100, обозначены на схеме (рис. 4).
Рис. 4.
Топографическая карта статистически значимых влияний факторов РЕЖИМ и ЗАДЕРЖКА на компоненты N100, P200, P250, P300 и N400. Соответствие между компонентами и значками показано справа, причем влиянию фактора РЕЖИМ соответствуют белые значки, а влиянию фактора задержка – темно-серые.
Fig. 4. The topographical map of statistically significant effects of the MODE and DELAY factors onto N100, P200, P250, P300, and N400 components. It is shown on the right which mark corresponds to which ERP components. The effect of MODE is shown with marks filled with white color; the effect of DELAY is shown with marks filled with dark gray color.
Остальные компоненты анализировались по аналогичной схеме.
Компонент P200
Для 8 пар билатерально-симметричных отведений было обнаружено значимое влияние фактора ЗАДЕРЖКА (F(1, 20) = 13.259, p = = 0.002, $\eta _{p}^{2}$ = 0.399) и двух взаимодействий с его участием: ЗАДЕРЖКА × ОТВЕДЕНИЕ (F(7, 14) = 2.895, p = 0.043, $\eta _{p}^{2}$ = 0.591) и ЗАДЕРЖКА × ПОЛУШАРИЕ (F(1, 20) = = 5.829, p = 0.025, $\eta _{p}^{2}$ = 0.226).
Для 4 сагиттальных отведений значимым также оказалось влияние фактора ЗАДЕРЖКА (F(1, 20) = 9.276, p = 0.006, $\eta _{p}^{2}$ = 0.317).
Дисперсионный анализ амплитуды компонента P200, выполненный для каждой из 8 пар симметричных отведений, выявил значимые эффекты фактора ЗАДЕРЖКА в центральных С3 и С4 (F(1, 20) = 10.735, p = 0.004, $\eta _{p}^{2}$ = 0.349), теменных P3 и P4 (F(1, 20) = = 21.795, p < 0.001, $\eta _{p}^{2}$ = 0.521), передневисочных T3 и T4 (F(1, 20) = 19.431, p < 0.001, $\eta _{p}^{2}$ = = 0.593) и задневисочных T5 и T6 (F(1, 20) = = 9.396, p = 0.006, $\eta _{p}^{2}$ = 0.320) отведениях. Во всех отмеченных выше случаях амплитуда P200 была больше при длительной задержке по сравнению с короткой задержкой.
В случае сагиттальных отведений обнаружен единственный значимый эффект — влияние фактора ЗАДЕРЖКА в Pz (F(1, 20) = 12.767, p = 0.002,$\eta _{p}^{2}$ = 0.390). При этом амплитуда компонента также выше при длительной задержке. Симметричные и сагиттальные отведения, для которых были выявлены значимые различия амплитуд P200, обозначены на схеме (рис. 4).
Дисперсионный анализ амплитуды P200 в отдельных отведениях не выявил значимых взаимодействий фактора ЗАДЕРЖКА c другими анализируемыми факторами.
Компонент P250
Дисперсионный анализ амплитуды компонента P250 в парах билатерально-симметричных отведений выявил значимое влияние только одного фактора ЗАДЕРЖКА (F(1, 20) = = 14.277, p = 0.001, $\eta _{p}^{2}$ = 0.417). Значимое влияние этого же фактора обнаружено в случае сагиттальных отведений (F(1, 20) = 9.528, p = = 0.006, $\eta _{p}^{2}$ = 0.323).
Несмотря на отсутствие значимых взаимодействий ЗАДЕРЖКА × ОТВЕДЕНИЕ, было интересно посмотреть, в каких отведениях эффект длительности задержки выражен лучше, поэтому для амплитуды P250, так же как для других компонентов, проведен анализ в отдельных симметричных зонах по схеме ЗАДЕРЖКА × ПОЛУШАРИЕ и отдельных сагиттальных зонах по схеме РЕЖИМ × × ЗАДЕРЖКА.
Значимый эффект фактора ЗАДЕРЖКА был обнаружен в лобных полюсных Fp1 и Fp2 (F(1, 20) = 9.313, p = 0.006, $\eta _{p}^{2}$ = 0.318), нижнелобных F7 и F8 (F(1, 20) = 10.549, p = 0.004, $\eta _{p}^{2}$ = 0.345), теменных P3 и P4 (F(1, 20) = = 9.447, p = 0.006, $\eta _{p}^{2}$ = 0.321) и передневисочных T3 и T4 (F(1, 20) = 14.214, p = 0.001, $\eta _{p}^{2}$ = = 0.448) отведениях. Во всех этих случаях амплитуда P250 оказалась выше при более длительной задержке. Симметричные и сагиттальные отведения, для которых были выявлены значимые различия амплитуд P200, обозначены на схеме (рис. 4).
И только в одном случае был обнаружен значимый эффект фактора РЕЖИМ: в затылочных латеральных отведениях – O1, O2 – амплитуда компонента P250 была выше при предъявлении ломаной линии в статическом режиме, чем в динамическом (F(1, 20) = = 10.917, p = 0.004, $\eta _{p}^{2}$ = 0.353).
Компонент P300
Дисперсионный анализ амплитуды компонента P300 в парах билатерально-симметричных отведений выявил значимое влияние фактора ЗАДЕРЖКА (F(1, 20) = 7.580; p = = 0.012, $\eta _{p}^{2}$ = 0.275) и значимое взаимодействие ЗАДЕРЖКА × ОТВЕДЕНИЕ (F(7, 14) = = 5.692; p = 0.003, $\eta _{p}^{2}$ = 0.740).
В случае сагиттальных отведений значимых влияний ни фактора РЕЖИМ, ни фактора ЗАДЕРЖКА не выявлено, но значимыми оказались взаимодействия этих факторов: РЕЖИМ × ОТВЕДЕНИЕ (F(3, 18) = 3.565, p = 0.035, $\eta _{p}^{2}$ = 0.373) и ЗАДЕРЖКА × ОТВЕДЕНИЕ (F(3, 18) = 7.892, p = 0.001, $\eta _{p}^{2}$ = 0.568).
Дисперсионный анализ амплитуды компонента P300, выполненный для каждой из 8 пар симметричных отведений, выявил значимый эффект фактора ЗАДЕРЖКА в следующих двух парах отведений: в лобных полюсных отведениях Fp1 и Fp2 (F(1, 20) = 12.478, p = 0.002, $\eta _{p}^{2}$ = 0.384) и нижнелобных отведениях F7 и F8 (F(1, 20) = 11.842, p = 0.003, $\eta _{p}^{2}$ = = 0.372). При этом амплитуда компонента P300 была выше при длительной задержке. Других значимых эффектов или взаимодействий не обнаружено ни в отдельных парах латеральных отведений, ни в одном из сагиттальных отведений.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Связанные с событиями потенциалы на слуховой императивный сигнал соответствуют (см. рис. 3) тем, что описаны в большинстве нейрокогнитивных исследований для стимулов слуховой модальности, а выделенные компоненты относятся к категории длиннолатентных компонентов (long-latency responses), к которым обычно относят компоненты с латентностью более 50 мс (Luck, 2012).
Полученные в настоящей работе данные показывают, что факторы РЕЖИМ (ST, DN) и ЗАДЕРЖКА (500 мс, 3000 мс) оказывают статистически значимое влияние на амплитуду компонентов ССП, возникающего в ответ на простой и неизменный звуковой императивный сигнал. Этот результат неудивителен, поскольку относительно длиннолатентных компонентов известно, что как в слуховой, так и в зрительной модальности компоненты с латентностью 100 мс и более чувствительны не только к различным параметрам самого сенсорного сигнала, но также к эндогенным воздействиям: к различным аспектам внимания (Woldorff et al., 1993; Luck, Kappenman, 2012) и памяти (Rugg, Curran, 2007), в том числе РП (Agam, Sekuler, 2007), а также к характеру ответной реакции (Aasen, Brunner, 2016).
В нашей экспериментальной модели звуковой сигнал одновременно является и стимулом, зондирующим состояние нейронных сетей (probe stimulus) в период удержания значимой информации. Хотя в литературе данные о связи ССП на подобный стимул с мозговой организацией РП весьма ограниченны, все же показано, например, что в период удержания в РП зрительно-пространственной информации увеличение нагрузки на РП приводит к изменению величины позитивных и негативных ССП с латентностью от 100 до 400 мс в ответ на предъявление фиксационного крестика в качестве пробного стимула в период между тестовым и эталонным изображениями (Boonstra et al., 2013). В настоящем исследовании во всех экспериментальных условиях мы использовали один и тот же императивный сигнал, идентичными были и требования к ответной реакции (копирование ломаной линии). Это позволило минимизировать влияние экзогенных сенсорных, а также моторных аспектов когнитивной задачи на связанные с экспериментальными условиями изменения ССП на императивный стимул. Поэтому выявленные нами значимые изменения ССП правомерно рассматривать как отражение различий в активности нейронных сетей коры в процессе эндогенного извлечения релевантной информации из РП. Характер этих различий указывает на зависимость нейронной организации РП от способа предъявления серийной зрительной информации (статический vs. динамический) и времени задержки ответа.
Влияние фактора РЕЖИМ
Влияние фактора РЕЖИМ ограничивается всего одним компонентом N100 и наблюдается только в симметричных отведениях C3 и C4 и сагиттальных отведениях Cz и Fz, в которых не выявлено влияния фактора ЗАДЕРЖКА (рис. 4). Этот эффект не зависит от длительности удержания информации в РП (см. таблицу 1).
Согласно литературным данным, в компоненте N100 слухового ВП присутствуют функционально и топографически различные субкомпоненты (Zhang et al., 2011; Horváth, 2015; Fogarty et al., 2020). Один из них – субкомпонент N1b – регистрируется при относительно редком появлении слухового сигнала с интервалом более 5 с (Horváth, 2015) и как раз имеет максимальную амплитуду в передне-центральных отведениях (Fogarty et al., 2020), причем корковые источники N1b были обнаружены не только в сенсорно-специфических слуховых зонах, но и в различных зонах префронтальной и премоторной коры (Fogarty et al., 2020). Условия регистрации (редкое возникновение звукового сигнала) и передне-центральная топография значимых изменений N100 в нашем исследовании позволяют предположить, что фактор РЕЖИМ влияет именно на этот субкомпонент N1b.
Большинство авторов связывают передне-центральный компонент N100 c вовлечением механизмов эндогенного нисходящего внимания на ранних стадиях анализа релевантного стимула. В нашем случае, когда речь идет о реакции мозга на простой звуковой сигнал, нет основания предполагать, что N100 связан с привлечением внимания к звуковому сенсорному сигналу для его последующей обработки. Скорее сигналы от слуховых сенсорно-специфических нейронов (корковых и/или таламических) могут выступать триггером активации нейронных сетей нисходящего контроля на относительно ранних стадиях извлечения информации.
Косвенным подтверждением наличия связи компонента N100 с активацией механизмов нисходящего контроля, запускаемых внешней инструкцией при решении когнитивных задач, является связь между амплитудой компонента N1 (с латентностью около 160 мс) ССП на целевой зрительный стимул, следующий за стимулом–подсказкой, и временем реакции при выполнении flanker test: более быстрым и успешным пробам соответствовала большая амплитуда N100 (Schomaker, 2009).
В нашем исследовании более высокая амплитуда N100 в пробах с использованием статического способа предъявления ломаной может свидетельствовать о большем вовлечении систем эндогенного нисходящего контроля при извлечении статической зрительной информации по сравнению с информацией динамической. Действительно, преобразование изображения ломаной в последовательность моторных команд, соответствующих отдельным ее сегментам, требует дополнительного преобразования статической информации в динамическую форму. О некотором преимуществе динамического способа предъявления зрительно-пространственной информации перед статическим свидетельствуют также экспериментальные данные: результаты сравнения в возрастной динамике эффективности решения когнитивной задачи при этих двух режимах предъявления информации (Pickering et al., 2001) и преимущество при использовании динамического представления информации по сравнению со статическим при двигательном научении по зрительному образцу у детей 6 лет (Chikha et al., 2021). Об этом же говорят (опосредованно) клинические исследования пациентов с шизофренией, которые указывают на относительную независимость репрезентаций статической и динамической зрительной информации в РП и необходимость дополнительного вовлечения механизмов нисходящего контроля для манипулирования с внутренними репрезентациями статических изображений (Cocchi et al., 2007).
Различия в амплитуде компонента N100 слухового ВП при статическом и динамическом предъявлении ломаной линии могут быть связаны не только с рассмотренными выше особенностями нисходящих (top-down) модулирующих влияний, но и с различиями в механизмах восприятия статических и динамических стимулов, и связанным с ними различием в мозговой организации РП.
Статически заданная ломаная анализируется зрительной системой как контур. Считается, что в восприятии контуров ключевую роль играют первичная зрительная кора V1, входящие в вентральный зрительный путь части экстрастриарных областей V2, V3, а также латеральный затылочный комплекс LOC (Neumann, Sepp, 1999; Larsson, Heeger 2006; Shpaner et al., 2013; Dumoulin et al., 2014; Li et al., 2019).
При динамическом задании траектории будущего движения направление и длина очередного сегмента ломаной линии определяется из наблюдения за движущимся пятном. В восприятии движущихся объектов принимают участие первичная зрительная кора V1, часть вторичной коры V2, относящаяся к дорсальному пути, и область MT (у человека – это hMT+) (Kriegeskorte et al., 2003; Perry, Fallah, 2014; Donato et al., 2020).
Вся информация, полученная о будущей траектории графического движения, сохраняется в РП, что обеспечивается не только префронтальной корой, как предполагает каноническая модель РП (Curtis, Sprague, 2021), а и широко распределенной системой мозговых структур (D’Esposito, Postle, 2015), куда входят другие ассоциативные отделы коры, а также обеспечивающие зрительное восприятие сенсорно-специфические корковые отделы вплоть до первичной зрительной коры (Lee et al., 2016; Gayet et al., 2018; Scimeca et al., 2018; Curtis, Sprague, 2021).
Можно предположить, что предъявление звукового императивного сигнала приводит к тому, что слуховая кора “оповещает” корковые структуры (ассоциативные префронтальные, зрительные и моторные), входящие в мозговой ансамбль, обеспечивающий сохранение в РП репрезентации воспринятого стимула и плана графического движения. В частности, в зависимости от режима предъявления, слуховая кора посылает сигнал разным корковым областям: либо структурам вентрального пути (ломаная была предъявлена в статическом режиме), либо структурам дорсального пути (при динамическом режиме). Это “оповещение” может осуществляться через неспецифические ядра таламуса посредством кортико-таламических и таламо-кортикальных путей (Cappe et al., 2009; Wolff et al., 2019; Worden et al., 2021) и/или посредством прямых кортико-кортикальных путей (Saenz et al., 2008; Petro et al., 2017). В любом случае сигнал, посылаемый разным адресатам, формируется разными популяциями нейронов первичной слуховой коры, что (при различном числе нейронов в популяциях) может приводить к различию в амплитуде компонента N100, первичным источником которого является слуховая кора.
Влияние фактора ЗАДЕРЖКА
Следующие за N100 позитивные компоненты ССП на императивный сигнал (P200, P250 и P300) не продемонстрировали зависимости от режима предъявления, однако они оказались чувствительными ко времени удержания зрительно-пространственной информации в РП: их амплитуды увеличивались с увеличением времени задержки между тестовыми стимулами и императивным сигналом с 500 до 3000 мс. Наблюдаемые нами изменения позитивных компонентов ССП в проекциях различных корковых зон указывают на преобразования нейрональной основы внутренней репрезентации зрительно предъявляемой траектории будущего движения в процессе ее удержания в РП.
В нашем предыдущем исследовании мозговой организации РП в задаче копирования зрительно предъявляемой траектории (Корнеев и др., 2016б) уже были обнаружены изменения электрической активности мозга по мере увеличения времени удержания информации в РП: в этом исследовании при анализе корковых источников ССП на императивный слуховой сигнал было выявлено выраженное монотонное возрастание реактивности орбитальной коры правого полушария и билатерально-симметричное возрастание реактивности дорсальных отделов сенсомоторной коры при увеличении времени задержки от 500 до 4000 мс. Мы связали такое возрастание с высказанным в наших предыдущих работах (Корнеев, Курганский, 2013, 2014а; Корнеев и др., 2016а) предположением о процессе спонтанного преобразования нейрональной основы внутренней репрезентации зрительно предъявляемой траектории будущего движения в процессе ее удержания в РП.
Исследования нейрональных основ РП, выполненные в последние 10–15 лет, убедительно показали динамический характер процессов в нейронных сетях, относящихся к мозговой системе РП (Murray et al., 2017; Cavanagh et al., 2018; Meyers, 2018; Curtis, Sprague, 2021). Хотя классические представления об удержании информации в РП связывают его с постоянной повышенной активностью нейронов префронтальной коры, в период удержания информации в РП обнаружено также монотонное возрастание активности префронтальных нейронов (Spaak et al., 2017) и на макроскопическом уровне – возрастание амплитуды BOLD-сигнала (Picchioni et al., 2007). В работе (Picchioni et al., 2007) было обнаружено возрастание BOLD-сигнала в височных, затылочно-височных и теменных зонах коры при увеличении времени удержания в РП зрительных объектов (абстрактных изображений, состоящих из комбинации различных геометрических фигур) от 4 до 12 с. В исследовании (Spaak et al., 2017) при анализе активности отдельных нейронов префронтальной коры макак в ситуации отсроченной саккады в направлении целевого стимула были обнаружены динамические перестройки активности нейронных сетей коры, связанные с увеличением времени удержания релевантной зрительной информации.
Не исключено, что непосредственное отношение к предполагаемому нами преобразованию нейрональной основы внутренней репрезентации в период ее удержания в РП могут иметь следующие процессы. Во-первых, есть основания считать, что во время удержания информации в РП происходит переход от кодирования посредством электрической активности в нейронных сетях к кодированию без опоры на нейронную активность (“activity silent” representations) – к кодированию на основе кратковременной синаптической пластичности (Stokes, 2015; Chota, Van der Stigchel, 2021). Во-вторых, получены данные о том, что в зрительной РП параллельно могут сохраняться репрезентации различной степени абстрактности, причем обнаруживается тенденция к переходу от зрительно-специфических видов репрезентации к более абстрактной семантической репрезентации (Rose, 2020; Chota, Van der Stigchel, 2021). Наконец, данные, полученные при сочетании фМРТ и транскраниальной магнитной стимуляции мозга, свидетельствуют о динамических изменениях нейронной активности по мере удержания информации в РП: эта активность в зависимости от контекста деятельности смещается от зон, функционально связанных с сенсорно-специфическим кодированием, к распределенным нейронным фронто-париетальным сетям, связанным с преобразованием информации в абстрактные коды (Rose, 2020).
Выделенные нами позитивные компоненты P200, P250 и P300 ассоциируются в специальной литературе с различными процессами обработки информации в коре головного мозга (Key et al., 2005; Finnigan et al., 2011).
Компонент P200 (другое обозначение – P2) в ряде исследований связывают с процессами семантического кодирования – соотнесением сенсорной информации, удерживаемой в РП, с контекстом прошлого опыта. Так, в работе (Lefebvre et al., 2005) обнаружен рост амплитуды компонента P200 ССП, регистрируемого в теменных отведениях на императивный слуховой сигнал в задаче обратного воспроизведения числового ряда, при увеличении нагрузки на слуховую РП и длительности удержания релевантной информации.
Приведенные выше данные позволяют связать выявленный нами значимый рост амплитуды P200 в средневисочных, теменных и нижневисочных отведениях (рис. 4) именно с преобразованием внутренней репрезентации траектории в период ее удержания в РП, причем в этом преобразовании принимают участие нейронные сети заднеассоциативных областей коры, функционально связанные с семантическими кодированием (Binder et al., 2009).
Следующие два выделенные нами компонента (P250 и P300) демонстрировали сходные по локализации и зависимости от экспериментальных условий значимые изменения: их амплитуда увеличивалась при увеличении длительности задержки в лобных полюсных и нижнелобных отведениях, а для компонента P250 – еще и в средневисочных зонах.
Позитивный компонент с латентностью 250 мс описан как для слуховых, так и для зрительных ССП в различных экспериментальных ситуациях. Для зрительной модальности отмечена реактивность этого компонента при распознавании лицевых паттернов (Yang et al., 2020), включая собственное лицо (Butler et al., 2012), и неоднозначных (ambiguous) изображений (de Jong et al., 2014). Упоминание P250 в исследованиях слухового ССП преимущественно связано с восприятием значимых тональных стимулов в парадигме Oddball (Gilmore et al., 2009). Согласно данным (Gilmore et al., 2009) ССП на целевые стимулы сопровождается ростом амплитуды P250, распределенные источники которого находятся в передневисочной и переднецентральной зонах коры. В одной из работ описана реактивность P250 в составе ССП, возникающего на знакомые звуки окружающей среды (например, звуки, издаваемые домашними животными), даже когда задача не требует привлечения внимания к ним (Kirmse et al., 2009). Несмотря на различия в экспериментальных ситуациях и разную локализацию изменений P250 для зрительных (преимущественно затылочные, теменные и височно-теменно-затылочные зоны) и слуховых (преимущественно переднецентральные зоны) ССП, во всех перечисленных выше исследованиях отмечен рост амплитуды этого компонента при идентификации стимула как знакомого (например, собственное лицо, знакомый звук) или релевантного для решения экспериментальной задачи (например, при наличии в изображении элементов, позволяющих оценить эмоциональное выражение лица). Одним из возможных объяснений реактивности P250 на знакомую или релевантную информацию может быть его связь с активацией нейрональных механизмов памяти, в описанных выше случаях, вероятно, c извлечением следов долговременной памяти и их кратковременным удержанием в процессе распознавания сенсорной информации. Еще в 1978 г. Чэпман и соавт. (Chapman et al., 1978) выявили связь между P250 и эффективностью кратковременной памяти в задачах на отсроченное сопоставление зрительно предъявляемых цифр и букв. В более позднем исследовании (Chapman et al., 2015) связь между амплитудой P250 и вовлечением мозговых механизмов кратковременного удержания значимой информации была подтверждена, более того, была показана специфика реактивности P250 и более популярного у исследователей компонента P300 в зависимости от характера когнитивной задачи. В этой работе испытуемым предъявляли на экране последовательно 4 стимула, состоящие из одной буквы или одной цифры (по 2 стимула каждого вида), каждый стимул появлялся на экране на 20 мс с интервалом между стимулами 750 мс. Задача испытуемого состояла в том, чтобы сравнить букву или цифру из второй пары (тестовый стимул) с буквой или цифрой из первой пары (эталонный стимул). Таким образом, целевые стимулы могли различаться по релевантности в зависимости от того, что надо было сравнивать (буквы или цифры), и нагрузке на кратковременную память (1-й и 2-й стимулы требовали удержания, а 3-й и 4‑й – нет). При анализе ССП на целевые стимулы оказалось, что амплитуда P250 существенно выше в ответ на первые два стимула (как при сравнении букв, так и при сравнении цифр) в том случае, если они являются релевантными, чем на стимулы второй пары, даже если они релевантные. Пространственное распределение P250 оказалось диффузным, вместе с тем максимальный статистический эффект нагрузки на кратковременную память наблюдался в переднецентральных отведениях. Сопоставление P250 c более поздними позитивными компонентами P3a и P3b (см. обсуждение их реактивности ниже) позволило авторам сделать вывод об отражении в этом компоненте нейрональных процессов, связанных с запечатлением релевантной информации в кратковременной памяти. Возвращаясь к результатам нашего исследования, можно предположить, что рост амплитуды P250 на императивный сигнал при увеличении длительности задержки отражает дополнительную активацию нейронных сетей, участвующих в сохранении и извлечении релевантной информации.
Компонент P300 (или P3) – один из наиболее часто упоминаемых в нейрокогнитивных исследованиях (Luck, 2012). P300 регистрируется в самых разных экспериментальных ситуациях, но наиболее распространенной является простая экспериментальная модель oddball, в которой один из стимулов предъявляется с малой вероятностью (редкий стимул). Амплитуда P300 увеличивается, а латентность сокращается в ответ на редкие звуковые или зрительные целевые сигналы, предъявляемые на фоне отличающихся от них по отдельным параметрам частых стимулов (Polich, Kok, 1995). Несмотря на довольно распространенную в клинической литературе и практике точку зрения об отражении некой общей “когнитивной способности” в характеристиках P300 (см. например, (Zhong, 2019)), у современных исследователей нет единого мнения о специфической связи P300 с когнитивными функциями (Machado et al., 2014; Verleger, 2020). Спектр факторов, которые влияют на характеристики этого компонента ССП, достаточно широк – от новизны (Polich, Kok, 1995) или субъективной эмоциональной значимости стимула (Hajcak, Foti, 2020), увеличивающих общий уровень возбудимости коры (arousal), до процессов принятия решений (Rohrbaugh et al., 1974; Schuermann et al., 2012; Twomey et al., 2015). Учитывая цели настоящего исследования, рассмотрим данные о возможной связи P300 с процессами преобразования информации в РП. В литературе отмечается наличие по крайней мере двух позитивных волн ССП во временном диапазоне от 250 до 400 мс, которые регистрируются в ответ как на слуховые, так и на зрительные целевые стимулы (Katayama, Polich, 1999; Polich, 2007; Wronka et al., 2012; Bachiller et al., 2015; Machado et al., 2014).
Еще в ранних исследованиях P300 c использованием задачи oddball (цит. по (Polich, 2007)) были обнаружены различия в параметрах этого компонента для разных когнитивных задач: если обнаружение редких стимулов в ряду стандартных не требовало ответной реакции, то позитивная волна, соответствующая этому компоненту, развивалась раньше, чем в том случае, когда при обнаружении целевого стимула нужно было произвести какое-то действие. Эти наблюдения послужили началом дифференциации P300 на не связанный с ответным действием, но возникающий в ответ на редкий сигнал (двухстимульная задача oddball) или дистрактор (трехстимульная задача oddball) более ранний субкомпонент P3a, и на более поздний, связанный c ответным действием при обнаружении целевого стимула компонент P3b. Согласно нейропсихологической модели, представленной в (Polich, 2007), оба субкомпонента P300 связаны с процессами памяти, но при этом P3a имеет отношение к сопоставлению новой значимой информации с предыдущим опытом (сформированной репрезентацией) и отражает рассогласование между ними, а P3b – к обновлению (updating) информации в РП.
В нашем исследовании компонент P300, несмотря на нетипичную топографию, в функциональном отношении может рассматриваться как аналог P3b, поскольку он возникает в ответ на императивный стимул, требующий моторного ответа, а не в ответ на стимул-дистрактор, как P3a. В литературе дискутируется вопрос о специфических когнитивных факторах, способствующих росту амплитуды этого компонента. В обзоре (Verleger, 2020) на основании сопоставления различных экспериментальных условий автор рассматривает в качестве наиболее реалистичных две гипотезы роста амплитуды P3b: гипотезу обновления информации в РП и гипотезу реактивации заданной инструкцией и/или предыдущим опытом связи между стимулом и ответным действием (reactivation of S–R links), отдавая предпочтение второй гипотезе. Автор также замечает, что обе эти гипотезы объясняют рост амплитуды P3b при увеличении интервала между целевыми стимулами, требующими определенных действий. Точка зрения Верлегера (Verleger, 2020) согласуется с результатами процитированного выше исследования (Chapman et al., 2015), в котором показано, что активация процессов кратковременного удержания значимой информации отражается в росте амплитуды P250, а более поздний компонент P300 связан скорее с использованием удерживаемой информации для последующих действий. Учитывая современные представления о функциональной роли P300, мы можем предположить, что выявленный нами рост амплитуды этого компонента при увеличении длительности задержки от 500 до 3000 мс отражает реактивацию внутренних репрезентаций, содержащих информацию, необходимую для построения будущего действия. Отдельного обсуждения заслуживает локализация изменений P300 – рост его амплитуды в лобных полюсных и нижнелобных отведениях. Несмотря на то, что в данном исследовании анализируются сигналы от сенсоров, а не от источников в коре, имеются основания для предположения, что наблюдаемые нами изменения амплитуды P300 связаны с возрастающей по мере удлинения задержки активацией префронтальных корковых зон, функционально связанных с планированием последовательности действий. Это предположение согласуется с результатами нашего предыдущего исследования, в котором показан линейный рост сигналов от распределенных корковых источников, расположенных в том числе в правой орбитальной коре (Корнеев и др., 2016б).
ВЫВОДЫ
1. Длиннолатентные компоненты (N100, P200, P250 и P300) коркового ССП, возникающего в ответ на звуковой императивный сигнал в задаче отсроченного копирования изображения ломаной линии (траектории), зависят от режима ее предъявления и длительности удержания в рабочей памяти.
2. Режим предъявления траектории оказывает значимое влияние на активность нейронных сетей коры на относительно ранних этапах извлечения информации из рабочей памяти: при статическом режиме амплитуда компонента N100 ССП на императивный сигнал выше, чем при динамическом, в симметричных центральных, а также сагиттальных лобном и центральном отведениях.
3. При увеличении длительности удержания информации в рабочей памяти от 500 мс до 3000 мс значимо увеличивается амплитуда позитивных компонентов: P200 растет в билатерально-симметричных височных и теменных отведениях, а также в теменном сагиттальном отведении; P250 – в билатерально-симметричных передневисочных, нижнелобных и лобных полюсных отведениях; P300 – в билатерально-симметричных нижнелобных и лобных полюсных отведениях.
4. Наблюдаемые нами изменения позитивных компонентов ССП в проекциях различных корковых зон указывают на преобразования нейрональной основы внутренней репрезентации зрительно предъявляемой траектории будущего движения в процессе ее удержания в РП.
Список литературы
Корнеев А.А., Ломакин Д.И., Курганский А.В. Отсроченное копирование незнакомых контурных изображений: отражает ли убывание времени реакции с ростом задержки изменение внутреннего представления будущего движения? Журнал высшей нервной деятельности им. И.П. Павлова. 2016а. 66(1): 51–61.
Корнеев А.А., Ломакин Д.И., Курганский А.В., Мачинская Р.И. Отсроченное копирование незнакомых контурных изображений: анализ потенциалов, связанных с предъявлением стимулов. Журнал высшей нервной деятельности им. И.П. Павлова. 2016б. 66(4): 470–483.
Корнеев А.А., Курганский А.В. Внутренняя репрезентация серии движений при воспроизведении статического рисунка и траектории движущегося объекта. Журнал высшей нервной деятельности им. И.П. Павлова. 2013. 63(4): 437–450.
Корнеев А.А., Курганский А.В. Влияние способа зрительного предъявления сложной траектории на временные параметры ее отсроченного двигательного воспроизведения. Психологические исследования. 2014а. 7(37): 11. http://psystudy.ru.
Корнеев А.А., Курганский А.В. Преобразование порядка движений в серии, заданной зрительным образцом. Вестн. Моск. ун-та. Сер. 14. Психология. 2014б. 2: 61–74.
Aasen I.E., Brunner J.F. Modulation of ERP components by task instructions in a cued go/no-go task. Psychophysiology. 2016. 53(2): 171–185.
Absatova K.A., Kurgansky A.V. Does the way we memorize information depend on the way we are going to use it? Psychol. J. High. Sch. Econ. 2016. 13(1): 177–191.
Agam Y., Sekuler R. Interactions between working memory and visual perception: an ERP/EEG study. NeuroImage. 2007. 36(3), 933–942.
Alain C., McDonald K.L., Kovacevic N., McIntosh A.R. Spatiotemporal analysis of auditory “what” and “where” working memory. Cereb Cortex. 2009. 19(2): 305–14.
Bachiller A., Romero S., Molina V., Alonso J.F., Mañanas M.A., Poza J., Hornero R. Auditory P3a and P3b neural generators in schizophrenia: An adaptive sLORETA P300 localization approach. Schizophr Res. 2015. 169(1–3): 318–325.
Baddeley A. Working memory: theories, models, and controversies. Annu Rev Psychol. 2012. 63: 1–29.
Baddeley A.D., Hitch G. Working memory. In Psychology of learning and motivation (Vol. 8, pp. 47–89). Academic press. 1974.
Binder J.R., Desai R.H., Graves W.W., Conant L.L. Where is the semantic system? A critical review and meta-analysis of 120 functional neuroimaging studies. Cereb Cortex. 2009 19(12): 2767–2796.
Boonstra T.W., Powell T.Y., Mehrkanoon S., Breakspear M. Effects of mnemonic load on cortical activity during visual working memory: linking ongoing brain activity with evoked responses. Int J Psychophysiol. 2013. 89(3): 409–418.
Butler D.L., Mattingley J.B., Cunnington R., Suddendorf T. Mirror, mirror on the wall, how does my brain recognize my image at all? PloS one, 2012. 7(2): e31452–e31452.
Cappe C., Morel A., Barone P., Rouiller E.M. The thalamocortical projection systems in primate: an anatomical support for multisensory and sensorimotor interplay. Cereb Cortex. 2009. 19(9): 2025–2037.
Cavanagh S.E., Towers J.P., Wallis J.D., Hunt L.T., Kennerley S.W. Reconciling persistent and dynamic hypotheses of working memory coding in prefrontal cortex. Nat Commun. 2018. 9(1): 3498.
Chapman R.M., McCrary J.W., Chapman J.A. Short-term memory: the “storage” component of human brain responses predicts recall. Science. 1978 . 202(4373): 1211–1214.
Chapman R.M., Gardner M.N., Mapstone M., Dupree H.M., Antonsdottir I.M. Memory timeline: Brain ERP C250 (not P300) is an early biomarker of short-term storage. Brain Res. 2015. 1604: 74–83.
Chikha A.B., Khacharem A., Trabelsi K., Bragazzi N.L. The Effect of Spatial Ability in Learning From Static and Dynamic Visualizations: A Moderation Analysis in 6-Year-Old Children. Front. Psychol. 2021. 12(2085).
Chota S., Van der Stigchel S. Dynamic and flexible transformation and reallocation of visual working memory representations. Vis Cogn. 2021. 29(7): 409–415.
Cocchi L., Schenk F., Volken H., Bovet P., Parnas J., Vianin P. Visuo-spatial processing in a dynamic and a static working memory paradigm in schizophrenia. Psychiatry Res. 2007. 152(2–3): 129–142.
Curtis C.E., Sprague T.C. Persistent Activity During Working Memory From Front to Back. Front Neural Circuits. 2021. 15: 696060.
de Jong M.C., Brascamp J.W., Kemner C., van Ee R., Verstraten F.A. Implicit perceptual memory modulates early visual processing of ambiguous images. J. Neurosci. 2014. 34(30): 9970–9981.
D’Esposito M., Postle B.R. The cognitive neuroscience of working memory. Annu Rev Psychol. 2015. 66: 115–142.
Donato R., Pavan A., Campana G. Investigating the Interaction Between Form and Motion Processing: A Review of Basic Research and Clinical Evidence. Front Psychol. 2020. 11: 566848.
Dumoulin S.O., Hess R.F., May K.A., Harvey B.M., Rokers B., Barendregt M. Contour extracting networks in early extrastriate cortex. J Vis. 2014. 14(5): 18.
Finnigan S., O’Connell R.G., Cummins T.D., Broughton M., Robertson I.H. ERP measures indicate both attention and working memory encoding decrements in aging. Psychophysiology. 2011. 48(5): 601–611.
Fogarty J.S., Barry R.J., Steiner G.Z. The First 250 ms of Auditory Processing: No Evidence of Early Processing Negativity in the Go/NoGo Task. Sci Rep. 2020. 10(1): 4041.
Gayet S., Paffen C.L.E., Van der Stigchel S. Visual Working Memory Storage Recruits Sensory Processing Areas. Trends Cogn Sci. 2018. 22(3): 189–190.
Gilmore C.S., Clementz B.A., Berg P. Hemispheric differences in auditory oddball responses during monaural versus binaural stimulation. Int J Psychophysiol. 2009. 73(3): 326–333.
Hajcak G., Foti D. Significance?… Significance! Empirical, methodological, and theoretical connections between the late positive potential and P300 as neural responses to stimulus significance: An integrative review. Psychophysiology. 2020. 57(7): e13570.
Horváth J. Action-related auditory ERP attenuation: Paradigms and hypotheses. Brain Res. 2015. 1626: 54–65.
Hurlstone M.J., Hitch G.J., Baddeley A.D. Memory for serial order across domains: An overview of the literature and directions for future research. Psychol Bull. 2014. 140(2): 339–373.
Jaroslawska A.J., Gathercole S.E., Holmes J. Following instructions in a dual-task paradigm: Evidence for a temporary motor store in working memory. Q. J. Exp. Psychol. (Hove). 2018. 71(11): 2439–2449.
Katayama J., Polich J. Auditory and visual P300 topography from a 3 stimulus paradigm. Clin Neurophysiol. 1999. 110(3): 463–468.
Key A.P.F., Dove G.O., Maguire M.J. Linking Brainwaves to the Brain: An ERP Primer. Dev Neuropsychol. 2005. 27(2): 183–215.
Kirmse U., Jacobsen T., Schröger E. Familiarity affects environmental sound processing outside the focus of attention: an event-related potential study. Clin Neurophysiol. 2009. 120(5): 887–896.
Kriegeskorte N., Sorger B., Naumer M., Schwarzbach J., van den Boogert E., Hussy W., Goebel R. Human cortical object recognition from a visual motion flowfield. J Neurosci. 2003. 23(4): 1451–1463.
Machado S., Arias-Carrión O., Sampaio I., Bittencourt J., Velasques B., Teixeira S., Ribeiro P. Source Imaging of P300 Visual Evoked Potentials and Cognitive Functions in Healthy Subjects. Clin EEG Neurosci. 2014. 45(4): 262–268.
Meyers E.M. Dynamic population coding and its relationship to working memory. J Neurophysiol. 2018. 120(5): 2260–2268.
Murray J.D., Bernacchia A., Roy N.A., Constantinidis C., Romo R., Wang X.J. Stable population coding for working memory coexists with heterogeneous neural dynamics in prefrontal cortex. Proc Natl Acad Sci U S A. 2017. 114(2): 394–399.
Larsson J., Heeger D.J. Two retinotopic visual areas in human lateral occipital cortex. J Neurosci. 2006. 26(51): 13128–13142.
Lee S.H., Baker C.I. Multi-Voxel Decoding and the Topography of Maintained Information During Visual Working Memory. Front Syst Neurosci. 2016. 10: 2.
Lefebvre C.D., Marchand Y., Eskes G.A., Connolly J.F. Assessment of working memory abilities using an event-related brain potential (ERP)-compatible digit span backward task. Clin Neurophysiol. 2005. 116(7): 1665–1680.
Li Y., Wang Y., Li S. Recurrent processing of contour integration in the human visual cortex as revealed by fMRI-guided TMS. Cereb Cortex. 2019. 29(1): 17–26.
Luck S.J. Event-related potentials APA handbook of research methods in psychology, Vol 1: Foundations, planning, measures, and psychometrics. (pp. 523–546). 2012. Washington, DC, US: American Psychological Association.
Luck S.J., Kappenman E.S. ERP components and selective attention The Oxford handbook of event-related potential components. (pp. 295–327). 2012. New York, NY, US: Oxford University Press
Neumann H., Sepp W. Recurrent V1–V2 interaction in early visual boundary processing. Biol Cybern. 1999. 81(5-6): 425–444.
Perry C.J., Fallah M. Feature integration and object representations along the dorsal stream visual hierarchy. Front Comput Neurosci. 2014. 8: 84.
Petro L.S., Paton A.T., Muckli L. Contextual modulation of primary visual cortex by auditory signals. Philos Trans R Soc Lond B Biol Sci. 2017. 372(1714): 20160104.
Picchioni M., Matthiasson P., Broome M., Giampietro V., Brammer M., Mathes B., Fletcher P., Williams S., McGuire P. Medial temporal lobe activity at recognition increases with the duration of mnemonic delay during an object working memory task. Hum Brain Mapp. 2007. 28(11): 1235–1250.
Pickering S.J., Gathercole S.E., Hall M., Lloyd S.A. Development of Memory for Pattern and Path: Further Evidence for the Fractionation of Visuo-Spatial Memory. Q J Exp Psychol (Hove) [A]. 2001. 54(2): 397–420.
Polich J. Updating P300: an integrative theory of P3a and P3b. Clin Neurophysiol. 2007. 118(10): 2128–2148.
Polich J., Kok A. Cognitive and biological determinants of P300: an integrative review. Biol Psychol. 1995. 41(2): 103–146.
Rohrbaugh J.W., Donchin E., Eriksen C.W. Decision making and the P300 component of the cortical evoked response. Percept Psychophys. 1974. 15(2): 368–374.
Rose N.S. The Dynamic-Processing Model of Working Memory. Curr Dir Psychol Sci. 2020. 29(4): 378–387.
Rugg M.D., Curran T. Event-related potentials and recognition memory. Trends Cogn Sci. 2007. 11(6): 251–257.
Saenz M., Lewis L.B., Huth A.G., Fine I., Koch C. Visual Motion Area MT+/V5 Responds to Auditory Motion in Human Sight-Recovery Subjects. J. Neurosci. 2008. 28(20): 5141–5148.
Schomaker J. The relationship between response time and the strength of top-down attentional control: An ERP study. J. Eur. Psychol. Stud. 2009. 1(1), p. Art. 2.
Schuermann B., Endrass T., Kathmann N. Neural correlates of feedback processing in decision-making under risk. Front. Hum. Neurosci. 2012. 6(204).
Scimeca J.M., Kiyonaga A., D’Esposito M. Reaffirming the sensory recruitment account of working memory. Trends Cogn Sci. 2018. 22(3): 190–192.
Shpaner M., Molholm S., Forde E., Foxe J.J. Disambiguating the roles of area V1 and the lateral occipital complex (LOC) in contour integration. Neuroimage. 2013. 69: 146–156.
Spaak E., Watanabe K., Funahashi S., Stokes M.G. Stable and dynamic coding for working memory in primate prefrontal cortex. J Neurosci. 2017. 37(27): 6503–6516.
Stokes M.G. ‘Activity-silent’ working memory in prefrontal cortex: a dynamic coding framework. Trends Cogn Sci. 2015. 19(7): 394–405.
Twomey D.M., Murphy P.R., Kelly S.P., O’Connell R.G. The classic P300 encodes a build-to-threshold decision variable. Eur J Neurosci. 2015. 42(1): 1636–1643.
Verleger R. Effects of relevance and response frequency on P3b amplitudes: Review of findings and comparison of hypotheses about the process reflected by P3b. Psychophysiology. 2020. 57(7): e13542.
Woldorff M.G., Gallen C.C., Hampson S.A., Hillyard S.A., Pantev C., Sobel D., Bloom F. E. Modulation of early sensory processing in human auditory cortex during auditory selective attention. Proc Natl Acad Sci U S A. 1993. 90(18): 8722–8726.
Wolff M., Vann S.D. The Cognitive Thalamus as a Gateway to Mental Representations. J Neurosci. 2019. 39(1): 3–14.
Worden R., Bennett M.S., Neacsu V. The thalamus as a blackboard for perception and planning. Front Behav Neurosci. 2021. 15: 633872.
Wronka E., Kaiser J., Coenen A.M. Neural generators of the auditory evoked potential components P3a and P3b. Acta Neurobiol Exp (Wars). 2012. 72(1): 51–64.
Yang T.X., Allen R.J., Yu Q.J., Chan R.C.K. The influence of input and output modality on following instructions in working memory. Sci Rep. 2015. 5: 17657.
Yang Y.-F., Brunet-Gouet E., Burca M., Kalunga E.K., Amorim M.-A. Brain processes while struggling with evidence accumulation during facial emotion recognition: An ERP study. Front Hum Neurosci. 2020. 14: 340–340.
Zhang F., Deshpande A., Benson C., Smith M., Eliassen J., Fu Q.-J. The adaptive pattern of the auditory N1 peak revealed by standardized low-resolution brain electromagnetic tomography. Brain Res. 2011. 1400: 42–52.
Zhong R., Li M., Chen Q., Li J., Li G., Lin W. The P300 event-related potential component and Ccgnitive impairment in epilepsy: A systematic review and meta-analysis. Front Neurol. 2019. 10(943).
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


