Журнал высшей нервной деятельности им. И.П. Павлова, 2022, T. 72, № 2, стр. 233-249
Половые различия во влиянии раннего провоспалительного стресса на обучение и память взрослых крыс в водном лабиринте Морриса
М. И. Зайченко 1, *, А. В. Шаркова 1, И. В. Павлова 1, Г. А. Григорьян 1
1 Федеральное государственное бюджетное учреждение науки
Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
* E-mail: mariya-zajchenko@yandex.ru
Поступила в редакцию 01.03.2021
После доработки 07.04.2021
Принята к публикации 05.10.2021
- EDN: JYLADT
- DOI: 10.31857/S0044467722020125
Аннотация
Исследовали влияние раннего провоспалительного стресса, создаваемого введением бактериального липополисахарида (ЛПС) на 3-й и 5-й дни жизни, на обучение, долговременную и рабочую память взрослых крыс в водном лабиринте Морриса. Самки по сравнению с самцами в контрольной группе обучались менее успешно, у самок в конце обучения пройденная до платформы дистанция, латентность, время на периферии были больше, а доля попыток с нахождением платформы – меньше. Трудности обучения у самок были связаны с дефицитом долгосрочной памяти. Ранний провоспалительный стресс ухудшал обучение только у самцов, уменьшая скорость плавания и долю попыток с нахождением платформы, увеличивая латентность достижения платформы и проплываемую дистанцию. У самцов ЛПС-группы нарушалась долгосрочная память. Тестирование рабочей памяти с ежедневной сменой места платформы не выявило когнитивных различий между самцами и самками в контрольной группе, хотя в начале опытов наблюдались половые различия по уровню двигательной активности и тактике поиска платформы. Ранний провоспалительный стресс не влиял на рабочую память, но оказывал влияние на двигательную активность у самцов, уменьшая скорость плавания и увеличивая латентность достижения платформы. Таким образом, обнаружены половые различия во влиянии раннего провоспалительного стресса на обучение и память у крыс в водном лабиринте Морриса, у самцов наблюдались наибольшие нарушения поведения.
Известно, что стресс в раннем возрасте приводит к изменению регуляции гипоталамо-гипофизарной надпочечниковой системы (ГГНС), нарушает нормальное функционирование иммунной системы и повышает чувствительность нейровоспалительной системы к повторным стрессовым воздействиям (см. обзор Григорьян, 2020). Это приводит к нарушениям в поведении и развитию тревожно-депрессивных и других расстройств во взрослом организме. Для создания нейровоспалительного процесса в раннем возрасте наиболее часто используется модель провоспалительного стресса, вызываемого путем введения бактериального липополисахарида (ЛПС) животным в разные периоды развития (см. обзор Григорьян, 2020). Необходимо отметить, что модель раннего ЛПС-стресса чаще всего используется для исследования изменений в поведении у взрослых животных, гомологичных тревожно-депрессивным и другим эмоционально-негативным состояниям у человека. Остаются малоизученными ранние провоспалительные влияния на когнитивные процессы во взрослом организме, особенно на гиппокамп-зависимое обучение и память, которые традиционно исследуются в водном лабиринте Морриса. Речь идет о влияниях раннего ЛПС-стресса, отдаленного по времени от момента тестирования. Исследование влияний ЛПС-стресса непосредственно перед началом тестирования в лабиринте Морриса проведено в большом числе работ (Jin et al., 2017; Zhu et al., 2019; Czerniawski et al., 2015; Huang et al., 2010; Sparkman et al., 2006; Arai et al., 2001; Shaw et al., 2001). Что же касается влияния отдаленных последствий раннего провоспалительного ЛПС-стресса на обучение и память в водном лабиринте Морриса, то на этот счет имеются лишь единичные работы (Zubareva et al., 2020; Peng et al., 2019; Harre et al., 2008). В этих работах крысы, получавшие бактериальный токсин, обучались хуже (Harre et al., 2008) и проводили существенно меньше времени в квадранте платформы во время тестовой пробы по сравнению с контрольными животными (Harre et al., 2008; Zubareva et al., 2020).
Целью настоящей работы было исследование отдаленных влияний раннего провоспалительного ЛПС-стресса на поведение взрослых крыс в водном лабиринте Морриса. Конкретными задачами исследования были: 1) изучение динамики обучения крыс, испытавших ранний ЛПС-стресс, по сравнению с контрольными животными; 2) изучение рабочей и долгосрочной памяти у крыс ЛПС-группы по сравнению с контрольными животными; 3) исследование половых различий в обучении и проявлениях рабочей памяти у крыс, как переживших ранний ЛПС-стресс, так и у контрольных животных.
МЕТОДИКА
Эксперименты были выполнены на крысах линии Вистар обоего пола. У 15 крысят (8 самцов и 7 самок) вызывали провоспалительный стресс путем введения бактериального липополисахарида (ЛПС) подкожно в дозе 50 мкг/кг в объеме 10 мкл/г дважды, на 3-й и 5-й дни жизни (группа ЛПС). 22 крысятам (11 самцам и 11 самкам) в этом же возрасте подкожно вводили физиологический раствор в объеме 10 мкл/г (группа ФИЗ, контроль). Всего использовали пять пометов, каждый помет делили примерно пополам, одной половине вводили ЛПС, другой – физиологический раствор. Деление пометов проводили с целью ослабить влияние генетического фактора. Для того чтобы различать группы, крысятам ЛПС в возрасте 3 дней в область над хвостом подкожно вводили натуральный пигмент для татуажа. В возрасте 25 дней крысят отлучали от матери и разделяли на 4 подгруппы: 1) получавшие инъекции ЛПС самцы (n = 8); 2) получавшие введение физиологического раствора самцы (ФИЗ) (n = 11); 3) получавшие инъекции ЛПС самки (n = 7); 4) получавшие введение ФИЗ самки (n = 11). В дальнейшем животных содержали в виварии при обычном 12-часовом световом режиме в свободном доступе к воде и стандартному корму в клетках по 3–5 крыс, в одной клетке находились крысы одного пола из одной группы. В экспериментах соблюдали принципы гуманности, изложенные в директивах Европейского Совета (2010/63/ЕU) и положении ИВНД и НФ РАН о работе с экспериментальными животными.
Обучение в водном лабиринте Морриса. В возрасте 5 мес крыс обучали находить скрытую под водой платформу в лабиринте Морриса. Лабиринт представлял собой круглый пластиковый бассейн черного цвета диаметром 150 см и высотой 60 см (Noldus Ltd), наполненный водой до уровня 30 см. В помещении вокруг бассейна располагались внелабиринтные ориентиры – изображения геометрических фигур. Лабиринт условно, с помощью двух пересекающихся через центр прямых, разделяли на 4 квадранта. Точки пересечения прямых со стенками бассейна служили в качестве мест погружения животных в воду (условно – север, юг, запад, восток). С помощью 2 окружностей лабиринт условно делили на центральную (диаметр 40 см), среднюю (ширина 30 см) и периферическую (ширина 25 см) зоны. В середину одного из квадрантов (средняя зона) помещали круглую платформу (диаметром 10 см), верхний край которой был на 1.5–2.0 см ниже уровня воды, сделанную из прозрачного оргстекла и незаметную под водой. Во время опытов в комнате было слегка затемненное освещение (30–50 Лкc); температура воды в ходе опытов была 22–24 град. Обучение проводили в течение 9 дней по две пробы в день. Между первой и второй пробой время составляло 15–20 мин. Положение платформы в ходе обучения не менялось. Стартовые позиции, с которых крыс опускали в бассейн с водой, постоянно меняли, используя 4 основные точки погружения. Максимальное время одной пробы составляло 60 с. Если крыса не находила платформу, ее сажали на нее и оставляли на платформе в течение 20 с. На 10-й день для проверки степени усвоения навыка у крыс проводили тест-пробу без платформы в бассейне. О степени обученности крыс судили по времени нахождения в квадранте платформы. Из других показателей для оценки поведения крыс в лабиринте использовали латентный период (время) достижения платформы, проплываемую до платформы дистанцию, скорость плавания, время пребывания в квадранте платформы и успешность нахождения платформы (доля попыток, завершившихся нахождением платформы, от общего числа попыток в этот день или на этой пробе). Для оценки тактики поиска платформы рассчитывали процент времени пребывания или процент проплываемой дистанции в периферической зоне от общего времени пребывания в лабиринте или общей длины дистанции соответственно. Долгосрочную память оценивали по первым попыткам в день, кратковременную – по вторым попыткам.
После обучения и проверки долгосрочной памяти у разных групп крыс приступали к оценке у них же краткосрочной или рабочей памяти. В этом случае опыты проводили в течение 4 дней, с ежедневным изменением местоположения платформы. В день давали 4 пробы. Продолжительность пробы составляла 60 с, время между попытками составляло 30 с. Вычисляли средние значения для каждой пробы за четыре дня обучения.
Для обработки результатов использовали стандартную программу STATISTICA 8.0. Распределение исследованных параметров проверяли на нормальность по критерию Колмогорова–Смирнова (Basic Statistics, раздел Descriptive Statistics). Если анализируемый параметр удовлетворял данному критерию, то при сравнении групп крыс использовали дисперсионный анализ ANOVA, раздел factorial ANOVA или One-Way ANOVA. При post-hoc анализе применяли критерий Fisher LSD. Нормальное распределение наблюдали у небольшого числа анализируемых параметров: веса крыс, скорости плавания при обучении, а также латентности, времени в целевом квадранте, числа посещений зоны платформы при тестировании. Во всех экспериментах анализировали влияние факторов “ПОЛ” и “ГРУППА” и их взаимодействие. Вес крыс разного пола сопоставляли с помощью критерия Стьюдента (Т-test). При отсутствии нормальности в распределении применяли Mann–Whitney U Test (Nonparametric Statistics). Ненормальное распределение наблюдали у большинства параметров при обучении и тестировании рабочей памяти, таких как дистанция, латентность, процент времени и дистанции на периферии. При сравнении доли попыток, когда крысы успешно нашли платформу, использовали непараметрическую статистику 2 × 2 Table, применяли критерий χ2. Во всех случаях различия считали статистически значимыми при р < 0.05, отмечали наличие тенденции при 0.05 ≤ р < 0.1.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Половые различия в весе крыс. В три месяца вес самцов (333.1 ± 4.0 г) был больше, чем у самок (223.6 ± 4.8 г, t = 17.74, p = 0.001). Половые различия по весу крыс сохранялись и в дальнейшем, самцы весили значительно больше самок в четыре месяца (406.1 ± 6.5 г и 267.5 ± 6.5 г соответственно, t = 15.33, p = = 0.000) и в шесть месяцев (411.3 ± 7.6 и 286.3 ± 6.7 соответственно, t = 12.33, p = 0.000).
Половые различия при обучении в водном лабиринте Морриса у контрольных крыс ФИЗ-группы.
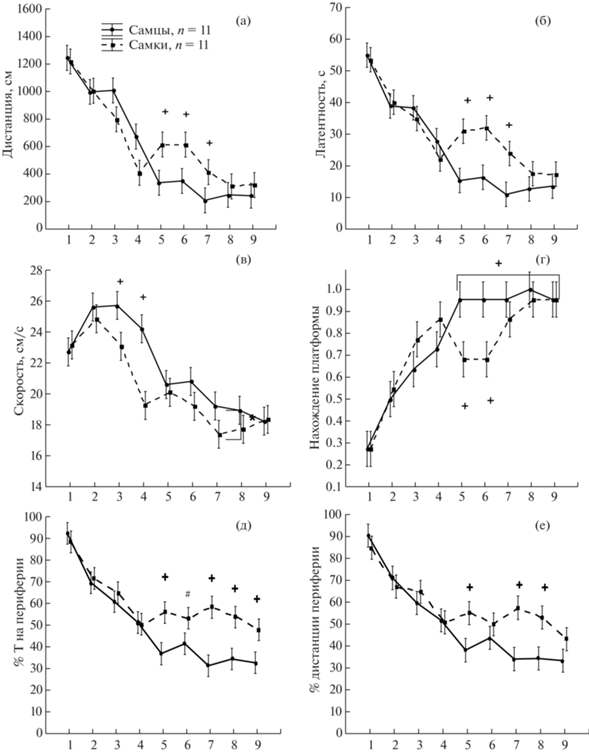
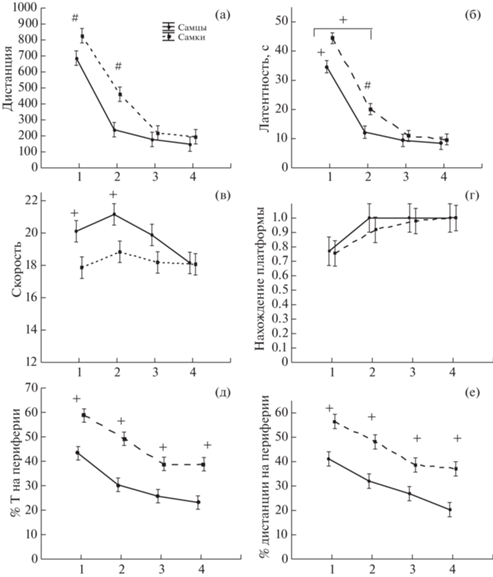
Значительные изменения основных параметров поведения крыс в течение 9 дней свидетельствуют о произошедшем обучении (рис. 1). Наблюдалось уменьшение проплываемой дистанции с 1200 до 200 см (рис. 1 (а)), латентности достижения скрытой под водой платформы с 55 до 10–15 с (рис. 1 б)), а также увеличение доли попыток с нахождением платформы с 0.3 до 0.95 (рис. 1 (г)). К концу обучения уменьшался процент времени и дистанции, проплываемой в периферической зоне бассейна (рис. 1 (д, е)). Также снижалась скорость плавания крыс (рис. 1 (в)), с 22–26 до 18 см/с. Кроме того, наблюдались половые различия. У самок скорость плавания была меньше, чем у самцов (фактор ПОЛ F1,378 = = 11.44, p = 0.001), наибольшие различия наблюдались на 3-й и 4-й дни обучения. Анализ графиков на рис. 1 (а, б, г, д, е) позволил выделить начальный этап (1–4-й дни), когда происходило наибольшее изменение всех параметров, и заключительный период (5–9-й дни), во время которого анализируемые параметры менялись незначительно (плато). В заключительный период наблюдались половые различия по многим анализируемым параметрам. При этом самки по сравнению с самцами проплывали большую дистанцию, имели большую (р < 0.05) латентность, больший процент времени находились на периферии и проплывали там большую дистанцию и менее успешно находили платформу (рис. 1 (а, б, г, д, е)). При этом скорость плавания самцов и самок в эти дни слабо различалась (на уровне тенденции). Поскольку самки по сравнению с самцами проплывали большую дистанцию до платформы в заключительный период обучения и совершали меньше попыток, завершившихся нахождением платформы, можно сделать вывод, что самки испытывали трудности в нахождении платформы, т.е. имелись различия в способностях самцов и самок к пространственному обучению. Кроме того, обнаружилась разница в тактике поиска платформы: у самок тигмотаксис в конце обучения был более выражен, чем у самцов. Различия в двигательной активности (по скорости) выявлялись в основном в начале обучения.
Рис. 1.
Половые различия в показателях поведения контрольной группы крыс при обучении находить платформу в лабиринте Морриса в течение 9 дней. По вертикали на (а–е) – изменение различных показателей поведения в течение 9 дней обучения, по горизонтали – день обучения. + – статистически значимые различия (р < 0.05) между самцами и самками (на (а–б), (д–е) – Mann–Whitney U Test, на (г) – 2 × 2 table, на (в) – Factorial ANOVA). Квадратные скобки над кривыми указывают период, в который наблюдаются статистически значимые различия. n – число крыс в группе. Данные представлены в виде среднее ± ошибка среднего.
Fig. 1. The sex differences in parameters of behavior of the control group of rats during learning to find a safe platform in the Morris water maze for 9 days of training. Оn the vertical axis – the changes of different parameters of behavior during 9 days of training, the horizontal axis on (а–е) – days of learning. + – the significant differences (р < 0.05) between males and females (on (а–б), (д–е) – Mann–Whitney U Test, on (г) – 2 × 2 table, on (в) – Factorial ANOVA). Square brackets above the curves indicate the period in which statistically significant differences are observed. n – a number of rats in a group. The data are presented as mean ± mean’s error.
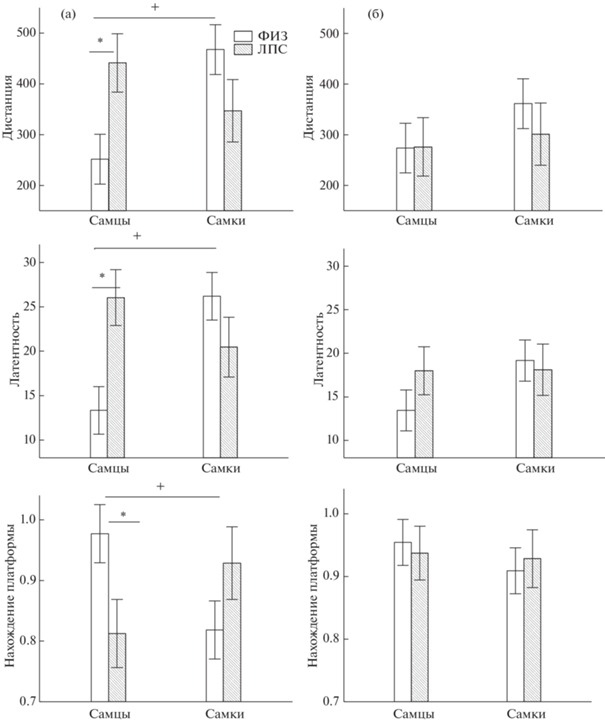
Каждый день крысам предоставлялись две попытки найти платформу, первая попытка проходила через 24 ч после предыдущей пробы и, согласно данным литературы (Grigoryan et al., 1994), по временным параметрам отражала проявление долговременной памяти, а вторая попытка проходила через 15–20 мин после первой, и здесь отражалась уже промежуточная или оперативная память. На рис. 2 (а) представлены средние значения по первым попыткам в конце обучения крыс (6–9-й день), а на рис. 2 (б) – по вторым попыткам. Видно, что в контрольной группе (ФИЗ) самки по сравнению с самцами на первых попытках (рис. 2 (а)) проплывали большую дистанцию, находили платформу с большей латентностью, а доля попыток с нахождением платформы у них была меньше (все различия статистически значимы). На вторых попытках (рис. 2 (б)) статистически значимых различий по данным параметрам между самцами и самками не было обнаружено. Полученные результаты свидетельствуют о том, что у самок по сравнению с самцами наблюдался дефицит долговременной памяти, тогда как по проявлению оперативной памяти животные не отличались.
Рис. 2.
Сопоставление первых и вторых попыток в день в конце обучения. По горизонтали – средние значения параметров за 4 дня обучения (с 6-го по 9-й) для первой (а) и второй (б) пробы. + – статистически значимые различия (р < 0.05) между самцами и самками, * – статистически значимые различия между группами ФИЗ и ЛПС.
Fig. 2. Comparison of the first and second trial per day at the end of training. Horizontally – the average values of the parameters for 4 days of training (from the 6th to the 9th) for the first (а) and second (б) trial. + – statistically significant differences (p < 0.05) between males and females, * – between the ФИЗ and ЛПС groups.
В тестовой пробе на 10-й день при отсутствии платформы в лабиринте половые различия по проценту времени, проведенного в целевом квадранте, и по латентности достижения зоны платформы не обнаруживались (рис. 3 (а–б), табл. 1). Это свидетельствует о том, что в результате обучения и самцы, и самки контрольной группы успешно и примерно одинаково обучились находить скрытую под водой платформу. У самцов в тесте число посещений зоны платформы было больше, чем у самок (рис. 3 (в), табл. 1), что может свидетельствовать о некоторой инерционности самцов, неспособности перестроиться на поиск нового места платформы при отсутствии платформы на привычном месте.
Рис. 3.
Показатели поведения крыс при тестировании способности крыс находить платформу в лабиринте Морриса на 10-й день. (а–в) – сопоставление самцов и самок в контрольной группе крыс, (г–е) – сопоставление контрольной (ФИЗ) и ЛПС-групп. + – статистически значимые различия (p < 0.05) между самцами и самками (One Way ANOVA), * – различия между ФИЗ- и ЛПС-группами (Factorial ANOVA).
Fig. 3. The parameters of rats behavior at testing the abilities of rats to find a hidden platform in the Morris maze on the 10th day (a probe trial). (а–в) – a comparison of males and females of the control group, (г–е) – a comparison of control (ФИЗ) and ЛПС groups. + – the significant differences (p < 0.05) between males and females (One Way ANOVA), * – the differences between ФИЗ (Saline) and ЛПС (LPS) groups (Factorial ANOVA).
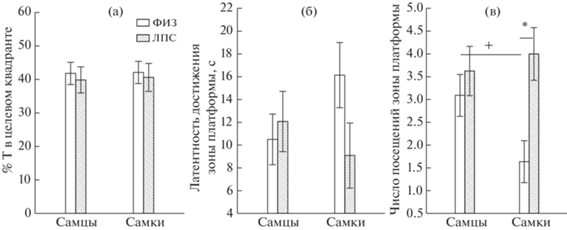
Таблица 1.
Значение F и р при анализе с помощью Factorial ANOVA показателей поведения при тестировании у разных групп крыс (10-й день) Table 1. The F and p values at analysis by Factorial ANOVA of behavioral parameters during testing the different groups of rats (10 day)
| Группа крыс The group of rats |
Показатель поведения The parameters of behavior |
Фактор ПОЛ A SEX factor |
Фактор ГРУППА A GROUP factor |
|---|---|---|---|
| Только одна группа ФИЗ Saline |
Латентность достижения зоны платформы A latency to reach a platform zone |
F1,20 = 1.93, p = 0.186 | |
| Время нахождения в целевом квадранте (0–60 c) Time spent in the goal quadrant |
F1, 20 = 0.01, p = 0.944 | ||
| Число посещений зоны платформы A number of visits a platform zone |
F1, 20 = 6.96, p = 0.016 | ||
| Обе группы ЛПС+ФИЗ LPS+SAL |
Латентность достижения зоны платформы A latency to reach a platform zone |
F1, 33 = 0.25, p = 0.623 | F1, 33 = 1.06, p = 0.313 |
| % времени нахождения в целевом квадранте (0–60 c) Percentage of time spent in the goal quadrant (0–60 c) |
F1, 33 = 0.02, p = 0.889 | F1, 33 = 0.22, p = 0.644 | |
| Число посещений зоны платформы A number of visits a platform zone |
F1,33 = 1.06, p = 0.006 | F1,33 = 7.97, p = 0.008 |
Влияние раннего провоспалительного стресса на обучение в лабиринте Морриса.
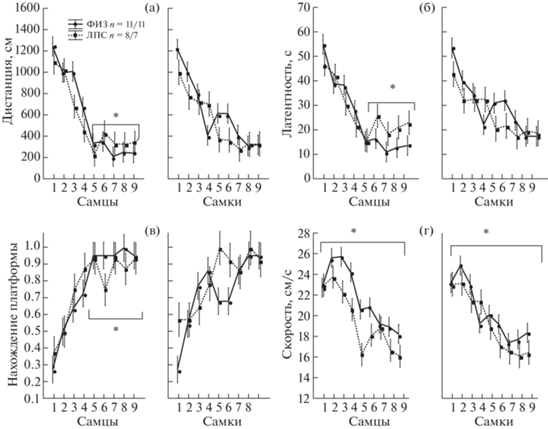
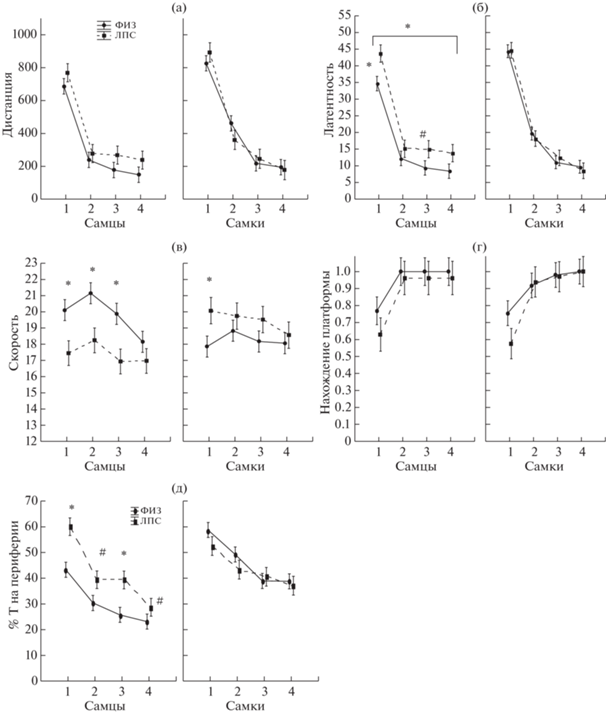
Из рис. 4 видно, что у крыс как группы ФИЗ, так и ЛПС происходило существенное изменение латентности достижения платформы, проплываемой дистанции и доли попыток с нахождением платформы на протяжении девяти дней обучения, что свидетельствует об обучении всех групп крыс. Фактор ПОЛ влиял на скорость плавания, у самок скорость была ниже (F1,630 = 0.571, p = 0.019). Анализ графиков на рис. 4 позволил выявить интервал в конце обучения (6–9-й дни), где межгрупповые различия проявлялись в наибольшей степени. Из рис. 4 видно, что у самцов ЛПС-группы по сравнению с контрольной ФИЗ-группой с 6-го по 9-й дни были больше (p < 0.05) проплываемая дистанция и латентность достижения платформы (рис. 3 (а, б)), а доля попыток с нахождением платформы – меньше (рис. 4 (в)). Скорость движения у самцов и самок ЛПС-группы в целом была ниже, чем у ФИЗ-группы за все время обучения (фактор группа F1,630 = 23.19, p = 0.000, рис. 4 (г), но взаимодействие факторов ГРУППА × ДНИ было недостоверным (F8,630 = 0.96, p = 0.46). Таким образом, ранний провоспалительный ЛПС-стресс оказывал влияние на обучение в лабиринте Морриса в основном у самцов, затрудняя нахождение платформы в конце обучения, влияние на самок было значительно слабее и проявлялось только в уменьшении скорости плавания.
Рис. 4.
Влияние раннего провоспалительного стресса на показатели поведения при обучении крыс находить платформу в лабиринте Морриса. (а–г) по вертикали – изменение различных показателей поведения в течение 9 дней обучения, (д) – сопоставление ФИЗ- и ЛПС-групп при первых попытках в день в конце обучения (6–9 дни), (е) – сопоставление ФИЗ- и ЛПС-групп при вторых попытках в день в конце обучения (6–9 дни). По горизонтали на (а–г) – день обучения, пол. ФИЗ – группа с введением физиологического раствора, ЛПС – группа с введением ЛПС. * – статистически значимые различия между группами ФИЗ и ЛПС (на (а, б, г–е) Mann–Whitney U Test , на (в) – 2 × 2 table), n – число крыс в группе (самцы/самки).
Fig. 4. The influence of early proinflammatory stress on parameters of behavior during learning of rats to find a hidden platform in the Morris water maze. Оn the vertical axis – the changes of different parameters of behavior during 9 days of training, (д) – a comparison of ФИЗ (Saline) and ЛПС (LPS) groups at the first daily trials at the end of learning (6–9 days), (е) – a comparison of Saline and LPS groups at the second daily trials at the end of learning (6–9 days). оn horizontal axis on (а–г) – days of learning, sex. ФИЗ – a group with injection of Saline, ЛПС – a group with injections of LPS. * – the significant differences between ФИЗ and ЛПС groups (on (а, б, г–е) Mann–Whitney U Test , on (в) – 2 × 2 table), n – a number of rats in a group (males/females).
Сопоставление первых и вторых попыток в конце обучения (6–9-й день) показало, что при первой попытке у самцов ЛПС-группы по сравнению с самцами ФИЗ-группы были больше дистанция и латентность, а доля попыток с нахождением платформы – меньше (рис. 2 (а)). При вторых попытках различий по этим параметрам между группами не было обнаружено (рис. 2 (б)). У самок различий между ФИЗ- и ЛПС-группами не выявлялось как при первых (рис. 2 (а)), так и вторых попытках (рис. 2 (б)). Таким образом, ранний провоспалительный стресс приводил к ухудшению долгосрочной памяти только у самцов, не влияя на краткосрочную память.
При тестировании в пробе с отсутствующей платформой на 10-й день эксперимента различий между ФИЗ- и ЛПС-группами не было обнаружено по проценту времени нахождения в целевом квадранте (рис. 3 (а)) и латентности достижения зоны платформы (рис. 3 (б)), влияние факторов ПОЛ и ГРУППА на эти параметры было незначительное (табл. 1). Эти данные свидетельствуют об одинаковой степени обученности крыс разных групп и разного пола. У самок ЛПС-группы число посещений зоны платформы было больше, чем у ФИЗ-группы, что может свидетельствовать об увеличении инерционности самок ЛПС-группы (рис. 3 (в)).
Половые различия в проявлениях рабочей памяти у контрольной группы крыс
На рис. 5 видно, что к четвертой пробе уменьшались проплываемая дистанция до платформы, латентность нахождения платформы, скорость плавания, процент времени и дистанции в периферической зоне, а также увеличивалась доля попыток с нахождением платформы (рис. 5 (а–е)), что свидетельствует о том, что как самцы, так и самки справлялись с задачей. Из рис. 5 (в) видно, что наибольшие половые различия по скорости плавания наблюдались при 1–3 попытках (фактор ПОЛ F1, 344 = 5.1, p = 0.024), самки плавали медленнее. Самки по сравнению с самцами на 1–2 пробах достигали платформы с большей латентностью (рис. 5 (б)), больший процент времени проводили на периферии и проплывали там большую дистанцию (рис. 5 (д, е)). Поскольку платформа находилась в средней части бассейна, при такой тактике поиска нового места платформы у самок на 1-й и 2-й попытках увеличивалась латентность достижения платформы. Несмотря на выраженный тигмотаксис у самок в тесте на рабочую память, на 3-й и 4-й попытках они справлялись с задачей, половых различий по дистанции, латентности, доле попыток с нахождением платформы не наблюдалось. Эти данные свидетельствуют о том, что рабочая память у самок не была нарушена.
Рис. 5.
Половые различия в показателях поведения крыс контрольной группы при тестировании рабочей памяти при смене места платформы. По горизонтали – номер пробы, по вертикали – различные показатели поведения, усредненные по четырем дням. + – статистически значимые различия между самцами и самками, # – тенденция, 0.05 ≤ p < 0.1. ((а–б) – Mann–Whitney U Test, на (г) – 2 × 2 table, на (в, д, е) – Factorial ANOVA).
Fig. 5. The sex differences in parameters of rats’ behavior at working memory testing with a daily changing a platform position. On horizontal axis – a number of trial, on verical axis – the different parameters of behavior averaged over four days. + – the significant differences between males and females, # – trend, 0.05≤ p < 0.1. ((а–б) – Mann–Whitney U Test, on (г) – 2 × 2 table, on (в, д, е) – Factorial ANOVA).
Влияние раннего провоспалительного стресса на рабочую память. На рис. 6 видно, что к четвертой пробе у всех групп крыс уменьшались проплываемая дистанция, латентность нахождения платформы, скорость движения, время на периферии, увеличивалась доля попыток с нахождением платформы (рис. 6). Фактор ГРУППА оказывал влияние на скорость движения (F1,576 = 4.7, p = 0.031), также наблюдалось взаимодействие факторов ГРУППА × ПОЛ (F1,576 = 12.2, p = 0.001). У самцов ЛПС-группы по сравнению с самцами ФИЗ-группы во все время тестирования скорость плавания была меньше (рис. 6 (в)). Из рис. 6 (б, д) видно, что у самцов ЛПС-группы по сравнению с ФИЗ-группой латентность нахождения платформы, процент времени на периферии были больше. Дистанция и доля попыток с нахождением платформы у самцов ЛПС-группы не отличались от группы ФИЗ. У самок различий между ФИЗ- и ЛПС-группами не наблюдалось по практически всем анализируемым параметрам. Таким образом, ранний провоспалительный стресс оказывал влияние только на двигательную активность самцов, но не самок в тесте на рабочую память, приводя к снижению скорости плавания и увеличению латентности достижения платформы. Тактика поиска платформы менялась также только у самцов ЛПС-группы. Поскольку дистанция и успешность нахождения платформы в группах ФИЗ и ЛПС не отличались, можно заключить, что ранний провоспалительный стресс не влиял на рабочую память.
Рис. 6.
Влияние раннего провоспалительного стресса на рабочую память. По вертикали – различные показатели поведения при тестировании рабочей памяти, усредненные по четырем дням, по горизонтали – проба, пол. ФИЗ – контрольная группа с введением физиологического раствора, ЛПС – группа с введением ЛПС. * – статистически значимые различия (р < 0.05) между группами ФИЗ и ЛПС, # – тенденция, 0.05 ≤ p < 0.1 (на (а–б), (д–е) – Mann–Whitney U Test, на (г) – 2 × 2 table, на (в) – Factorial ANOVA ).
Fig. 6. The influence of early proinflammatory stress on working memory. On vertical axis – the different parameters of behavior during the working memory testing averaged over four days, on horizontal axis – the trials, sex. ФИЗ – a control group with injection of Saline, ЛПС – a group with injection of LPS. * – the significant differences (р < 0.05) between SAL and LPS, # – trend, 0.05 ≤ p < 0.1. (on (а–б), (д–е) – Mann–Whitney U Test, on (г) – 2 × 2 table, on (в) – Factorial ANOVA ).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Половые различия при обучении и проявления рабочей памяти в водном лабиринте Морриса у контрольных крыс
В настоящей работе половые различия при обучении по параметрам – проплываемой дистанции, латентности нахождения платформы и времени пребывания на периферии лабиринта – наблюдались в конце обучения, начиная с пятого дня, когда кривые выходили на плато. Различия по скорости плавания наблюдались в начале обучения и не могли сказаться на отмеченных параметрах. Эти результаты говорят о том, что на определенном этапе обучения самцы лучше, чем самки, находили в бассейне скрытую под водой платформу. Другими словами, контрольные самцы в когнитивном плане оказались более способными в решении данной пространственной гиппокамп-зависимой задачи, чем самки. Большинство литературных данных совпадает с полученными нами результатами. В частности, было показано, что самцы крыс лучше справляются с нахождением скрытой под водой платформы в лабиринте Морриса, чем самки (Veng et al., 2003; см. обзор Jonasson, 2005). Превосходство самцов наблюдалось в том случае, когда вначале проводилось исследование поведения с видимой платформой (сигнальное обучение), а уже потом – со скрытой платформой (Berger-Sweeney et al., 1995). Самцы лучше решали задачу поиска платформы, если в каждой пробе животное погружали в воду с новой стартовой позиции. Они лучше воспринимали внешние ориентиры и их изменения по отношению к местоположению платформы (Roof, Stein, 1999). Предварительное обучение также нивелировало половые различия (Jonasson, 2005; Beiko et al., 2004; Perrot Sinal et al., 1996) и улучшало показатели поведения самок за счет более быстрого снижения у них уровня стресса (Anderson et al., 2013; Beiko et al., 2004). Все это свидетельствует о том, что самцы лучше используют аллоцентрическую стратегию поведения, связанную с использованием стимулов, расположенных вне лабиринта, тогда как самки лучше используют эгоцентрическую стратегию поведения, связанную с внутрилабиринтными стимулами (Devan et al., 2016). Неслучайно именно самки при отсутствии видимых стимулов в лабиринте часто переходят к плаванию вдоль стенок бассейна (tigmotaxis) (Beiko et al., 2004; Perrot Sinal et al., 1996), что является проявлением эгоцентрической стратегии поведения (Koss, Frick, 2017). На половые различия влияли также вид животного (самцы-крыс превосходили самок-крыс намного больше, чем самцы-мышей превосходили самок-мышей) и условия проживания (самцы-изолянты превосходили самок-изолянтов) (Jonasson, 2005). Половые различия зависели также от возраста: сильнее всего они проявлялись в среднем возрасте по сравнению с молодым или старым возрастом (Markowska, 1999; Frick et al., 2000). Считается, что в этом возрасте самки уступают самцам из-за снижения уровня эстрогенов и прогестерона (Markowska, 1999; Frick et al., 2000). Однако в некоторых работах половые различия либо совсем не выявлялись, либо самки выполняли задачу лучше, чем самцы (Lamberty and Gower, 1988; Bucci et al., 1995; Jonasson, 2005; Benoit et al., 2015). В работе S. Healy и соавт. (Healy et al., 1999) наибольшая латентность нахождения платформы у самок была в фазе эструса, затем она снижалась при метаэструсе, диэструсе и была наименьшей при проэструсе. При усреднении влияний разных фаз гормонального цикла не было обнаружено различий в поведении самцов и самок. Важно отметить, что все условия опыта и полученные результаты (без учета влияний гормонального цикла) в работе С. Хили практически совпадали с результатами нашей работы.
При исследовании рабочей памяти в наших опытах половые различия наблюдались при 1–2 пробах, у самок была меньше скорость плавания, а латентность больше, они больше времени проводили на периферии. Возможно, меньшая скорость плавания и соответственно большая латентность достижения платформы у самок была связана с их меньшими размерами и меньшей силой по сравнению с самцами. Взрослые самцы были по весу в полтора раза больше, чем самки. Поскольку при тестировании рабочей памяти половых различий в проплываемой дистанции и проценте проб с нахождением платформы не наблюдалось, можно заключить, что не было половых различий в рабочей памяти у самцов и самок. Аналогичные данные мы получили при сопоставлении вторых попыток при обучении, которые отстояли от первых на 15–20 мин и отражали в основном кратковременную память. Различий между самцами и самками при вторых попытках не наблюдали. Следует отметить, что в данном случае нельзя определить, как именно сказался в этой серии предыдущий опыт обучения в соответствии с первым протоколом.
Сопоставление первых ежедневных попыток при обучении, отстоящих от предыдущей пробы на 24 ч, позволило выявить различия в долговременной памяти. У самцов на первых попытках были меньше дистанция, латентность, но больше процент проб с нахождением платформы по сравнению с самками.
Влияние раннего провоспалительного стресса на обучение и память в водном лабиринте Морриса
В нашей работе самцы, испытавшие ранний провоспалительный ЛПС-стресс (50 мкг/кг) на 3-й и 5-й дни жизни, хуже обучались находить скрытую под водой платформу в лабиринте Морриса во взрослом возрасте по сравнению с контрольными самцами, получавшими в те же дни физиологический раствор. Ухудшение проявилось в конце обучения и характеризовалось удлинением времени нахождения платформы и увеличением проплываемого расстояния по сравнению с контрольными крысами. У самок ЛПС-группы ухудшения обучения в сравнении с контрольной группой не наблюдалось. Кроме того, у самцов и самок ЛПС-группы замедлялась скорость плавания. Ранее влияние ЛПС на двигательную активность изучали в “открытом поле” (Брошевицкая и соавт., 2020). При этом у самцов ЛПС-группы скорость, дистанция и время движения были ниже, чем у контрольных животных. Ухудшение обучения у самцов ЛПС-группы могло быть связано с ослаблением долгосрочной, но не краткосрочной памяти, поскольку влияние ЛПС проявилось только на первых попытках в день, но не сказалось на вторых. Специальное тестирование рабочей памяти также не выявило различий в дистанции и времени нахождения платформы между ФИЗ- и ЛПС-группами, что свидетельствует об отсутствии различий у них в рабочей памяти. В то же время было обнаружено снижение скорости и латентности, а также увеличение тигмотаксиса у самцов ЛПС-группы, что отражало влияние на двигательную активность и тактику поиска.
В работе E.М. Harre и др. (Harre et al., 2008) самцы крыс, которые получали инъекции ЛПС (100 мкг/кг) однократно в возрастные периоды 5, 14, 30, 77 дней, не показали различий в латентности достижения скрытой под водой платформы по сравнению с контрольными животными. Различия с результатами наших опытов могли быть обусловлены рядом процедурных особенностей и различий. Во-первых, в работе (Harre et al., 2008) намного больше была платформа, на которую взбирались крысы (20 см против 10 см), и в два раза дольше продолжалась каждая проба (120 с против 60 с). Эти два обстоятельства увеличивали шансы крыс обеих групп отыскать платформу за отведенное время. Другой причиной могло быть то, что в работе E.М. Harre и соавт. (Harre et al., 2008) применяли 4 пробы в день с очень коротким интервалом в 30 с в течение 6 дней с неизменным местоположением платформы во все эти дни. То есть использовался процедурный вариант опытов, который включал в себя элементы смешанной (“гибридной”) памяти, состоящей из эффектов рабочей и долгосрочной памяти. На наш взгляд, такая процедура с ежедневной тренировкой рабочей памяти существенно облегчала общий процесс обучения и нивелировала групповые различия (ЛПС против ФИЗ), что было выявлено с помощью дисперсионного анализа, который не показал достоверного взаимодействия факторов ГРУППА × ДНИ. Однако удивительно, что в тестовой пробе без платформы группы, получавшие ЛПС на 5-й и 30-й постнатальные дни, проводили достоверно меньше времени в квадранте платформы, чем контрольные крысы, получавшие физиологический раствор. В работе (Peng et al., 2019) на самцах мышей, получавших ЛПС-стресс (50 мкг/кг) дважды на 3-й и 5-й дни жизни, в процессе обучения также не было обнаружено различий в латентности достижения безопасной платформы по сравнению с контрольными самцами, получавшими физиологический раствор. В ней, как и в предыдущей работе на крысах (Harre et al., 2008), также применяли 4 пробы в день, хотя только в течение 4 дней и тоже с неизменным положением платформы во все дни. Время пробы при обучении было 90 с, а время тестовой пробы без платформы – 60 с. К сожалению, мы не нашли в методике величины временного интервала между пробами. Остается только догадываться, что он был очень коротким (15 с – время нахождения крыс на платформе между пробами), поскольку новую пробу начинали, забирая животное прямо с платформы. То есть, по существу, опыты на крысах и мышах по процедуре были очень похожи друг на друга; в обоих случаях животным предоставлялись облегченные условия для процесса обучения с вовлечением “гибридной” (рабочей и долгосрочной) памяти, может быть, поэтому обе группы без труда справлялись с решением искомой задачи. Так же как в опытах на крысах (Harre et al., 2008), различий между ЛПС- и ФИЗ-группами не наблюдалось, но неожиданно в тестовой пробе между группами выявились различия по времени пребывания в квадранте платформы. Самцы, получавшие ранний ЛПС-стресс, находились достоверно меньше времени в квадранте платформы, чем самцы ФИЗ-группы. В наших опытах на крысах мы получили прямо противоположные результаты. В процессе обучения самцы ЛПС-группы уступали самцам ФИЗ-группы по показателям латентности достижения платформы и проплываемого расстояния, однако в тестовой пробе, наоборот, различий между группами уже не наблюдалось. Такие расхождения, на наш взгляд, связаны с процедурными особенностями наших опытов, в которых мы постарались развести процессы, связанные с долгосрочной и рабочей памятью. Хотя в нашей работе для ускорения обучения мы тоже использовали не одну (идеальной была бы одна проба), а две пробы в день, они были значительно отставлены друг от друга по времени (15–20 мин). В опытах О. Зубаревой и др. (Zubareva et al., 2020) ЛПС вводили 3 раза на 14, 16 и 18-й дни жизни, но в очень малой дозе, 25 мкг/кг. Несмотря на это, в лабиринте Морриса были обнаружены существенные различия между группой, получавшей ЛПС, и контрольными крысами. Процедурно авторы использовали промежуточный вариант по длительности интервалов между пробами, которые составляли 2 мин. Всего было проведено 16 проб по 4 пробы в день в течение 4 дней. Примечательно, что в рассматриваемой работе были получены достоверные влияния факторов ГРУППА и ПРОБА, но не их взаимодействия. Оказалось, что влияние проб было значимым только для контрольной группы, а у ЛПС-группы проплываемое расстояние в зависимости от проб не изменялось. Авторы не приводят изменений латентности нахождения платформы, но по показателю проплываемой дистанции обе группы крыс хорошо справляются с задачей (Zubareva et al., 2020).
Интересным является то, что в нашей работе различия между ЛПС- и ФИЗ-группами проявились только у самцов и не проявились у самок. Это обстоятельство заслуживает особого внимания, поскольку в работах других авторов половые различия под влиянием раннего ЛПС-стресса в лабиринте Морриса не исследовались. Ранее мы (Брошевицкая и др., 2020) сообщали, что введение ЛПС (50 мкг/кг) на 3-й и 5-й дни жизни вызывает увеличение тревожного поведения у самцов в большей степени, чем у самок подросткового возраста (1–1.5 мес) в тестах открытого поля и приподнятого крестообразного лабиринта. В тесте вынужденного плавания признаки депрессивно-подобного поведения проявлялись только у самцов. Одной из возможных причин неоднозначного влияния раннего ЛПС-стресса на тревожно-депрессивное поведение (Брошевицкая и др., 2020) и обучение/память у самцов и самок может быть разная активация у них гипоталамо-гипофизарной надпочечниковой системы и неодинаковое вовлечение процесса нейровоспаления и иммунной системы (Fonken et al., 2018; Villa et al., 2016). Известно, что ранний стресс вызывает сенситизацию системы нейровоспаления, которую называют еще праймингом (priming). Но имеются данные, что сенситизация системы нейровоспаления у самцов и самок проходит по-разному (Bekhbat, Neigh, 2018; Fonken et al., 2018). У самцов в ответ на стресс усиливается активация микроглии in vivo и потенцируются реакции микроглии ex vivo (Frank et al., 2007). Это свидетельствует о том, что у самцов активность микроглии обеспечивает высокую чувствительность к нейровоспалению. У самок функционирование микроглии не связано с эффектом сенситизации. Интересно, что у самок в ответ на повторный стресс происходило увеличение интерлейкина IL-10, который оказывает противовоспалительное действие. На основании этого высказывалось предположение, что иммунная система у самок может выполнять функцию буфера для смягчения реакций на повторный стресс через активацию противовоспалительных путей (Barrientos et al., 2019).
Ухудшение гиппокамп-зависимого пространственного обучения и долгосрочной памяти в водном лабиринте Морриса у ЛПС-группы может быть связано с нарушениями функции гиппокампа за счет развития нейровоспалительного процесса, который подавляет нейротрофическую функцию факторов роста (BDNF и других) и нейрогенез (Gulyaeva, 2019; Григорьян и др. 2014). Дефицит BDNF и ослабленный нейрогенез способствуют гибели клеток гиппокампа. При этом вызываются типичные пластические перестройки в виде уменьшения выраженности шипикового аппарата, длины, ветвления и выраженности дендритного дерева, уменьшения объема гиппокампа. В работе (Sarkar et al., 2020) было показано, что потомство матерей, которые недоедали во время беременности, получавшее на 3-й и 9-й постнатальные дни соответственно Poly I:C и ЛПС, при тестировании на 180-й день жизни проявляли ухудшение пространственной памяти в водном лабиринте Морриса, клеточный апоптоз, ослабление дендритного ветвления и ряд других отрицательных биохимических изменений. И. Кудряшова и соавт. (Kudryashova et al., 2019) обнаружили в поле СА1 переживающих срезов гиппокампа крыс 17–33-дневного возраста после неонатального введения бактериального липополисахарида дефицит длительной потенциации у группы с ЛПС-стрессом. Синаптическая потенциация у них отсутствовала в 61% опытов или была слабо выражена, что связано с ослаблением афферентного притока к нейронам гиппокампа. Фоновая депрессия синаптических потенциалов преобладала в гиппокампе самок. Авторы полагают, что синаптическая депрессия могла иметь отношение к протекторным функциям, которые, по-видимому, менее эффективно используются в гиппокампе самцов (Kudryashova et al., 2019). При исследовании срезов гиппокампа были обнаружены половые различия по влиянию ЛПС на активность клеток. Мышам линии C57BL/6 вводили ЛПС на 14-й день жизни, а в подростковом (35–45-й дни) и в зрелом возрасте (60–70) животных забивали, готовили срезы и регистрировали активность пирамидных нейронов поля СА1 (Gomez et al., 2019). У мышей самцов, которым вводили ЛПС, число потенциалов действия, вызванных деполяризующими токами, значительно увеличивалось по сравнению с контролем. Эти изменения были связаны с механизмами избыточного проникновения хлора внутрь клетки, деполяризации потенциалов, вызванных реверсией активности ГАМК, усилением активности транспортера хлора, NKCC1. Примечательно, что у самок подобных изменений не наблюдалось на срезах ни в подростковом, ни в зрелом периоде (Gomez et al., 2019). Monfort и соавт. (Monfort et al., 2015) в своей работе показали, что у самок крыс в базовых условиях преобладают синаптические реакции, больше связанные с активацией АМПА-рецепторов. В противоположность этому длительная посттетаническая потенциация (long-term potentiation, LTP) была слабее выражена у самок, чем у самцов. Это происходило за счет активации растворимой гуанилат циклазы и образования cGMP, ведущих к ослаблению активации cGMP-зависимой протеинкиназы и фосфориляции GluR1 в Ser845. В результате уменьшалось включение АМPA-рецепторов в синаптическую мембрану и снижалась амплитуда LTP. Авторы полагают, что благодаря этим механизмам самки уступают самцам в поиске скрытой платформы в водном лабиринте Морриса (Monfort et al., 2015). В работе О. Зубаревой и соавт. (Zubareva et al., 2020) у крыс самцов, получавших ЛПС, также происходило значительное уменьшение длительной потенциации гиппокампа. При этом авторы связывают эти изменения с разной экспрессией субъединиц АМPA- и NМDА-рецепторов. В частности, наблюдались существенное уменьшение экспрессии субъединицы GluN2B в гиппокампе на 23-й день постнатальной жизни и умеренные изменения экспрессии GluN1, GluN2A и GluA1 mRNA (Zubareva et al., 2020).
ВЫВОДЫ
1. Самцы по сравнению с самками в контрольной группе (получавшие в раннем онтогенезе инъекции физиологического раствора) легче обучались находить скрытую под водой платформу в конце обучения (на 6–9-й дни). У самцов дистанция, латентность и время на периферии были меньше, а доля попыток с нахождением платформы – больше. Трудности обучения у самок были связаны с дефицитом долгосрочной памяти.
2. Ранний провоспалительный стресс ухудшал обучение только у самцов. У самцов ЛПС-группы по сравнению с ФИЗ-группой увеличивались латентность достижения платформы и проплываемая дистанция, уменьшалась скорость плавания и доля проб с нахождением платформы. У самцов ЛПС-группы нарушалась долгосрочная память. У самок различий в обучении между ЛПС- и ФИЗ-группами не наблюдалось.
3. Тестирование рабочей памяти с ежедневной сменой места платформы не выявило когнитивных различий между самцами и самками в контрольной группе, хотя в начале опытов наблюдались половые различия по двигательной активности и тактике поиска платформы. Ранний провоспалительный стресс не влиял на рабочую память, но оказывал влияние на двигательную активность у самцов, уменьшая скорость плавания и увеличивая латентность достижения платформы.
Работа поддержана частично грантом РФФИ (проекты № 19-015-00129A) и средствами государственного бюджета по госзаданию Министерства образования и науки Российской Федерации на 2021–2023 годы (№ г.р. АААА-А17-117092040002-6).
Список литературы
Брошевицкая Н.Д., Павлова И.В., Зайченко М.И., Груздева В.А., Григорьян Г.А. Влияние раннего провоспалительного стресса на тревожное и депрессивно-подобное поведение у крыс разного возраста. Физиологический журнал. 2020. 106 (7): 823–842.
Григорьян Г.А. Половые различия в поведении и биохимических маркерах у животных в ответ на нейровоспалительный стресс. Успехи физиол. наук. 2020. 51 (1): 18–32.
Григорьян Г.А., Дыгало Н.Н., Гехт А.Б., Степаничев М.Ю., Гуляева Н.В. Молекулярно-клеточные механизмы депрессии. Роль глюкокортикоидов, цитокинов и нейротрофических факторов в генезе депрессивных расстройств. Успехи физ. наук. 2014. 44 (2): 3–20.
Anderson E.M., Moenk M.D., Barbaro L., Clarke D.A., Matuszewich L. Effects of pretraining and water temperature on female rats’ performance in the Morris water maze. Physiol. Behav. 2013. 122: 216–21.
Arai K., Matsuki N., Ikegaya Y., Nishiyama N. Deterioration of spatial learning performances in lipopolysaccharide-treated mice. Jpn. J. Pharmacol. 2001. V. 87. № 3. P. 195–201.
Barrientos R.M., Brunton P.J., Lenz K.M., Pyter L., Spencer S.J. Neuroimmunology of the female brain across the lifespan: Plasticity to psychopathology. Brain Behav. Immun. 2019. 79: 39–55.
Bekhbat M., Neigh G.N. Sex differences in the neuroimmune consequences of stress: Focus on depression and anxiety. Brain Behav. Immun. 2018. 67: 1–12.
Beiko J., Lander R., Hampson E., Boon F., Cain D.P. Contribution of sex differences in the acute stress response to sex differences in water maze performance in the rat. Behav. Brain Res. 2004. 151 (1–2): 239–253.
Benoit J.D., Rakic P., Frick K.M. Prenatal stress induces spatial memory deficits and epigenetic changes in the hippocampus indicative of heterochromatin formation and reduced gene expression. Behav Brain Res. 2015. 281: 1–8.
Berger-Sweeney J., Arnold A., Gabeau D., Mills J. Sex differences in learning and memory in mice: effects of sequence of testing and cholinergic blockade. Behav Neurosci. 1995. 109 (5): 859–873.
Bucci D.J., Chiba A.A., Gallagher M. Spatial learning in male and female Long-Evans rats. Behav. Neurosci. 1995. 109 (1): 180–183.
Czerniawski J., Miyashita T., Lewandowski G., Guzowski J.F. Systemic lipopolysaccharide administration impairs retrieval of context-object discrimination, but not spatial, memory: Evidence for selective disruption of specific hippocampus-dependent memory functions during acute neuroinflammation. Brain Behav. Immun. 2015. 44: 159–166.
Devan B.D., Tobin E.L., Dunn E.N., Magalis C. Sex differences on the competitive place task in the water maze: The influence of peripheral pool time on spatial navigation performance in rats. Behav. Processes. 2016. 132: 34–41.
Fonken L.K., Frank M.G., Gaudet A.D., D’Angelo H.M., Daut R.A., Hampson E.C., Ayala M.T., Watkins L.R., Maier S.F. Neuroinflammatory priming to stress isdifferentially regulated in male and female rats. Brain Behav. Immun. 2018. 70: 257–267.
Frank M.G., Baratta M.V., Sprunger D.B., Watkins L.R., Maier S.F. Microglia serve as a neuroimmune substrate for stress-induced potentiation of CNS pro-inflammatory cytokine responses. Brain Behav. Immun. 2007. 21 (1): 47–59.
Frick K.M., Burlingame L.A., Arters J.A., Berger-Sweeney J. Reference memory, anxiety and estrous cyclicity in C57BL/6NIA mice are affected by age and sex. Neuroscience. 2000. 95 (1): 293–307.
Gomez C.D., Read J., Acharjee S., Pittman Q.J. Early Life Inflammation Increases CA1 Pyramidal Neuron Excitability in a Sex and Age Dependent Manner through a Chloride Homeostasis Disruption. J Neurosci. 2019. 39 (37): 7244–7259.
Grigoryan G.A., Mitchell S., Hodges H., Sinden J. and Gray J.A. Are the cognitive enhancing effects of nicotine in the rats with lesion to the forebrain cholinergic projection system mediated by an interaction with the noradrenergic system? Pharmacol. Biochem. Behav. 1994. 49 (3): 511–521.
Gulyaeva N.V. Functional neurochemistry of the ventral and dorsal hippocampus:stress, depression, dementia and remote hippocampal damage. Neurochem. Res. 2019. 44 (6): 1306–1322.
Harre E.M., Galic M.A., Mouihate A., et al. Neonatal inflammation produces selective behavioural deficits and alters N-methyl-D- aspartate receptor subunit mRNA in the adult rat brain. Eur J. Neurosci. 2008. 832 (27): 644–653.
Healy S.D., Braham S.R., and Braithwaite V.A. Spatial working memory in rats: no differences between the sexes. Proc. Biol. Sci. 1999. 266 (1435): 2303–2308.
Huang Z.B., Wang H., Rao X.R., Liang T., Xu J., Cai X.S., Sheng G.Q. Effects of immune activation on the retrieval of spatial memory. Neurosci. Bull. 2010. 26 (5): 355–364.
Jin Y., Peng J., Wang X., Zhang D., Wang T. Ameliorative effect of ginsenoside Rg1 on lipopolysaccharide-induced cognitive impairment: role of cholinergic system. Neurochem. Res. 2017. 42 (5): 1299–1307.
Jonasson Z. Meta-analysis of sex differences in rodent models of learning and memory: a review of behavioral and biological data. Neurosci. Biobehav. Rev. 2005. 28 (8): 811–825.
Koss W.A., Frick K.M. Sex differences in hippocampal function. J Neurosci Res. 2017. 95 (1–2): 539–562.
Kudryashova I.V., Tishkina A.O., Gulyaeva N.V. Neonatal Proinflammatory Stress and Defi cit of Induction of Long-Term Potentiation in the Hippocampus in Rats: Gender Differences. Neurosci. Behav. Physiol. 2019. 49 (9): 1118–1126.
Lamberty Y., Gower A.J. Investigation into sex-related differences in locomotor activity, place learning and passive avoidance responding in NMRI mice.
Physiol. Behav. 1988. 44 (6): 787–790.
Markowska A.L. Sex dimorphisms in the rate of age-related decline in spatial memory: relevance to alterations in the estrous cycle. J. Neurosci. 1999. 19 (18): 8122–8133.
Monfort P., Gomez-Gimenez B., Llansola M., Felipo V. Gender differences in spatial learning, synaptic activity, and long-term potentiation in the hippocampus in rats: molecular mechanisms. ACS Chem. Neurosci. 2015. 6 (8): 1420–1427.
Peng L., Zhu M., Yang Y., Weng Y., Zou W., Zhu X., Guo Q., Zhong T. Neonatal lipopolysaccharide challenge induces long-lasting spatial cognitive impairment and dysregulation of hippocampal histone acetylation in mice. Neuroscience. 2019. 398: 76–87.
Perrot-Sinal T.S., Kostenuik M.A., Ossenkopp K.P., Kavaliers M. Sex differences in performance in the Morris water maze and the effects of initial nonstationary hidden platform training. Behav Neurosci. 1996. 110 (6): 1309–1320.
Roof R.L., Stein D.G. Gender differences in Morris water maze performance depend on task parameters. Physiol. Behav. 1999. 68 (1–2): 81–86.
Sarkar T., Patro N.1, Patro I.K. Neuronal changes and cognitive deficits in a multi-hit rat model following cumulative impact of early life stressors. Biol Open. 2020 Sep. 24. 9 (9): bio054130.
Shaw K.N., Commins S., O’Mara S.M. Lipopolysaccharide causes deficits in spatial learning in the watermaze but not in BDNF expression in the rat dentate gyrus. Behav Brain Res. 2001. 124 (1): 47–54.
Sparkman N.L., Buchanan J.B., Heyen J.R., Chen J., Beverly J.L., Johnson R.W. Interleukin-6 facilitates lipopolysaccharide-induced disruption in working memory and expression of other proinflammatory cytokines in hippocampal neuronal cell layers. J. Neurosci. 2006. 26 (42): 10709–10716.
Veng L.M., Granholm A.C., Rose G.M. Age-related sex differences in spatial learning and basal forebrain cholinergic neurons in F344 rats. Physiol Behav. 2003. 80 (1): 27–36.
Villa A., Vegeto E., Poletti A., Maggi A. Estrogens, neuroinflammation, and neurodegeneration. Endocr. Rev. 2016. 37 (4): 372–402.
Zhu X., Liu J., Chen S., Xue J., Huang S., Wang Y., Chen O. Isoliquiritigenin attenuates lipopolysaccharide-induced cognitive impairment through antioxidant and anti-inflammatory activity. BMC Neurosci. 2019. 20 (1): 41.
Zubareva O.E., Postnikova T.Y., Grifluk A.V., Schwarz A.P., Smolensky I.V., Karepanov A.A., Vasilev D.S., Veniaminova E.A., Rotov A.Y., Kalemenev S.V., Zaitsev A.V. Exposure to bacterial lipopolysaccharide in early life affects the expression of ionotropic glutamate receptor genes and is accompanied by disturbances in long-term potentiation and cognitive functions in young rats. Brain Behav. Immun. 2020. 90: 3–15.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


